2008-2015 年深圳某醫院金黃色葡萄球菌血流感染的臨床特征和預后分析
鄭金鑫, 王紅燕, 徐芹珍, 蒲彰雅, 李多云, 陳 重, 鄧向斌, 鄧啟文, 余治健
2008-2015 年深圳某醫院金黃色葡萄球菌血流感染的臨床特征和預后分析
鄭金鑫, 王紅燕, 徐芹珍, 蒲彰雅, 李多云, 陳 重, 鄧向斌, 鄧啟文, 余治健
目的 分析深圳市南山區人民醫院金黃色葡萄球菌血流感染的臨床特征和起病后 30 d 內死亡相關的危險因素。方法 回顧分析 2008-2015 年由金黃色葡萄球菌所致血流感染患者的臨床和微生物學資料,分析 30 d 內死亡相關危險因素。結果 共 121 例患者入組,其中 MRSA 血流感染檢出率為 17.4%(21/121)。相比較于 MSSA 血流感染,MRSA 血流感染中年齡≥65 歲老年患者更多、醫院感染和呼吸道感染更為常見(P 值分別為 0.026、0.035 和 0.001);并且 MRSA 血流感染患者中復數菌感染更多和接受了更多的不恰當初始抗感染治療(P 值分別為 0.005 和 0.001)。患者起病后 30 d 內的死亡率為 18.2%(22/121)。通過單因素和多因素回歸分析示僅實體腫瘤(OR, 8.932, P = 0.004)和感染性休克(OR, 56.721,P <0.001)是患者起病后 30 d 內死亡的獨立危險因素。結論 實體腫瘤和感染性休克,比 MRSA 感染在金黃色葡萄球菌血流感染患者死亡中起了更重要的作用。
金黃色葡萄球菌 ; 血流感染 ; 死亡率 ; 危險因素
金黃色葡萄球菌(金葡菌)目前仍然是引起血流感染最常見的病原菌之一,David 等[1]統計全美國年發病率可高達 26/100 000 人次。而 MRSA 引起的血流感染,因較高的發病率和病死率引起較多關注[2]。但近年研究發現自 2000 年以來,MRSA引起的血流感染,特別是醫院感染中的血流感染正逐漸減少[3]。而另外一些研究也發現 MSSA 引起的血流感染正在增多或至少處于穩定狀態[4-5]。
目前,國內關于金葡菌血流感染發病率等研究的結論仍然較少,而且存在較大分歧。Huang 等[6]報道 MRSA 引起血流感染的發病率僅占金葡菌血流感染的 37.5%, 而國內其他研究則可高達 57.4%甚至 63.6%[7-8]。為研究金葡菌血流感染的臨床特征和起病后 30 d 內死亡相關的危險因素,收集深圳大學附屬南山區人民醫院 2008 年 1 月-2015 年12月金葡菌血流感染患者的臨床資料進行分析。
1 材料與方法
1.1 研究對象
對我院 2008 年 1 月-2015 年 12 月血培養分離出金葡菌的全部住院患者病例進行回顧性分析,收集患者臨床資料和菌株藥敏資料。對每例患者計算 Charlson 合并癥評分。對入住 ICU 的患者,通過簡化急性生理學評分Ⅱ(SAPS II)以評估患者疾病的危重程度。對每例患者的合并癥進行回顧分析。其中心血管病主要包括高血壓、冠心病和心臟瓣膜性疾病。
1.2 菌株鑒定與藥敏試驗
菌株來自我院細菌室從各科患者血標本中分離的金葡菌。鑒定采用法國生物梅里埃公司 VITEK-2 鑒定儀。藥敏紙片和專用瓊脂由英國 OXOID 公司提供。質控菌株為金葡菌 ATCC 25923。藥物敏感試驗方法和判斷折點采用 CLSI M2-A8 和 M100-S15 標準。
1.3 診斷標準
血流感染診斷標準系根據美國疾病預防控制中心對于血流感染的實驗室診斷標準和參考文獻標準:①患者≥1次血培養分離出金葡菌;②同時患者有相應感染的臨床證據,至少有以下 1 項癥狀或體征,即發熱(>38 ℃)、寒戰或低血壓[9-10]。血流感染來源部位根據參考文獻方法判斷:在血流感染前機體某部位有明確感染表現或分離出金葡菌, 則定義該部位為原發感染灶 ; 中心靜脈導管末端培養出金葡菌或導管末端培養雖陰性, 但臨床上未發現其他明確感染灶, 則定義為導管相關性血流感染 ;如果不能證明有明確感染病灶者, 則定義為原發感染灶不明[9]。
糖皮質激素治療定義為靜脈用激素至少超過1周。恰當的初始抗感染治療(經驗性抗感染治療)定義為 :在血培養采集后的最初 48 h 內所用抗感染藥物,血培養體外藥敏結果證實其抗菌活性可覆蓋病原菌[8]。復數菌感染定義為 2 種以上細菌不同部位的感染[8]。
感染途徑判斷根據參考文獻方法:醫院獲得性血流感染,患者入院時不存在感染且不處于感染潛伏期, 在入院 48 h 后血培養陽性。衛生保健相關血流感染,血培養在入院 48 h 內陽性,且符合下列條件中至少 1 項,即入院前的 30 d 內接受過靜脈化療或血液透析治療 ;入院前的 30 d 內接受家庭靜脈輸液治療或傷口護理 ;入院前的 90 d內曾住院治療超過 2 d ;長期居住在護理保健設施中。除此之外其他血流感染均認為社區獲得性感染 [11-12]。
1.4 統計學方法
采 用 SPSS 14.0 軟 件 進 行 統 計 分 析, 計 數資 料 組 間 比 較 采 用 χ2檢 驗 或 Fisher's exact test。P <0.05 為差異有統計學意義。通 過 單 因 素和多因素 Logistic 回歸分析與患者起病后 30 d 內死亡相關的危險因素。采用 backward 方法建立多因素Logistic 回歸分析模型,單因素分析中 P<0.05 變量納入模型。
2 結果
2.1 一般資料
剔除重復菌株和臨床資料缺失病例, 121 例金葡菌血流感染患者入選最終統計分析。其中男81例, 女 40 例, 起 病 后 30 d 內死 亡 22 例(18.2%,22/121),見表1。本研究病例合并有較多種慢性疾病和危重疾病,14.0%(17/121)患者 Charlson合并癥評分≥7。20.7%(25/121)患者入住 ICU,其中 SAPS II ≥40 有 10 例(40.0 %,10/25)。
2.2 單因素分析和患者起病后 30 d 內死亡相關的危險因素
本 研 究 中 患 者 起 病 后 30 d 內 的 死 亡 率 為18.2%。單因素分析示,年齡≥65 歲和男性均不是危險因素。而患者合并慢性疾病,如實體腫瘤、消化道潰瘍和腦卒中是患者起病后 30 d 內死亡的危險因素(P 值分別為 0.014、 0.017 和 0.042)。Charlson 合并癥評分≥7 和 SAPS II≥40,反映患者具有較多合并癥和危急重癥疾病,是危險因素(P <0.001 和 P=0.001)。另外,糖皮質激素治療和導管或其他人工裝置,也是患者起病后 30 d 內死亡的危險因素(P=0.001 和 P=0.005)。
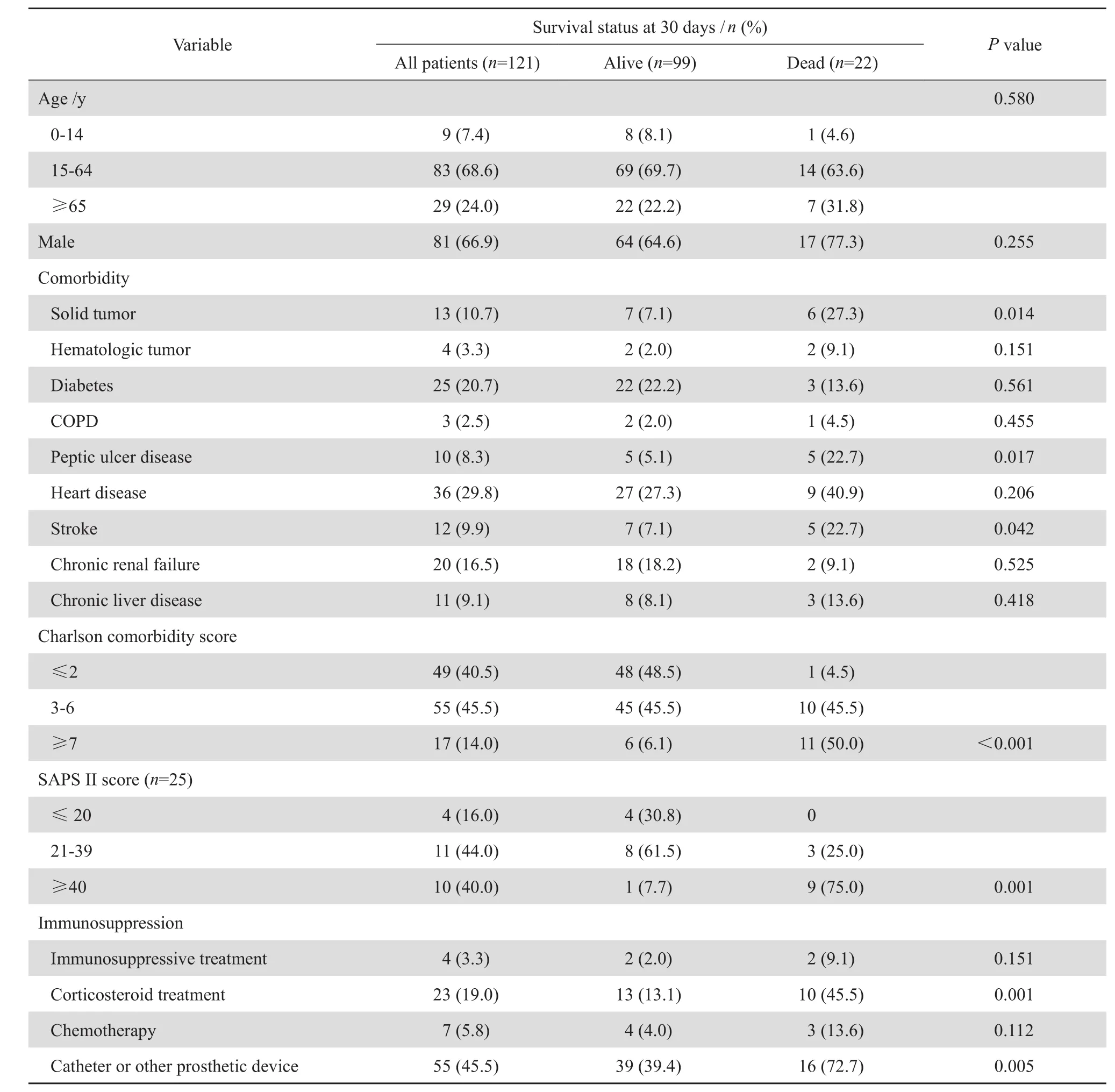
表1 患者一般臨床特征和起病后 30 d 內死亡相關的危險因素分析Table 1 Clinical characteristics and risk factors for 30-day mortality in patients with bloodstream infections by univariate analysis
從細菌感染途徑和來源部位分析,只有醫院感染、ICU內感染和呼吸道來源感染是患者起病后30 d內死亡的危險因素(P值分別為0.005、0.001和0.013)。本研究中38例患者有復數菌感染,起病后30 d內死亡22例患者中有11例患者有復數菌感染,分別合并有其他1~5種細菌感染,常見有鮑曼不動桿菌(痰)、銅綠假單胞菌(痰)、嗜麥芽窄食單胞菌(痰或血)、屎腸球菌(痰或血)、肺炎克雷伯菌(痰)、大腸埃希菌(痰)、陰溝腸桿菌(痰), 其中痰培養細菌陽性患者其胸部X線片或CT檢查診斷有支氣管炎或肺部感染。復數菌感染經單因素分析是患者起病后30 d內死亡的危險因素(P=0.038)。感染性休克也是患者起病后30 d內死亡的危險因素(P<0.001)。但是本研究中MRSA血流感染和不恰當的初始抗感染治療并不是危險因素。見表2。
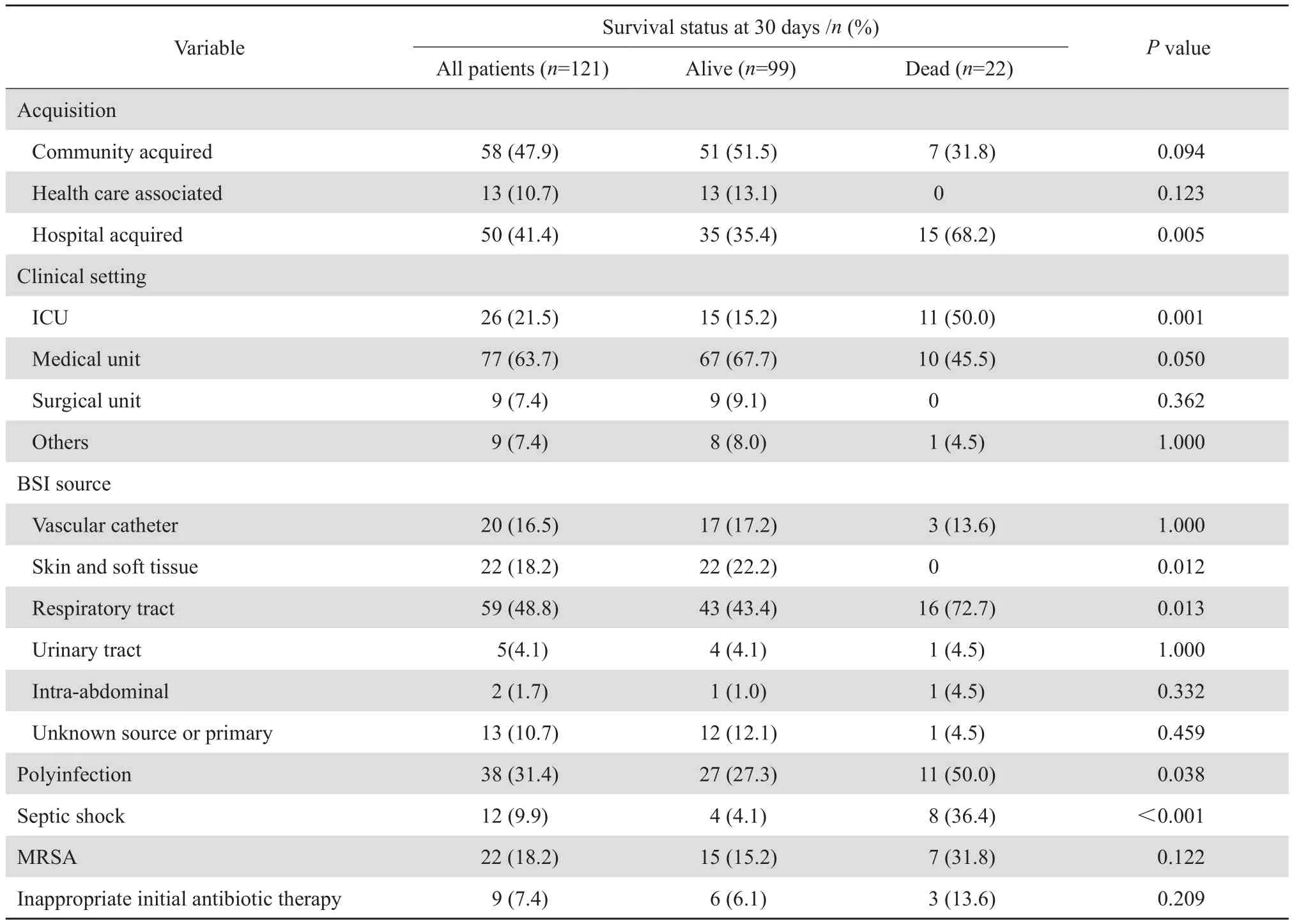
表2 金葡菌血流感染的特點和起病后 30 d 內死亡相關的危險因素分析Table 2 Features of bloodstream infections caused by Staphylococcus aureus and risk factors for 30-day mortality by univariate analysis
2.3 MRSA 和 MSSA 血流感染不同特點及藥敏試驗
本研究中 MRSA 血流感染患者 21 例,檢出率為 17.4%。相比 MSSA 血流感染,MRSA 血流感染患者中 :年齡≥65 歲者比例更高(42.9% 對20.0%,P=0.026);醫院感染和呼吸道感染比例更高(61.9% 對 37.0%,P=0.035 和 81.0% 對 42.0%,P=0.001);MRSA 血流感染患者接受了更多的不恰當初始抗感染治療(28.6% 對 3.0%,P=0.001)。21 例 MRSA 血流感染患者中,12 例為復數菌感染,分別合并其他細菌感染,常見有鮑曼不動桿菌、銅綠假單胞菌、嗜麥芽窄食單胞菌、屎腸球菌、肺炎克雷伯菌、大腸埃希菌、陰溝腸桿菌、產氣腸桿菌、糞腸球菌、摩根摩根菌,其中痰培養細菌陽性患者其X線胸片或CT檢查診斷有支氣管炎或肺部感染(57.1% 對 26.0%,P=0.005)。見表3。
藥敏試驗顯示,所有菌株對萬古霉素、替考拉寧和利奈唑胺均敏感,但對青霉素的耐藥率高達95.0%,對其他抗菌藥物的耐藥率從 4.1%~50.4%。 MRSA 菌株對慶大霉素、妥布霉素、左氧氟沙星、紅霉素、克林霉素、利福平和莫匹羅星的耐藥率均明顯高于 MSSA 菌株。見表4。
2.4 多 因 素 Logistic 回 歸 分 析 與 患 者 起 病 后 3300 dd 內死亡相關的危險因素
之前單因素分析中P<0.05的因素納入多因素Logistic回歸分析模型。由于實體腫瘤、消化道潰瘍和腦卒中在Charlson合并癥評分中起到重要作用并差異有顯著統計學意義,因此這3種因素取代Charlson合并癥評分≥7納入回歸分析。由于僅對ICU患者進行SAPS II評分(25例),并且感染性休克在SAPS II評分中起關鍵性作用,因此取代SAPS II ≥40納入回歸分析。最終實體腫瘤、消化道潰瘍、腦卒中、糖皮質激素治療、導管或其他人工裝置、醫院感染、ICU內感染、呼吸道來源感染、復數菌感染和感染性休克作為自變量,患者起病后30 d內死亡作為因變量進行多因素Logistic回歸分析,見表5。回歸分析示僅實體腫瘤(OR,8.932,95% CI,2.020~39.487;
P = 0.004) 和感染性休克(OR,56.721,95% CI,11.651~276.135;P<0.001) 是患者起病后30 d內死亡的獨立危險因素。
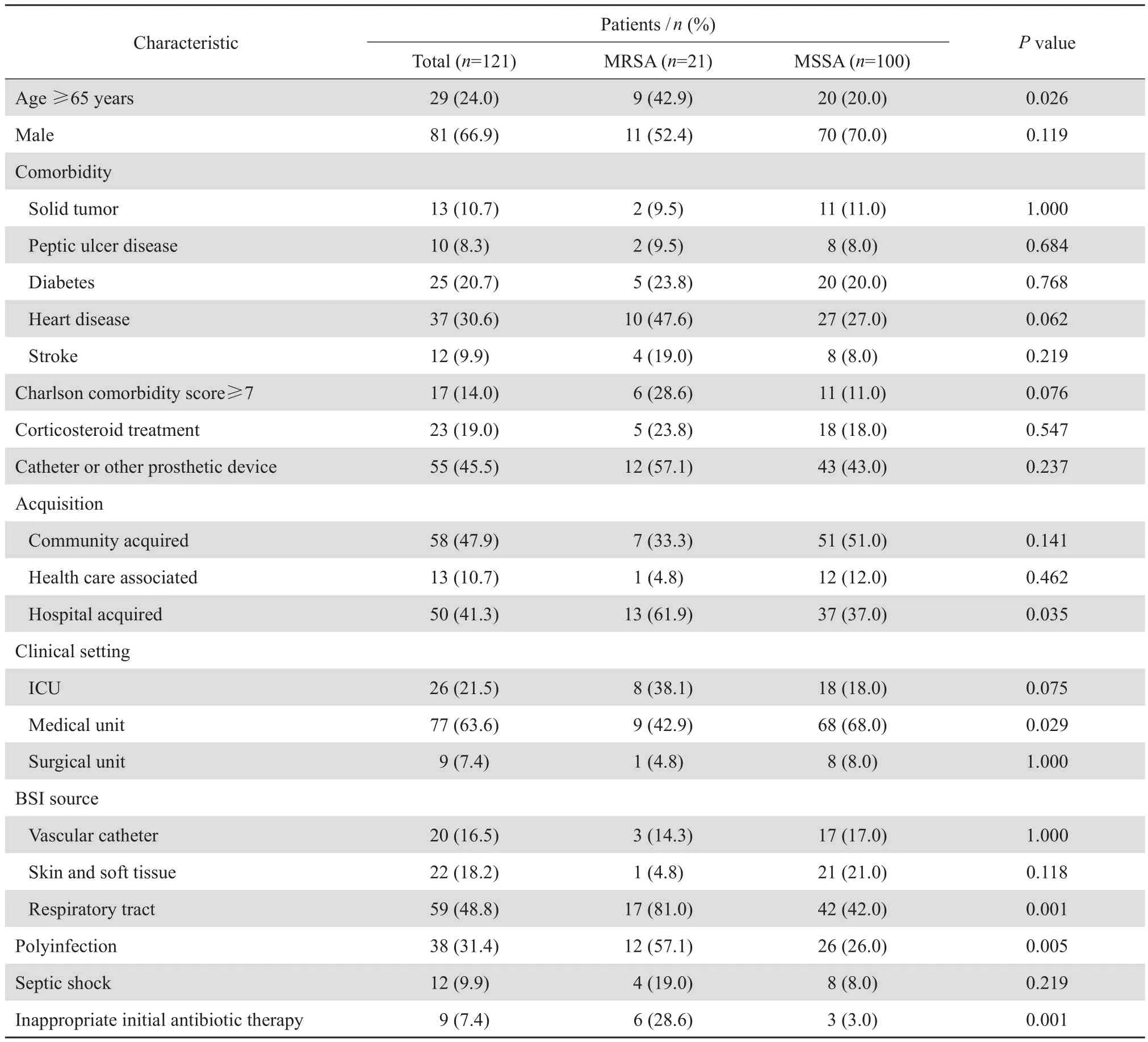
表3 MRSA 和 MSSA 血流感染不同特點的比較Table 3 Characteristics of patients with MRSA versus MSSA bloodstream infections
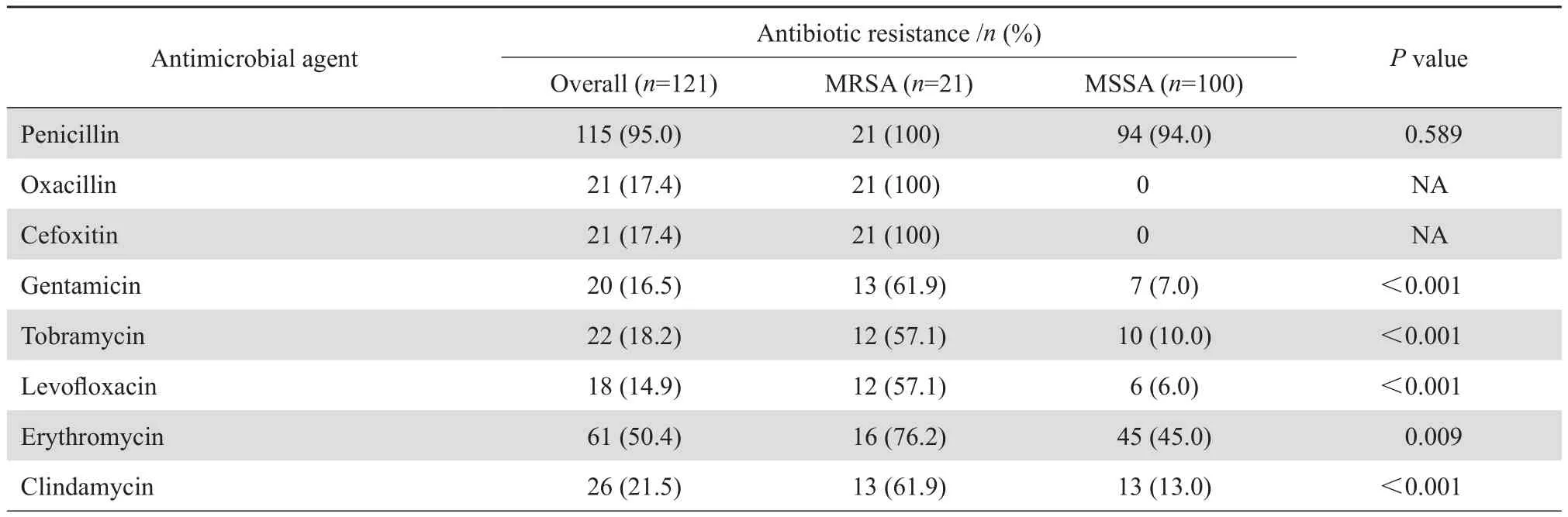
表4 MRSA 和 MSSA 血流感染不同藥敏特點的比較Table 4 Antibiotic resistance prof i le of MRSA versus MSSA isolates from bloodstream infections
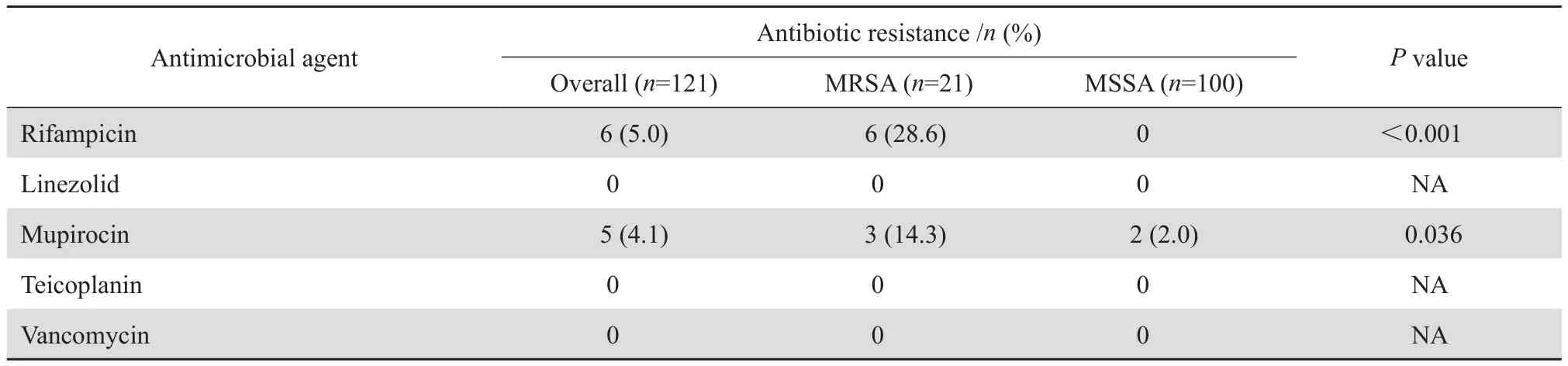
表4 (續)Table 4(continued)

表5 多因素 Logistic 回歸分析與金葡菌血流感染起病后30 d 內死亡相關的危險因素Table 5 Multivariate analysis of risk factors associated with 30-day mortality in patients with S. aureus bloodstream infection
3 討論
本研究中患者合并有較多慢性疾病,如實體腫瘤(10.7%)、心血管病(29.8%)、糖尿病(20.7%)、腦卒中(9.9%)等;大部分為男性和年齡較大患者;47.9% 金葡菌血流感染為社區獲得,41.4% 為醫院獲得,衛生保健相關獲得僅占 10.7%。Paulsen 等[13]研究顯示,衛生保健相關獲得金葡菌血流感染可高達 41.8%,而社區獲得和醫院獲得血流感染僅占29.0% 和 29.2%。這種差異可能是國內患者的疾病譜與國外不同,并且醫療體制和患者就醫習慣不同。本研究的 48.8% 金葡菌血流感染為呼吸道感染來源,與 Chen 等[8]研究結果一致。
本研究所有菌株對萬古霉素、替考拉寧和利奈唑胺均敏感,MRSA菌株對慶大霉素、妥布霉素、左氧氟沙星、紅霉素、克林霉素、利福平和莫匹羅星的耐藥率均明顯高于MSSA菌株,這與國內的2項研究結果相一致[7-8]。本研究金葡菌血流感染中MRSA檢出率為17.4%,明顯低于國內其他研究報道的57.4%甚至63.6%[7-8]。原因可能是之前研究在華東地區,而本研究在華南地區,地域不同而MRSA的流行率不同,但這些差異和原因需要更多研究證實。本研究社區獲得性MRSA血流感染占到MRSA血流感染的33.3%,發病率高于其他報道[7-8]。而之前有研究將MRSA感染細分為衛生保健相關醫院內發病或衛生保健相關社區發病2種感染類型[14]。因此兩者存在劃分標準問題。但已有研究發現衛生保健相關醫院內發病MRSA感染患者更多地合并有腎衰竭、血液透析、長期居住在護理保健機構[14]。所以我們對社區獲得性MRSA血流感染病例進行了仔細的回顧分析,發現這些患者感染來源多為呼吸道、皮膚和軟組織。而且在本研究衛生保健相關獲得血流感染病例中僅發現1例MRSA感染。
本研究對 MRSA 和 MSSA 血流感染的不同特點進行了比較,結果發現相比于 MSSA 感染,MRSA 血流感染患者中,年齡≥65 歲老年患者更多,有更多患者為醫院感染和呼吸道來源感染,更高的復數菌感染和接受了更多不恰當初始抗感染治療,這也與國內其他研究結果相似[8]。盡管在研究中 MRSA 血流感染患者接受了更多的不恰當初始抗感染治療,但回顧分析發現這些患者隨后根據藥敏結果,均接受了恰當的針對性抗感染治療,對預后未造成影響。有研究發現,MRSA血流感染患者在最初 24 h 內接受了不恰當初始抗感染治療與起病后 30 d 內死亡密切相關[15]。
本 研 究 中 患 者 起 病 后 30 d 內 的 死 亡 率 為18.2%,通過單因素和多因素分析發現實體腫瘤和感染性休克是獨立的危險因素,這與其他研究結論相似[14-15]。實體腫瘤和感染性休克不僅是金葡菌血流感染患者死亡的危險因素,也是其他病原菌如腸球菌等血流感染死亡的危險因素[16]。
綜上所述,在本次研究中實體腫瘤和感染性休克是金葡菌血流感染患者死亡的危險因素。因此,在金葡菌血流感染的治療中,應重視基礎疾病的積極治療,并注意密切監測感染性休克的發生,爭取在休克早期給予及時的抗休克治療以改善預后。
[1] DAVID MZ, DAUM RS, BAYER AS, et al. Staphylococcus aureus bacteremia at 5 US academic medical centers, 2008–2011 : significant geographic variation in community-onset infections [J]. Clin Infect Dis, 2014, 59(6): 798-807.
[2] TONG SY , DAVIS JS , EICHENBERGER E , et al. Staphylococcus aureus infections : epidemiology,pathophysiology, clinical manifestations, and management [J]. Clin Microbiol Rev, 2015, 28(3): 603-661.
[3] DANTES R, MU Y, BELFLOWER R, et al. National burden of invasive methicillin-resistant Staphylococcus aureus infections,United States, 2011 [J]. JAMA Intern Med, 2013, 173(21):1970-1978.
[4] SAN-JUAN R, VIEDMA E, CHAVES F, et al. High MICs for vancomycin and daptomycin and complicated catheter-related bloodstream infections with methicillin-sensitive Staphylococcus aureus [J]. Emerg Infect Dis, 2016, 22(6): 1057-1066.
[5] LAUPLAND KB, LYYTIKAINEN O, SOGAARD M, et al. The changing epidemiology of Staphylococcus aureus bloodstream infection : a multinational population-based surveillance study [J]. Clin Microbiol Infect, 2013, 19(5):465-471.
[6] HUANG YC, XIE Y, CHEN ZX, et al. Bloodstream infections in southwestern China : 2012 Whire Union report on bacterial susceptibility to antibiotics [J]. Sichuan Da Xue Xue Bao Yi Xue Ban, 2015, 46(1): 75-81.
[7] CHEN X, WANG WK, HAN LZ, et al. Epidemiological and genetic diversity of Staphylococcus aureus causing bloodstream infection in Shanghai, 2009-2011[J]. PLoS One, 2013, 8(9):e72811.
[8] CHEN R, YAN ZQ, FENG D, et al. Nosocomial bloodstream infection in patients caused by Staphylococcus aureus : drug susceptibility, outcome, and risk factors for hospital mortality [J]. Chin Med J (Engl), 2012, 125(2): 226-229.
[9] 路明, 姚婉貞, 王筱宏, 等 . 金黃色葡萄球菌血流感染的臨床特征分析 [J].中華醫院感染學雜志, 2011, 21(8): 1596-1598.
[10] 毛原飛,孫慧平,李軍民 . 達托霉素治療金黃色葡萄球菌血流感染 21 例臨床分析 [J].中國感染與化療雜志, 2016, 16(1): 30-32.
[11] PICOT-GUERAUD R, BATAILLER P, CASPAR Y, et al. Bacteremia caused by multidrug-resistant bacteria in a French university hospital center: 3 years of collection [J]. Am J Infect Control, 2015,43(9):960-964.
[12] TSENG YJ,WU JH, LIN HC, et al. A web-based, hospitalwide health care-associated bloodstream infection surveillance and classification system : development and evaluation [J]. JMIR Med Inform, 2015, 3(3): e31.
[13] PAULSEN J, MEHL A, ASKIM ?, SOLLIGARD E, et al. Epidemiology and outcome of Staphylococcus aureus bloodstream infection and sepsis in a Norwegian county 1996–2011 : an observational study [J]. BMC Infect Dis, 2015, 15 :116.
[14] WANG SH, HINES L, VAN BALEN J, et al. Molecular and clinical characteristics of hospital and community onset methicillin-resistant Staphylococcus aureus strains associated with bloodstream infections [J]. J Clin Microbiol, 2015, 53(5):1599-608.
[15] SIMOR AE, PELUDE L, GOLDING G, et al. Determinants of outcomes in hospitalized patients with methicillin-resistant Staphylococcus aureus bloodstream infection :results from national surveillance in Canada, 2008-2012[J]. Infect Control Hosp Epidemiol, 2016, 37(4): 390-397.
[16] MARSCHALL J, PICCIRILLO ML, FRASER VJ, et al. Catheter removal versus retention in the management of catheterassociated enterococcal bloodstream infections[J]. Can J Infect Dis Med Microbiol, 2013, 24(3): e83-e87.
Bloodstream infections caused by Staphylococcus aureus in a university hospital center in Shenzhen, 2008-2015
ZHENG Jinxin, WANG Hongyan, XU Qinzhen, PU Zhangya, LI Duoyun, CHEN Zhong, DENG Xiangbin, DENG Qiwen, YU Zhijian.
(Department of Infectious Diseases, Shenzhen Key Laboratory for Endogenous Infection, Shenzhen Nanshan Hospital, Shenzhen University, Shenzhen Guangdong 518052, China)
Objective This study was designed to examine the clinical characteristics of bloodstream infections (BSI) caused by Staphylococcus aureus in a teaching hospital and the risk factors for 30-day mortality. Methods A single center retrospective cohort study was conducted for all the patients with BSI caused by S. aureus between 2008 and 2015. The data of clinical features, microbiology, and 30-day mortality were collected from the database of electronic medical records. Results A total of 121 patients with S. aureus BSI were identif i ed. The prevalence of methicillin-resistant S. aureus (MRSA) was 17.4% (21/121). MRSA BSIs were signif i cantly associated with old age (≥65 years) (P=0.026), hospital acquired infection (P=0.035), respiratory tract infection (P=0.001), polyinfection (P=0.005) and inappropriate initial antibiotic therapy (P=0.001) than methicillin-sensitive S. aureus (MSSA) BSIs. The 30-day mortality was 18.2% (22/121). Both univariate and multivariate analysis suggested that solid tumor (OR, 8.932, P=0.004) and septic shock (OR, 56.721, P<0.001) were independently associated with the 30-day mortality. Conclusions The present study confirms that solid tumor and septic shock are more important risk factors than MRSA in mortality of patients with S. aureus BSI.
Staphylococcus aureus; bloodstream infection; mortality; risk factor
R453.2
:A
:1009-7708 ( 2017 ) 03-0238-07
10.16718/j.1009-7708.2017.03.002
2016-05-17
2016-10-16
深 圳 市 科 技 創 新 - 知 識 創 新 計 劃 項 目(JCYJ20150402152130167,JCYJ20150402152130173);深圳市衛生計生系統科研項目(201601058)。
深圳大學附屬南山區人民醫院感染疾病科,深圳市內源性感染診治重點實驗室,廣東深圳 518052。
鄭金鑫(1982—),男,博士,副主任醫師,主要從事細菌耐藥機制相關研究。
余治健,E-mail:yuzhijiansmu@163.com。

