窖泥中產丁酸菌的篩選、鑒定及生長性能研究
袁華偉,趙 猛,蔣 君,劉光錢,胡永奇,3,沈才洪,3,吳重德,周榮清3,,宋 川,3
(1.宜賓學院生命科學與食品工程學院,四川宜賓644000; 2.瀘州老窖股份有限公司,四川瀘州646000;3.國家固態釀造工程技術研究中心,四川瀘州646000; 4.四川大學輕紡與食品學院,四川成都610065)
窖泥中產丁酸菌的篩選、鑒定及生長性能研究
袁華偉1,趙 猛1,蔣 君1,劉光錢2,胡永奇2,3,沈才洪2,3,吳重德4,周榮清3,4,宋 川2,3
(1.宜賓學院生命科學與食品工程學院,四川宜賓644000; 2.瀘州老窖股份有限公司,四川瀘州646000;3.國家固態釀造工程技術研究中心,四川瀘州646000; 4.四川大學輕紡與食品學院,四川成都610065)
通過對川南某酒廠的老窖泥富集培養、分離純化,經丁酸發酵實驗,篩選出1株高產丁酸的梭菌。經16Sr DNA鑒定,該菌為丁酸梭狀芽孢桿菌(Clostridium butyricum),命名為丁酸菌YD-4。經對該菌株生長性能條件研究,其最適生長溫度為37℃,最適pH值為7.0,最適接種量為2%,菌體濃度達1.64×108個/mL,產丁酸量可達到3.44 g/L。
窖泥; 丁酸菌; 篩選; 鑒定; 生長性能
以瀘州老窖為典型代表的濃香型白酒發酵過程是在窖池內進行的,窖池的窖泥中富集了大量對濃香型白酒釀造有益的微生物,窖齡越長,所富集的微生物越多。老窖泥中存在大量的厭氧芽孢桿菌特別是梭狀芽孢桿菌,除己酸菌外,還存在較多的丁酸菌[1-3]。在濃香型白酒的香味物質形成方面,窖泥中棲息的己酸菌、丁酸菌、甲烷菌等窖泥功能菌在發酵過程中吸收營養,生長繁殖并代謝生成己酸、丁酸等有機酸,滲透到糟醅體系中與乙醇縮合生成酯類芳香物質,其中己酸乙酯被確定為濃香型白酒的主體香味物質;丁酸菌的代謝產物丁酸能與乙醇酯化形成丁酸乙酯,這是濃香型白酒中一種重要的香味成分,它與己酸乙酯形成的復合香氣則是濃香型白酒的典型香氣[4-7]。丁酸菌可以配合己酸菌用于制作新窖泥和養護窖池,對濃香型白酒釀造的窖池維護起著十分重要的作用[8-10]。丁酸菌的應用能促進丁酸乙酯的生成,全面提升和協調濃香型白酒的香味成分,從而提高濃香型白酒的質量[11-12]。因此丁酸菌是窖泥中相對重要的一類產酸菌,丁酸菌在養窖護窖和提高酒質方面具有很強的應用價值,篩選窖泥中產丁酸菌和研究其生長性能對于提高濃香型白酒的整體質量具有重大意義。本研究中,從窖泥中經厭氧培養分離篩選得到1株性能優良的產丁酸梭菌,運用16Sr DNA序列分析鑒定了其種屬關系,研究了其生長性能,測定了其生長曲線。
1 材料與方法
1.1 材料、試劑與儀器
1.1.1 實驗材料
窖泥樣品采集自川南某酒廠釀酒基地的窖池,為多點采樣的混合樣品。
1.1.2 培養基
①梭菌增殖培養基:酵母膏0.3%,牛肉浸膏1%,胰蛋白胨1%,葡萄糖0.5%,可溶性淀粉0.1%,氯化鈉0.5%,三水合乙酸鈉0.3%,半胱氨酸鹽酸鹽0.05%,調節pH 7.1±0.1,121℃滅菌20 min備用[13]。
②分離培養基:胰蛋白胨2%,牛肉浸膏1%,酵母膏0.6%,葡萄糖0.4%,磷酸氫二鉀0.2%,磷酸二氫鉀0.1%,硫酸鎂0.04%,氯化鈣0.02%,硫酸亞鐵0.01%,鹽酸半胱氨酸0.05%,瓊脂1.8%,pH7.2~7.4,121℃滅菌20 min。
③發酵培養基:葡萄糖3%,蛋白胨0.5%,酵母膏0.5%,硫酸銨0.3%,硫酸鎂0.03%,磷酸二氫鉀0.1%,鹽酸半胱氨酸0.05%,pH值自然,在沸水浴中煮沸除氧,培養基在121℃下滅菌20 min。
1.1.3 試劑和儀器
色譜分析用丁酸等標準品均為色譜純,天津光復精細化工研究所;蛋白胨,酵母膏,牛肉膏,北京奧博星生物有限公司;其他試劑均為分析純,成都科龍化工試劑廠。
YQX-II型厭氧培養箱,上海躍進醫療器械廠;Spectrumlab22PC型可見分光光度計,美國Perkin Elmer TM公司;PowerPac Basic型電泳儀,美國Bio-Rad公司;Gel Doc XR型凝膠成像儀,美國Bio-Rad公司;TGL16M型高速冷凍離心機,湘麓離心機儀器有限公司;Trace DSQⅡ型氣相色譜-質譜聯用儀,美國Thermo Fisher公司,配備DB-WAX(30 m× 250μm×0.25μm,Agilent,美國)毛細管色譜柱。
1.2 產丁酸細菌分離及篩選
富集培養:取10 g窖泥樣品加入到100 mL無菌水中,置于80℃熱水浴中處理10 min,殺滅非芽孢菌,轉入梭菌增殖液體培養基中,以37℃厭氧培養48 h。
稀釋分離:將培養液置于80℃水浴中10 min,取熱處理培養液1 mL,加入盛有100 mL無菌水及玻璃珠的三角瓶中,振蕩5 min,吸取菌液1 mL加入到無菌培養皿中,然后用融化好的培養基倒平板。將平板置于厭氧培養箱,以37℃恒溫培養48 h。
液體培養:從培養皿中挑取菌落觀察菌體形態,如為梭狀芽孢桿菌且顯微鏡觀察形態與丁酸菌相符,則用接種環挑取1環接種于發酵培養基中,37℃厭氧培養箱中培養48 h,GC-MS測定培養液中的丁酸等代謝產物含量。
1.3 代謝產物GC/MS分析
培養液在4℃下10000 r/min離心5 min,收集上清液,加入5倍量的乙醚及一定量的2-乙基丁酸(內標),經分液漏斗分離得到有機相,重復提取2次。向有機相中加5 g無水Na2SO4脫水,過濾,在水浴中經氮氣吹掃濃縮至0.5 mL供GC-MS檢測分析。
色譜條件:進樣口溫度為250℃,初始溫250℃;分流模式,分流比10∶1;升溫程序,初始溫度60℃,保持5 min,以5℃/min升到150℃,再以8℃/min升到220℃,保持5 min;載氣:高純氦氣,流速為1 mL/min。質譜條件:連接口溫度:250℃;電離方式:EI;電子能量:70 eV;離子源溫度:200℃;掃描范圍:40~500 amu,檢出物經GC-MS標準譜庫(NIST05)檢索及標準品的保留時間進行鑒定。
1.4 菌株鑒定
1.4.1 菌落及菌體形態觀察
篩選出的菌株,將其菌懸液梯度稀釋后,涂布于分離培養基瓊脂平板上,于37℃厭氧培養96 h,觀察菌落形態;挑產丁酸量最高的單個菌落分別用光學顯微鏡及掃描電子顯微鏡觀察個體形態。
1.4.2 菌種16S rDNA鑒定
選取培養特征、菌落形態和顯微形態均符合丁酸梭菌培養特征且產丁酸量最高的菌株進行16S rDNA序列分析鑒定。離心收集液體培養至對數生長期的菌體,采用Bacterial DNA Kit試劑盒提取總DNA。提取得到的總DNA采用0.6%瓊脂糖凝膠電泳檢測其純度。采用細菌通用引物(27f:5'-AGAGTTTGATCCTGGCTCAG-3';1492r:5'-GGCTACCTTGTTACGACTT-3')對總DNA進行PCR擴增,送至上海生工公司進行測序。將測序得到的16S rDNA序列在eztaxon上進行BLAST比對后,與GenBank數據庫做相似性分析。
1.5 丁酸菌生長性能研究
1.5.1 培養溫度對菌體生長的影響
發酵培養基初始pH7.0,接種后分別于30℃、34℃、37℃、40℃和45℃溫度下厭氧靜置培養24 h,用血球計數法測定菌體濃度,研究培養溫度對菌體生長的影響。
1.5.2 初始pH值對菌體生長的影響
分別用6 mol/L的HCl和40%的NaOH溶液將發酵培養基起始pH值調節為5.0、5.5、6.0、6.5、7.0、7.5和8.0,接種后以37℃厭氧靜置培養24 h,用血球計數法測定菌數,研究培養基初始pH值對菌體生長的影響。
1.5.3 接種量對菌體生長的影響
調節發酵培養基的初始pH值為7.0,按0.5%、1.0%、1.5%、2.0%、2.5%和3.0%的接種量接種,以37℃厭氧靜置培養24 h,用血球計數法測定菌數,研究接種量對菌體生長的影響。
1.5.4 生長曲線的測定
以2%接種量接種滅菌后的發酵培養基,將接種后的培養基分裝于40支培養管中,15 mL/支,37℃溫度下厭氧靜置培養。每2 h取出2個樣品,立即放入冰箱中貯存,最后用未接種的發酵培養基作空白對照,于波長600 nm處測量吸光值(A600),重復測量3次取平均值。以時間為橫坐標,A600的均值為縱坐標繪制丁酸菌的生長曲線。
2 結果與討論
2.1 產丁酸菌株篩選
通過對窖泥中產丁酸細菌的分離培養后共挑取94株單菌落。根據《伯杰細菌鑒定手冊》,丁酸梭菌為嚴格厭氧桿菌,內生孢子卵圓,偏心或次端生,培養過程中發酵產酸產氣[14]。依據菌株的培養特征和顯微形態,對結果不符合要求的不再進行下一步實驗,對于可能存在不確定結果的繼續進行下一步實驗,初篩出9株個體形態、菌落特征符合條件的菌株。對得到的9株菌進一步進行丁酸發酵實驗。測定發酵液中的丁酸等代謝產物的含量,其結果見表1。得到4株產丁酸梭狀芽孢桿菌,其中菌株YD-4有較好的產丁酸能力,以產丁酸為主,有少量乙酸生成,因此選擇YD-4菌株作為優選菌株。
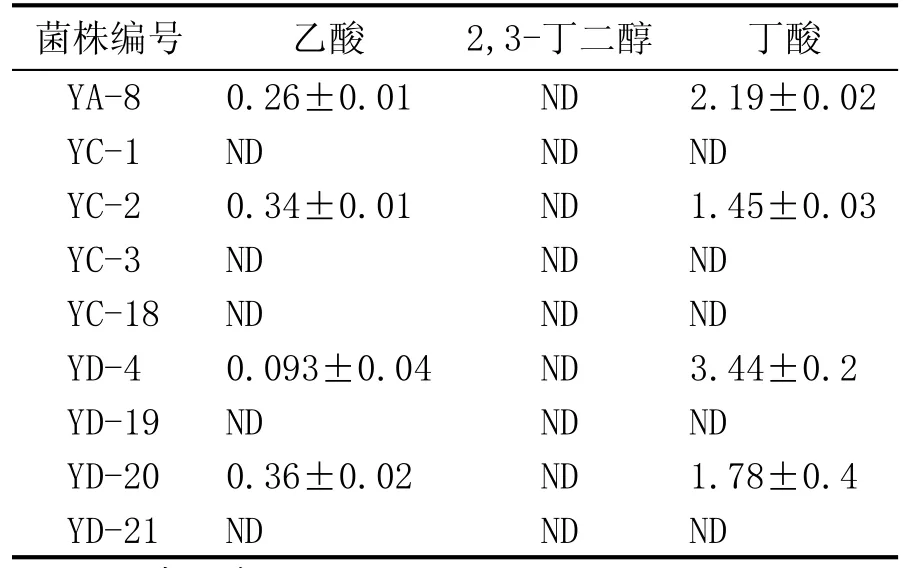
表1 分離菌株的產酸實驗結果 (g/L)
2.2 菌株鑒定
2.2.1 菌落及細胞形態觀察
菌株YD-4經進一步純化后,進行個體形態、菌落特征觀察。菌體形態的電鏡圖和在牛肉膏蛋白胨瓊脂培養基上的菌落形態見圖1。菌落表面黏稠,邊緣處形成白色或乳白色一圈突起,呈不規則圓形形態,稍突。菌體形態為直桿狀,單生,革蘭氏陽性,產芽孢,芽孢中生。
2.2.2 細菌16S rDNA基因序列測定結果
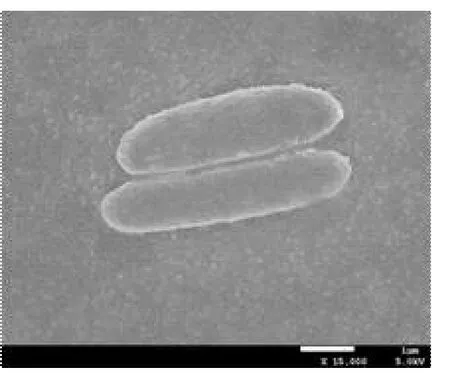
A 掃描電鏡下菌株個體形態
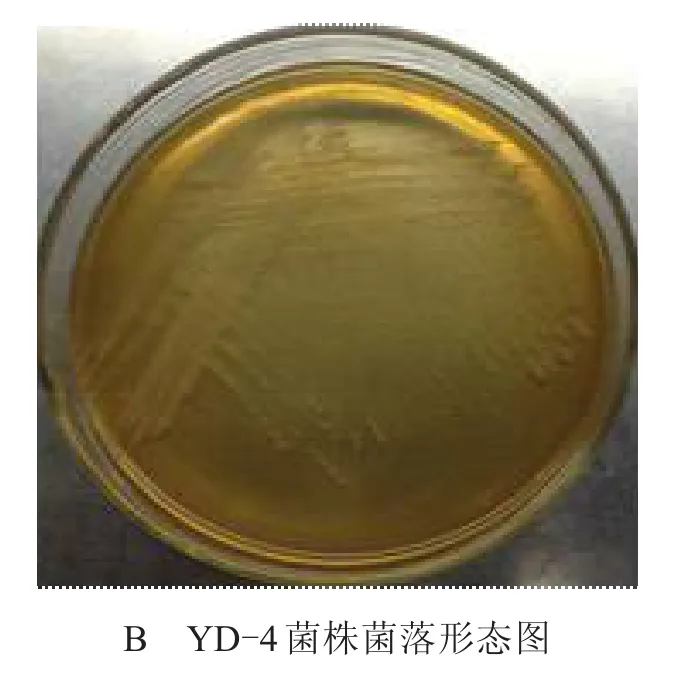
圖1 菌株YD-4的形態特征
YD-4菌株的16S rDNA核苷酸序列結果為:TCTCGCTAGCGTGACCATGCAGTCGAGCGATG AAGCTCCTTCGGGAGTGGATTAGCGGCGGACG GGTGAGTAACACGTGGGTAACCTGCCTCATAG AGGGGAATAGCCTTTCGAAAGGAAGATTAATA CCGCATAAGATTGTAGTACCGCATGGTACAGCA ATTAAAGGAGTAATCCGCTATGAGATGGACCCG CGTCGCATTAGCTAGTTGGTGAGGTAACGGCT CACCAAGGCGACGATGCGTAGCCGACCTGAGA GGGTGATCGGCCACATTGGGACTGAGACACGG CCCAGACTCCTACGGGAGGCAGCAGTGGGGA ATATTGCACAATGGGGGAAACCCTGATGCAGC AACGCCGCGTGAGTGATGACGGTCTTCGGATT GTAAAGCTCTGTCTTTAGGGACGATAATGACG GTACCTAAGGAGGAAGCCACGGCTAACTACGT GCCAGCAGCCGCGGTAATACGTAGGTGGCAAG CGTTGTCCGGATTTACTGGGCGTAAAGGGAGC GTAGGTGGATATTTAAGTGGGATGTGAAATACC CGGGCTTAACCTGGGTGCTGCATTCCAAACTG GATATCTAGAGTGCAGGAGAGGAAAGGAGAAT TCCTAGTGTAGCGGTGAAATGCGTAGAGATTA GGAAGAATACCAGTGGCGAAGGCGCCTTTCTG GACTGTAACTGACACTGAGGCTCGAAAGCGTG GGGAGCAAACAGGATTAGATACCCTGGTAGTC CACGCCGTAAACGATGAATACTAGGTGTAGGG GTTGTCATGACCTCTGTGCCGCCGCTAACGCAT TAAGTATTCCGCCTGGGGAGTACGGTCGCAAG ATTAAAACTCAAAGGAATTGACGGGGGCCCGC ACAAGCAGCGGAGCATGTGGTTTAATTCGAAG CAACGCGAAGAACCTTACCTAGACTTGACATC TCCTGAATTACTCTGTAATGGAGGAAGCCACTT CGGTGGCAGGAAGACAGGTGTTGCATGGTTGT CGTCAGCTCGTGTCGTGAGATGTTGGGTTAAG TCCCGCAACGAGCGCAACCCTTATTGTAGTTG CTACCATTTAGTTGAGCACTCTAGCGAGAC
測序結果在NCBI使用BLASTN比對初步確定為丁酸梭狀芽孢桿菌,從GenBank數據庫中獲得有關種的公認標準序列數據,使用ClustalX1.8對齊后使用MEGA 2.1計算序列相似性并作系統發育分析,結果見圖2。系統發育樹中篩選出的產丁酸菌株與Clostridium butyricum屬同一分枝,確定篩選出的產丁酸菌株為Clostridium butyricum,暫命名為丁酸菌YD-4。
2.3 丁酸菌的生長特性
2.3.1 培養溫度對菌體生長的影響
不同溫度條件下培養24 h的菌體濃度見表2。由表2可以看出,丁酸菌的適宜培養溫度為30~45℃,培養溫度為37℃時菌體濃度最高,為1.56× 108個/mL。因此丁酸菌YD-4的最適培養溫度應為37℃。
2.3.2 初始pH值對菌體生長的影響
培養基的初始pH值對菌體生長的影響,結果見表3。由表3可以看出,當培養基的初始pH值為5.0~6.0時,菌體濃度沒有明顯變化;當pH值大于7.0時,菌體濃度開始下降;當pH值為7.0時,菌體濃度最大,為1.45×108個/mL。因此培養基的初始pH值應為7.0。培養基的pH值對微生物的生命活動有較大影響,pH值會影響細胞膜所帶的電荷,引起細胞對營養物質的吸收狀況發生變化。另外pH值還可以通過改變培養基中有機化合物離子化作用的程度,對丁酸菌細胞施加間接的影響[15]。
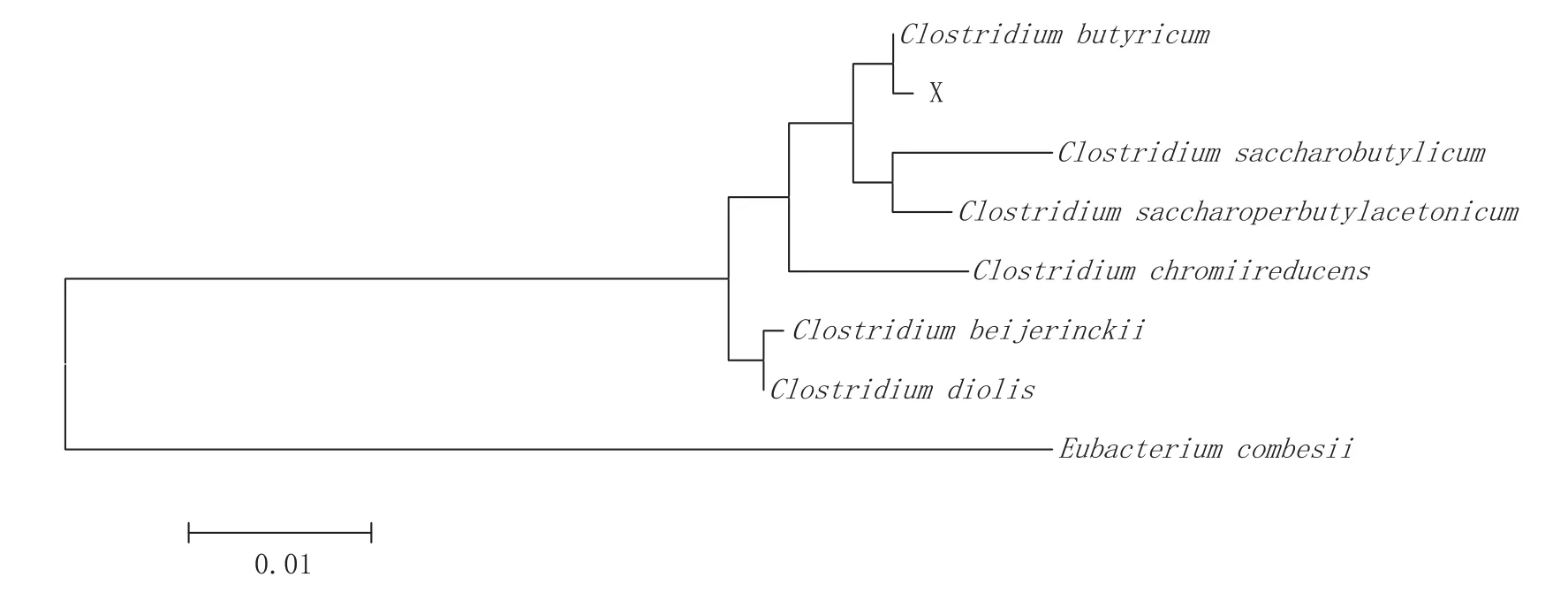
圖2 菌株YD-4系統發育樹
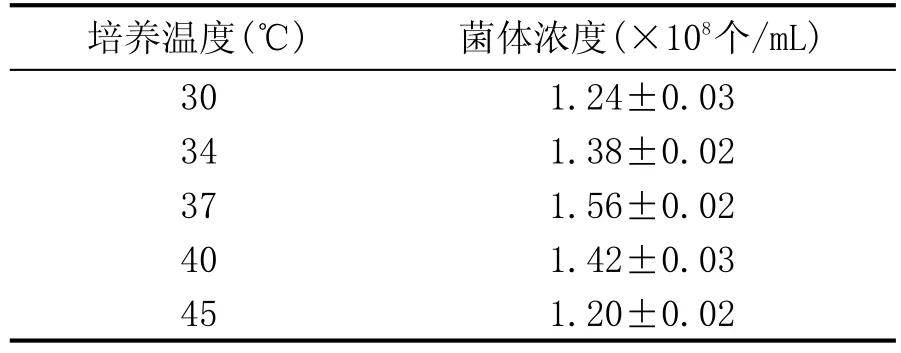
表2 不同培養溫度對菌體生長的影響

表3 初始pH值對菌體生長的影響
2.3.3 接種量對菌體生長的影響
接種量的大小對發酵液的菌體數量具有一定的影響。過小的接種量會使菌體增殖緩慢,延長延滯期和培養時間。過大的接種量由于帶入較多的種子培養時期的代謝產物,會使菌體前期生長過快,影響最終的菌體數量[16]。接種量對丁酸菌YD-4菌體生長的影響結果見表4。由表4可以看出,丁酸菌YD-4的菌體濃度隨著接種量的增加而增加,當接種量為0.5%時菌體濃度最低;接種量2%與 3%比較菌體濃度并無顯著差異,因此選取2%為最佳接種量,此時菌體濃度為1.64×108個/mL。

表4 接種量對菌體生長的影響
2.3.4 丁酸菌的生長曲線
丁酸菌YD-4生長曲線見圖3。
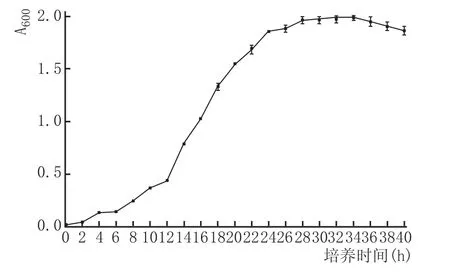
圖3 丁酸菌YD-4的生長曲線
由圖3可以看出,丁酸菌YD-4在發酵培養基中培養12 h后進入對數生長期,菌體濃度急劇上升,培養24 h后進入穩定期,菌體濃度達到最大值,此后菌體數不再增加。由于培養過程中消耗營養物質,生長環境也會發生相應的改變,變得不再適合其生長,大部分菌體由營養體生長狀態逐漸向芽孢狀態轉化,同時芽孢生長速率加快,隨著培養時間的增加,菌體濃度呈下降趨勢[17]。培養到34 h后菌體濃度略有降低。
3 結論
從川南某酒廠的老窖泥中經嚴格厭氧培養分離出94株菌種,從中篩選得到符合丁酸梭菌屬個體形態、菌落特征的菌株9株,對其進行發酵能力試驗,得到4株產丁酸細菌。選出產丁酸量最高的菌株進行16S rDNA鑒定,確定為Clostridium butyricum,暫命名為丁酸菌YD-4。丁酸菌YD-4的最適培養溫度為37℃、初始pH值為7.0、最適的接種量為2%。丁酸菌YD-4在發酵培養基培養48 h,以產丁酸為主,有少量乙酸生成,丁酸產酸量可達到3.44 g/L。
[1] 周恒剛.老窖泥培養[M].北京:中國計量出版社,1998.
[2] 施思,王海英,張文學,等.濃香型白酒不同窖泥的微生物群落特征分析[J].釀酒科技,2011(5):29-32.
[3] 胡承,應鴻,許德富,等.窖泥微生物群落的研究及其應用[J].釀酒科技,2005(3):34-38.
[4] 吳衍庸.濃香型曲酒微生物技術[M].成都:四川科學技術出版社,1987.
[5] 雷光電,姚萬春,唐玉明,等.瀘州老窖窖泥中重要功能菌群分布及代謝產物研究[J].釀酒科技,2012(11):54-57.
[6] 沈怡方.白酒中四大乙酯在釀造發酵中形成的探討[J].釀酒科技,2003(5):28-31.
[7]ZHANG W X,QIAO Z W,SHIGEMATSU T,et al. Analysis of the bacterial community in Zaopei during production of Chinese Luzhou-flavor liquor[J].Journal of the institute of brewing,2005,113(2):215-222.
[8] 任道群,唐玉明,姚萬春,等.多菌株共酵培養優質窖泥的研究[J].中國釀造,2013,32(6):61-64.
[9] 任劍波,姚萬春,唐玉明,等.窖泥復合功能菌液培養配方研究[J].釀酒,2014,41(5):47-50.
[10] 杜禮泉,王遠成,饒家權,等.窖泥復合功能菌液培養及應用的研究[J].釀酒,2009,36(5):35-36.
[11] 徐立新,徐開成,王春梅.產酸菌的分離純化[J].釀酒科技,2001(5):23-24.
[12] 陳翔,王亞慶,邵海燕.己酸菌純種培養與混合培養技術在窖泥生產中的應用[J].釀酒,2009,36(3):35-37.
[13] 杜連祥,路福平.微生物實驗技術[M].北京:中國輕工業出版社,2006:110-112.
[14] HOLT J G.Bergey's manual of determinative bacteriology[M].9th ed.Philadelphia:Lippincott Williams&Wilkins,1993.
[15] 李賢宇,張蕊,周博.酪酸菌培養條件的優化[J].天津化工,2010(1):22-24.
[16] 王剛.酪酸梭狀芽孢桿菌活菌制劑的研制[D].天津:天津科技大學,2002.
[17]DüRRE P,HOLLERGSCHWANDNER C.Initiation of endospore formation in Clostridium acetobutylicum[J]. Anaerobe,2004,10(2):69-74.
Isolation and Identification of a Butyric Acid-Producing Strain from Pit Mud and Study on Its Growth Performance
YUAN Huawei1,ZHAO Meng1,JIANG Jun1,LIU Guangqian2,HU Yongqi2,3, SHEN Caihong2,3,WU Chongde4,ZHOU Rongqing3,4and SONG Chuan2,3
(1.College of Life Science and Food Engineering,Yibin University,Yibin,Sichuan 644000;2.Luzhou Laojiao Co.Ltd.,Luzhou, Sichuan 646000;3.National Engineering Technology Research Center of Solid-state Brewing,Luzhou,Sichuan 646000; 4.College of Light Industry,Textile and Food Engineering,Sichuan University,Chengdu,Sichuan 610065,China)
A Clostridium strain with high yield of butyric acid was isolated through cumulation cultivation,isolation,purification,and butyric acid fermentation from aged pit mud in a distillery in south Sichuan.16Sr DNA identification suggested that such strain is Clostridium butyricum and it was named YD-4.The research on its growth performance indicated that its optimum growth temperature was at 37℃,its optimum pH value was about 7.0,its best inoculating quantity was 2%.As the total number of bacteria reached up to 1.64×108個/mL,the yield of butyric acid was 3.44 g/L.
pit mud;butyric acid-producing bacteria;isolation;identification;growth performance
TS262.3;TS261.4;TS261.1
A
1001-9286(2017)05-0035-06
10.13746/j.njkj.2017023
四川省科技廳科技計劃重點項目《基于風味指紋圖譜的微生物強化共培技術研究及應用》(2014SZ0129);四川省科技成果轉化項目《濃香型白酒智能化與自動化生產關鍵技術集成及產業化示范》(2016CC0032)。
2017-02-13
袁華偉(1967-),男,四川安岳人,高級工程師,博士,主要研究方向為白酒微生物發酵,發表論文數篇。
周榮清(1960-),男,教授,博導,研究方向:現代發酵技術及酶應用技術,E-mail:rqzhou@163.com。
優先數字出版時間:2017-03-15;地址:http://kns.cnki.net/kcms/detail/52.1051.TS.20170315.1637.005.html。

