植物MYB44轉(zhuǎn)錄因子的功能及其在橡膠樹抗逆研究中的應(yīng)用前景
王立豐+陸燕茜+王紀(jì)坤+覃碧+張冬

摘 要 MYB44是植物典型的R2R3-MYB轉(zhuǎn)錄因子,在不同物種間基因結(jié)構(gòu)保守,可轉(zhuǎn)錄調(diào)控植物對干旱和鹽等脅迫的抵抗能力。筆者總結(jié)了MYB44的結(jié)構(gòu)特征,著重闡述MYB44轉(zhuǎn)錄因子在逆境響應(yīng)中的調(diào)控機(jī)制與應(yīng)用現(xiàn)狀,并對HbMYB44在橡膠樹抗逆研究中的應(yīng)用進(jìn)行了展望。
關(guān)鍵詞 MYB44 ;轉(zhuǎn)錄調(diào)控 ;逆境 ;橡膠樹
中圖分類號 S794.1 ;Q291 文獻(xiàn)標(biāo)識碼 A Doi:10.12008/j.issn.1009-2196.2017.05.007
Functions of Plant MYB44 Transcript Factor and Its ApplicationProspects
for Stress Resistance Research in Rubber Tree
WANG Lifeng1) LU Yanxi2) WANG Jikun1) QIN Bi1) ZHANG Dong2)
(1 Rubber Research Institute, CATAS / Danzhou Investigation and Experiment Station of
Tropical Crops, Ministry of Agriculture, Danzhou, Hainan 571737;
2 Hainan Key Laboratory for Sustainable Utilization of Tropical Bioresource /
Institute of Tropical Agriculture and Forestry, Hainan University, Haikou, Hainan 570228)
Abstract MYB44 was a typical plant R2R3-MYB transcription factor, and its gene structure was conserved in different plant species. MYB44 could regulate plant resistance to drought and salt stress. The structural characteristics of MYB44 were summarized, with an emphasis on the regulation mechanism and application status of MYB44 transcription factor in stress response, and a prospect for application of HbMYB44 in the study of stress resistance of Hevea brasiliensis was put forward.
Keywords MYB44 ; transcriptional regulation ; stress ; Hevea brasiliensis Muell. Arg
植物R2R3-MYB轉(zhuǎn)錄因子通過結(jié)合靶標(biāo)基因啟動子MBSI(T/C)AAC(T/G)G和MBSIIG(G/T)T(A/T)G(G/T)T元件來調(diào)控植物次生代謝和逆境響應(yīng)等重要生理生化過程,且其調(diào)控過程還受多種激素和環(huán)境因子誘導(dǎo)。MYB轉(zhuǎn)錄因子主要通過與bHLH、WD等其它轉(zhuǎn)錄因子或者其互作蛋白相結(jié)合來調(diào)控植物多個(gè)重要生理生化過程,其自身也受到轉(zhuǎn)錄水平和翻譯后水平的調(diào)節(jié)。天然橡膠生物合成是通過異戊二烯合成路徑進(jìn)行的,是典型的植物次生代謝途徑,參與橡膠樹生長發(fā)育和抗逆反應(yīng)。在模式植物中,已證明MYB調(diào)控異戊二烯合成關(guān)鍵酶的表達(dá),但MYB轉(zhuǎn)錄因子轉(zhuǎn)錄調(diào)節(jié)天然橡膠生物合成的機(jī)制尚不清楚。筆者詳細(xì)綜述了R2R3MYB類轉(zhuǎn)錄因子MYB44的結(jié)構(gòu)特征及其在逆境響應(yīng)中的調(diào)控機(jī)制和應(yīng)用現(xiàn)狀,并對HbMYB44在橡膠樹抗逆研究中的應(yīng)用進(jìn)行了展望。
1 MYB轉(zhuǎn)錄因子結(jié)構(gòu)與功能概述
MYB轉(zhuǎn)錄因子在高等植物中分布廣泛,是最大的轉(zhuǎn)錄因子家族成員之一,在N端具有高度保守的HTH_MYBDNA結(jié)合結(jié)構(gòu)域[1]。MYB轉(zhuǎn)錄因子是植物激素信號轉(zhuǎn)導(dǎo)和各種應(yīng)激反應(yīng)途徑的關(guān)鍵物質(zhì),在植物生長發(fā)育、代謝及響應(yīng)生物和非生物脅迫的調(diào)控網(wǎng)絡(luò)中具有重要作用[2]。植物第一個(gè)MYB轉(zhuǎn)錄因子是玉米中與色素合成相關(guān)的ZmMYBC1基因[3]。迄今為止,在擬南芥中已發(fā)現(xiàn)超過198個(gè)MYB家族基因[4],棉花中發(fā)現(xiàn)大約有200個(gè)MYB轉(zhuǎn)錄因子[5],玉米中有100個(gè)左右MYB 轉(zhuǎn)錄因子[6],毛果楊中至少有197個(gè)MYB轉(zhuǎn)錄因子,葡萄中已發(fā)現(xiàn)超過124個(gè)MYB轉(zhuǎn)錄因子[7]。MYB類轉(zhuǎn)錄因子以其結(jié)構(gòu)上都有一段保守的DNA結(jié)合區(qū)——MYB結(jié)構(gòu)域而得名,由3個(gè)保守的結(jié)構(gòu)域組成,即DNA結(jié)合結(jié)構(gòu)域、轉(zhuǎn)錄激活結(jié)構(gòu)域和一個(gè)不完全界定的負(fù)調(diào)節(jié)區(qū)[8]。其中DNA結(jié)合結(jié)構(gòu)域最為保守,一般包含1~3個(gè)不完全重復(fù)序列(R),每個(gè)重復(fù)片段R由51~52個(gè)保守的氨基酸殘基和間隔序列組成,每隔約18個(gè)氨基酸規(guī)則間隔1個(gè)色氨酸殘基,這些氨基酸殘基使MYB結(jié)構(gòu)域折疊成一個(gè)3D的螺旋-轉(zhuǎn)角-螺旋(Helix-Turn-Helix,HTH)結(jié)構(gòu)[9],對維持HTH的構(gòu)型有重要意義。根據(jù)MYB結(jié)構(gòu)域所含MYB重復(fù)個(gè)數(shù),把MYB類轉(zhuǎn)錄因子分為4種類型,即單一的MYB結(jié)構(gòu)域蛋白(R1/R2)、包含2個(gè)重復(fù)的2R蛋白(R2R3)、包含3個(gè)重復(fù)的3R蛋白(R1R2R3)以及4個(gè)MYB重復(fù)的4R-MYB蛋白[10-11]。
研究表明,MYB轉(zhuǎn)錄因子廣泛參與植物次生代謝[12]、激素和環(huán)境因子應(yīng)答[13],并對細(xì)胞分化、細(xì)胞周期以及葉片等器官形態(tài)建成[14]具有重要的調(diào)節(jié)作用。例如,AtMYB23轉(zhuǎn)錄因子能調(diào)控?cái)M南芥表皮細(xì)胞分化、誘導(dǎo)不定根發(fā)育及葉子和莖的伸長[15],過表達(dá)AtMYB2能增強(qiáng)轉(zhuǎn)基因植株的抗旱能力[16]。GhMYB109轉(zhuǎn)錄因子能直接參與調(diào)節(jié)棉花纖維細(xì)胞的發(fā)生和延伸[17]。在楊樹中過表達(dá)BpMYB106轉(zhuǎn)錄因子能顯著地提高表皮毛密度、凈光合速率以及生長速率[18],JcMYB2通過參與茉莉酸和脫落酸信號途徑交互來調(diào)控麻風(fēng)樹(Jatropha curcas)根系發(fā)育的逆境響應(yīng)[19]。MYB轉(zhuǎn)錄因子主要通過下調(diào)下游關(guān)鍵基因表達(dá)參與防衛(wèi)反應(yīng)和植物生長發(fā)育。如,金魚草AmMYB305和其同源的擬南芥AtMYB4轉(zhuǎn)錄因子通過抑制編碼C4H酶的關(guān)鍵基因的表達(dá)來積累紫外線,從而防護(hù)物質(zhì)芥子酸酯[20]。AmMYB308轉(zhuǎn)錄因子下調(diào)C4H(cinnamate-4-hydroxylase),4CL(coumaroyl-4-Co A ligase),CAD(cinnamyl alcohol dehdrogenase)基因調(diào)控苯丙酸和木質(zhì)素的生物合成[21]。AtMYB32轉(zhuǎn)錄因子通過抑制擬南芥中COMT基因的表達(dá)來調(diào)控花粉管發(fā)育[22]。
2 MYB44轉(zhuǎn)錄因子研究進(jìn)展
2.1 MYB44轉(zhuǎn)錄因子結(jié)構(gòu)
擬南芥基因組MYB轉(zhuǎn)錄因子按結(jié)構(gòu)特性分為22個(gè)亞組[23],相同亞組的基因成員具有類似的功能。MYBR1(MYB44)是最早發(fā)現(xiàn)的與動物MYB轉(zhuǎn)錄因子相似的基因之一[24]。AtMYB44是典型的R2R3-MYB轉(zhuǎn)錄因子,屬于第22亞家族,這個(gè)亞家族中由AtMYB44、AtMYB70、AtMYB73[25]和AtMYB77[26]4個(gè)成員組成,有2個(gè)保守的基元TGLYMSPxSP和GxFMxVVQEMIxxEVRSYM,此結(jié)構(gòu)含2個(gè)分別由50~53個(gè)氨基酸序列形成的螺旋-轉(zhuǎn)角-螺旋R2R3基元。該亞組成員具有基因結(jié)構(gòu)保守、功能相近和表達(dá)規(guī)律相似等特點(diǎn),與下游基因啟動子區(qū)MBSI(T/C)AAC(T/G)G和MBSIIG(G/T)T(A/T)G(G/T)T元件結(jié)合[23,27-28]。
2.2 MYB44轉(zhuǎn)錄因子在逆境脅迫中的功能研究
2.2.1 MYB44在植物激素信號中的作用
植物抗逆、防御病蟲害主要與激素信號轉(zhuǎn)導(dǎo)機(jī)制有關(guān)。研究表明,MYB44是水楊酸(salicylic acid,SA)、脫落酸(abscisic acid,ABA)、茉莉酸(jasmonic acid,JA)和乙烯(ethylene,ET)、生長素(Auxin)和赤霉素(gibberellin,GA)信號途徑共同的轉(zhuǎn)錄因子,參與上述激素信號途徑的交互作用,對微生物、真菌、鈣離子信號、鹽和干旱等生物和非生物脅迫有所響應(yīng)。
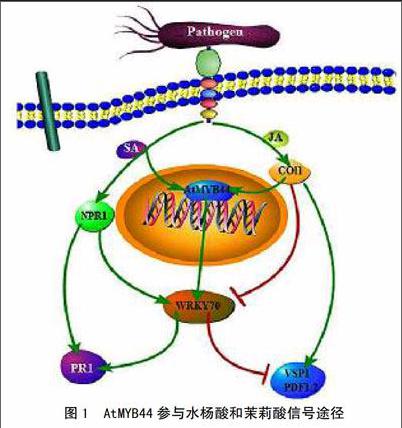
茉莉酸類是一種植物激素家族,調(diào)節(jié)生殖發(fā)育過程,例如花發(fā)育、花粉成熟和衰老[29],茉莉酮酸酯還作為響應(yīng)于傷口和病原體感染中的激活防御基因的局部或系統(tǒng)的信號分子[30]。AtMYB44是擬南芥中一個(gè)多功能的轉(zhuǎn)錄激活因子,最初通過微陣列被確定為茉莉酸誘導(dǎo)的基因[31]。茉莉酸和胡蘿卜軟腐歐文氏菌胡蘿卜亞種(Erwinia carotovora subsp. Carotovora, Ecc)可以誘導(dǎo)AtMYB44的表達(dá)[32],這說明AtMYB44參與擬南芥防衛(wèi)胡蘿卜軟腐歐文氏菌的過程,其機(jī)制為AtMYB44抑制JA通路信號傳導(dǎo)(圖1),并負(fù)調(diào)控?cái)M南芥對胡蘿卜軟腐歐文氏菌的抗病性。盡管茉莉酸甲酯(MeJA)和傷害處理能夠上調(diào)AtMYB44表達(dá),但AtMYB44對茉莉酸激素信號的響應(yīng)無特異性[32-33]。
用ABA處理擬南芥后,AtMYB44轉(zhuǎn)錄水平明顯增加,并且在導(dǎo)管和葉片氣孔中高效表達(dá)。MYB44在ABA信號轉(zhuǎn)導(dǎo)中的作用機(jī)制為脫落酸信號受體PYL8與MYB77和MYB44形成蛋白復(fù)合體,促進(jìn)MYB44結(jié)合下游靶標(biāo)基因啟動子區(qū)的MBSI基序,從而調(diào)控ABA響應(yīng)基因表達(dá)(圖2)[34]。此外,AtMYB44通過抑制ABA的負(fù)調(diào)控因子PP2Cs(絲氨酸/蘇氨酸蛋白激酶2C家族)來對ABA進(jìn)行正向調(diào)控[35]。Li等[36]2014采用pulldown和酵母雙雜交技術(shù)證明AtMYB44轉(zhuǎn)錄因子N端54-105氨基酸與ABA受體RCAR1具有直接互作作用。
在乙烯信號途徑中,MYB44調(diào)控乙烯信號途徑重要環(huán)節(jié)EIN2表達(dá),從而調(diào)節(jié)植株對蚜蟲和蛾子的抗性。AtMYB44與EIN2都對芥子油苷合成相關(guān)基因中的11個(gè)基因轉(zhuǎn)錄水平有影響,AtMYB44與EIN2的轉(zhuǎn)錄調(diào)控作用可能是通過影響芥子油苷合成來達(dá)到抗蚜蟲和小菜蛾的目的,這一調(diào)控過程對誘導(dǎo)抗性和免疫反應(yīng)都有作用,代表了植物抵抗植食昆蟲的一種重要防衛(wèi)機(jī)制[37]。
在激素信號交互中,革蘭氏陰性植物病原細(xì)菌產(chǎn)生的harpin蛋白HrpNEa在抗蟲、抗病中的作用是:通過擬南芥MYB44轉(zhuǎn)錄調(diào)控ABA和乙烯信號的關(guān)鍵因子ABI2和EIN2蛋白來實(shí)現(xiàn)的[38]。AtMYB44通過直接調(diào)控WRKY70表達(dá)來調(diào)節(jié)水楊酸和茉莉酸信號在植物防衛(wèi)反應(yīng)中的作用[39]。脫落酸和赤霉素在植物種子萌發(fā)和幼苗發(fā)育過程具有拮抗作用,如赤霉素抑制劑會上調(diào)MYB44表達(dá)來抑制種子萌發(fā)[40]。
2.2.2 MYB44在病蟲害防御和植物生長發(fā)育中的作用機(jī)制
MYB44在氧化脅迫和非生物抗性中具有重要作用,還參與種子成熟、胚的發(fā)育等生理過程。MYB44是絲裂原活化蛋白激酶(MPK3)底物,是植物防衛(wèi)的早期響應(yīng)因子[41],參與ISR(intergenic spacer region)分子機(jī)制,對葉片氣孔阻力進(jìn)行調(diào)控[42]。研究表明,過表達(dá)MYB44轉(zhuǎn)錄因子能提高葉片的抗旱能力,降低葉片水分蒸發(fā)幾率[34]。王艷紅等[43]采用 mRNA差異顯示技術(shù)(DDRT-PCR)和反向Northern雜交技術(shù)分析小麥 Brock在白粉菌誘導(dǎo)下的差異表達(dá)基因,發(fā)現(xiàn)經(jīng)白粉菌誘導(dǎo)后MYB44的表達(dá)明顯上調(diào)。AtMYB44可調(diào)控?cái)M南芥受丁香假單胞菌侵染后所引起的細(xì)胞防衛(wèi)反應(yīng),這種反應(yīng)依賴SA信號通路PR1基因,AtMYB44通過調(diào)控PR1基因的表達(dá)來提高對丁香假單胞菌的抗性[44]。擬南芥對蚜蟲的抗性與harpin蛋白有關(guān),MYB44是37個(gè)響應(yīng)harpin蛋白的一員,其上調(diào)表達(dá)量最高[45-46]。植物生長促進(jìn)真菌Penicillium simplicissimum GP17-2通過調(diào)控MYB44介導(dǎo)氣孔張開,從而提高植株對丁香假單胞菌Pseudomonas syringae pv. tomato DC3000(Pst)的抗性[42]。但是,灰霉病會導(dǎo)致過表達(dá)擬南芥的抗性降低。可見,擬南芥對真菌Penicillium simplicissimum的系統(tǒng)抗性與HbMYB44調(diào)控氣孔開關(guān)有關(guān)。
在擬南芥種子萌發(fā)過程中,MPK3和MPK6激酶分別作用于MYB44的Ser53和Ser145,從而調(diào)控種子萌發(fā)[40]。AtMYB44還具有促進(jìn)擬南芥抗病、耐熱及抑制開花的作用。過表達(dá)MYB44會使細(xì)胞變小,但不影響細(xì)胞數(shù)量[47]。
2.3 MYB44在其它作物中的應(yīng)用
以小麥幼胚誘導(dǎo)的愈傷組織為轉(zhuǎn)化受體,以磷酸甘露糖異構(gòu)酶基因作為選擇標(biāo)記,通過基因槍介導(dǎo)法將帶有AtMYB44基因的表達(dá)質(zhì)粒AF234296-44導(dǎo)入小麥品種揚(yáng)麥158,證明擬南芥轉(zhuǎn)錄因子AtMYB44基因?qū)π←溈共∧芰Φ挠绊慬48]。在番茄中的研究證明番茄激酶SpMPKs通過調(diào)控MYB44轉(zhuǎn)錄因子蛋白,進(jìn)而調(diào)控番茄對非生物脅迫的響應(yīng)。將擬南芥AtMYB44轉(zhuǎn)入水稻后,分別對經(jīng)不同脅迫處理后的水稻各組織進(jìn)行RT-PCR 分析,結(jié)果表明AtMYB44基因在干旱和高鹽的脅迫下存在過量表達(dá)。生理功能分析結(jié)果表明,轉(zhuǎn)基因水稻中MYB44基因的過量表達(dá)明顯提高了水稻對低溫脅迫的耐受性[49]。將番茄的SpMPK3基因在擬南芥中過表達(dá),也發(fā)現(xiàn)它能通過提高AtMYB44表達(dá)量來提高植株對滲透脅迫的抗性[50]。在轉(zhuǎn)基因大豆中,也證明了MYB44在大豆對干旱和鹽脅迫抗性中的作用[51]。
3 MYB44轉(zhuǎn)錄因子在橡膠樹抗逆研究中的展望
盡管相關(guān)學(xué)者在多種植物中證明MYB轉(zhuǎn)錄因子具有多樣性的功能,但在橡膠樹中研究較少。研究較為深入的是與死皮相關(guān)的HbMYB1轉(zhuǎn)錄因子,其在橡膠樹的葉片、樹皮以及膠乳中表達(dá),并且能有效地減少橡膠樹死皮病的發(fā)生[13]。轉(zhuǎn)基因?qū)嶒?yàn)證明,HbMYB1還具有抑制煙草遭遇逆境所引起的細(xì)胞死亡過程[52]。HbSM1也是與橡膠樹發(fā)育有關(guān)的MYB轉(zhuǎn)錄因子,參與橡膠樹抗逆響應(yīng)過程[53]。
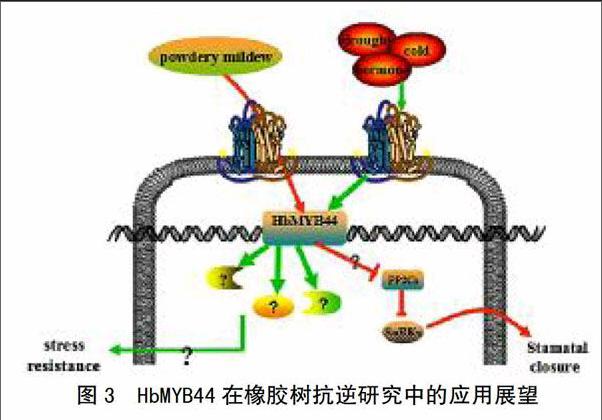
橡膠樹在中國經(jīng)常受到干旱[54]、寒害和病原菌侵染[55]等非生物與生物脅迫。最近,筆者采用分子生物學(xué)技術(shù)在橡膠樹中克隆了HbMYB44轉(zhuǎn)錄因子基因,結(jié)合其在模式植物和作物中的研究進(jìn)展,對其在橡膠樹抗逆研究中的應(yīng)用前景展望如圖3所示。
在基因功能驗(yàn)證方面,將HbMYB44轉(zhuǎn)入擬南芥[56]、水稻[49]、小麥[48]是最直接有效的驗(yàn)證方式。可將HbMYB44轉(zhuǎn)入煙草、擬南芥或者橡膠草中,經(jīng)測序鑒定為穩(wěn)定植株后,通過采用干旱、低溫、激素分別處理幼苗和白粉菌侵染葉片的方法來鑒定該基因在抗逆和抗病中的作用。
突變體技術(shù),包括利用雙突變體和四突變體研究基因功能的有效手段,例如,mybr1(MYB44)×mybr2(MYB77)雙突變體比單突變體表型衰老更明顯,說明MYB44和MYB77對衰老均有重要的調(diào)控作用[34]。將HbMYB44基因在擬南芥野生Col中過表達(dá),并將其轉(zhuǎn)入atmyb44突變體進(jìn)行互補(bǔ)驗(yàn)證,獲得穩(wěn)定植株后分析轉(zhuǎn)基因植株表型和經(jīng)干旱、低溫、激素處理后的基因差異表達(dá)規(guī)律,有助于揭示HbMYB44結(jié)構(gòu)及其在植物生長發(fā)育和抗逆過程中的功能。
在轉(zhuǎn)錄因子鑒定方面,除了轉(zhuǎn)錄因子自激活活性鑒定和亞細(xì)胞定位分析,還要結(jié)合體內(nèi)體外蛋白-蛋白和蛋白-DNA互作技術(shù)闡明HbMYB44調(diào)控下游基因啟動子區(qū)的結(jié)合元件、互作蛋白的位點(diǎn)等,例如,凝膠阻滯實(shí)驗(yàn)證明MYB44與MBSII元件在體外具有結(jié)合活性[57],體內(nèi)共轉(zhuǎn)化實(shí)驗(yàn)證明二者不具有結(jié)合活性[41]。此外,可采用染色質(zhì)免疫沉淀技術(shù)與體內(nèi)共轉(zhuǎn)化熒光素酶技術(shù)相結(jié)合研究HbMYB44與其互作DNA、蛋白的結(jié)合。
總之,系統(tǒng)地分析橡膠樹HbMYB44及其互作蛋白、基因有助于闡明HbMYB44轉(zhuǎn)錄調(diào)控天然橡膠抗逆的分子機(jī)制,為培育橡膠樹抗逆品種和研發(fā)新型抗逆栽培技術(shù)提供技術(shù)指導(dǎo)。
參考文獻(xiàn)
[1] 陳 俊, 王宗陽. 植物MYB類轉(zhuǎn)錄因子研究進(jìn)展[J]. 植物生理與分子生物學(xué)學(xué)報(bào),2002,28(2):81-88.
[2] Ambawat S, Sharma P, Yadav N R, et al. MYB transcription factor genes as regulators for plant responses: an overview[J]. Physiol Mol Biol Plants, 2013, 19(3): 307-321.
[3] Paz-Ares J, Ghosal D, Wienand U, et al. The regulatory c1 locus of Zea mays encodes a protein with homology to myb proto-oncogene products and with structural similarities to transcriptional activators [J]. Embo J, 1987, 6(12): 3 553-3 558.
[4] Chen Y H, Xiaoyuan Y, Kun H, et al. The MYB transcription factor superfamily of Arabidopsis: expression analysis and phylogenetic comparison with the rice MYB family[J]. Plant Mol Biol, 2006, 60(1): 107-124.
[5] Cedroni M L, Cronn R C, Adams K L, et al. Evolution and expression of MYB genes in diploid and polyploid cotton[J]. Plant Mol Biol, 2003, 51(3): 313-325.
[6] Rabinowicz P D, Braun E L, Wolfe A D, et al. Maize R2R3 Myb genes: Sequence analysis reveals amplification in the higher plants [J]. Genetics, 1999, 153(1): 427-444.
[7] Wilkins O, Nahal H, Foong J, et al. Expansion and diversification of the Populus R2R3-MYB family of transcription factors [J]. Plant Physiol, 2009, 149(2): 981-993.
[8] Rosinski J A, Atchley W R. Molecular evolution of the Myb family of transcription factors: evidence for polyphyletic origin[J]. J Mol Evoluti, 1998, 46(1): 74-83.
[9] Ogata K, Kanei-Ishii C, Sasaki M, et al. The cavity in the hydrophobic core of Myb DNA-binding domain is reserved for DNA recognition and trans-activation [J]. Nat Struct Biol, 1996, 3(2): 178-187.
[10] Ogata K, Morikawa S, Nakamura H, et al. Solution structure of a specific DNA complex of the Myb DNA-binding domain with cooperative recognition helices[J]. Cell, 1994, 79(4): 639-648.
[11] 陳 清,湯浩茹,董曉莉,等. 植物Myb轉(zhuǎn)錄因子的研究進(jìn)展 [J]. 基因組學(xué)與應(yīng)用生物學(xué),2009,28(2):365-372.
[12] Uimari A, Strommer J. Myb26: a MYB-like protein of pea flowers with affinity for promoters of phenylpropanoid genes[J]. Plant J, 1997, 12(6): 1 273-1 284.
[13] Chen S, Peng S, Huang G, et al. Association of decreased expression of a Myb transcription factor with the TPD(tapping panel dryness)syndrome in Hevea brasiliensis[J]. Plant Mol Biol, 2003, 51(1): 51-58.
[14] Lee M M, Schiefelbein J. Cell pattern in the Arabidopsis root epidermis determined by lateral inhibition with feedback[J]. The Plant Cell, 2002, 14(3): 611-618.
[15] Matsui K, Hiratsu K, Koyama T, et al. A chimeric AtMYB23 repressor induces hairy roots, elongation of leaves and stems, and inhibition of the deposition of mucilage on seed coats in Arabidopsis [J]. Plant & Cell Physiol, 2005, 46(1): 147-155.
[16] Abe H, Urao T, Ito T, et al. Arabidopsis AtMYC2(bHLH)and AtMYB2(MYB)function as transcriptional activators in abscisic acid signaling[J]. The Plant Cell, 2003, 15(1): 63-78.
[17] Suo J, Liang X, Pu L, et al. Identification of GhMYB109 encoding a R2R3 MYB transcription factor that expressed specifically in fiber initials and elongating fibers of cotton(Gossypium hirsutum L.)[J]. Biochim Biophys Acta, 2003, 1630(1): 25-34.
[18] Zhou C, Li C. A Novel R2R3-MYB transcription factor BpMYB106 of birch(Betula platyphylla)confers increased photosynthesis and growth rate through up-regulating photosynthetic gene expression [J]. Front Plant Sci, 2016, 7: 315.
[19] Peng X, Liu H, Wang D, et al. Genome-wide identification of the Jatropha curcas MYB family and functional analysis of the abiotic stress responsive gene JcMYB2[J]. BMC Genomics, 2016, 17: 251.
[20] Jin H, Cominelli E, Bailey P, et al. Transcriptional repression by AtMYB4 controls production of UV-protecting sunscreens in Arabidopsis[J]. EMBO J, 2000, 19(22): 6 150-6 161.
[21] Tamagnone L, Merida A, Parr A, et al. The AmMYB308 and AmMYB330 transcription factors from antirrhinum regulate phenylpropanoid and lignin biosynthesis in transgenic tobacco[J]. The Plant Cell, 1998, 10(2): 135-154.
[22] Preston J, Wheeler J, Heazlewood J, et al. AtMYB32 is required for normal pollen development in Arabidopsis thaliana[J]. Plant J, 2004, 40(6): 979-995.
[23] Stracke R, Werber M, Weisshaar B. The R2R3-MYB gene family in Arabidopsis thaliana[J]. Curr Opin Plant Biol, 2001, 4(5): 447-456.
[24] Kirik V, Kolle K, Misera S, et al. Two novel MYB homologues with changed expression in late embryogenesis-defective Arabidopsis mutants[J]. Plant Mol Biol, 1998, 37(5): 819-827.
[25] 樊錦濤. 擬南芥AtMYB73響應(yīng)干旱機(jī)制初探[D]. 保定:河北農(nóng)業(yè)大學(xué),2015.
[26] Zhao Y, Xing L, Wang X, et al. The ABA receptor PYL8 promotes lateral root growth by enhancing MYB77-dependent transcription of auxin-responsive genes[J]. Sci Signal, 2014, 7(328): ra53.
[27] Kranz HD, Denekamp M, Greco R, et al. Towards functional characterisation of the members of the R2R3-MYB gene family from Arabidopsis thaliana[J]. Plant J, 1998, 16(2): 263-276.
[28] Romero I, Fuertes A, Benito M J, et al. More than 80R2R3-MYB regulatory genes in the genome of Arabidopsis thaliana[J]. Plant J, 1998, 14(3): 273-284.
[29] Creelman R A, Mullet J E. Biosynthesis and action of jasmonates in plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1997, 48:355-381.
[30] Reymond P, Farmer E E. Jasmonate and salicylate as global signals for defense gene expression [J]. Curr Opin Plant Biol, 1998, 1(5): 404-411.
[31] Jung C, Lyou S H, Yeu S, et al. Microarray-based screening of jasmonate-responsive genes in Arabidopsis thaliana[J]. Plant Cell Rep, 2007, 26(7): 1 053-1 063.
[32] Jung C, Shim J S, Seo J S, et al. Non-specific phytohormonal induction of AtMYB44 and suppression of jasmonate-responsive gene activation in Arabidopsis thaliana[J]. Molecules and Cells, 2010, 29(1): 71-76.
[33] Jung C, Seo J S, Han S W, et al. Overexpression of AtMYB44 enhances stomatal closure to confer abiotic stress tolerance in transgenic Arabidopsis [J]. Plant Physiol, 2008, 146(2): 623-635.
[34] Jaradat M R, Feurtado J A, Huang D, et al. Multiple roles of the transcription factor AtMYBR1/AtMYB44 in ABA signaling, stress responses, and leaf senescence[J]. BMC Plant Biol, 2013, 13: 192.
[35] Shim J S, Jung C, Lee S, et al. AtMYB44 regulates WRKY70 expression and modulates antagonistic interaction between salicylic acid and jasmonic acid signaling[J]. Plant J, 2013, 73(3): 483-495.
[36] Li D, Li Y, Zhang L, et al. Arabidopsis ABA receptor RCAR1/PYL9 interacts with an R2R3-type MYB transcription factor, AtMYB44 [J]. Int J Mol Sci, 2014, 15(5): 8 473-8 490.
[37] Lu B B, Li X J, Sun W W, et al. AtMYB44 regulates resistance to the green peach aphid and diamondback moth by activating EIN2-affected defences in Arabidopsis[J]. Plant Biol (Stuttg), 2013, 15(5): 841-850.
[38] 呂貝貝. MYB44對HrpN_(Ea)誘導(dǎo)擬南芥抗蟲防衛(wèi)信號傳導(dǎo)的調(diào)控作用[D]. 江蘇:南京農(nóng)業(yè)大學(xué),2012.
[39] Shim J S, Choi Y D. Direct regulation of WRKY70 by AtMYB44 in plant defense responses[J]. Plant Signaling & Behavior, 2013, 8(6): e20 783.
[40] Nguyen X C, Hoang M H, Kim H S, et al. Phosphorylation of the transcriptional regulator MYB44 by mitogen activated protein kinase regulates Arabidopsis seed germinatio [J]. Biochem Biophys Res Commun, 2012, 423(4): 703-708.
[41] Persak H, Pitzschke A. Dominant repression by Arabidopsis transcription factor MYB44 causes oxidative damage and hypersensitivity to abiotic stress[J]. Int J Mol Sci, 2014, 15(2): 2 517-2 537.
[42] Hieno A, Naznin H A, Hyakumachi M, et al. Possible Involvement of MYB44-Mediated Stomatal Regulation in Systemic Resistance Induced by Penicillium simplicissimum GP17-2 in Arabidopsis[J]. Microbes and environments/JSME, 2016, 31(2): 154-159.
[43] 王艷紅,肖 瑩,鄭舒揚(yáng),等. 白粉菌誘導(dǎo)的小麥品種Brock的差異表達(dá)基因解析[J]. 天津師范大學(xué)學(xué)報(bào)(自然科學(xué)版),2015,35(2):71-76.
[44] 鄒保紅. 染色質(zhì)修飾基因HUB1和CHR5及轉(zhuǎn)錄因子MYB44在擬南芥防衛(wèi)反應(yīng)中的功能研究[D]. 南京:南京農(nóng)業(yè)大學(xué),2013.
[45] Liu R, Lu B, Wang X, et al. Thirty-seven transcription factor genes differentially respond to a harpin protein and affect resistance to the green peach aphid in Arabidopsis[J]. Journal of biosciences, 2010, 35(3): 435-450.
[46] Lü B, Sun W, Zhang S, et al. HrpNEa-induced deterrent effect on phloem feeding of the green peach aphid Myzus persicae requires AtGSL5 and AtMYB44 genes in Arabidopsis thaliana[J]. Journal of Biosciences, 2011, 36(1): 123-137.
[47] Park J-B, Sendon P M, Kwon S H, et al. Overexpression of stress-related genes, BrERF4 and AtMYB44, in Arabidopsis thaliana alters cell expansion but not cell proliferation during leaf growth[J]. Journal of Plant Biology, 2012, 55(5): 406-412.
[48] 柳金偉,焦 嬌,張洪濱,等. 轉(zhuǎn)AtMYB44基因小麥的獲得和檢測[J]. 魯東大學(xué)學(xué)報(bào)(自然科學(xué)版),2012,28(2):150-154.
[49] 李 敏. 擬南芥AtMYB44和LWT1基因在水稻中的遺傳轉(zhuǎn)化及功能驗(yàn)證[D]. 合肥: 安徽農(nóng)業(yè)大學(xué), 2012.
[50] Li C, Chang P P, Ghebremariam K M, et al. Overexpression of tomato SpMPK3 gene in Arabidopsis enhances the osmotic tolerance[J]. Biochem Biophys Res Commun, 2014, 443(2): 357-362.
[51] Seo J S, Sohn H B, Noh K, et al. Expression of the Arabidopsis AtMYB44 gene confers drought/salt-stress tolerance in transgenic soybean[J]. Molecular Breeding, 2011, 29(3): 601-608.
[52] Peng S Q, Wu K X, Huang G X, et al. HbMyb1, a Myb transcription factor from Hevea brasiliensis, suppresses stress induced cell death in transgenic tobacco[J]. Plant Physiol Biochem, 2011, 49(12): 1 429-1 435.
[53] Qin B, Zhang Y, Wang M. Molecular cloning and expression of a novel MYB transcription factor gene in rubber tree[J]. Mol Biol Rep, 2014, 41(12): 8 169-8 176.
[54] Wang L F. Physiological and molecular responses to drought stress in rubber tree(Hevea brasiliensis Muell. Arg.)[J]. Plant Physiology and Biochemistry, 2014, 83: 243-249.
[55] Wang L F, Wang M, Zhang Y. Effects of powdery mildew infection on chloroplast and mitochondrial functions in rubber tree[J]. Tropical Plant Pathology, 2014, 39(3): 242-250.
[56] 孫偉偉. 擬南芥轉(zhuǎn)錄因子MYB44與葡聚糖合酶GSL5對抗桃蚜防衛(wèi)反應(yīng)的調(diào)控作用[D]. 南京:南京農(nóng)業(yè)大學(xué),2012.
[57] ung C, Kim Y K, Oh N I, et al. Quadruple 9-mer-based protein binding microarray analysis confirms AACnG as the consensus nucleotide sequence sufficient for the specific binding of AtMYB44[J]. Molecules and Cells, 2012, 34(6): 531-537.

