椰子油微乳的制備及其性質研究
魯夢齊,向東
(海南大學 食品學院,海南 海口, 570228)
椰子油微乳的制備及其性質研究
魯夢齊,向東*
(海南大學 食品學院,海南 海口, 570228)
用非離子型表面活性劑司班80和吐溫80制備椰子油微乳,考察制備方法、親水親油平衡值(hydrophilic lipophilic balance value ,HLB)、助乳化劑和乳化劑用量對微乳形成的影響,以確定椰子油微乳的最優制備工藝參數。結果表明,復合乳化劑的HLB值為12,助乳化劑為丙三醇,乳化劑用量為油水總量的3.2%時,用超聲輔助攪拌的方法能制備穩定的o/w型椰子油微乳。當椰子油和乳化劑與水的質量比為1∶9和2∶8時制得的微乳穩定性最佳,而3∶7時制得的微乳在低溫下不太穩定。
椰子油;超聲;微乳;穩定性
微乳是一種由適當比例的表面活性劑、助表面活性劑、水和油自發形成的各向同性、外觀透明或半透明、熱力學穩定的分散體系[1],其粒徑一般在1~100 nm之間。微乳液是一種熱力學穩定的牛頓非黏稠液體,但其內部結構是由一系列的表面活性劑所穩定的,并對另一種液體或者是其他的包嵌分子有很大的增溶能力如食品添加劑、營養制品、香味、化妝品、活性成分和藥物[2]。由于其良好的穩定性和增溶性,微乳液在涂料工業[3]、織物染整[4]、皮革助劑[5]、金屬加工[6]、醫藥[7-8]、美容[9]、食品[10]等領域均有廣泛應用。
椰子油是源于椰子果肉的植物性油脂,是國際油脂貿易的大宗產品,椰子油中短鏈脂肪酸的比例高達80%以上,其中C12脂肪酸含量占60%,具有減少機體負荷[11]、抗菌、抗氧化、降血脂和膽固醇等多種生理功能,廣泛用于食品、化工、醫藥等領域[12]。但椰子油流動性差,在工業上大量使用時難均勻分散于基質中,并在稱取、填充、包裝及容器清洗時都會造成困難。故實驗擬制備椰子油微乳,擴大其應用范圍。
1 材料與方法
1.1 材料與設備
椰子油,海南乾程科技實業開發有限公司;吐溫80(HLB值15),國藥集團化學試劑有限公司;司班80(HLB值4.3),國藥集團化學試劑有限公司;丙三醇,國藥集團化學試劑有限公司;葡萄糖,廣州化學試劑廠;NaCl,廣州化學試劑廠。實驗所用試劑均為分析純。
DropMeter A-60光學接觸角/表界面張力測量儀,寧波海曙邁時檢測科技有限公司;ZMD-2自動電子密度(比重)儀,上海方瑞儀器有限公司;FJ-200高速分散均質機,上海標本模型廠;AL204電子天平,梅特勒-托利多儀器(上海)有限公司;FS-600N超聲處理器,上海生析超聲儀器有限公司;PHS-3C型pH計,上海儀電科學儀器股份有限公司;DDS-11C型電導率儀,上海儀電科學儀器股份有限公司;TS-RO-20L/H超純水設備,陶氏水處理設備工程有限公司;TG16-WS臺式高速離心機,長沙高新開發區湘麓離心機儀器有限公司。
1.2 實驗方法
1.2.1 微乳的制備
在一直攪拌或均質輔以攪拌(即將形成微乳的其中3種成分混合后經均質處理,再邊攪拌邊滴加第4種成分)或超聲輔以攪拌(即將形成微乳的其中3種成分混合后經超聲處理,再邊攪拌邊滴加第四種成分)的條件下,采用滴水法、滴油法、滴助劑法制備微乳。控制油水比為2∶8,固定乳化劑量占油水總量比為0.16%,將不同方法制備的微乳裝在25 mL比色管中放在室溫下觀察并連續3天測量乳析指數Y。
(1)
式中:A,微乳上浮層高度,mm;B,微乳總高度,mm。
1.2.2 微乳配方篩選
1.2.2.1 乳化劑最佳HLB的確定
以司班80和吐溫80 復配得到不同HLB值的復合乳化劑,根據不同的HLB值確定其各自的質量分數,按下式計算:
(2)
WAB=WA+WB
式中:HLBAB,復合乳化劑的親水親油平衡值;HLBA,司班80的親水親油平衡值,本試驗中HLBA=4.3;HLBB,吐溫80的親水親油平衡值,本試驗中HLBB=15。WA,溶液中司班80的質量分數,%;WB,溶液中吐溫80的質量分數,%;WAB,溶液中復合乳化劑的質量分數,%。
根據上式計算HLB值為7.9、8.3、8.7、9.1、9.5、9.9、10.3、10.7、11.1、11.5、11.9、12.3、12.7、13.1、13.5、13.9、14.3、14.7所需的司班80和吐溫80的量,稱量加入蒸餾水中于60 ℃水浴加熱使之充分溶解后并冷至室溫測定密度,同時測定椰子油在室溫下的密度,再測界面張力。根據測定結果確定界面張力較小的樣品所對應的HLB值范圍,在該范圍選取八個代表性HLB值并制備微乳,根據乳化效率確定最佳HLB值。

(3)
式中:M表示質量,g。
1.2.2.2 助乳化劑的篩選
按1.2.1確定的制備方法,1.2.2.1確定的最佳HLB條件下,固定油水比為1∶9,乳化劑量占油水總量比為1.6%,從丙三醇、1,2-丙二醇,乙醇,PEG-400中篩選最佳助乳化劑。
1.2.2.3 乳化劑最佳用量的確定
設定乳化劑量占油水總量的質量比為0.8%、1.6%、2.4%、3.2%、4%、4.8%、5.6%、6.4%、7.2%、8%、8.8%、9.6%,通過現象觀察、乳化效率和三元相圖來確定最佳乳化劑用量。
1.2.3 微乳類型的鑒定
用染色法[13]鑒定微乳類型,將制備的微乳置于比色管中,分別加入少量等量的油溶性染料蘇丹紅Ⅲ(紅色)和水溶性染料亞甲基藍(藍色),靜置觀察2種染料的擴散速度。若藍色比紅色擴散快,則是水包油型微乳,反之,則是油包水型微乳,若2種染色溶液的擴散速度相同,則該微乳為雙連續型。
1.2.4 穩定性實驗
選取各組分比例不同的微乳樣品進行短期穩定性研究。
1.2.4.1 離心穩定性
將制備的微乳經4 000 r/min,離心30 min,觀察外觀是否出現分層、渾濁等不穩定現象。
1.2.4.2 化學穩定性
配制0.9%的NaCl溶液和5%的葡萄糖溶液,分別緩慢滴加到5g微乳中并攪拌均勻直至微乳變渾濁,記錄加入的溶液質量。
1.2.4.3 貯藏穩定性
將微乳分別置于-18 ℃、4 ℃、60 ℃、常溫下放置1周,觀察放置前后的外觀并測定放置前后的電導率、pH和粒徑及分散指數(polydisper dispersion index,PDI)。
2 結果與分析
2.1 微乳的制備方法
在一直攪拌或均質輔以攪拌或超聲輔以攪拌的條件下,采用滴水法不能制備出透明微乳,溶液一直呈乳白狀態。采用滴油法也不能制備出透明微乳,油難被乳化,浮于溶液表面。采用滴助表面活性劑的方法均能制備出透明微乳,但穩定性有差異,通過測定乳析指數進一步確定微乳的最佳制備方法。不同方法制備的微乳的乳析指數見圖1。

圖1 不同方法制備的微乳的乳析指數Fig.1 Creaming index of microemulsion prepared by different methods
如圖1所示,不同方法制備的微乳的乳析指數相差很大,經超聲輔以攪拌的方法制備的微乳的乳析指數最小且隨時間的變化不大,即微乳最穩定。另兩種方法制備的微乳穩定性不佳。故選用超聲輔以攪拌的方法制備微乳。
2.2 微乳配方篩選
2.2.1 乳化劑最佳HLB的確定
DropMeter A-60光學接觸角/表界面張力測量儀是利用儀器的自動加液系統形成一相液體在另一相液體中的懸滴,通過LED燈從背面照射液滴,從而獲得液滴的軸截面輪廓圖像。儀器自帶的軟件依靠高速視頻攝像系統周期性的獲取液滴的輪廓圖像(選取實驗中具有代表性的不同HLB體系經過相同攝像時間的懸滴圖像見圖2,并擬合到Young-Laplace[14]方程,求得界面張力在內的相關參數。實驗測得不同HLB體系的界面張力見圖3。

圖2 懸滴圖像Fig.2 Image of pendent drop

圖3 不同HLB體系的界面張力Fig.3 Interfacial tension of systems with different hydrophilic-lipophilic balance
懸滴形狀越趨于圓形,兩相間的界面張力越大,反之則越小。如圖2所示從左到右圖形越來越圓表明界面張力越來越小,與圖3所測定的張力值趨勢一致。界面張力是影響乳液穩定性的一個重要因素,一般界面張力越小,則乳液越穩定。由圖3可知,當HLB介于8.7~12.7時,界面張力較小且在較小的范圍內波動,體系相對穩定。故選取HLB值為9、9.5、10、10.5、11、11.5、12、12.5的體系進行乳化效率分析以確定最佳HLB值,測定結果見圖4。

圖4 不同HLB值體系的乳化效率Fig.4 Emulsifying efficiency of systems with different hydrophilic-lipophilic balance
由圖4可知,當復合乳化劑的HLB值為12時,乳化效率最高。
2.2.2 助乳化劑的篩選
在超聲輔以攪拌的條件下,控制乳化劑的HLB為12,四種助乳化劑制備微乳的情況見表1。

表1 不同助乳化劑的滴定結果
由表1可知,丙三醇和聚乙二醇400作為助乳化劑均能得到微乳。但聚乙二醇400制得的微乳穩定性不好,而且實驗中聚乙二醇400制得微乳的乳化效率相比丙三醇的要小很多。所以丙三醇為助乳化劑能制得穩定的微乳。
2.2.3 乳化劑最佳用量的確定
在超聲輔以攪拌的條件下,控制乳化劑的HLB為12,不同乳化劑用量所制備的微乳乳化效率見圖5,表觀見圖6。

圖5 不同乳化劑量制備的微乳的乳化效率Fig.5 Emulsifying efficiency of microemulsion prepared by different amount of emulsifier

圖6 不同乳化劑量制備的微乳的表觀Fig.6 Appearance of microemulsion prepared by different amount of emulsifier
由圖5可知,乳化效率隨乳化劑量的增加呈上升趨勢,但由圖5可知不同乳化劑量對微乳體系的表觀影響很大,隨乳化劑量增多,微乳表觀偏白。目測判定微乳粒徑等級的方法[15]表明,澄清微藍的微乳粒徑通常小于50 nm,藍白色的微乳粒徑在50~100 nm,亮白色奶狀乳劑粒徑則大于100 nm。乳化劑量為1.6%、2.4%、3.2%時微乳表觀澄清微藍且表面無油花,乳化效率呈逐漸上升趨勢但在較小范圍18.88%~22.88%之間。為進一步確定最佳乳化劑量,作乳化劑量為1.6%、2.4%、3.2%的微乳的偽三元相圖進行判斷。
由圖7可知,當乳化劑量為1.6%和2.4%時,微乳區面積(陰影部分)基本相同,當乳化劑量為3.2%時,微乳區面積明顯增大。故微乳的最佳乳化劑的量確定為3.2%。

圖7 含不同乳化劑量的微乳的偽三元相圖Fig.7 Pseudo-ternary phase diagrams of microemulsions with different amount of emulsifier
2.3 微乳類型的鑒定
觀察可見藍色亞甲基藍在微乳中的擴散速度明顯快于紅色蘇丹紅Ⅲ的擴散速度,表明所制備的微乳為水包油(o/w)型。
2.4 微乳的穩定性
由2.1和2.2可知,司盤80和吐溫80復配HLB值為12,乳化劑用量為油水總量的3.2%時,在超聲輔助攪拌的條件下滴丙三醇可制得穩定微乳。選取(椰子油和乳化劑)與水的質量比為1∶9,2∶8,3∶7時制得的微乳進行穩定性分析。
2.4.1 離心穩定性
3組試樣經離心后外觀仍保持均一透明,說明制得的微乳具有一定的穩定性。
2.4.2 化學穩定性
由表2可知,隨微乳配方中的水增加而油減少,微乳對NaCl溶液和葡糖糖溶液的增溶能力增加,即微乳的化學穩定性越好。可能是因為NaCl和葡糖糖溶于水而不溶于油,則隨水油質量比的增加其增溶量變大。且微乳對葡萄糖的增溶量遠大于NaCl的增溶量,可能是由于NaCl的鹽析作用使體系臨界膠束濃度和界面張力升高,不利于微乳形成,使粒徑又逐漸增大[16-19]。
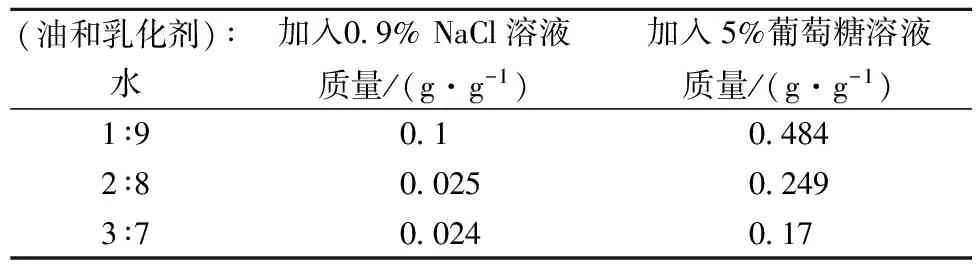
表2 微乳的化學穩定性
2.4.3 貯藏穩定性
試樣1∶9、2∶8、3∶7貯藏前后性質依次見表3、表4、表5。

表3 試樣1∶9貯藏前后的性質

表4 試樣2∶8貯藏前后的性質

表5 試樣3∶7貯藏前后的性質
由表3和表4可知,微乳試樣1∶9和2∶8在貯藏前后外觀、電導率、pH和粒徑/PDI均變化不大,表明該微乳穩定性好。由表5可知,微乳試樣3∶7經-18 ℃和4 ℃貯藏后出現分層現象,說明該微乳不適宜低溫貯藏。
3 結論
采用超聲輔助攪拌的方法,當司班80和吐溫80復合乳化劑HLB值為12,乳化劑用量為油水總量的3.2%時,滴丙三醇能制備出具有一定穩定性的o/w型椰子油微乳。當椰子油和乳化劑與水的質量比為1∶9和2∶8時制得的微乳穩定性良好,而質量比為3∶7時制得的微乳在低溫下穩定性略差。椰子油是一種多功能性植物油脂,微乳具有穩定、粒徑小、增容性強等優點,兩者在食品、化工、醫藥等領域均有廣泛應用,制備出的椰子油微乳將兩者的優點加以結合,應用前景可觀。
[1] HOAR T P,SCHULMAN J H.Transparent water-in-oil dispersions:the oleopathic hydro-micelle[J].Nature,1943,152:102-103.
[2] AVIRAM SPERNATH,ABRAHAM ASERIN.Microemulsion as carriers for drugs and nutraceuticals[J].Advances in Colloid and Interface Science,2006,128-130:47-48.
[3] 劉品華,楊芬,陳吉書,等.有機無機復合微乳膠囊內墻涂料的開發研究[J].新型建筑材料2003(8):50.
[4] 周利民,許劍平,劉峙嶸,等.微乳液原位制備磁性殼聚糖納米粒子及其對染料的吸附性能[J].高分子材料科學與工程,2012(6):142-145,150.
[5] 安秋鳳,黃良仙,張知俠.復合型氨基硅微乳皮革柔軟劑的制備及應用[J].西北輕工業學院學報,1998(4):51-53.
[6] 呂俊凡,鐘明,黃奮.機械制造用微乳切削液的研制及應用[J].機械制造,2014(5):65-67.
[7] 張正全,陸彬.微乳給藥系統研究概況[J].中國醫藥工業雜志,2001(3):43-46.
[8] HIROSHI ARAYA,MIKIO TOMITA,MASAHIRO HAYASHI.The novel formulation design of o/w microemulsion for improving the gastrointestinal absorption of poorly water soluble compounds[J].International Journal of Pharmaceutics,2005,305(1-2):61-74.
[9] 叢琳,李楚忠,鄧慧,等.微乳液技術的研究進展及其在化妝品上的應用[J].廣東化工,2014(21):126-127.
[10] XU Zhe-bo, JIN Jun, ZHENG Min-ying, et al. Co-surfactant free microemulsions: Preparation, characterization and stability evaluation for food application[J].Food Chemistry,2016,204:194-200.
[11] LIN C L,CHIANG S H,LEE H F.Causes of reduced survival of neonatal pigs by medium-cha in triglycerides:blood metabolite and behavioral activity approaches[J].Journal of Animal Science,1995,73 (7) :2 019-2 025.
[12] 李瑞,李枚秋,夏秋瑜,等.原生態椰子油的功能性質及應用[J].中國油脂,2007,32 (10):10-13.
[13] SCHECHTER R S.Microemulsions and related systems[M].New York Marcel Dekker,1998:1-200.
[14] 天津大學物理化學教研室.物理化學(上)[M].北京:高等教育出版社,1983:35-220.
[15] KHOO S M, HUMBERSTONE A J, PORTER C J H,et al.Formulation design and bioavailability assessment of lipidic self-emulsifying formulations of halofantrine[J].Int J Pharm,1998, 167(1): 155-164.
[16] ARVIDSSON A, SODERMAN O, The microemulsion phase in the didecyldimethylammonium bromide /dodecane /water system, Phase diagram, microstructure and nucleation kinetics of excess oil phase[J].Langmuir,2001,17(12): 3 567-3 572.
[17] BYELOV D.Microemulsion efficiency boosting and the complementary effect and structural properties[J]. Langmuir,2004,20(24): 10 433-10 443.
[18] 王守慶.非離子表面活性劑微乳液體系的相行為和增溶性能研究進展[J].天津化工,2011,25( 4) : 7-9.
[19] STEYTLER J,DAVID C.Retention of structure in microemulsion polymerization: Formation of nanolatices[J].Langmuir,2004,20(9):3 509-3 512.
Study on the preparation and properties of coconut oil microemulsion
LU Meng-qi, XIANG Dong*
(College of Food Science, Hainan University, Haikou 570228,China)
The microemulsion of coconut oil was prepared with span 80 and Tween 80. The effect of preparation method, hydrophilic lipophilic balance value (HLB), cosurfactant and emulsifier amount were investigated for determining the best process parameters of coconut oil microemulsion. The results showed that stable oil in water microemulsion of coconut oil can be prepared by ultrasonic assisted stirring method with HLB12, glycerol as cosurfactant and 3.2% of emulsifier. The microemulsion had the best stability when the ratio of total amount of coconut oil and emulsifier and the amount of water was 1∶9 or 2∶8, the microemulsion was not stable at low temperature when the ratio was 3∶7.
coconut oil; ultrasonic; microemulsion; stability
10.13995/j.cnki.11-1802/ts.201704027
碩士研究生(向東副教授為通訊作者,E-mail:foods2003@126.com)。
海南省重點研發計劃項目(ZDYF2016102)
2016-07-27,改回日期:2016-09-22

