乳腺癌分子病理診斷的機遇與挑戰
鄭唯強
·專家論壇·
乳腺癌分子病理診斷的機遇與挑戰
鄭唯強
乳腺腫瘤;分子診斷;預后;靶向治療
乳腺癌的臨床病理特征是由腫瘤組織學類型、癌細胞增殖活性和淋巴血管浸潤等形態學確定的[1]。傳統的乳腺癌組織學分類對小管癌、浸潤性篩狀癌、單純性黏液癌、腺樣囊性癌等,無論是其臨床預后還是治療方式均無太大差異。現階段臨床醫師已不滿足于單純組織形態學診斷的信息,乳腺癌的治療已從循證醫學模式向個體化醫學模式轉變。
鑒于乳腺癌對治療的反應及腫瘤的異質性,目前ER、PR和HER-2已經作為全身性治療的主要依據。臨床病理實踐中除主要運用形態學診斷以外,已經開始結合分子生物學技術如免疫組化、原位雜交、RT-PCR等進行評估,提供臨床需要的生物學標記狀態如HER-2,并試圖通過這些技術對乳腺癌作出比較正確的診斷、分類和預后評估。隨著分子生物學技術的迅猛發展,基因表達譜、蛋白組學、DNA拷貝數改變或甲基化、染色體改變、基因突變和microRNAs分析等為我們更準確地對乳腺癌生物學特性的了解和個體化治療的評估提供良好的機遇。二代測序技術的運用也為乳腺癌分子生物學的解碼、分子學分類的重新定義提供新途徑[2],但準確的運用和臨床效果還有待于臨床實踐的檢驗。
1 乳腺病理診斷和預后評估的分子生物學主要標記
乳腺病理診斷和預后評估標記通常主要用以良性和惡性病變、原位癌及浸潤性癌、某些癌的亞型定義(如基底細胞樣癌)和腫瘤起源(如肌上皮癌)的鑒定,實踐工作中主要依賴免疫組化的生物學標記進行[3-4]:如梭形細胞病變、肌上皮細胞鑒別、乳頭狀病變分類、導管癌與小葉癌的鑒別(如E-cadherin和p120)以及增生性和腫瘤性上皮(如CK5和ER)的鑒別等。其它免疫組化標記如CK可用于淋巴結微轉移的鑒別,Pax-8、WT1可用于卵巢癌的鑒別,TTF-1可用于甲狀腺癌、肺癌的鑒別,Melan-A、HMB-45 和S-100可用于黑色素瘤的鑒別等。有時還需借助特殊的遺傳學易位加以鑒別,如乳腺腫塊實施粗針穿刺僅獲得惡性葉狀腫瘤的間質成分時,則需與其它軟組織肉瘤鑒別[5]。
精準醫學主要目的是預測患者對治療的反應,它最早起始于20世紀70年代基于ER表達的內分泌治療反應。實踐證明ER和PR的表達對乳腺癌治療有重要意義;HER-2蛋白過表達或基因的擴增可作為靶向治療的依據。盡管諸如21-基因復發評分等多基因的檢測還未作為常規檢測內容,但作為指導臨床治療的決策和預后判斷有較好的參考意義。
1.1 乳腺癌治療的常規檢測
1.1.1 ER、PR檢測 目前,日常病理工作常采用免疫組化法檢測ER、PR的表達;但不同的實驗室有不同的陽性評估標準,常用有Allred免疫組化得分法(即H-score法),其既評估了陽性細胞的比例,又結合了細胞核陽性著色的強度。美國臨床腫瘤學會/美國病理學會指南推薦的陽性標準為1%[6],理由是只要大于該閾值的受體陽性患者對內分泌治療有良好療效。但是對轉移性乳腺癌的鑒別可能需要結合每個病理醫師的實際臨床經驗和綜合分析確定其陽性標準,不能僅依賴于1%的陽性程度進行鑒別。
1.1.2 HER-2檢測 15%~20%的乳腺癌有HER-2的過表達(3+)或擴增,由于其對靶向治療的指導意義已非常明確,國內外均有相應的檢測指南和諸多文獻報道[7],在此不作贅述。
1.1.3 Ki-67增殖指數 免疫組化是檢測Ki-67增殖指數的常規方法,其可以鑒定各類型乳腺癌的增殖狀態[8],Ki-67增殖指數可作為預后判斷的指標之一[9-10]。然而,無論是室內還是室間質控的標準化問題,對Ki-67評估的正確性始終存在爭議。2011年St. Gallen共識中將Ki-67陽性率設定為14%,作為乳腺癌分子亞型(Luminal A型、Luminal B型)的閾值曾引起較大爭議。2016年美國臨床腫瘤學會在臨床實踐指南中并不建議Ki-67用以新輔助化療的標記[11]。因此,免疫組化檢測Ki-67 增殖指數的指標運用尚有待于進一步探討。
1.2 腫瘤的遺傳學檢測和診斷 乳腺癌在基因水平(基因組雜交和顯微芯片的基因組雜交)存在明顯的異質性,在導管原位癌和浸潤性導管癌有基因拷貝數的差異,在組織學I級浸潤性導管癌通常為二倍體或近二倍體,頻發16q的缺失,但III級的癌則具有復雜且眾多的拷貝數異常,常為非整倍體,而16q的缺失僅限于ER陰性病例,且只有30%的發生頻率。
乳腺癌的原發灶和轉移灶的配伍采用全基因組測序顯示,腫瘤是由多種癌細胞亞克隆嵌合構成,不僅含有原發性的遺傳學改變,也可出現繼發遺傳學改變,如乳腺癌的轉移灶可起源于遺傳學有別于原發瘤的亞克隆。有些顯微芯片的診斷基因表達檢測可用來明確腫瘤組織的來源,包括使用2000基因分類模型Path work和應用RT-PCR的Theros CancerType ID 92基因檢查可確定低分化惡性腫瘤的原發部位[12]。某些特殊類型的乳腺癌顯示特殊易位:如分泌性癌顯示特征性染色體的t(12;15)的遺傳學易位,導致 ETV6的5′段與NTRK3 的3′段的融合,形成ETV6-NTRK3融合基因[13];黏液表皮樣癌中發現有特征性的t(11;19)(q21;p13),形成MECT1-MAML2 融合基因[14];腺樣囊性癌出現特征性的t(6;9)(q22-23; p23-24),形成 MYB-NFIB融合基因[15]。在腺樣囊性癌混合高級別的三陰型乳腺癌中也發現有MYB-NFIB融合基因。因此,可以假設從腺樣囊性癌進展到三陰型乳腺癌的過程中可能涉及腫瘤性克隆的選擇和(或)影響某些特殊基因,如FGFR1突變的遺傳學改變[16]。
2 乳腺癌的分子學分類
除了對乳腺癌的雜合性缺失、比較基因譜雜交等檢測外,按ER、PR和HER-2表達可以對乳腺癌進行分子分型(Luminal A型、Luminal B型、HER-2過表達型和基底細胞樣型等)的方法已被臨床普遍接受[17],使用非監督分層聚類分析全基因表達譜技術可以使分類更為準確。通過“固有”基因的差異表達分析顯示:在轉錄組水平上乳腺癌不是單一性的疾病,就是富于ER表達相關的獨特性而被命名為“腔樣”表型。盡管每種乳腺癌分類具有獨特的全基因表達譜與它的生物學特征和異常有關,其它的分子類型(HER-2陽性、基底樣型等)均是根據該基因表達譜判斷的。腔樣型乳腺癌又可依據它的異質性分為Luminal A型、Luminal B型,有文獻報道[18-19]其也曾進一步分為Luminal C型、Luminal N型,由于未能被證實而棄用。Burstein等[20]報道基底樣型乳腺癌可以根據基因表達譜細分為基底樣型1、基底樣型2、免疫調節型、間葉型、間葉干細胞型和腔樣雄激素受體型。這些不同的類型顯示不同的臨床意義,如Luminal A型具有最多和最散的突變基因,其PIK3CA的基因突變率達45%;Luminal B型顯示既有PIK3CA又有TP53的較高突變頻率,而在基底樣型中GATA3和PIK3CA等突變相對少見,TP53突變較多[21]。癌癥基因譜協作機構(TCGA)[22]曾報道使用5種不同的平臺(基因表達譜DNA拷貝數分析、DNA甲基化、外顯子測序、mRNA陣列、microRNA測序和逆相蛋白陣列)分析466例乳腺癌患者,識別2個新的涉及間質/微環境的蛋白表達以及特殊的信號途徑。
為了克服使用新鮮組織、陣列分析技術和費用等問題,我們可以把RT-PCR和免疫組化等檢測技術運用到常規病理工作中。目前臨床實踐主要有2種方式:(1)使用顯微芯片檢測由基因表達譜定義的分類,如PAM50(即檢測50個分類基因和5個參照基因)[23];(2)采用組織芯片和免疫組化對ER和HER-2的表達進行檢測。WHO(2012)乳腺癌分類提出預測臨床預后的多基因表達譜標識,顯微芯片分析是檢測乳腺癌治療反應的有效方法。其中70-基因預后標識可用于Ⅰ~Ⅱ期淋巴結陰性且腫瘤直徑小于5 cm的乳腺癌預后,該二元分類法把預后分為“好”和“差”,可作為遠處轉移的獨立預后指標,但它不能用于ER陰性腫瘤的預后判斷,而且必須要用術后新鮮標本。21-基因復發評分是根據21個基因qRT-PCR結果的評分系統,包括16個癌相關基因和5個參照基因,該系統為數學函數,用于評估ER陽性但淋巴結轉移陰性乳腺癌的10年遠處復發風險。它是一個連續變量,由此將患者分為3組:低危組、中危組和高危組[24]。該分組可以使低危組患者避免不必要的化療,其優點是它可使用10%中性福爾馬林固定后的石蠟包埋標本進行實驗,缺點是該評分系統對于ER陰性或HER-2陽性等乳腺癌患者的臨床運用有限。
3 特殊類型乳腺癌的分子病理學特征
浸潤性小葉癌是最常見的特殊類型,除E-cadherin的缺失,還有特殊的PTEN、TBX3和FOXA1突變。PTEN缺失與增加的AKT磷酸化有關,基因表達譜分析將其分為反應樣、免疫相關和增殖型3個亞型,這些亞型顯示它們在mRNA和蛋白/磷酸蛋白水平上的基因譜特征,其中增殖型的預后最差,反應樣型預后較好[25],在DNA水平上可檢測到浸潤性小葉癌富于CDH1突變,其次是GATA3突變。乳腺的純黏液癌實驗顯示有相對較低的遺傳學不穩定性并且傾向于同源性而非異質性。遺傳學主要表現為1q和16p的獲得、16q和22q的缺失,而混合型黏液癌不同成分基因表達譜與單純黏液癌相似。浸潤性微乳頭狀癌除了它的特殊乳頭形態,還有特殊的拷貝數異常、Cyclin D1高表達和MYC(8q24)擴增,其特征性的一系列基因拷貝數異常有別于分級和ER狀態相匹配的浸潤性導管癌。伴大汗腺分化的癌通過基因表達微陣列分析識別的“大汗腺分子標識”,以雄激素信號增加以及與HER-2過表達組顯著重疊為特征。提示伴大汗腺分化乳腺癌并非一個獨特的組別,它由“大汗腺”和“腔樣”兩種分子亞型構成。值得注意的是,在混合型微乳頭狀癌中含微乳頭的區域和非微乳頭區域顯示相同的基因異常,這種形態上不同但基因異常卻相同的現象值得思考。基底樣型的包括髓樣特征的癌(可出現體細胞突變和BRCA1啟動子甲基化)、化生性癌(10%~25%可出現EGFR的擴增和多態性,可發生PIK3CA及Wnt通路基因頻發突變)和唾液腺樣腫瘤如腺樣囊性癌[(頻發易位t(6;9)(q22-23;p23-24)](圖1、2)[26]。采用大規模平行測序檢測嗜酸細胞癌有高頻率的TP53突變,常顯示11q13.1-q13.2和19p13獲得;其它的體細胞突變包括PIK3CA、mTOR、CTNNB1、BRCA1、ERBB4、ERBB3、INPP4B和FGFR2等。
4 引入二代測序技術
二代測序技術對乳腺癌的個體化治療,尤其是對于識別源于“乘客”基因和“驅動”基因的不同突變有很大幫助。二代測序技術證實乳腺癌的突變頻率低于肺鱗狀細胞癌或膀胱尿路上皮癌,但類似于卵巢癌和腎透明細胞癌。約10%不同類型、不同組織學分級、ER、PR、HER-2陰陽性的乳腺癌染色體異常頻率以上的乳腺癌40基因中有7個(TP53、PIK3CA、MYC、ERBB2、 FGFR1、CCND1和GATA3)發生突變,與58%的驅動突變有明顯關聯;但三陰型和基底樣乳腺癌有較高的腫瘤內異質性,常見的驅動基因如TP53、PIK3CA和PTEN突變有較高的克隆發生率,而體細胞突變僅出現在少量癌細胞中。二代測序技術也顯示若出現乳腺癌轉移后的一系列體細胞突變,提示該克隆遺傳異質性對乳腺癌治療的耐受性。
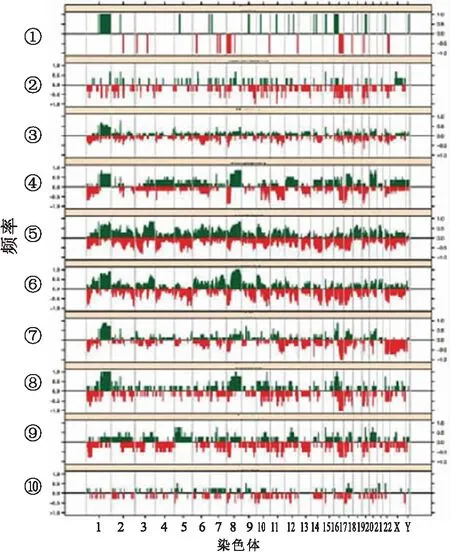
圖1 部分特殊類型的乳腺癌染色體基因拷貝數異常分布圖
1.小管癌;2.神經內分泌癌;3.黏液癌;4.微乳頭狀癌;5.化生性癌;6.伴髓樣特征癌;7.小葉癌;8.伴破骨細胞樣間質巨細胞的癌;9.大汗腺癌;10.腺樣囊性癌;其中綠色示染色體片段的擴增;紅色示缺失

圖2 特殊類型乳腺癌的基因表達譜聚類分析
采用二代測序技術檢測微腺性腺病/非典型性微腺性腺病,結果顯示至少有1個與TP53突變一致的體細胞非同義突變[27];在放射狀瘢痕/復雜性硬化性病變中也有類似現象。相反,純微腺性腺病則缺乏克隆性的類似突變,其拷貝數改變也有限。提示前者這些病變可能是腫瘤性的而非增生性改變。有證據表明與浸潤性癌并存的導管原位癌和前者有相似的基因譜、轉錄譜和表型[28],但遺憾的是預測復發或進展到浸潤性癌的癌前病變分子學分析還有所欠缺。
5 結語
由于日益增加的高通量測序或二代測序技術的運用,新的具有靶向治療意義的驅動基因不斷被發現,為曾經治療失敗的病例尋找發生的機制,為尋找更具潛力的有效靶點提供參考。乳腺癌分子病理學檢測在其診斷尤其是在分子分型和治療中的地位逐漸顯現。然而,組織病理學的診斷是我們病理醫師一切工作的根本,病理醫師在評估乳腺腫瘤大小、淋巴結轉移、組織學類型等仍需對腫瘤TNM分期、分子分型、預后與療效進行判斷。隨著分子生物學新技術運用的不斷推進,大量的可供分析的臨床檢測數據會持續涌現[29],由此必然會導致新的治療靶點出現,并促進對乳腺癌形態學與分子病理學相結合的更精細分類以指導臨床實踐。
[1] Rakha E A, Reis-Filho J S, Baehner F,etal. Breast cancer prognostic classification in the molecular era: the role of histological grade[J]. Breast Cancer Res, 2010,12(4):207.
[2] Ng C K, Schultheis A M, Bidard F C,etal. Breast cancer genomics from microarrays to massively parallel sequencing: paradigms and new insights[J]. J Natl Cancer Inst, 2015,107(5):djv015.
[3] Lee A H. Use of immunohistochemistry in the diagnosis of problematic breast lesions[J]. J Clin Pathol, 2013,66(6):471-477.
[4] Rakha E A, Aleskandarany M A, Lee A H,etal. An approach to the diagnosis of spindle cell lesions of the breast[J]. Histopathology, 2016,68(1):33-44.
[5] Fisher C. The diversity of soft tissue tumours with EWSR1 gene rearrangements: a review[J]. Histopathology, 2014,64(1):13450.
[6] Hammond M E, Hayes D F, Dowsett M,etal. American society of clinical oncology/college of American pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer[J]. J Clin Oncol, 2010,28(16):2784-2795.
[7] 楊 瑩,魏 兵,步 宏. 乳腺癌HER-2檢測的現狀及存在的問題[J]. 臨床與實驗病理學雜志, 2010,26(5):602-605.
[8] Aleskandarany M A, Rakha E A, Macmillan R D,etal. MIB1/Ki-67 labelling index can classify grade 2 breast cancer into two clinically distinct subgroups[J]. Breast Cancer Res Treat, 2011,127(3):591-599.
[9] Wishart G C, Rakha E, Green A,etal. Inclusion of Ki-67 significantly improves performance of the PREDICT prognostication and prediction model for early breast cancer[J]. BMC Cancer, 2014,14:908.
[10] Yerushalmi R, Woods R, Ravdin P M,etal. Ki-67 in breast cancer: prognostic and predictive potential[J]. Lancet Oncol, 2010,11(2):174-183.
[11] Harris L N, Ismaila N, McShane L M,etal. Use of biomarkers to guide decisions on adjuvant systemic therapy for women with early-stage invasive breast cancer: American Society of Clinical Oncology Clinical Practice Guideline[J]. J Clin Oncol, 2016,34(10):1134-1150.
[12] Ma X J, Patel R, Wang X,etal. Molecular classification of human cancers using a 92-gene real-time quantitative polymerase chain reaction assay[J]. Arch Pathol Lab Med, 2006,130(4):465-473.
[13] Tognon C, Knezevich S R, Huntsman D,etal. Expression of the ETV6-NTRK3 gene fusion as a primary event in human secretory breast carcinoma[J]. Cancer Cell, 2002,2(5):367-376.
[14] Tonon G, Modi S, Wu L,etal. t(11;19)(q21;p13) translocation in mucoepidermoid carcinoma creates a novel fusion product that disrupts a Notch signaling pathway[J]. Nat Genet, 2003,33(2):208-213.
[15] Mitani Y, Li J, Rao P H,etal. Comprehensive analysis of the MYBNIB gene fusion in salivary adenoid cystic carcinoma: incidence, variability, and clinicopathologic significance[J]. Clin Cancer Res, 2010,16(19):4722-4731.
[16] Fusco N, Geyer F C, De Filippo M R,etal. Genetic events in the progression of adenoid cystic carcinoma of the breast to high-grade triplenegative breast cancer[J]. Mod Pathol, 2016,29(11):1292-1305.
[17] Rakha E A, Reis-Filho J S, Ellis I O. Combinatorial biomarker expression in breast cancer[J]. Breast Cancer Res Treat, 2010,120(2):293-308.
[18] Sotiriou C, Neo S Y, McShane L M,etal. Breast cancer classification and prognosis based on gene expression profiles from a population-based study[J]. Proc Natl Acad Sci USA, 2003,100(18):10393-10398.
[19] Rakha E A, Soria D, Green A R,etal. Nottingham prognostic index plus (NPI+): a modern clinical decision making tool in breast cancer[J]. Br J Cancer, 2014,110(7):1688-1697.
[20] Burstein M D, Tsimelzon A, Poage G M,etal. Comprehensive genomic analysis identifies novel subtypes and targets of triple-negative breast cancer[J]. Clin Cancer Res, 2015,21(7):1688-1698.
[21] Santarpia L, Bottai G, Kelly C M,etal. Deciphering and targeting oncogenic mutations and pathways in breast cancer[J]. Oncologist, 2016,21(7):1063-1078.
[22] Cancer Genome Atlas Network. Comprehensive molecular portraits of human breast tumours[J]. Nature, 2012,490(7418):61-70.
[23] Parker J S, Mullins M, Cheang M C,etal. Supervised risk predictor of breast cancer based on intrinsic subtypes[J]. J Clin Oncol, 2009,27(8):1160-1167.
[24] van de Vijver M J, He Y D, van’t Veer L J,etal. A gene-expression signature as a predictor of survival in breast cancer[J]. N Engl J Med, 2002,347(25):1999-2009.
[25] Ciriello G, Gatza M L, Beck A H,etal. Comprehensive molecular portraits of invasive lobular breast cancer[J]. Cell, 2015,163(2):506-519.
[26] Horlings H M, Weigelt B, Anderson E M,etal. Genomic profiling of histological special types of breast cancer[J]. Breast Cancer Res Treat, 2013,142(2):257-269.
[27] Guerini-Rocco E, Piscuoglio S, Ng C K,etal. Microglandular adenosis associated with triple-negative breast cancer is a neoplastic lesion of triple-negative phenotype harbouring TP53 somatic mutations[J]. J Pathol, 2016,238(5):677-688.
[28] Vincent-Salomon A, Lucchesi C, Gruel N,etal. Integrated genomic and transcriptomic analysis of ductal carcinoma in situ of the breast[J]. Clin Cancer Res, 2008,14(7):1956-1965.
[29] 楊舉倫,王 麗. 乳腺癌的分子病理學研究[J]. 臨床與實驗病理學雜志, 2011, 27(1):10-14.
國家自然科學基金(81272905)
第二軍醫大學附屬長海醫院病理科,上海 200433
鄭唯強,男,主任醫師,教授。 E-mail: zheng6947@126.com
時間:2017-5-17 23:52 網絡出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170517.2352.001.html
R 737.9
A
1001-7399(2017)05-0473-04
10.13315/j.cnki.cjcep.2017.05.001
接受日期:2017-04-12

