水培實驗中不同粒徑納米TiO2對蘆葦種子發芽和植株生長和生理的影響
文雙喜, 王毅力,2,*
1. 北京林業大學林學院, 北京 1000832. 北京林業大學環境科學與工程學院, 北京 100083
水培實驗中不同粒徑納米TiO2對蘆葦種子發芽和植株生長和生理的影響
文雙喜1, 王毅力1,2,*
1. 北京林業大學林學院, 北京 1000832. 北京林業大學環境科學與工程學院, 北京 100083
納米二氧化鈦(TiO2-NPs)是目前應用最為廣泛的納米材料之一,進入到天然濕地和人工濕地中的TiO2-NPs會在濕地生物、基質、水體之間進行遷移轉化和歸趨。目前針對TiO2-NPs對濕地植物蘆葦的毒性研究很少。本文采用水培實驗方法,研究了不同粒徑TiO2對蘆葦種子發芽和植株生長的影響,解析了TiO2-NPs對蘆葦的生態毒理效應。研究結果表明:幾種粒徑的TiO2-NPs在較低濃度(≤200 mg·L-1)下對蘆葦種子發芽均具有一定的促進作用,高濃度處理會抑制蘆葦種子發芽;當TiO2-NPs濃度為500 mg·L-1時,處理后的蘆葦種子的發芽指標較空白對照均出現顯著降低,4 nm和20 nm的TiO2-NPs對蘆葦種子發芽的半數有效濃度(EC50)分別為1 075 mg·L-1和1 680 mg·L-1。 TiO2-NPs對蘆葦植株的毒害作用表現為植株生長速度減緩甚至停滯、葉片失綠、植株萎焉或枯死、蘆葦倒二葉面積增長率降低,并且TiO2-NPs的粒徑越小、濃度越高毒害作用越明顯。隨TiO2-NPs濃度升高,處理后蘆葦葉片的葉綠素含量和植株體內的Mg含量均降低,根系的超氧化物歧化酶(superoxide dismutase, SOD)活性、丙二醛(malondialdehyde, MDA)均升高,而且越小粒徑的TiO2-NPs對蘆葦的處理效果越明顯。3種粒徑的TiO2-NPs均能進入蘆葦體內,粒徑越小、濃度越高進入的量越多,但是TiO2-NPs比較難以從根遷移轉運至莖和葉。
納米二氧化鈦;蘆葦;生態毒理;累積;分布
納米技術是21世紀最為重要和發展最為迅速的研究領域之一。近年來,應用在不同領域的商用納米材料在急劇增加[1]。據保守估計,到2020年全世界僅人工金屬氧化物納米材料的年產量就將由2012年的270 041 t增加到1 663 168 t[2]。納米二氧化鈦(TiO2-NPs)作為一種人工金屬氧化物納米材料,具有優異的吸收紫外線能力、高效的光催化效果、良好的抗光化學腐蝕能力及導電能力,因而被大量應用在醫療、食品、化妝品、廢水處理、能量儲存、油漆及建筑材料等關系到國計民生的各行各業中[1,3-5],預計其全球年產量在2025年將達到2 500 000 t[6]。
大量的納米材料在生產、運輸和使用的過程中將不可避免地被釋放到周圍環境中[7]。研究表明,TiO2-NPs已經在城市污染水處理廠的出水、污泥以及地表水體中均有檢出。付佳璐等[8]研究發現,長江口外取水點水樣中的納米顆粒形態的鈦濃度達89.0 μg·L-1;劉志遠等[9]報道,曲陽污水處理廠水體中的鈦濃度達到了768 μg·L-1;Kiser等[10]研究發現亞利桑那州生活污水廠中鈦濃度在0.1~3.0 mg·L-1的范圍內波動。
自然水體是經多種途徑釋放到環境介質中的納米顆粒的最終受納體,因此進入到天然濕地和人工濕地中的TiO2-NPs會在濕地生物、基質、水體之間進行遷移轉化和歸趨。已有的研究表明,植物可以作為納米材料進入環境及其在食物鏈中的向上傳遞和生物富集重要通道之一[11]。因此,研究納米材料對濕地植物的影響特征可以揭示該材料在環境中的歸趨、生態毒理效應及其去除機制。蘆葦是濕地中常見的植物,目前關于納米材料對蘆葦污染生態效應方面的文獻還比較缺乏。因此,本研究選取蘆葦作為研究對象,考察不同粒徑TiO2-NPs對蘆葦種子發芽、植株生長形態和生理特征的影響,同時研究蘆葦植株對不同粒徑TiO2-NPs的吸收、累積及TiO2-NPs進入植株后的分布特征。
1 材料與方法(Materials and methods)
1.1 實驗材料
實驗所用蘆葦種子購自南京景香園有限公司,所用蘆葦植株(展葉期,采于當年5月)采自圓明園九州景區池塘。SOD試劑盒購于南京建成生物工程研究所,培養植物所用1/4濃度的霍格蘭氏植物培養液按照文獻[12]中的方法配制。
4 nm、20 nm、50 nm的TiO2-NPs購于北京安特普納科貿責任有限公司(含量≥99.5%;銳鈦礦:金紅石 = 71:29),本研究中對3種粒徑TiO2-NPs的TEM圖像、各粒徑不同濃度TiO2-NPs在25 ℃、pH = 6.5±0.1的1/4濃度的霍格蘭氏植物培養液中的Zeta電位值及XRD圖譜(20 nm)進行了表征。
主要儀器:帶能譜儀的透射電鏡(TEM-EDX, JEM-2100, JEOL, Japan);Reichert超薄切片機;X射線衍射儀(XRD, BruckerD-8 Diffractometer, 德國);Zeta電位分析儀(Zetasizer 2000, Malvern, UK);光照培養箱(MGC-300B, 上海一恒科學儀器有限公司);電感耦合等離子體質譜(ICPS-1000IV, Shimadzu, 日本);氣浴恒溫振蕩器(RH-8811,常州潤華電器有限公司);7230 型分光光度計(上海);立式高速冷凍離心機(GL-25MS, 匡貝實業有限公司)。
1.2 種子發芽試驗
為了保證發芽試驗的準確性,挑選形態豐滿、品相良好的蘆葦種子(百粒重0.0334 g)進行發芽試驗,考察不同濃度的TiO2-NPs對蘆葦種子的發芽影響。
種子和實驗器材消毒滅菌,TiO2-NPs處理濃度分別為 0, 20, 100, 200, 500, 1 000, 2 000 mg·L-1,按文獻[13]中的方法進行種子暴露處理,按文獻[14]中的方法進行發芽試驗,每天(6 d)記錄種子發芽數,發芽結束測定種子發芽重量,所有發芽試驗均設置3次重復。按照文獻[15]中的公式計算蘆葦種子的發芽指數、發芽率、發芽勢及活力指數等發芽指標。
1.3 植株暴露培養
為了保證試驗結果的可靠性,所有蘆葦植株從圓明園取回后都先放入裝有1/4濃度的霍格蘭氏植物培養液的50 cm×40 cm×35 cm玻璃水族箱中25 ℃下馴化培養15 d。
取馴化后高度與生長情況相當的蘆葦植株放入裝有含不同濃度TiO2-NPs的1/4濃度霍格蘭氏植物培養液的1 000 mL燒杯中進行TiO2-NPs暴露培養。把裝有植株的燒杯放入光照培養箱中培養,培養條件:白天/黑夜溫度為(26±1)℃/(22±1) ℃;光照/黑暗周期為16 h/8 h;光照強度為300 μE·m-2·s-1,培養時間為12 d。
TiO2-NPs的濃度梯度設置為:0, 1, 10, 100, 200和500 mg·L-1,每個燒杯放入4株蘆葦植株,每個濃度設置3次重復,每天記錄植株生長情況。
1.4 植株生長指標的測定
每2天取1.3節中經不同濃度TiO2-NPs溶液培養的蘆葦樣品進行MDA、葉綠素含量測定。培養結束取樣進行SOD活性測定。 SOD活性和MDA含量取根進行測定。
其中,SOD酶活性按南京建成生物工程研究所的SOD試劑盒的說明書進行測定;MDA和葉綠素含量分別按照文獻[16]和[17]中的方法進行測定。
1.5 TiO2-NPs在植株體內的分布與累積
培養結束,取1.3中經不同濃度TiO2-NPs溶液培養的蘆葦植株分成根、莖、葉3部分按文獻[18]中的方法進行TEM-EDX觀察。另取適量樣品按文獻[19]中的方法利用ICP-MS測定樣品中的Ti含量。同時,由于鎂(Mg)是植物正常生長所必需的微量元素之一,是構成葉綠素的中心分子,有促進植物光合碳同化的作用,考慮到Mg含量和葉綠素之間的關系,在測定Ti含量的同時也測定樣品中Mg的含量。
1.6 數據分析
本試驗所有處理均設3次重復,以 3 個平行組數據計算平均值±標準差(Mean±SD),采用ANOVA(Analysis of variance, LSD檢驗法)對試驗數據進行差異顯著性分析(檢驗標準為P < 0.05)。
2 結果與討論 (Results and discussion)
2.1 TiO2-NPs表征結果
3種粒徑TiO2-NPs的TEM圖像、不同濃度TiO2-NPs在25 ℃、pH = 6.5±0.1的1/4濃度的霍格蘭氏植物培養液中的Zeta電位值及XRD圖譜(20 nm)如圖1所示。
圖1a~c中的TEM圖像顯示各粒徑的TiO2-NPs均呈圓形、橢圓形或長方形顆粒,平均粒徑與商家所標基本吻合;TiO2-NPs(20 nm)的XRD圖譜如圖1d所示,在25.24°、37.7°、48.0°、55.04°、62.76°、70.22°和75.06°檢測到了峰的存在,其中25.24° 到48.0°之間的峰為區分特征峰,與粉體衍射標準卡聯合委員會(JCPDS)數據庫No.21-1272號卡片吻合,表明本試驗所用TiO2-NPs的主要成分為銳鈦礦,滿足試驗需求。從圖1e中可以看出:各粒徑不同濃度的TiO2-NPs在1/4濃度的霍格蘭氏植物培養液中的Zeta電位整體數值范圍在±10.0~±30.0之間,說明分散體系不太穩定[20]。因此,在培養實驗中需要每天定時對培養液進行攪動數次,保證 TiO2-NPs顆粒在溶液中保持良好的分散狀態。
2.2 TiO2-NPs對蘆葦種子發芽的影響
不同粒徑、不同濃度TiO2-NPs溶液處理后的蘆葦種子發芽率及發芽重量見圖2,主要發芽指數如表1所示。
從圖2a中可以看到,3種粒徑的TiO2-NPs在濃度<200 mg·L-1時對蘆葦種子發芽的促進不明顯,且粒徑間的差異性不顯著。之前也有低濃度的納米材料促進植物發芽的報道,Khodakovskaya等[21]發現:濃度為10~40 mg·L-1的多壁碳納米管(MWCNTs)能夠促進西紅柿種子的發芽和其植株的生長,可能是由于碳納米管可以穿透種子外皮從而促進西紅柿種子對水分的吸收,而水分在種子發芽過程中起著十分重要的作用,因為干燥的種子要萌發需要一定的水分來促進種子的新陳代謝和生長。但隨著暴露濃度的升高,3種粒徑處理均使蘆葦種子的發芽率下降,當濃度為500 mg·L-1時,3種粒徑TiO2-NPs處理的蘆葦種子發芽率較空白對照均出現顯著降低,4 nm和20 nm的TiO2-NPs對蘆葦種子發芽的半數有效濃度(EC50)分別為1 075和1 680 mg·L-1,當濃度為2 000 mg·L-1時,3種粒徑TiO2-NPs處理的蘆葦種子的發芽率由空白處理的85%分別下降到24%(4 nm)、30%(20 nm)和46.67%(50 nm)。
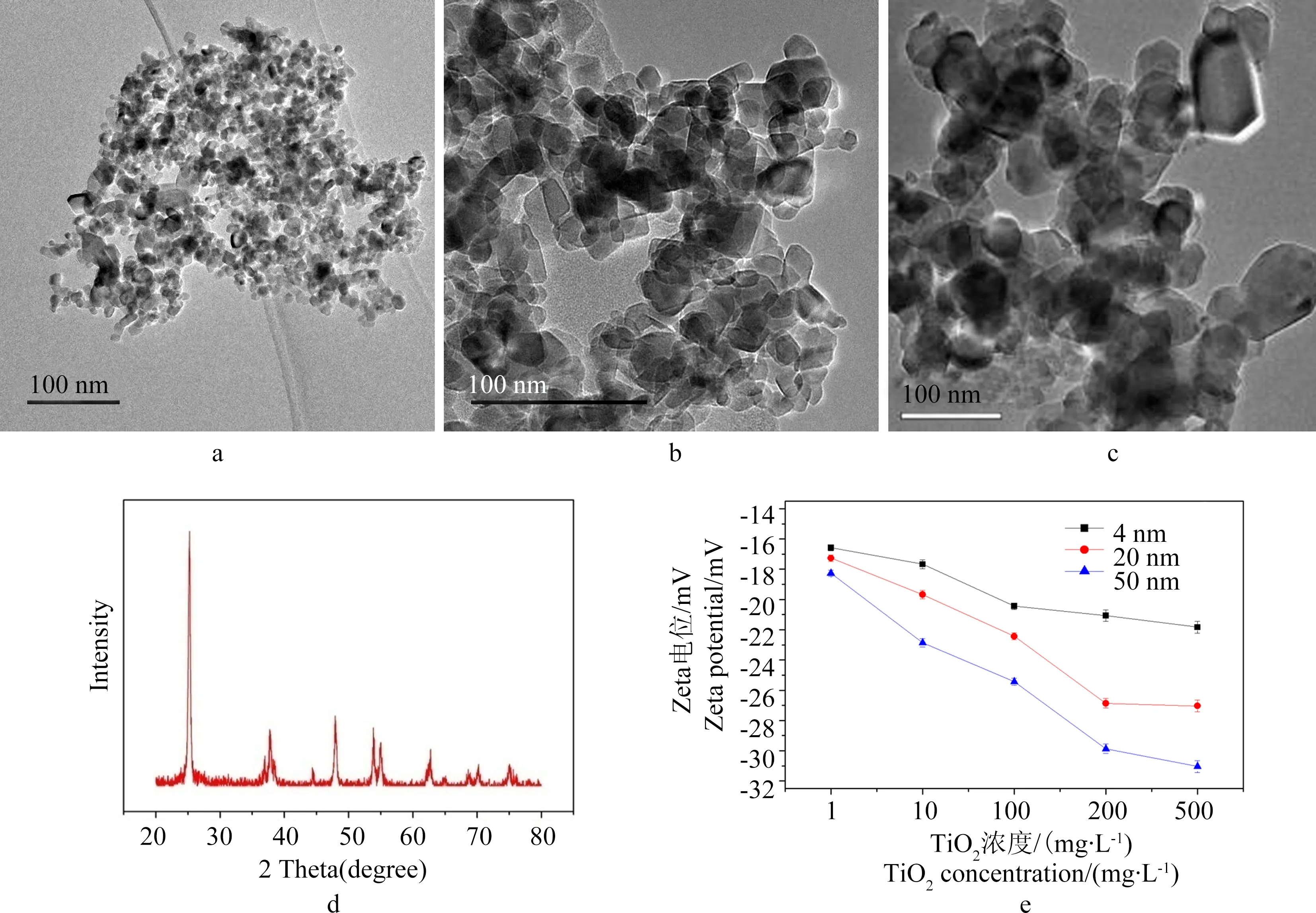
圖1 TiO2-NPs的TEM表征(a-4 nm;b-20 nm;c-50 nm)以及XRD圖譜(d-20 nm)和25 ℃下不同濃度的TiO2-NPs在1/4濃度的霍格蘭氏植物培養液中的Zeta電位Fig. 1 TEM images (a-4 nm; b-20 nm; c-50 nm) and physical properties of TiO2-NPs: (d-20 nm) XRD patterns; (e) zeta potential vs. different TiO2-NPs concentrations in 25% strength Hoagland nutrient solution at 25 ℃

圖2 TiO2-NPs處理后蘆葦種子的發芽率(a)和發芽重量(b)注:*代表不同處理與空白對照之間存在顯著性差異(P<0.05)。Fig. 2 Germination rates (a) and seedling masses (b) of Phragmites australis seeds under TiO2-NPs treatmentNote: *indicates a significant difference between the treatment and the control groups (P<0.05).

圖3 不同粒徑的TiO2-NPs處理下蘆葦植株的生長形態Fig. 3 Phragmites australis cultured under different sizes of TiO2-NPs
從圖2b中可以看出,TiO2-NPs處理后蘆葦種子發芽幼苗重量的變化趨勢基本與發芽率的變化趨勢一致,當濃度為2 000 mg·L-1時,3種粒徑TiO2-NPs處理的蘆葦種子的發芽幼苗重量由空白處理的43 mg分別下降到9 mg(4 nm)、14 mg(20 nm)和22 mg(50 nm)。可能是因為高濃度的TiO2-NPs處理后進入蘆葦種子的TiO2-NPs量增加,對蘆葦種子的生理機能造成損傷,并且隨著顆粒尺度變小,TiO2-NPs表面晶格破損程度更高,產生活性位點更多,形成超氧自由基及其他活性氧化物質(ROS)更多,氧化壓力(OS)提高,導致脂質過氧化,破壞種子細胞膜,因此對蘆葦種子發芽產生抑制作用[22]。
由表1可以看出,各粒徑TiO2-NPs處理的蘆葦種子的各項發芽指標也是在低濃度下有所升高,高濃度處理則快速下降,且粒徑越小變化幅度越大,說明粒徑越小的TiO2-NPs對蘆葦種子的發芽影響作用越大。
2.3 TiO2-NPs對蘆葦植株生長與生理的影響
2.3.1 植株生長形態
不同粒徑的TiO2-NPs處理下蘆葦植株的生長形態如圖3所示。
從圖中可以看出:經過12 d的培養后,空白對照(0 mg·L-1)處理的蘆葦植株整體生長狀況良好,葉片無失綠現象發生;不同粒徑的TiO2-NPs處理后,蘆葦的生長狀況均受到不同程度的抑制,表現為植株生長速度減緩甚至停滯,葉片失綠,植株萎焉,且TiO2-NPs的粒徑越小,上述影響越顯著。Asli等[23]研究發現TiO2-NPs對玉米的生長也有一定的抑制作用。培養于TiO2-NPs溶液中的玉米其根部的導水率降低,且其根細胞的細胞壁孔徑從空白培養下的6.6 nm降低到了3 nm,從而導致玉米植株的蒸騰作用減弱,致使葉片的生長受到了抑制。這主要是因為TiO2-NPs的物理阻塞作用致使玉米的根細胞細胞壁的孔徑變小,導致根系對水分的吸收能力減弱,從而抑制了葉片的蒸騰作用,抑制了葉片的生長。

表1 TiO2-NPs處理對蘆葦種子發芽的影響Table 1 The germination of Phragmites australis seeds treated with TiO2-NPs
2.3.2 蘆葦倒二葉面積變化
不同粒徑的不同濃度TiO2-NPs處理對蘆葦植株倒二葉面積的影響如表2所示。
由表2可知,不同粒徑的TiO2-NPs培養處理的蘆葦倒二葉面積的增長率均隨著處理濃度的升高而顯著降低。在同一高濃度TiO2-NPs處理下,粒徑越小蘆葦倒二葉面積的增長率也越小,說明在高濃度處理下,TiO2-NPs粒徑越小對蘆葦的生長抑制作用越強。
2.3.3 葉綠素與Mg含量
不同粒徑、不同濃度的TiO2-NPs處理對蘆葦葉片葉綠素含量的影響結果如圖4所示。培養12 d后,空白處理(0 mg·L-1)下的蘆葦葉片的總葉綠素含量在12 d的培養期間基本穩定在同一濃度水平;而不同粒徑TiO2-NPs處理下蘆葦葉綠素含量均隨處理濃度的升高而下降,且粒徑越小下降幅度越大。在經過濃度為500 mg·L-1的不同粒徑的TiO2-NPs暴露培養12 d后,蘆葦葉片的總葉綠素含量從剛移栽的2.67 mg·L-1分別下降到1.55(4 nm)、1.83(20 nm)和1.95 mg·L-1(50 nm)。
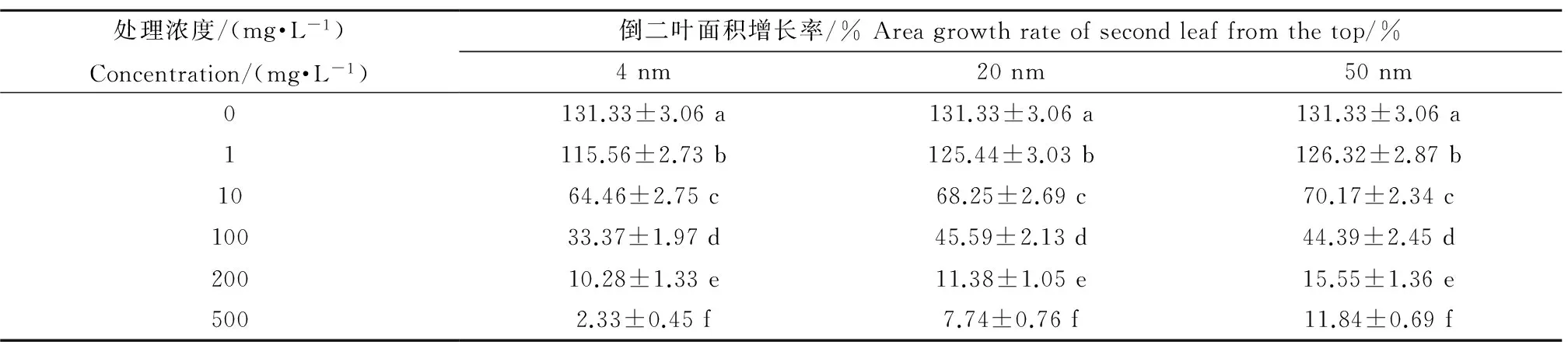
表2 TiO2-NPs處理對蘆葦植株倒二葉面積的影響Table 2 The area of the top second leaf of Phragmites australis treated with TiO2-NPs
注:同列數值后的不同字母代表處理間存在顯著性差異(P<0.05)。
Note: Different letters in the same column indicate a significant difference at P<0.05.
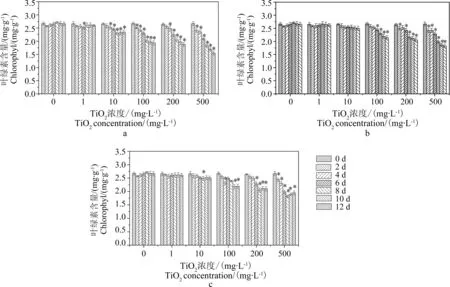
圖4 不同濃度TiO2-NPs處理后蘆葦植株葉綠素含量(a-4 nm; b-20 nm; c-50 nm) Fig. 4 Chlorophyll content of Phragmites australis cultured under different TiO2-NPs concentrations (a-4 nm; b-20 nm; c-50 nm)
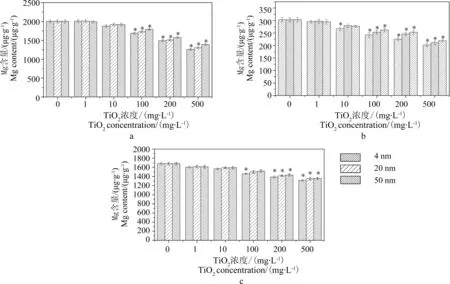
圖5 不同濃度TiO2-NPs處理后蘆葦植株不同部位Mg含量的變化(a-根; b-莖; c-葉)Fig. 5 Mg content of Phragmites australis cultured under different TiO2-NPs concentrations (a-roots; b-stems; c-leaves)
從圖5中可以看出,隨著暴露培養時間的延長和TiO2-NPs處理濃度的升高蘆葦植株體內不同組織部位的Mg含量均出現不同程度的減少,整體變化趨勢與葉片總葉綠素含量的變化趨勢相仿。說明TiO2-NPs處理影響了蘆葦植株對Mg的吸收,進而影響到了植株葉綠素的合成。
2.3.4 SOD活性和MDA含量
SOD是生物體內清除自由基保護細胞免受損傷的首要物質。它可阻止氧自由基對細胞造成的損害并修復受損細胞[24]。不同粒徑、不同濃度的TiO2-NPs處理對蘆葦植株SOD酶活性和MDA含量的影響結果如圖6所示。從圖6a中可知:培養結束后隨著TiO2-NPs濃度的不斷升高,蘆葦根系的SOD活性也不斷增強,且TiO2-NPs的粒徑越小蘆葦植株體內的SOD活性越高,可能是因為粒徑小的TiO2-NPs更容易進入蘆葦體內,從而對蘆葦植株產生更強的毒害作用,致使對蘆葦的氧化脅迫水平升高。當TiO2-NPs濃度升高到500 mg·L-1時,不同粒徑TiO2-NPs處理的蘆葦根系的SOD活性從空白處理的25.52 U·g-1FW分別升高到88.60(4 nm)、71.59(20 nm)和60.57 U·g-1FW(50 nm)。表明TiO2-NPs對蘆葦具有一定的毒害作用,蘆葦體內SOD活性升高以清除納米脅迫產生的ROS,各種酶活性的調節是植物自我保護的體現。
圖6b~d表明了蘆葦根系的MDA含量與不同粒徑、不同濃度TiO2-NPs暴露培養處理的關系,由圖中可以看到:空白處理下的蘆葦根系的MDA含量在整個培養期間(0~12 d)內都保持在一個穩定的水平,沒有出現大幅波動;但當各粒徑TiO2-NPs濃度為1~500 mg·L-1時,蘆葦根系內的MDA水平隨著培養時間的推進而不斷升高,隨著TiO2-NPs濃度的升高而快速上升,并且粒徑越小上升幅度越大。不同粒徑在TiO2-NPs濃度為500 mg·L-1時蘆葦根系的MDA含量由移栽時的1.35 μmol·g-1分別上升到4.33(4 nm)、3.81(20 nm)和3.50 μmol·g-1(50 nm),分別出現了高達320.74%、282.22%和259.26%的增長。表明TiO2-NPs對蘆葦有一定的毒害作用,能迫使蘆葦植株體內脂質發生過氧化反應而產生大量MDA,且TiO2-NPs的粒徑越小對蘆葦的毒害作用越強。
2.4 TiO2-NPs顆粒在蘆葦植株體內的分布
經500 mg·L-1不同粒徑TiO2-NPs暴露培養12 d后,蘆葦植株各組織部位切片的TEM-EDX分析結果如圖7所示。

圖6 不同濃度TiO2-NPs處理對蘆葦根系SOD酶活性(a)和MDA(b-4 nm; c-20 nm; d-50 nm)含量的影響Fig. 6 SOD activity (a) and MDA content (b-4 nm; c-20 nm; d-50 nm) of Phragmites australis roots treated with TiO2-NPs

圖7 500 mg·L-1 TiO2-NPs處理蘆葦植株不同部位的TEM-EDX觀察:根(a-4 nm; c-20 nm; e-50 nm); 莖(b-4 nm; d-20 nm; f-50 nm); 葉(g-20 nm); EDX掃描表明了Ti的存在(h)Fig. 7 TEM analysis of TiO2-NPs distribution in plants exposed to 500 mg·L-1 of TiO2-NPs: roots (a-4 nm; c-20 nm; e-50 nm); stems (b-4 nm; d-20 nm; f-50 nm); leaves (g-20 nm); EDX analysis of the bright zone showing the presence of Ti (h)
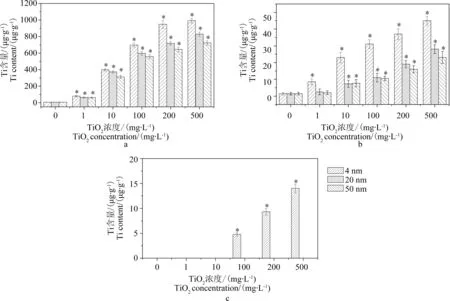
圖8 ICP-MS測定Ti在蘆葦根(a)、莖(b)和葉(c)里的累積量Fig. 8 ICP-MS observations of Ti accumulation in Phragmites australis: (a) roots; (b) stems; (c) leaves
從圖中可以看出,3種粒徑TiO2-NPs處理的蘆葦植株根中都發現了顆粒沉積物的存在,且粒徑越小蘆葦根中的沉積物越多;4 nm和20 nm TiO2-NPs處理的蘆葦莖中都發現了顆粒沉積物的存在,但是要明顯的少于相應根中的沉積量,而50 nm TiO2-NPs處理的蘆葦莖中則觀察不到明顯的沉積物;3種粒徑處理的蘆葦葉中都觀察不到明顯沉積物存在。EDX能譜分析結果表明顆粒沉積物中有很高含量的Ti存在,表明顆粒沉積物應該為進入蘆葦體內的TiO2-NPs顆粒。說明在12 d的培養時期內蘆葦植株根吸收的TiO2-NPs只有少部分能被轉運到了蘆葦的莖中,而這些顆粒沉降物基本不能從莖中轉移到蘆葦的葉片中。
2.5 Ti在蘆葦體內的累積量
通過ICP-MS檢測經不同粒徑、不同濃度TiO2-NPs暴露培養后蘆葦植株不同組織部位的Ti元素累積量(圖8),發現各粒徑TiO2-NPs處理后Ti在蘆葦根系和莖里的累積量均隨著TiO2-NPs處理濃度的升高而不斷增加,且增加量隨粒徑的增大而減少。
當TiO2-NPs濃度為500 mg·L-1時不同粒徑培養處理的蘆葦根中的Ti含量分別可以達到993(4 nm)、829(20 nm)和722 μg·g-1(50 nm),蘆葦莖中的Ti累積量分別可達45(4 nm)、28(20 nm)和23 μg·g-1(50 nm),根系中Ti含量要遠遠大于莖中的Ti含量,證明TiO2-NPs顆粒容易被蘆葦根系吸收,但是比較難從根系中向上轉移到莖里;3種粒徑TiO2-NPs培養處理的蘆葦葉片中只有在4 nm、濃度大于100 mg·L-1的TiO2-NPs暴露處理下才檢測到了Ti的存在,其他處理蘆葦葉片中的含量低于檢測限,這和組織切片的TEM觀察結果相一致,證明在12 d的培養時期里各粒徑TiO2-NPs都很難從莖中運輸至葉片,且粒徑越大轉移運輸難度越大。
[1] Hossain F, Perales-perez O J, Hwang S, et al. Antimicrobial nanomaterials as water disinfectant: Applications, limitations and future perspectives [J]. Science of the Total Environment, 2014, 466-467: 1047-1059
[2] He X J, Aker W G, Fu P P, et al. Toxicity of engineered metal oxide nanomaterials mediated by nano-bio-eco-interactions: A review and perspective[J]. Environmental Science: Nano, 2015, 2: 434-438
[3] Aitken R J, Chaudhry M Q, Boxall A B A, et al. Manufacture and use of nanomaterials: Current status in the UK and global trends [J]. Occupational Medicine-Oxford, 2006, 56: 300-306
[4] Sharma V K. Aggregation and toxicity of titanium dioxide nanoparticles in aquatic environment—A review [J]. Journal of Environmental Science and Health, Part A Toxic, 2009, 44: 1485-1495
[5] Weng Z Y, Guo H, Liu X M, et al. Nano-structured TiO2for energy conversion and storage [J]. RSC Advance, 2013, 3: 24758-24775
[6] Robichaud C O, Uuar A E, Darby M R, et al. Estimates of upper bounds and trends in nano-TiO2production as a basis for exposure assessment [J]. Environmental Science Technology, 2009, 43: 4227-4233
[7] Macwan D P, Dave P N, Chaturvedi S. A review on nano-TiO2sol-gel type syntheses and its applications [J]. Journal of Materials Science, 2011, 46: 3669-3686
[8] 付佳露, 楊毅, 彭歡, 等. 長江口水環境中納米顆粒物初探[J]. 環境科學, 2011, 32(2): 1024-1031
Fu J L, Yang Y, Peng H, et al. Study on nanoparticles in Yangtze Estuary [J]. Environmental Science, 2011, 32(2): 1024-1031 (in Chinese)
[9] 劉志遠, 于水利, 劉貴彩, 等. 不同消解方法對納米二氧化鈦濃度測定的影響[J]. 環境化學, 2013, 32(4): 666-669
Liu Z Y, Yu S L, Liu G C, et al. Effect of different digesting methods on the detection of titanium dioxide nanoparticles concentration [J]. Environmental Chemistry, 2013, 32(4): 666-669 (in Chinese)
[10] Kiser M A, Westerhoff P, Benn T, et al. Titanium nanomaterial removal and release from wastewater treatment plants [J]. Environmental Science and Technology, 2009, 43(17): 6757-6763
[11] Remya N, Saino H V, Baiju G N, et al. Nanoparticulate material delivery to plants [J]. Plant Science, 2010, 179: 154-163
[12] Gao X P, Zou C Q, Wang L J, et al. Silicon decreases transpiration rate and conductance from stomata of maize plant [J]. Journal of Plant Nutrition, 2006, 29: 1637-1647
[13] Song U, Shin M, Lee G, et al. Functional analysis of TiO2nanoparticle toxicity in three plant species [J]. Biological Trace Element Research, 2013, 155: 93-103
[14] Lin D, Xing B. Phytotoxicity of nanoparticles: Inhibition of seed germination and root growth[J]. Environmental Pollution, 2007, 150: 243-250
[15] 肖密. 哈茨木霉T2-16對西瓜枯萎病防治效果及機理初探[D]. 長沙: 湖南農業大學, 2015
Xiao M. Effect and mechanism of trichoderma inducing watermelon to resistance Fusarium wilt [D]. Changsha: Hunan Agricultural University, 2015 (in Chinese)
[16] Buege J A, Aust J D. Microsomal lipid peroxidation [J]. Methods in Enzymology, 1978, 52: 302-310
[17] 楊遠強. 納米氧化銅的植物吸收累積與毒性效應初探 [D]. 杭州: 浙江大學, 2012
Yang Y Q. The uptake, accumulation and phytotoxicity of CuO nanoparticles[D]. Hangzhou: Zhejiang University, 2012 (in Chinese)
[18] Larue C, Laurette J, Herlin-boime N, et al. Accumulation, translocation and impact of TiO2nanoparticles in wheat (Triticum aestivum spp.): Influence of diameter and crystal phase [J]. Science of the Total Environment, 2012, 431: 197-208
[19] 巴翠蘭. 納米二氧化鈦在植物體內吸收,轉運和蓄積及與蛋白作用機理的研究[D]. 保定: 河北大學, 2010
Ba C L. Absorption and transport and accumulation of Titanium dioxide in plants and function methods between protein and metal [D]. Baoding: Hebei University, 2010 (in Chinese)
[20] 高嫄. 納米TiO2、納米CuO對青萍生長影響及機理探討[D]. 淄博: 山東理工大學, 2012
Gao Y. Effect and mechanism of TiO2and CuO nano-particles on Lemna minor growth [D]. Zibo: Shandong University of Technology, 2012 (in Chinese)
[21] Khodakovskaya M, Dervishi E, Mahmood M, et al. Carbon nanotubes are able to penetrate plant seed coat and dramatically affect seed germination and plant growth [J]. ACS Nano, 2009, 3(10): 3221-3227
[22] 林道輝, 冀靜, 田小利, 等. 納米材料的環境行為與生物毒性[J]. 科學通報, 2009, 54(29): 3590-3604
Lin D H, Ji J, Tian X L, et al. Environmental behavior and toxicity of engineered nanomaterials [J]. Chinese Science Bulletin, 2009, 54(29): 3590-3604 (in Chinese)
[23] Asli S, Neumann P M. Colloidal suspensions of clay or titanium dioxide nanoparticles can inhibit leaf growth and transpiration via physical effects on root water transport [J]. Plant, Cell and Environment, 2009, 32(5): 577-584
[24] 鄒麗莎. 納米氧化鋅的玉米吸收積累與毒性效應初探[D]. 杭州: 浙江大學, 2014
Zou L S. The uptake, accumulation and phytotoxicitv of ZnO nanoparticles to maize (Zea mays L.) [D]. Hangzhou: Zhejiang University, 2014 (in Chinese)
◆
Effect of Nano Titanium Dioxide with Different Particle Size on the Seed Germination and Plant Growth and Physiology of Phragmites australis in Hydroponic Experiments
Wen Shuangxi1, Wang Yili1,2,*
1. College of Forestry, Beijing Forestry University, Beijing 100083, China2. College of Environmental Science and Engineering, Beijing Forestry University, Beijing 100083, China
9 November 2016 accepted 3 March 2017
Nano titanium dioxide (TiO2-NPs) is one of the most widely used nanometer materials, which will migrate and transform among the wetland biotas, substrate and water body as entering the natural wetland and constructed wetland. At present, there are few studies on the toxicity of TiO2-NPs to the Phragmites australis. In this study, the effect of TiO2-NPs with different sizes on the seed germination and plant growth of typical constructed wetland plant—P. australis was explored through hydroponic experiments, and their ecotoxicological effects were also determined. The results showed that the seed germination of P. australis was promoted at low concentration (less than 200 mg·L-1) treatment by TiO2-NPs with different sizes, while was hindered at high concentration treatment. When the concentration of TiO2-NPs was higher than 500 mg·L-1, the seed germination indexes of treated P. australis significantly decreased in comparison with control samples. Moreover, the EC50of 4 nm and 20 nm TiO2-NPs on the seed germination of P. australis were determined as 1 075 and 1 680 mg·L-1, respectively. The toxic effects of TiO2-NPs on P. australis were characterized as growth retardation and even stagnation, leaf chlorosis, plant wilting or death, and decrease in the area growth rate of second leaf from the top. Moreover, the decreased size and increased concentration of TiO2-NPs could strengthen the aforementioned toxic effects. With the increase of TiO2-NPs concentration, the chlorophyll in leaf and Mg content in plant of treated P. australis decreased, while the superoxide dismutase (SOD) activity and malondialdehyde (MDA) content in the root system increased, and such treatment effect was more obvious as the smaller TiO2-NPs were used. TiO2-NPs with different sizes could enter the P.australis, and small size or high concentration could favor this entrance. However, it was difficult for TiO2-NPs to transfer from roots to stems and leaves.
TiO2nanoparticles; ecotoxicological effects; Phragmites australis; accumulation; distribution
國家水體污染控制與治理科技重大專項(2012ZX07105-002-03);國家自然科學基金(51478041,21177010)
文雙喜(1986-),男,博士研究生,研究方向為環境修復與污染生態學, E-mail: wenshuangxide@126.com;
*通訊作者(Corresponding author), E-mail: wangyilimail@126.com
10.7524/AJE.1673-5897.20161109002
2016-11-09 錄用日期:2017-03-03
1673-5897(2017)2-071-10
X171.5
A
王毅力(1972-),男,博士,教授,博士生導師,美國特拉華大學土木與環境系訪問學者(2008.10-2009.09)。2006年入選北京市科技新星計劃A,并于同年入選教育部新世紀優秀人才計劃。主要研究方向為:水體污染防治,污泥表征、調理脫水與資源化,分形與流變學,飲用水物理化學處理技術,污染環境生態修復技術。
文雙喜, 王毅力. 水培實驗中不同粒徑納米TiO2對蘆葦種子發芽和植株生長和生理的影響[J]. 生態毒理學報,2017, 12(2): 71-80
Wen S X, Wang Y L. Effect of nano titanium dioxide with different particle size on the seed germination and plant growth and physiology of Phragmites australis in hydroponic experiments [J]. Asian Journal of Ecotoxicology, 2017, 12(2): 71-80 (in Chinese)

