部分或完全低強化型胰腺神經內分泌腫瘤多層螺旋CT的表現特征
許秦風 郭萬華
·論著·
部分或完全低強化型胰腺神經內分泌腫瘤多層螺旋CT的表現特征
許秦風 郭萬華
目的 探討部分或完全低強化型胰腺神經內分泌腫瘤(PNENs)多層螺旋CT(MSCT)的影像學特征。方法 回顧性分析44例PNENs患者的臨床及術前MSCT資料,主要記錄腫瘤直徑、部位、邊界、密度、內部結構、是否合并胰膽管擴張、有無遠處器官轉移等信息,并按胰腺期強化特征將其分為完全強化型及部分或完全低強化型進行比較分析。結果 44例PNENs患者中共發現腫瘤56枚,部分或完全低強化型組31枚,完全強化型組25枚,前者腫瘤直徑(3.3±2.2)cm,大于后者(1.4±0.9)cm,且形態不規則者居多,腫瘤內可出現囊性成分,兩組間的差異具有統計學意義(P<0.05),而患者性別、腫瘤是否有功能、腫瘤的部位、病灶邊緣是否清晰、內部是否出現鈣化、胰膽管是否擴張、是否出現轉移等兩組比較差異無統計學意義。增強后完全強化型病灶的強化峰值多出現于動脈期(76.0%,19/25),而部分或完全低強化型病灶的強化峰值多出現于胰腺期(71.0%,22/31),并且在動脈期病灶內可出現增強迂曲的微血管影,差異具有統計學意義(P<0.05)。完全強化型病灶中G1級21例,G2級4例,無G3級病例;部分或完全低強化型病灶G1級18例,G2級5例,G3級8例,兩組之間差異有統計學意義(P<0.05)。結論 部分或完全低強化型PNENs與完全強化型PNENs相比,體積較大,形態不規則,內部可含囊性成分,增強后動脈期易出現迂曲的微血管影,強化峰值出現略晚,病理學分級較高。
胰腺腫瘤; 神經內分泌瘤; 體層攝影術,螺旋計算機
胰腺神經內分泌腫瘤(pancreatic neuroendocrine neoplasms, PNENs)是一種起源于胰腺導管上皮多能干細胞的少見腫瘤,病因仍未明確。目前PNENs發病率逐年增高,達0.32/10萬[1]。WHO 2010年分級系統將PNENs根據細胞核分裂象以及細胞增殖指數Ki-67表達分為神經內分泌瘤G1、G2和神經內分泌癌(neuroendocrine carcinoma,NEC)G3級,后者的惡性程度遠高于前者[2],因此,對其較為準確的病理學分級是下一步治療方案選擇的前提。目前,多期增強的多層螺旋CT(multi-slice spiral computed tomography,MSCT)檢查是無創檢查PNENs的主要手段之一,對其定性、定位以及預后判斷、術后復查均具有重要作用。本研究回顧性分析PNENs的MSCT平掃及增強的表現特征。
資料與方法
一、一般資料
收集南京鼓樓醫院2009年1月至2016年6月經手術或內鏡超聲引導下細針穿刺活檢術病理證實的PNENs患者44例,其中男性18例,女性26例,年齡22~82歲,平均(55±14)歲,中位年齡56歲。21例有反復發作的低血糖病史,進食后迅速緩解;11例出現不同程度的上腹部疼痛;1例因長期腹瀉就診;1例出現明顯黃疸癥狀;余10例患者均無明顯癥狀,因體檢發現胰腺占位入院。2例患者出現CA19-9升高,1例患者CA125升高,1例患者CA19-9與CA125同時升高,其余患者腫瘤標志物均正常。
二、病理檢查
所有患者均按WHO 2010年PNENs標準進行分級。G1級:核分裂象<2個/10個高倍視野,Ki-67陽性指數≤2%;G2級:核分裂象2~20個/10個高倍視野,Ki-67陽性指數3%~20%;G3級:核分裂象>20個/10個高倍視野,Ki-67陽性指數>20%[2]。
三、多期增強MSCT掃描方法及圖像分析
采用GE Lightspeed 16或64排螺旋CT掃描儀進行腹部平掃+增強掃描。患者檢查前禁食4 h以上,先行腹部CT平掃,后行3期增強掃描,采用專用高壓注射器經肘前靜脈團注對比劑歐乃派克1.5 ml/kg體重,分別于注藥開始后25、45、90 s行3期掃描獲取動脈期、胰腺期和門脈期圖像。掃描條件為120 kV,250 mA,重建層厚為3 mm。
由2名具有5年以上腹部CT診斷經驗的醫師分別進行讀片,重點關注的影像學表現包括瘤體的位置、形態、大小、邊緣、強化特征,同時注意觀察有無血管侵犯、胰膽管擴張、淋巴結腫大等。瘤體大小取橫軸位上最大層面的長徑; CT值的測量取圓形感興趣區(region of interest,ROI),注意避開鈣化、囊變、血管及腫瘤邊緣部分,分別于平掃、動脈期、胰腺期、門脈期進行測量。每次測量同一患者時需保持ROI位置及大小基本相同,同時測量胰腺內正常實質部分作為對照,并參考Hyota等[3]的標準按瘤體胰腺期強化特征分為以下4型:1型為瘤體區域完全明顯強化;2型為瘤體區域大部分明顯強化,小部分不強化或強化程度低于正常胰腺實質;3型為瘤體區域大部分不強化或強化程度低于正常胰腺實質,小部分明顯強化;4型為瘤體區域完全不強化或強化程度低于正常胰腺實質。1型稱為完全強化型,2~4型歸為部分或完全低強化型。胰腺周圍淋巴結直徑>1 cm則認為是淋巴結轉移。當兩人意見不統一時,經討論達成一致。按強化類型將患者分為完全強化型及部分或完全低強化型兩組。
四、統計學分析
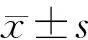
結 果
一、PNENs影像學表現
44例PNENs患者共發現胰腺病灶56枚,6例為多發,病灶最多者為4枚,余38例均為單發。完全強化型癌灶共25枚(44.6%),部分或完全低強化型31枚(55.4%),其中2型16枚, 3型10枚,4型5枚。
病灶體積最大的直徑為10.0 cm,最小的直徑為0.5 cm,>2 cm的病灶25枚(44.6%),≤2 cm的病灶31枚(55.4%)。部分或完全低強化型組的病灶直徑(3.3±2.2)cm,完全強化型組的病灶直徑(1.4±0.9)cm。與完全強化型組比較,部分或完全低強化型組的病灶直徑長,形態不規則者居多,病灶內無囊性成分、強化的微血管影出現率低,兩組間差異均有統計學意義(圖1,表1)。
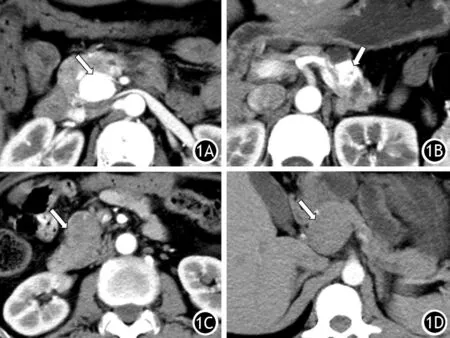
圖1 PNENs的強化類型 1A完全強化型 1B大部分強化型 1C少部分強化型 1D完全低強化型
二、PNENs的MSCT增強特征與病理分級的關系
56枚瘤體中39枚為G1級,9枚為G2級,8枚為G3級(NEC)。完全強化型中G1級21枚(80.8%),G2級4枚(19.2%),未見G3級;部分或完全低強化型中G1級18枚(58.1%),G2級5枚(16.1%)、G3級8枚(25.8%)。G1級與G2級組之間的CT強化類型差異無統計學意義,而G1級+G2級組與G3級的組間差異有統計學意義(χ2=5.567,P=0.018)。完全強化型與部分或完全低強化型病灶的實性部分平掃時CT值差異無統計學意義,增強后完全強化型病灶的CT值在動脈期及胰腺期顯著高于部分或完全低強化型病灶,差異具有統計學意義(P值均<0.05);而門脈期二者CT值的差異又無統計學意義(表2)。完全強化型病灶的強化峰值多出現于動脈期(19/25),而部分或完全低強化型病灶的強化峰值多出現于胰腺期(22/31),組間的差異具有統計學意義(P<0.001)。此外,56.3%(27/48)G1級+G2級病灶的強化峰值出現于動脈期,87.5%(7/8)G3級病灶的強化峰值出現于胰腺期,兩者之間的差異具有統計學意義(P=0.003,表3)。
注:-:Fisher確切概率法
三、PNENs的MSCT增強特征與伴發病變的影像學表現
PNENs的伴隨征象包括主胰管擴張、胰腺萎縮、膽總管擴張等,完全強化型組與部分或完全低強化型組間的差異均無統計學意義,其中膽總管擴張的4例均出現于部分或完全低強化型的病灶(表1)。PNENs的轉移多見于淋巴結轉移(7例,G2級2例、G3級5例)及肝轉移(5例,G1級1例、G2級1例、G3級3例),較少見的有1例位于胰頭部病灶浸潤下段膽管及膽囊(G3級),1例浸潤脾臟實質(G1級),1例浸潤左腎實質(G3級,圖2)。3例患者伴發漿液性囊腺瘤,1例患者伴發胰腺單純性囊腫。

表3 56枚胰腺神經內分泌腫瘤強化峰值與病理分級的關系
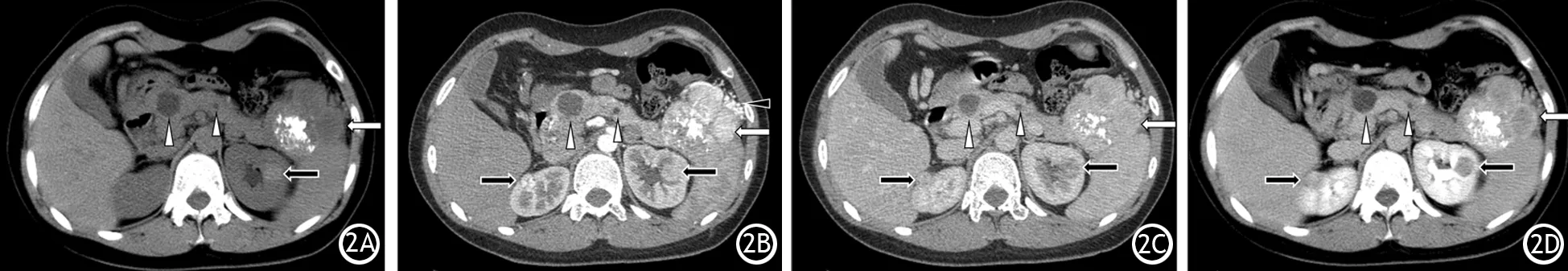
圖2 CT平掃見胰尾部分葉狀團塊(),內部密度不均,有斑片狀鈣化影及較低密度影,胰腺內另見多發囊性密度結節(△),左腎實質內見高密度小結節影(2A);CT增強胰腺期,可見胰尾部腫塊不均勻明顯強化(),周圍見迂曲擴張的小血管影(▲所示),雙腎實質內各見一枚明顯強化結節(2B);門脈期(2C)及延遲期(2D)可見胰尾部團塊()強化程度迅速下降,中心區域較邊緣更為明顯,胰腺內囊性占位始終未見明顯強化(△),雙腎結節強化程度亦呈明顯下降趨勢()
胰腺薄層多期增強CT是無創檢查PNENs的主要手段,對于早期診斷PNENs具有重要意義。PNENs的典型CT表現為等或低密度占位,增強后可見較為明顯的強化,但由于其表現多樣,亦可以見到部分病灶內部出現強化程度較低或者不強化的區域,一般認為這是由于病灶內部出現出血、壞死或者纖維組織成分較多而導致的,但也有研究認為含囊性成分的病灶是一種特殊類型的神經內分泌腫瘤,與MEN-1密切相關[4-5]。本研究將所有病灶分為部分強化型和部分或完全低強化型,并對其作比較研究。
本研究結果顯示,55.4%的PNENs病灶為部分或完全低強化型,略多于既往的研究,其中完全不強化型(4型)占總數的8.9%,表明PNENs病灶含低強化成分并不罕見。通常認為CT強化程度隨病理分級的增長而下降[6],本研究結果與之類似,NEC(G3級)100%表現為部分或完全低強化型,而NET (G1級+G2級)僅為47.9%。同時NEC的強化峰值多出現于胰腺期,NET的強化峰值多出現于動脈期,早于前者,部分病灶強化程度甚至近似于腹主動脈,證明NET的血供較NEC豐富。無論是部分強化型還是完全強化型,大多數病灶至少在某一期強化程度高于正常胰腺實質,提示大部分PNENs病灶為富血供病變,部分病灶在動脈期可見內部迂曲的微血管影,尤其以部分強化型更多見,證實了這一觀點。值得注意的是,5例完全不強化型病灶均為G1級,其中4例在CT平掃時內部呈均勻一致的實性密度,病理證實均為胰島細胞瘤,考慮可能由于病灶血供確實并不豐富,亦有可能因為強化峰值出現過早而未能在正確的強化時間點顯像,這一現象尚需進一步研究。
PNENs的定位對于后續手術治療有重要意義,本組病灶位于胰頭及胰尾部者較多,但病灶位置與其強化類型關系不大。部分或完全低強化型病灶的體積較完全強化者大,并且形態較為多變,內部出現囊變者較多,這可能因為惡性程度較高的腫瘤生長速度快,瘤體中心供血不足,常導致瘤體內出血壞死,因此體積較大,形態不規則,中心易出現壞死囊變,與之相反,完全強化型病灶多為G1級和G2級,惡性程度較低的腫瘤生長速度較慢,內部細胞形態較為均勻一致,因此體積較小,形態較為規則,血供較為豐富,囊變壞死較少。一項對109例PNENs患者的研究表明,大約21.1%的PNENs病灶會出現鈣化[7],本組病例中約17.9%的病灶出現斑點或斑片狀鈣化,略低于文獻報道。有學者認為非功能性PNENs鈣化灶出現概率高于功能性PNENs,且病灶中出現鈣化通常是提示腫瘤惡性程度較高[8],但本組病例中完全強化型與部分或完全低強化型病灶出現鈣化的概率沒有明顯差異,且病理證實為NEC的8枚病灶均未出現鈣化。
PNENs病灶邊緣一般都較為清晰,部分病灶增強后可見環形強化,這可能與大多數病灶具有完整包膜有關,且胰周脂肪間隙亦通常較為清晰。一般認為PNENs很少累及胰腺導管及膽管,少部分病灶由于位置和體積的原因會導致胰管或膽管受壓、擴張,但胰膽管擴張程度一般較輕,管壁光滑,病灶與胰膽管之間不存在密切聯系,通常也不會導致遠端胰腺萎縮。本組3例出現胰膽管擴張者均為體積較大的胰頭部病灶(>2.0 cm),其中1例的NEC浸潤累及膽總管下段及膽囊,CT及MRI均可見局部膽管截斷呈杯口狀,提示PNENs,特別是NEC具有侵犯胰膽管的能力。PNENs可以發生局部侵犯及遠處轉移,主要轉移至肝、脾及淋巴結等部位,發生轉移的多數為G2級及G3級病灶,亦可見G1級腫瘤局部浸潤脾臟者。此外,本組病例未見侵犯血管者,僅有部分位于胰腺尾部病灶的患者由于腫瘤體積較大(>5 cm),包繞、壓迫脾門血管,此時可出現胰源性門脈高壓癥。
總之,胰腺內分泌腫瘤含有低強化或不強化成分的并不少見,其惡性程度較高,影像學表現為體積較大,形態不規則,密度不均勻,囊變成分出現較多,增強后動脈期病灶內常出現強化的微血管影,實性成分強化峰值多在胰腺期,病灶病理學分級較高。掌握這些特征以及結合患者臨床資料,有助于早期診斷PNENs。
[1] 中華醫學會腫瘤學分會胰腺癌學組(籌).胰腺神經內分泌腫瘤診治專家共識[J].中華腫瘤雜志,2014,36(9):717-720.DOI:10.3760/cma.j.issn.0253-3766.2014.09.017.
[2] 中國胃腸胰神經內分泌腫瘤病理專家組.中國胃腸胰神經內分泌腫瘤病理學診斷共識[J].中華病理學雜志,2011,40(4):257-262. DOI:10.3760/cma.j.issn.0529-5807.2011.04.010.
[3] Hyodo R, Suzuki K, Ogawa H, et al. Pancreatic neuroendocrine tumors containing areas of iso- or hypoattenuation in dynamic contrast-enhanced computed tomography: Spectrum of imaging findings and pathological grading[J]. Eur J Radiol, 2015, 84(11):2103-2109.DOI: 10.1016/j.ejrad.2015.08.014.
[4] Chen M, Van Ness M, Guo Y, et al. Molecular pathology of pancreatic neuroendocrine tumors[J]. J Gastrointest Oncol, 2012, 3(3):182-188. DOI: 10.3978/j.issn.2078-6891.2012.018.
[5] Ridtitid W, Halawi H, DeWitt JM, et al. Cystic pancreatic neuroendocrine tumors: outcomes of preoperative endosonography-guided fine needle aspiration, and recurrence during long-term follow-up[J]. Endoscopy, 2015, 47(7):617-625. DOI: 10.1055/s-0034-1391712.
[6] Kartalis N, Mucelli RM, Sundin A. Recent developments in imaging of pancreaticneuroendocrine tumors[J]. Ann Gastroenterol, 2015, 28(2):193-202.
[7] Kim JH, Eun HW, Kim YJ, et al. Pancreatic neuroendocrine tumour (PNET): Staging accuracy of MDCT and its diagnostic performance for the differentiation of PNET with uncommon CT findings from pancreatic adenocarcinoma[J]. Eur Radiol, 2016,26(5):1338-1347. DOI: 10.1007/s00330-015-3941-7.
[8] 王鐵功,詹茜,劉芳,等.胰腺神經內分泌腫瘤良惡性CT征象分析[J].中華胰腺病雜志,2015,15(4):242-246. DOI: 10.3760/cma.j.issn.1674-1935.2015.04.006.
(本文編輯:冀凱宏)
MSCT features of partially or completely low enhancement of pancreatic neuroendocrine tumors
XuQinfeng,Guowanhua.
DepartmentofNuclearMedicine,NanjingDrum-TowerHospital,Nanjing, 210008China
Guowanhua,Email:wanhuaguo@163.com
Objective To observe MSCT features of partially or completely low enhancement of pancreas neuroendocrine tumors (PNENs). Methods The clinical data and MSCT features before pancreatectomy in 44 patients with confirmed PNENs were retrospectively reviewed. The MSCT findings were evaluated including tumor size, location, margin, density, intratumoral structure, bile duct and pancreatic ductal dilation and distant metastasis. Tumors were classified into complete enhancement type, partially or completely low enhancement type for further comparative analysis based on MSCT enhancement during pancreatic stage. Results A total of 56 PNENs in 44 patients were found, and there were 31 partially or completely low enhanced PNENs and 25 completely enhanced PNENs. The former were larger than the latter [mean tumor size, (3.3±2.2)cmvs(1.4±0.9) cm], and irregular shape and cystic components within tumors were more often observed (allP<0.05). There were no significant differences between the two types of PNENs in terms of gender, the presence of functional tumor, tumor location, clear tumor margin, intratumoral calcification, bile and pancreatic duct dilation and metastasis. 76.0%(19/25) of completely enhanced PNENs reached peak enhancement in arterial phase, and 71.0%(22/31) of low enhancement PNENs reached peak in pancreatic phase. Enhanced intratumoral blood vessels in the arterial phase were more frequent in low enhancement PNENs, and the difference was statistically significant (P<0.05). There were significant differences on pathological grade between the two types of PNENs (G1=21,G2=4,G3=0vsG1=18,G2=5, G3=8), and the difference was statistically significant (P<0.05). Conclusions Compared with complete enhancement PNENs, partially or completely low enhancement PNENs had bigger size, irregular shape, and cystic component. Intratumoral blood vessels in the arterial phase were observed, peak enhancement arrived later and the pathological grade was higher.
Pancreatic neoplasms; Neuroendocrine tumor; Tomography, spiral computed
10.3760/cma.j.issn.1674-1935.2017.03.009
210008 南京,南京鼓樓醫院核醫學科
郭萬華,Email: wanhuaguo@163.com
2016-08-02)

