長鏈非編碼RNA HIF1A-AS1對缺氧誘導的胰腺癌PANC1細胞自噬的調節作用
許豐 徐月梅 夏菲珍 姜玉華 張波 李先鵬
·論著·
長鏈非編碼RNA HIF1A-AS1對缺氧誘導的胰腺癌PANC1細胞自噬的調節作用
許豐 徐月梅 夏菲珍 姜玉華 張波 李先鵬
目的 觀察長鏈非編碼RNA HIF1A-AS1對缺氧誘導的胰腺癌PANC1細胞自噬的調節作用。方法 應用三氣培養箱及缺氧混合氣體(94%N2、5% CO2、1% O2)缺氧培養胰腺癌PANC1細胞3、6、12、24、36、48 h,實時熒光定量PCR法檢測HIF1A-AS1的表達。通過攜帶HIF1A-AS1過表達的重組腺病毒感染PANC1細胞和通過脂質體將靶向HIF1A-AS1的siRNA轉染PANC1細胞分別獲得過表達、低表達HIF1A-AS1的PANC1細胞株,以常規培養的PANC1細胞作為對照。對照組、過表達組、低表達組細胞分別缺氧培養24 h,采用實時熒光定量PCR法檢測各組PANC1細胞HIF1A-AS1的表達,流式細胞術檢測細胞凋亡率,蛋白質印跡法檢測自噬相關蛋白Beclin 1的表達。結果 缺氧培養的PANC1細胞HIF1A-AS1的表達隨缺氧時間的延長而增加,36 h時達峰值,從6 h開始均顯著高于對照組,差異均有統計學意義(P值均<0.01)。以對照組表達量為1,過表達組、低表達組細胞HIF1A-AS1的表達量分別為4.49±0.53、0.49±0.07,過表達組高于對照組,低表達組低于對照組,差異均有統計學意義(P值均<0.01)。對照組、過表達組、低表達組PANC1細胞經缺氧培養24 h后的細胞凋亡率分別為(8.27±1.28)%、(6.56±1.49)%、(19.9±2.34)%,過表達組低于對照組,低表達組高于對照組,差異均有統計學意義(P值均<0.01);Beclin 1表達量分別為1.05±0.11、1.29±0.19、0.38±0.18,過表達組高于對照組,低表達組低于對照組,差異均有統計學意義(P值均<0.01)。結論 HIF1A-AS1可能通過促進缺氧誘導胰腺癌PANC1細胞的自噬,參與胰腺癌的發病過程。
胰腺; 細胞系,腫瘤; 長鏈非編碼RNA; HIF1A-AS1; 自噬; 缺氧
Fund program: Natural Science Foundation of Zhejiang Province(LY16H160004)
缺氧微環境作為胰腺癌等實體腫瘤的重要特征之一,可誘導腫瘤細胞中多種耐藥基因的表達,導致化療耐藥[1]。自噬是真核細胞通過清除損傷細胞器或變性蛋白質維持細胞穩態的降解機制,在腫瘤形成、轉移及化療耐藥中起重要作用,但其調控機制尚未闡明[2-3]。長鏈非編碼RNA(long non-coding RNA, lncRNA)是最新發現的一類在表觀遺傳、轉錄水平、翻譯水平都具有調節作用的非編碼RNA分子[4-5],可通過調節腫瘤細胞的自噬水平參與腫瘤的發生、發展和轉移進程[6-7]。存在于缺氧誘導因子1α(hypoxia-inducible factor-1α,HIF-1α)反義鏈上的lncRNA HIF1A-AS1參與肝癌、非小細胞肺癌等腫瘤的發生和發展[8-9]。本研究在缺氧環境中培養胰腺癌PANC1細胞,觀察細胞HIF1A-AS1表達對細胞自噬活性的影響,探討其可能的調控機制。
材料與方法
一、PANC1細胞HIF1A-AS1表達的檢測
胰腺癌PANC1細胞株購自ATCC公司,常規培養傳代。應用三氣培養箱及缺氧混合氣體(94% N2、5% CO2、1% O2)培養細胞3、6、12、24、36、48 h,以常規培養細胞作為對照組。應用Trizol提取各組細胞總RNA,先利用隨機引物逆轉錄成cDNA,再采用實時熒光定量PCR法檢測HIF1A-AS1表達。HIF1A-AS1引物正義序列為5′-TTCGGTACTTTACGCACCCT-3′,反義序列為5′-TTTTCCTCCTTTTCGCCAGC-3′;內參β-actin引物正義序列為5′-TGGCATCCACGAAACTACCT-3′,反義序列為5′-CGTACAGGTCTTTGCGGATG-3′。反應條件:95℃ 15 s,58℃ 10 s,72℃ 20 s,40個循環。由儀器自帶軟件獲取Ct值,應用公式2-△△Ct計算其相對表達量,以對照組表達量計為1。
二、HIF1A-AS1過表達及低表達PANC1細胞株的構建及鑒定
HIF1A-AS1過表達的重組腺病毒由上海百力格生物技術公司合成,感染PANC1細胞,建立HIF1A-AS1過表達PANC1細胞株(過表達組)。靶向HIF1A-AS1的siRNA由上海吉瑪制藥公司設計并合成,采用脂質體法轉染PANC1細胞,建立HIF1A-AS1低表達細胞株(低表達組)。收集兩組細胞,抽提細胞總RNA,應用實時熒光定量PCR法檢測過表達、低表達細胞HIF1A-AS1表達,鑒定高、低表達細胞株構建是否成功。
三、PANC1細胞凋亡的檢測
取對照組、過表達組、低表達組對數生長期PANC1細胞,在缺氧環境中培養24 h。收集各組細胞,用預冷PBS洗滌2次。加入500 μl的Binding Buffer懸浮細胞,依次加入5 μl的Annexin V-FITC、5 μl的PI,混勻,置室溫避光反應5~15 min,上流式細胞儀檢測各組細胞凋亡率。
四、PANC1細胞自噬標志蛋白Beclin 1表達的檢測
取對照組、過表達組、低表達組對數生長期PANC1細胞,在缺氧環境中培養24 h,收集各組細胞,用細胞裂解液置冰上裂解30 min,離心5 min去除細胞碎片,收集上清液,應用BCA法測定蛋白濃度后取30 μg蛋白樣品行蛋白質印跡法檢測細胞Beclin 1蛋白表達,以β-actin為內參。抗Beclin 1一抗1∶1 000稀釋,辣根過氧化物酶標記的二抗 1∶2 000稀釋,最后ECL發光,X線片曝光、顯影、定影。通過Image J軟件獲取條帶灰度值,以目的條帶與內參條帶的灰度值比表示蛋白相對表達量。
五、統計學處理
結 果
一、缺氧培養對PANC1細胞HIF1A-AS1表達的影響
以對照組表達量為1,缺氧培養3、6、12、24、36、48 h的PANC1細胞的HIF1A-AS1表達量分別為1.37±0.21、1.96±0.27、2.22±0.16、3.46±0.54、4.26±0.27和3.04±0.23。HIF1A-AS1的表達隨缺氧時間的延長而增加,在36 h時達峰值。缺氧6 h以上各組HIF1A-AS1的表達量均顯著高于對照組,差異均有統計學意義(P值均<0.01)。
二、過表達及低表達HIF1A-AS1細胞鑒定
以對照組表達量為1,過表達組、低表達組細胞HIF1A-AS1的表達量分別為4.49±0.53、0.49±0.07。過表達組顯著高于對照組,低表達組顯著低于對照組,差異均有統計學意義(P值均<0.01)。
三、HIF1A-AS1對缺氧培養的PANC1細胞凋亡的影響
對照組、過表達組、低表達組PANC1細胞經缺氧培養24 h后的細胞凋亡率分別為(8.27±1.28)%、(6.56±1.49)%、(19.9±2.34)%,過表達組顯著低于對照組,低表達組顯著高于對照組,差異均有統計學意義(P值均<0.01,圖1)。

圖1 缺氧培養24 h后對照組(1A)、過表達組(1B)、低表達組(1C)PANC1細胞的凋亡率
四、HIF1A-AS1對缺氧培養的PANC1細胞自噬標志蛋白Beclin 1表達的影響
常氧培養24 h后,對照組、過表達組、低表達組PANC1細胞Beclin 1的表達量分別為0.15±0.08、0.31±0.15、0.13±0.11,過表達組明顯高于對照組,差異有統計學意義(P<0.01),而低表達組與對照組的差異無統計學意義。缺氧培養24 h后,對照組、過表達組、低表達組細胞的Beclin 1表達量分別為1.05±0.11、1.29±0.19、0.38±0.18,過表達組顯著高于對照組,低表達組顯著低于對照組,差異均有統計學意義(P值均<0.01,圖2)。
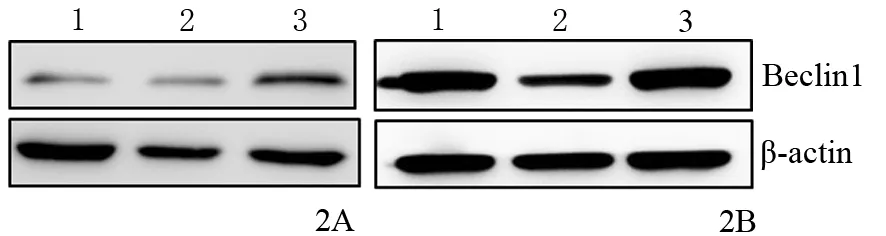
圖2 對照組(1)、低表達組(2)、過表達組(3)常氧(2A)及缺氧(2B)培養24 h后PANC1細胞Beclin 1蛋白表達
討 論
腫瘤細胞的高代謝和快速增殖狀態引起腫瘤組織局部微環境的氧含量持續降低,造成腫瘤內部的缺氧微環境。缺氧微環境引起缺氧相關轉錄因子的表達,進而誘導多種信號通路激活,不僅提高其惡性程度及轉移能力,還抑制針對腫瘤細胞的免疫反應,促使腫瘤細胞自身發生改變以逃避免疫細胞的攻擊[10-12]。因此,缺氧微環境下腫瘤細胞基因表達調控機制研究將為其靶向治療提供理論和實驗依據。
自噬是一種溶酶體依賴的真核細胞自身降解機制,在細胞功能維持穩定方面具有重要作用[13]。近年來的研究發現自噬與腫瘤發展和耐藥機制密切相關。自噬的“雙刃劍”作用,對耐藥的腫瘤細胞具有雙面作用。適量的自噬能夠促使耐藥細胞生存,而過度自噬能促使耐藥腫瘤細胞死亡[14]。研究發現胰腺癌細胞在缺氧微環境下通過氧化應激誘導黏蛋白-4(MUC4)降解,從而促進細胞自噬、增強細胞存活[15]。同時,自噬過程中溶酶體通過調控基因轉錄誘導胰腺癌細胞代謝形式發生改變[16]。但胰腺癌細胞自噬調控的具體作用機制還在初步研究階段。
研究發現,lncRNA作為具有重要調控作用的一類非編碼RNA,在多種腫瘤的發生、發展和轉移的過程中表達明顯異常,提示其可能參與腫瘤的發病過程[17]。HIF1A-AS1位于人的14號染色體HIF1α的反義鏈上,其成熟體長度為652 nt。近期有研究顯示在胸主動脈瘤組織中HIF1A-AS1表達明顯增加,HIF1A-AS1可能通過促進平滑肌細胞凋亡,調控胸主動脈瘤的發生發展進程[18]。本研究結果顯示HIF1A-AS1的水平與缺氧誘導的胰腺癌細胞自噬活性明顯相關,抑制HIF1A-AS1能夠顯著降低缺氧誘導的胰腺癌細胞自噬水平,但其具體調控機制還需深入探索。
[1] Strauss J, Alewine C, Figg WD, et al. Targeting the microenvironment of pancreatic cancer: overcoming treatment barriers and improving local immune responses[J]. Clin Transl Oncol, 2016,18(7):653-659. DOI: 10.1007/s12094-015-1459-8.
[2] Galluzzi L, Pedro JM, Demaria S, et al. Activating autophagy to potentiate immunogenic chemotherapy and radiation therapy[J]. Nat Rev Clin Oncol, 2017,14(4):247-258. DOI: 10.1038/nrclinonc.2016.183.
[3] Moscat J, Karin M, Diaz-Meco MT. p62 in cancer: signaling adaptor beyond autophagy[J]. Cell, 2016,167(3):606-609. DOI: 10.1016/j.cell.2016.09.030.
[4] Ling H, Vincent K, Pichler M, et al. Junk DNA and the long non-coding RNA twist in cancer genetics[J]. Oncogene, 2015,34(39):5003-5011. DOI: 10.1038/onc.2014.456.
[5] Di Gesualdo F, Capaccioli S, Lulli M. A pathophysiological view of the long non-coding RNA world[J]. Oncotarget, 2014,5(22):10976-10996. DOI: 10.18632/oncotarget.2770.
[6] Ying L, Huang Y, Chen H, et al. Downregulated MEG3 activates autophagy and increases cell proliferation in bladder cancer[J]. Mol Biosyst, 2013,9(3):407-411. DOI: 10.1039/c2mb25386k.
[7] Yang L, Zhang X, Li H, et al. The long noncoding RNA HOTAIR activates autophagy by upregulating ATG3 and ATG7 in hepatocellular carcinoma[J]. Mol Biosyst, 2016,12(8):2605-2612. DOI: 10.1039/c6mb00114a.
[8] Tantai J, Hu D, Yang Y, et al. Combined identification of long non-coding RNA XIST and HIF1A-AS1 in serum as an effective screening for non-small cell lung cancer[J]. Int J Clin Exp Pathol, 2015,8(7):7887-7895.
[9] Wang J, Chen L, Li H, et al. Clopidogrel reduces apoptosis and promotes proliferation of human vascular endothelial cells induced by palmitic acid via suppression of the long non-coding RNA HIF1A-AS1 in vitro[J]. Mol Cell Biochem, 2015,404(1-2):203-210. DOI: 10.1007/s11010-015-2379-1.
[10] Rey S, Schito L, Koritzinsky M, et al. Molecular targeting of hypoxia in radiotherapy[J]. Adv Drug Deliv Rev, 2017,109:45-62. DOI: 10.1016/j.addr.2016.10.002.
[11] Bredell MG, Ernst J, El-Kochairi I, et al. Current relevance of hypoxia in head and neck cancer[J]. Oncotarget, 2016,7(31):50781-50804. DOI: 10.18632/oncotarget.9549.
[12] Noman MZ, Hasmim M, Messai Y, et al. Hypoxia: a key player in antitumor immune response. A review in the theme: cellular responses to hypoxia[J]. Am J Physiol Cell Physiol, 2015,309(9):C569-C579. DOI: 10.1152/ajpcell.00207.2015.
[13] Hewitt G, Korolchuk VI. Repair, reuse, recycle: the expanding role of autophagy in genome maintenance[J]. Trends Cell Biol, 2017,27(5):340-351. DOI: 10.1016/j.tcb.2016.11.011.
[14] Yu L, Wu WK, Gu C, et al. Obatoclax impairs lysosomal function to block autophagy in cisplatin-sensitive and-resistant esophageal cancer cells[J]. Oncotarget, 2016,7(12):14693-14707. DOI: 10.18632/oncotarget.7492.
[15] Joshi S, Kumar S, Ponnusamy MP, et al. Hypoxia-induced oxidative stress promotes MUC4 degradation via autophagy to enhance pancreatic cancer cells survival[J]. Oncogene, 2016,35(45):5882-5892. DOI: 10.1038/onc.2016.119.
[16] Perera R, Stoykova S, Nicolay BN, et al. Transcriptional control of autophagy-lysosome function drives pancreatic cancer metabolism[J]. Nature, 2015,524(7565):361-251. DOI: 10.1038/nature14587.
[17] Chang YN, Zhang K, Hu ZM, et al. Hypoxia-regulated lncRNAs in cancer[J]. Gene, 2016,575(1):1-8. DOI: 10.1016/j.gene.2015.08.049.
[18] Wang S, Zhang X, Yuan Y, et al. BRG1 expression is increased in thoracic aortic aneurysms and regulates proliferation and apoptosis of vascular smooth muscle cells through the long non-coding RNA HIF1A-AS1 in vitro[J]. Eur J Cardiothorac Surg, 2015,47(3):439-446. DOI: 10.1093/ejcts/ezu215.
(本文編輯:冀凱宏)
Regulatory role of long-chain non-coding RNA HIF1A-AS1 on hypoxia-induced the autophagy of pancreatic cancer PANC1 cells
XuFeng,XuYuemei,XiaFeizhen,JiangYuhua,ZhangBo,LiXianpeng.
DepartmentofGastroenterology,YinzhouHospital,MedicalSchool,NingboUniversity,Ningbo315040,China
LiXianpeng,Email:849840290@qq.com
Objective To observe the regulatory role of long non-coding RNA HIF1A-AS1 on the autophagy of pancreatic cancer PANC1 cells induced by hypoxia. Methods The pancreatic cancer PANC1 cells were cultured in a three-gas incubator filled with hypoxic gas mixture (94% N2,5% CO2,1% O2) for 3, 6, 12, 24, 36 and 48 h. HIF1A-AS1 overexpression and low expression PANC1 cells were obtained by the infection of recombinant adenovirus carrying HIF1A-AS1 and the transfection of HIF1A-AS1 targeting siRNA by liposome, and routinely cultured PANC1 cells served as control. The expression of HIF1A-AS1 of PANC1 cells was detected by real-time quantitative PCR after being cultured in hypoxia-induced condition for 24 h. The apoptosis rate was detected by flow cytometry. The autophagy related proteins Beclin 1 were detected by western blot. Results The expression of HIF1A-AS1 in hypoxic cells was increased as the hypoxic time increased since 6 h and peaked at 36 h, which was significantly higher than that in control group (P<0.01). HIF1A-AS1 relative expression in HIF1A-AS1 overexpression and low expression PANC1 cells was 4.49±0.53 and 0.49±0.07, which were normalized to that of control group with the relative expression of 1. Control group had lower HIF1A-AS1 expression than HIF1A-AS1 overexpression PANC1 cells but higher HIF1A-AS1 in HIF1A-AS1 low expression PANC1 cells, and the differences were statistically significant (P<0.01).The cell apoptosis rate of control, HIF1A-AS1 overexpression and low expression PANC1 cells was (8.27±1.28)%, (6.56±1.49)% and (19.9±2.34)% after 24 h hypoxic culture. Control group had higher HIF1A-AS1 expression than HIF1A-AS1 overexpression PANC1 cells but lower HIF1A-AS1 in HIF1A-AS1 low expression PANC1 cells, and the differences were statistically significant (P<0.01). The expression of Beclin 1 protein was protein 1.05±0.11, 1.29±0.19 and 0.38±0.18, respectively. Control group had lower Beclin 1 expression than HIF1A-AS1 overexpression PANC1 cells but higher Beclin 1 in HIF1A-AS1 low expression PANC1 cells, and the differences were statistically significant (P<0.01). Conclusions HIF1A-AS1 can promote autophagy of pancreatic cancer PANC1 cells induced by hypoxia and participate in the pathogenesis and metastasis of pancreatic cancer.
Pancreas; Cell line, tumor; Long non-coding RNA; HIF1A-AS1; Autophagy; Anoxia
10.3760/cma.j.issn.1674-1935.2017.03.008
315040 寧波,寧波大學醫學院附屬鄞州醫院消化科
李先鵬,Email: 849840290@qq.com
浙江省自然科學基金(LY16H160004)
2017-01-04)

