河南省鄭州地區2014—2016年秋冬季腹瀉患兒輪狀病毒基因分型及干預研究
王艷麗 杜遠舉 李春力 程艷波
(1.鄭州市第一人民醫院 消化兒科 河南 鄭州 450003; 2. 河南出入境檢驗檢疫局 河南 鄭州 450003;3.鄭州人民醫院 兒科 河南 鄭州 450003; 4.河南省人民醫院 兒科 河南 鄭州 450003)
河南省鄭州地區2014—2016年秋冬季腹瀉患兒輪狀病毒基因分型及干預研究
王艷麗1杜遠舉2李春力3程艷波4
(1.鄭州市第一人民醫院 消化兒科 河南 鄭州 450003; 2. 河南出入境檢驗檢疫局 河南 鄭州 450003;3.鄭州人民醫院 兒科 河南 鄭州 450003; 4.河南省人民醫院 兒科 河南 鄭州 450003)
目的 研究2014—2016年鄭州地區秋冬季腹瀉患兒輪狀病毒基因分型及疫苗干預后發病情況。方法 收集鄭州市第一人民醫院消化兒科、鄭州人民醫院兒科、河南省人民醫院兒科2014年9月至2015年3月及2015年9月至2016年3月小于5歲門診及住院部秋冬季腹瀉患兒的糞便標本1 000份,采用免疫膠體金法檢測RV抗原,陽性標本進行VP7和VP4基因分型。結果 1 000份糞便標本中,624份檢測到A組輪狀病毒抗原,陽性率為62.4%(624/1 000);對陽性標本進行G、P分型,2014年9月至2015年3月輪狀病毒G血清型以G9型為主,和P型的組合以G9P8型為主。2015年9月至2016年3月G血清型以混合型為主,P基因型以P8型為主。624份陽性標本中,口服RV疫苗干預后再次感染的患兒以混合型感染者居多。以口服RV疫苗者為觀察組,以未使用者為對照組,觀察組與對照組再感染發病率差異有統計學意義(χ2=6.78,P<0.01);觀察組再感染的患兒出現腹瀉天數較少,差異有統計學意義(t=6.11,P<0.001);觀察組再感染的患兒發熱癥狀明顯減少,差異有統計學意義(χ2=75.21,P<0.001);觀察組再感染的患兒無脫水癥狀,差異有統計學意義(χ2=20.14,P<0.001)。結論 鄭州地區RV腹瀉患兒流行病毒株多樣,口服輪狀病毒疫苗后出現感染的以混合感染型別為主,且臨床表現較未使用疫苗者輕。
輪狀病毒;基因分型;腹瀉;干預治療
小兒腹瀉病是一種多因素、多病原引起的消化系統疾病,為世界性公共衛生問題,嚴重危害小兒的生長發育,也是導致嬰幼兒急診、死亡的主要原因之一。A組輪狀病毒(rotavirus ,RV)是導致嬰幼兒非細菌性腹瀉、院內交叉感染性腹瀉的最重要病原體[1-2]。RV感染較普遍,目前治療小兒RV腹瀉方法主要是對癥治療,預防脫水,維持電解質平衡,以及使用輪狀病毒疫苗,因此預防極其重要[3]。RV型別多樣,流行病學較復雜,在不同地區不同季節其流行型別各不相同,鄭州地區作為人口較多省會城市,為溫帶大陸氣候,四季分明,也是我國RV流行的代表性地區之一。本研究旨在對鄭州地區嬰幼兒A組RV腹瀉進行分子流行病學研究,并初步探討RV干預后再次感染患兒RV基因分型與臨床癥狀嚴重程度的關系,為RV的流行病學檢測提供科學數據。
1 資料和方法
1.1 標本及其來源 收集2014年9月至2015年3月及2015年9月至2016年3月鄭州市第一人民醫院消化兒科住院部和門診秋冬季腹瀉患兒500例,鄭州人民醫院兒科300例,河南省人民醫院兒科200例。其中2014年9月至2015年3月500份,2015年9月至2016年3月500份,符合臨床診斷標準見參考文獻[4-6]。該研究經醫院醫學倫理委員會批準后實施。
1.2 試驗方法 RT-PCR擴增RV的VP7全長基因及net-PCRVP7血清分型。分型方法見參考文獻[7]。Net-PCR進行VP4基因分型,分型方法見參考文獻[8]。
1.3 統計學方法 數據采用SPSS 17.0統計學軟件進行分析,定量資料采用獨立樣本t檢驗,定性資料采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 RV檢測結果以及RV感染的年齡和性別分布 1 000份糞便標本中A組RV陽性樣本為624份,陽性率為62.4%,624份陽性標本中年齡和性別分布如表1。

表1 2014年9月至2015年3月及2015年9月至2016年3月RV陽性標本年齡與性別分布(n)
2.2 RV的G血清型和P基因型型別特征 2014年9月至2015年3月G9型為優勢株,P基因型以P8為主。2015年9月至2016年3月混合型成為優勢株,P基因型以P8為主。見表2、3。
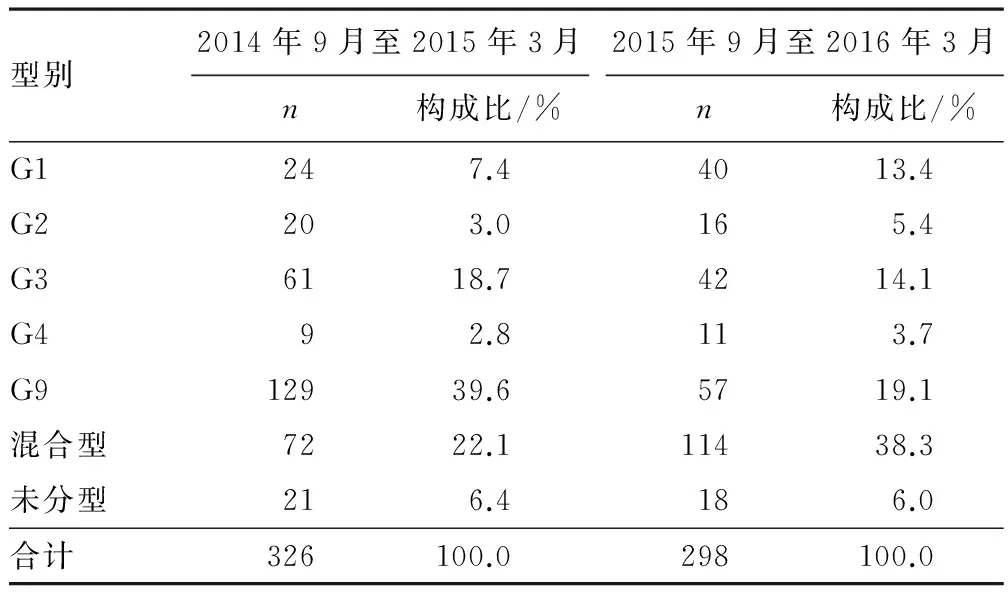
表2 2014年9月至2015年3月及2015年9月至2016年3月G分型
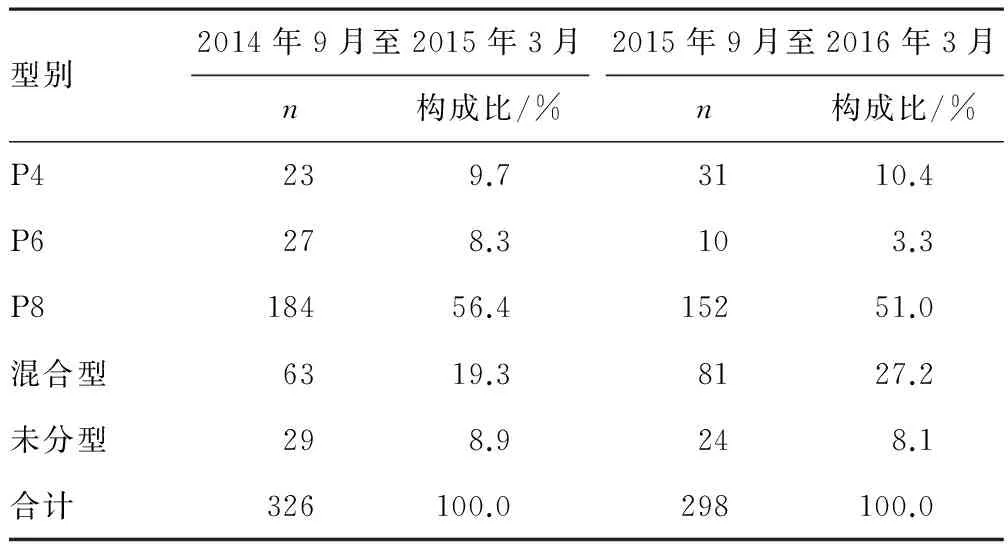
表3 2014年9月至2015年3月及2015年9月至2016年3月P基因分型
2.3 RV病毒分型及口服輪狀病毒疫苗后再次感染情況 624份陽性標本中,以口服RV疫苗者為觀察組,以未使用者為對照組。觀察組再次受感染的患兒有149例,對照組191例,差異有統計學意義(χ2=6.78,P<0.01);觀察組再感染的患兒臨床出現腹瀉天數較少,差異有統計學意義(t=6.11,P<0.001);觀察組再感染的患兒發熱癥狀明顯較少,差異有統計學意義(χ2=75.21,P<0.001);觀察組再感染的患兒無脫水癥狀,差異有統計學意義(χ2=20.14,P<0.001)。見表4。
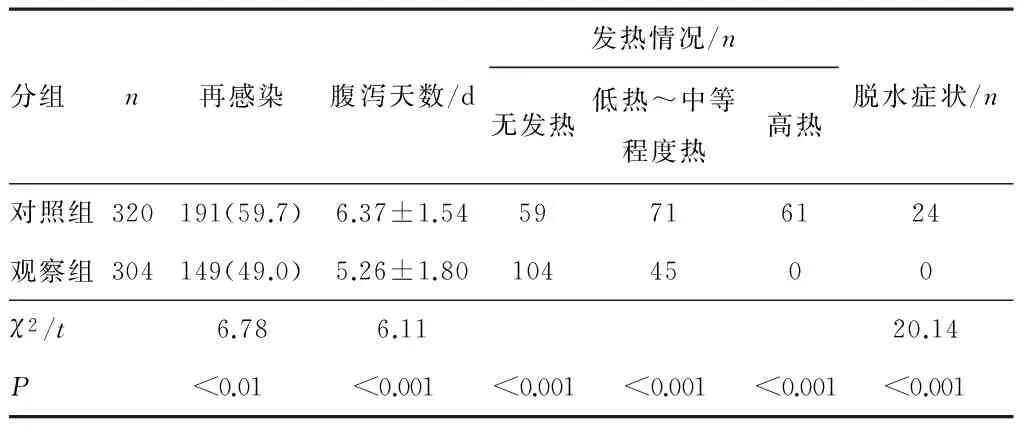
表4 口服輪狀病毒疫苗后再次感染情況及感染癥狀比較
3 討論
本課題研究結果顯示,鄭州地區2014—2016年秋冬季腹瀉患兒RV陽性率為62.4%,其中2014年9月至2015年3月陽性率為59.6%,2015年9月至2016年3月RV陽性率為65.2%,高于程艷波等[7-8]2010年鄭州地區監測陽性率的50%,低于王艷麗等[5]2011至2013年鄭州地區監測陽性率的68%,感染比例較往年相比有所下降,但RV仍是引起鄭州地區嬰幼兒腹瀉的主要因素。
RV由3層蛋白衣殼包裹11條雙鏈核糖核酸(RNA)片段組成,2個外層衣殼蛋白VP4和VP7,可分別誘導中和抗體的產生,發揮免疫保護作用。目前人們發現RV已有27個G血清型和35個P基因型被確定。在世界范圍內不同地域不同時間報道的RV流行株不同。全球最主要的流行毒株為G1型,其次是G3、G4、G2[9],不同型別之間具有一定的免疫交叉保護性。2003年8月至2007年7月,G3型被認為是中國最常見的輪狀病毒株,導致超過50%的病例[10]。如上海地區2001-2007年G基因型以G3為優勢株,2008—2011年G9和G1呈波動上升趨勢,尤其G9于2011年成為主要流行株[11]。蘭州地區G2型在2011年為優勢型,G3型在2009—2011年為優勢株,G8、G9型在2011—2013年為優勢株,G9和G3型在2013—2014年為優勢株[6]。鄭州地區2011年9月至2012年3月以G3型為主要流行株,2012年9月至2013年3月則以G9為主要流行株[5]。本研究發現鄭州地區2014年9月至2015年3月以G9型為主要流行株,2015年9月至2016年3月以混合型感染型別為主,其次為G9型,混合型感染較前有上升趨勢,流行株在鄭州地區不同年份出現了變異,且流行株以混合感染為主,考慮可能與RV突變有關。
目前引起嬰幼兒腹瀉的輪狀病毒P基因型多為P8和P4型,同時也發現了一些既往不常見的P6型。由于我國地域廣闊,各省份的優勢株更替速度不同,從全國總體來看P分型,自2006年以來以P8型為主,但G、P組合流行株隨著G分型的變更也出現了變化[12]。豫北地區2006—2012年間發現P8型多見,其次有P4型、P11型、P6型、P12型、P10型[13]。本研究發現鄭州地區2014—2016年P基因型均以P8型為主,有少量P6型出現,并發現P基因型混合感染,混合感染比例較往年有逐年增加的趨勢。
目前世界上被批準應用的人類輪狀病毒疫苗主要針對以往認為常見的G1~G4及P8型來預防感染[14]。關于在我國使用的輪狀病毒減毒株的Ⅲ期臨床評價,無相關文獻報道。只有一些上市后的保護性調查研究。2002—2004年在廣州的研究表明接種一劑輪狀病毒減毒株對預防5歲以下兒童因輪狀病毒腹瀉導致的住院的保護率為73.3%,對12~23月齡的幼兒的保護率要比2~11月齡的嬰幼兒的保護率髙,分別為80.9%和60.0%[15],說明輪狀病毒疫苗具有保護作用。本研究將624份陽性標本分為口服RV疫苗組(觀察組),以未使用RV疫苗者為對照組,研究發現使用RV疫苗干預后再次感染的病例以混合感染病例居多,且觀察組臨床表現一般為低熱或中等熱,腹瀉次數為3~5次,病程為3~5 d,無脫水癥狀,對照組表現為高熱,并伴有嘔吐,且病程一般為1周左右,出現脫水癥狀患兒多,較觀察組臨床表現較重,差異有統計學意義(P<0.05)。這表明RV疫苗在預防患兒感染方面具有一定意義,但目前疫苗保護具有局限性,臨床出現使用疫苗后再次感染情況,目前對使用疫苗干預再感染的研究報道較少,需要進一步深入研究以了解疫苗干預治療后對臨床的影響。
[1] GBD 2013 mortality and causes of death collaborators.Global,regional,and national age-sex specific all-cause and cause-specific mortality for 240 causes of death,1990-2013: a systematic analysis for the global burden of disease study 2013[J]. Lancet,2015,85(9963):117-171.
[2] Gargano L M, Tate J E, Parashar U D, et al. Comparison of impact and cost-effectiveness of rotavirus supplementary and routine immunization in a complex humanitarian emergency, Somali case study[J]. Confl Health, 2015,9:5.
[3] Afrad M H,Hassan Z,Farjana S, et al.Changing profile of rotavirus genotypes in Bangladesh, 2006-2012[J].BMC Infect Dis,2013, 13: 320.
[4] 王衛平, 毛萌, 李延玉.兒科學[M]. 第8版.北京:人民衛生出版社, 2013:251-260.
[5] 王艷麗, 杜遠舉, 李春力, 等. 鄭州地區秋冬季腹瀉患兒輪狀病毒基因分型及干預研究[J].中國醫學創新,2015,(36):8-11.
[6] 魏孔福, 劉新鳳, 劉東鵬, 等.蘭州地區嬰幼兒A組輪狀病毒腹瀉分子流行病學特征研究[J].中國病毒病雜志, 2016, 6(5): 328-331.
[7] 程艷波, 王艷麗. 2010年鄭州地區嬰幼兒腹瀉A組輪狀病毒VP7基因型分型[J].實用兒科臨床雜志,2011,26(7):518-519.
[8] 盧麗娟, 徐錦, 鐘華清, 等. 2006—2008年上海市住院腹瀉患兒A組輪狀病毒的分子流行病學調查[J].中華傳染病雜志,2012,30(2):90-94.
[9] Hoshino Y, Kapikian A Z.Rotavirus serotypes: classification and importance in epidemiology, immunity, and vaccine development[J].J Health Popul Nutr, 2000,18(1): 5-14.
[10]Duan Z J, Liu N, Yang S H, et al. Hospital-Based surveillance ofrotavirus diarrhea in the People's republic of China, August 2003-July 2007[J]. J Infect Dis, 2009, 200(1): S167-S173.
[11]盧麗娟, 鐘華清, 蘇犁云, 等. 2008—2011年上海單中心住院腹瀉兒童輪狀病毒基因型別流行特征[J].中國循證兒科雜志,2013,8(2):98-104.
[12]呂榜軍,黎明強,覃彥香.輪狀病毒感染性腹瀉流行及疫苗的研究進展[J].現代預防醫學雜志, 2016, 43(30): 739-757.
[13]李樹林.豫北地區小兒輪狀病毒腹瀉流行病學研究[J].中國衛生產業, 2016,13(6): 87-89.
[14]董慧瑾, 錢淵, 張又, 等. 2009—2010年北京兒童腹瀉中輪狀病毒新VP4基因亞型的研究[J]. 病毒學報, 2011, 27(6): 565-569.
[15]Fu C,Wang M,Liang J, et al.Effectivess of Lanzhou lamb rotavirus vaccine against rotavirus gastroenteritis requiring hospitalization:a matched case-control study[J].Vaccine,2007,25(52):8756-8761.
The analysis and intervention study about genotypes of rotavirus in infantile diarrhea in Zhengzhou from autumn to winter in 2014—2016
Wang Yanli1, DU Yuanju2, Li Chunli3, Cheng Yanbo4
(1.Digestion of Peadiatrics, the First People's Hospital of Zhengzhou, Zhengzhou 450003, China;2. Henan Entry-Exit Inspection and Quarantine Bureau, Zhengzhou 450003, China;3.Department of Pediatrics, the People's Hospital of Zhengzhou,Zhengzhou 450003, China;4.Department of Pediatrics, the People's Hospital of Henan Province, Zhengzhou 450003, China)
Objective To study the genotypes and the reinfection after vaccines interventions of rotavirus in infantile diarrhea from September of 2015 to March of 2016 in ZhengZhou.Methods Stool samples were collected from 1 000 children who were in hospital and outpatients in the Department of Peadiatrics, the First People's Hospital and the People's Hospital of Zhengzhou, the people's Hospital of Henan Province from September of 2014 to March of 2015, and from September of 2015 to March of 2016. Immune colloidal gold reagent was used to detect rotavirus antigen. The positive samples were performed to identify rotavirus P and G genotypes. Results Out of 1 000 samples investigated,434 positive samples were detected rotavirus G genemic, the positive rate was 62.4%(624/1 000),612 positive samples were performed to identify genotypes G and P.G9 genotypes were dominated the main prevalence from September in 2014 to March in 2015, the main mixed infection types were G9P8. The mixed genotypes were dominated the main G genotypes from September in 2015 to March in 2016, the main mixed infection types were P8. 624 positive samples, after taking rotavirus vaccine the reinfection cases were most mixed genotypes.Taking rotavirus vaccine children and notaking rotavirus vaccine children were divided into observation group and control group. There was significant difference between the two groups in the reinfection rates(χ2=6.78,P<0.01); the children who got reinfection had less duration of hospitalizationin observation group, the difference was statistically significant(t=6.11,P<0.001); there were mild feverish symptoms in observation group, the difference was statistically significant(χ2=75.21,P<0.001); there were no dehydration symptoms in observation group, the difference was statistically significant(χ2=20.14,P<0.001) .Conclusion The prevalent types in Zhengzhou were various, the mixed infection cases increased than ever.The uncommon G9 types are the dominated prevence genotypes. After taking rotavirus vaccine, the reinfection cases are most mixed genotypes,and the clinical manifestation is lighter than the children who are not taking rotavirus vaccine.
rotavirus;genotype;diarrhea;therapeutic intervention
河南省科技廳公關計劃項目(9412015Y0379)。
R 733.4
10.3969/j.issn.1004-437X.2017.11.002
2017-04-01)

