大黃素對裸鼠人結腸癌細胞移植瘤的抑制作用及機制
金劍,趙慶
(上海市第一人民醫院寶山分院,上海 200000)
大黃素對裸鼠人結腸癌細胞移植瘤的抑制作用及機制
金劍,趙慶
(上海市第一人民醫院寶山分院,上海 200000)
目的 探討大黃素對裸鼠人結腸癌細胞移植瘤生長及血管生成的抑制作用及其機制。方法 建立裸鼠人結腸癌細胞SW480移植瘤模型,隨機分為大黃素低、中、高劑量組和對照組,每組10只。大黃素低、中、高劑量組分別予濃度為10、20、40 mmol/L的大黃素(5 mL)灌胃,對照組予等量生理鹽水灌胃,均1次/d。灌胃3周脫臼處死,剝取腫瘤并測量其體積及質量,計算抑瘤率;免疫組化法檢測瘤組織微血管密度(MVD)和β-catenin表達;ELISA法測定血清內皮生長因子(VEGF)、血管生成素2(Ang-2)和堿性成纖維細胞生長因子(bFGF)水平。結果 抑瘤率:大黃素低、中、高劑量組分別為29.32%、36.08%、41.62%;MVD計數:對照組、大黃素低、中、高劑量組分別為(48.21±1.89)、(43.09±1.78)、(27.45±2.24)和(21.31±1.85)個,兩兩比較P均<0.01。大黃素低、中、高劑量組血清VEGF、Ang-2、bFGF水平及瘤組織β-catenin蛋白表達均明顯低于對照組(P均<0.01),且呈劑量依賴性。結論 大黃素可抑制裸鼠人結腸癌移植瘤的生長及微血管形成,其機制可能為下調Wnt/β-catenin通路中的促血管生成因子表達。
結腸癌;移植瘤;大黃素;Wnt/β-catenin;促血管生成因子;微血管密度;裸鼠
腫瘤向周圍臟器組織侵襲和轉移依賴于血管新生[1,2]。根據結腸癌病理特征及血管形成的分子機制,破壞結腸癌供血血管或阻斷新生血管形成是結腸癌治療的重要途徑[3]。研究報道,腸道腫瘤形成過程中血管內皮生長因子(VEGF)水平被Wnt/β-catenin通路中的轉錄因子上調,該作用方式在結腸癌中或許同樣存在。作為蒽醌類物質的大黃素,已在腫瘤細胞及動物模型中表現出抗增殖和抗轉移的作用[4,5]。大黃素對宮頸癌、肝癌細胞等具有殺傷和抑制生長的作用,效果非常明顯[6,7]。但大黃素能否抑制結腸癌細胞血管生成及其其作用機制,相關報道較少。2015年10月~2016年8月,本研究探討了大黃素對人結腸癌移植瘤生長及血管生成的抑制作用及機制,旨在為大黃素治療結腸癌提供實驗證據。
1 材料與方法
1.1 材料 細胞:人結腸癌細胞SW480購自上海中科院細胞庫,在含1.5 mmol/L谷氨酰胺的培養液,5%的FBS,5% CO2、37 ℃培養箱中培養。動物:BALB/c裸鼠40只,雄性,SPF級,體質量18~22 g,購自同濟醫院動物中心。藥物:大黃素(純度≥99.0%)購自中國食品藥品檢定研究院;0.5 mg大黃素溶于100 μL DMSO,并按順序加3.7 mL滅菌水、25 μL 5 mmol/L NaOH溶液;過濾溶液作為母液,-20 ℃凍存;臨用前無菌水稀釋。血管生成素2(Ang-2)、VEGF和堿性成纖維細胞生長因子(bFGF)試劑盒購自上海博谷生物科技公司。儀器:Galaxy S培養箱(RS);5804R高速冷凍離心機(Eppendorf)。
1.2 移植瘤模型建立及分組干預 取對數生長期人結腸癌細胞SW480,調整細胞密度為1×107個/mL,200 μL/只接種裸鼠背部近右上肢皮膚。1周后,瘤體直徑約1 cm。取腫瘤組織切成1 mm3,小鼠右側頸背部皮下皮下注射。細胞進行3次傳代,繼續接種,直至裸鼠移植瘤模型建立。約1周,游標卡尺測量移植瘤的直徑,待腫瘤體積200 mm3左右時,隨機分為對照組、大黃素低劑量組、大黃素中劑量組、大黃素高劑量組,每組10只。大黃素低、中、高劑量組分別給予濃度為10、20、40 mmol/L的大黃素(5 mL)灌胃;對照組予等體積生理鹽水灌胃,1次/d。
1.3 相關指標觀察 各組灌胃3周從眼球取血并取出瘤體,行以下指標觀察。
1.3.1 血清VEGF、Ang-2和bFGF水平 裸鼠經眼球取血并分離血清,采用ELISA法測定血清Ang-2、VEGF和bFGF水平。
1.3.2 抑瘤率 記錄腫瘤體積并稱重。抑瘤率(%)=(1-實驗組瘤重均值/對照組瘤重均值)×100%。
1.3.3 腫瘤微血管密度(MVD) 采用免疫組化法。腫瘤組織經甲醛固定后依次經乙醇脫水,石蠟包埋,切片,抗原修復,封閉,孵育,DAB顯色,終止反應;復染,脫水,透明,樹脂封片操作。陽性對照是已知的陽性切片,陰性對照采用PBS代替一抗進行。瘤體組織切片在100倍下光鏡掃描,選擇微血管標記區密集區域,200倍下光鏡掃描選取5個不重復視野計數,均值作為標本MVD值。定位于血管內皮細胞的CD34陽性染色呈棕褐色,黏膜組織中棕褐色單獨的內皮細胞及簇均計為一個血管,排除肌層厚及管腔紅細胞數大于8個的血管。
1.3.4 腫瘤組織β-catenin表達 采用免疫組化法。陽性片及PBS代替一抗片分別作為陽性、陰性對照。細胞質、細胞核和細胞膜是β-catenin表達聚集的地方,染色呈棕黃色顆粒,細胞中出現棕黃色顆粒狀物判定陽性。于200倍光鏡掃描下任選切片10個視野(細胞數>1 000),采用雙盲法計數陽性細胞。陽性率(%)=陽性細胞數/總細胞數×100%。
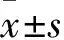
2 結果
2.1 各組血清Ang-2、VEGF和bFGF水平比較 與對照組比較,大黃素低、中、高劑量組血清VEGF、Ang-2、bFGF水平均明顯下調(P均<0.01),且具有劑量依賴性。見表1。

表1 各組血清Ang-2、VEGF和bFGF相對表達量比較
注:與對照組比較,*P<0.01;與大黃素低劑量組比較,△P<0.01。
2.2 各組抑瘤率比較 對照組及大黃素低、中、高劑量組腫瘤體積分別為(501.0±41.7)、(362.0±50.2)、(315.2±80.3)、(292.0±40.8)mm3,瘤重分別為(0.524±0.026)、(0.354±0.089)、(0.323±0.096)、(0.293±0.041)g,兩兩比較P均<0.01;大黃素低、中、高劑量組抑瘤率分別為29.32%、36.08%、41.62%;見插頁Ⅲ圖3。
2.3 各組腫瘤MVD比較 對照組及大黃素低、中、高劑量組瘤體MVD計數分別為(48.21±1.89)、(43.09±1.78)、(27.45±2.24)和(21.31±1.85)個,兩兩比較P均<0.01。見插頁Ⅲ圖4。
2.4 各組瘤體β-catenin蛋白表達比較 對照組和大黃素低、中、高劑量組β-catenin蛋白相對表達量分別為1.00±0.08、0.63±0.05、0.58±0.02、0.46±0.02。與對照組比較,大黃素低、中、高劑量組均明顯下調,且呈劑量依賴性(P均<0.01)。
3 討論
實體腫瘤快速生長、轉移的決定性因素是新生血管形成。抑制血管生成,切斷腫瘤生長的供養途徑使腫瘤的血行通道得以阻斷,可有效遏制腫瘤的生長和擴散[8,9]。抑制血管生成因子或抑制促血管生成因子均能抑制血管生成[10]。
中藥或其有效成分能夠抑制血管新生,起到抗腫瘤效果,如丹參酮ⅡA等。有研究表明,大黃素能夠抑制腫瘤細胞生長、誘導細胞凋亡[11,12]。本研究發現,與對照組比較,大黃素低、中、高劑量組瘤體較小,瘤重更輕,且呈劑量依賴性;大黃素低、中、高劑量組瘤重抑制率分別為29.32%、36.08%、41.62%,但與5-FU組比較差異無統計學意義。研究表明,大黃素能夠抑制腫瘤MVD形成以及下調促血管生成因子Ang-2、VEGF和bFGF表達。本研究結果發現,大黃素低、中、高劑量組與對照組相比,MVD均明顯降低,濃度越大下降越明顯,高劑量組MVD不足對照組的50%。大黃素抑制裸鼠人結腸癌微血管的形成作用效果顯著。與對照組比較,裸鼠血清中VEGF水平在大黃素低、中、高劑量組均下調,分別是對照組的0.71、0.56和0.42倍,具有劑量依賴性。血清中Ang-2水平在大黃素低、中、高劑量組同樣下調,分別是對照組的0.70、0.65和0.46倍;血清中bFGF表達水平在大黃素低、中、高劑量組均呈降低趨勢,分別為對照組的0.80、0.73和0.65倍。可以看出,大黃素對VEGF下調能力最強,其次Ang-2,再次bFGF。結果表明大黃素明顯抑制裸鼠人結腸癌促血管生成因子VEGF、Ang-2和bFGF表達,但調控能力有差異。
血管生成抑制因子Arresten可通過抑制內皮細胞增殖和凋亡進而抑制腫瘤血管生成[13~15]。有研究發現,轉染pSecTag2-arrestenLOVO后腫瘤結節形成數和MVD低于對照組[16,17];人Ⅳ型膠原腫瘤血管生成抑制因子具有類似功能[18,19]。Rao等[20]檢測結腸癌患者VEGF和β-catenin表達,發現兩者有正相關性。β-catenin的結合位點在VEGF啟動子區,轉染β-catenin后,VEGF的mRNA和蛋白表達上調。本研究移植瘤組織β-catenin表達下調,與MVD和VEGF等分子的變化趨勢相關;與Zhang等[21]、Huang等[22]研究結果吻合。
綜上所述,大黃素可抑制裸鼠人結腸癌移植瘤生長及MVD形成。其作用機制可能為調控Wnt/β-catenin通路中的關鍵分子,下調促血管生成因子VEGF等表達。
[1]RasoolS,KadlaSA,RasoolV,etal.AcomparativeoverviewofgeneralriskfactorsassociatedwiththeincidenceofColorectalcancer[J].TumourBiol, 2013,34(5):2469-476.
[2]AhnenDJ,WadeSW,JonesWF,etal.Theincreasingincidenceofyoung-onsetcolorectalcancer:acalltoaction[J].MayoClinProc, 2014,89(2):216-224.
[3]PriyadarsiniRV,NaginiS.Cancerchemopreventionbydietaryphytochemicals:promisesandpitfalls[J].CurrPharmBioteehnol, 2012,13(1):125-136.
[4]AhmedinJD,FreddieBray,MelissaM,etal.GlobalCancerStatistics[J].CACancerJClin, 2011,61(2):69-90.
[5] 劉寧寧,王炎,周利紅,等.健脾解毒方對幽門螺桿菌誘發胃癌血管新生的抑制研究[J].中國實驗方劑學雜志,2011,17(1): 88-92,95.
[6] 劉靜,史勤,呂祥,等.健脾復方對人大腸癌移植瘤裸小鼠COX-2,NF-kb和AP-1表達的影響[J].中華中醫藥雜志,2012,27(7):1932-1934.
[7] 金旻逸,丁越,張彤,等.腸胃清顆粒提取工藝研究[J].亞太傳統醫藥,2011,7(2):20-23.
[8] 王俞,崔書中.惡性腫瘤患者的免疫功能狀態及免疫治療研究進展[J].中國腫瘤臨床,2014,41(13):876-879.
[9] 劉宣,李丹光,周利紅,等.PGE2/COX-2激活Wnt/β-catenin信號通路調控人腸癌細胞VEGF表達[J].第二軍醫大學學報,2012,33(11):1178-1181.
[10] 劉宣,王炎,殷佩浩,等.Wnt/β-catenin信號通路對人腸癌細胞VEGF表達的調控作用[J].中國癌癥雜志,2012,22(12):881-885.
[11] 劉寧寧,周利紅,殷佩浩,等.健脾解毒方對幽門螺桿菌誘發胃癌過程微血管密度及環氧合酶表達的影響[J].中國中西醫結合雜志,2011,31(5):647-652.
[12] 劉宣,王炎,李丹光,等.丹參酮ⅡA對COX-2激活β-catenin信號通路介導的人腸癌細胞VEGF表達的調控作用[J].中華中醫藥雜志, 2013,28(1):108-112.
[13] 謝丹,林源,楊阿莉.大黃素抑制人肝癌裸鼠移植瘤生長機制探討[J].中華腫瘤防治雜志,2015,22(1):28-33.
[14] 錢曉萍,劉寶瑞,胡靜,等.漢防己甲素抑制血管生成的作用[J].癌癥,2008,27(10):1050-1055.
[15] 凌彬,陳曼麗,劉潔,等.普萘洛爾治療增殖期血管瘤患者血管內皮生長因子-A及表皮生長因子樣結構域7的表達分析[J].華西口腔醫學雜志,2014,32(5):441-445.
[16] 李杰玉,陳澤奇,林源,等.大黃素對人肝癌HepG2細胞AIF和EndoG蛋白表達的影響[J].現代生物醫學進展,2009,9(5):829-831.
[17] 凌彬,陳曼麗,劉潔,等.普萘洛爾治療增殖期血管瘤患者血管內皮生長因子-A及表皮生長因子樣結構域7的表達分析[J].華西口腔醫學雜志,2014,32(5):441-445.
[18] 洪亞瓊,金慧實,鄢鴻,等.低劑量輻射聯合阿霉素對荷乳腺癌裸鼠移植瘤生長及其移植瘤組織中HIF-1α和VEGF表達的影響[J].吉林大學學報:醫學版,2015,41(1):43-46.
[19] 謝丹,林源,楊阿莉.大黃素抑制人肝癌裸鼠移植瘤生長機制探討[J].中華腫瘤防治雜志,2015,22(1):28-33.
[20]RaoC,LinSL,WenH,etal.CrosstalkbetweencanonicalTGF-β/SmadandWnt/β-cateninsignalingpathway[J].ZhejiangDaXueXueBaoYiXueBan, 2013,42(5):591-596.
[21]ZhangL,KimS,DingW,etal.Arsenicsulfideinhibitscellmigrationandinvasionofgastriccancerinvitroandinvivo[J].DrugDesDevelTher, 2015(9):5579-5590.
[22]HuangD,DuX.CrosstalkbetweentumorcellsandmicroenvironmentviaWntpathwayincolorectalcancerdissemination[J].WorldJGastroenterol, 2008,14(12):1823-1827.
上海市衛生和計劃生育委員會科研課題(20144Y01116)。
10.3969/j.issn.1002-266X.2017.20.011
R735.3
A
1002-266X(2017)20-0037-03
2016-10-07)

