異葉敗醬提取物對白血病細胞體外抑制作用的實驗研究
劉 俐,穆麗華,劉 屏
(1.山西中醫學院,山西 太原 030024;2.解放軍總醫院藥理藥學研究室,北京 100853)
異葉敗醬提取物對白血病細胞體外抑制作用的實驗研究
劉 俐1,2,穆麗華2,劉 屏2
(1.山西中醫學院,山西 太原 030024;2.解放軍總醫院藥理藥學研究室,北京 100853)
目的:研究異葉敗醬提取物對白血病細胞體外增殖的毒性抑制作用。方法:提取異葉敗醬浸膏,通過硅膠柱分離純化異葉敗醬中的單體化合物,選擇白血病細胞株HL-60、K562、Jurkat為實驗對象,與不同濃度的異葉敗醬提取物及分離得到的單體化合物共同培養,采用CCK-8法檢測其對白血病細胞體外增殖的影響,并通過流式細胞儀檢測化合物3對K562細胞凋亡和周期的影響。結果:異葉敗醬提取物和單體化合物均對白血病細胞有一定的毒性抑制作用,并且抑制作用與藥物濃度有依賴關系。當不同濃度的化合物3作用于K562細胞后,K562細胞出現不同程度的凋亡,細胞早期凋亡率明顯上升,與對照組相比具有顯著性差異(P < 0.01);細胞周期G0/G1期所占比率由42.34%增至59.48%和64.72%,與對照組相比具有顯著性差異(P < 0.01)。結論:異葉敗醬提取物對白血病細胞具有明顯的體外增殖毒性抑制作用,從中分離得到的環烯醚萜類化合物3能夠誘導K562細胞的凋亡,并且將細胞周期阻滯在G0/G1期。異葉敗醬提取物發揮抗腫瘤藥理作用的物質基礎很可能與其中的環烯醚萜類成分有關。
異葉敗醬;白血病;細胞凋亡;環烯醚萜
白血病的發病是由于造血干細胞的惡性病變,白血病細胞在骨髓、造血組織中非正常大量增生,抑制正常造血過程,白血病的分型主要有慢性淋巴細胞白血病(chronic lymphocytic leukemia,CLL)、慢性粒細胞性白血病(chronic myelocytic leukemia,CML)、急性淋巴細胞白血病(acute lymphoblastic leukemia,ALL)和急性髓性白血病(acute myelogenous leukemia,AML)[1]。目前白血病的主要治療方法是化療,化學藥物在治療白血病的同時,也給患者機體造成難以逆轉的傷害,給患者和患者家庭都帶來了沉重的身體和精神負擔。國內外研究者將目光轉移到了中藥上,從前人的智慧中汲取經驗。中醫藥通過扶正祛邪辨證論治,在白血病的治療上取得了確切的療效[2]。異葉敗醬是中藥墓頭回的藥源植物之一[3],臨床用藥也證實了墓頭回對于白血病的控制作用[4]。本研究將異葉敗醬粗提物和其中3個環烯醚萜類單體化合物按照不同濃度配比與人早幼粒白血病細胞(HL-60)、人慢性粒細胞白血病細胞(K562)、人急性T細胞白血病細胞(Jurkat)共同培養,以順鉑為陽性對照,通過CCK-8法評價異葉敗醬提取物對細胞增殖的抑制作用,并初步探討化合物3對K562細胞的凋亡和周期的影響。
1 材料
1.1 細胞株
人早幼粒白血病細胞(HL-60)、人慢性粒細胞白血病細胞(K562)、人急性T細胞白血病細胞(Jurkat),以上三株細胞均購于中國醫學科學院腫瘤醫院細胞中心。
1.2 實驗藥品
異葉敗醬[2014年采于河南省,經中國人民解放軍總醫院劉萍主任藥師鑒定為異葉敗醬(Patrinia heterophylla Bunge)全草];順鉑(齊魯制藥有限公司)。
1.3 實驗儀器
YT-CJ-1ND超凈工作臺(北京亞泰科隆技術有限公司);MCO-15ACCO2恒溫培養箱(日本SANYO公司);DT5-2離心機(北京時代北利離心機有限公司);酶標儀(1420-012)(美國Perkin Elmer公司);ECLIPSE TS100顯微鏡(日本Nikon公司);流式細胞儀(美國BD公司)。
1.4 主要試劑
石油醚、氯仿、丙酮、乙酸乙酯、正丁醇和甲醇等分析純試劑(國藥集團化學試劑有限公司);RPMI 1640培養基(美國Gibco公司);胎牛血清(FBS,美國HyClone公司);二甲基亞砜(DMSO,Amresco公司);CCK-8試劑盒(Biosharp生物科技公司);細胞凋亡檢測試劑盒、細胞周期檢測試劑盒(凱基生物科技發展有限公司)。
2 方法
2.1 墓頭回粗提物和單體化合物的制備
將干燥的異葉敗醬全草粉碎,乙醇加熱50 ℃回流提取。提取液過濾,減壓濃縮,得到異葉敗醬總提取物浸膏。將上述浸膏懸浮在蒸餾水中,依次用等體積的石油醚、氯仿、乙酸乙酯、正丁醇萃取。收集有機相并減壓濃縮,得到石油醚部位、氯仿部位、乙酸乙酯部位和正丁醇部位浸膏。將乙酸乙酯萃取部位經硅膠柱色譜,以氯仿-甲醇-水系統為流動相,梯度洗脫,得到餾分Y-1 ~ Y-95,合并餾分Y-12 ~ Y-15(氯仿 : 甲醇 = 30 : 1),以石油醚 : 丙酮(3 : 1)等度洗脫得化合物1;合并餾分Y-16 ~ Y-18(氯仿 : 甲醇 = 30 : 1),以石油醚 : 丙酮(3 : 1)等度洗脫得到化合物2和化合物3。
2.2 細胞培養
HL-60、K562、Jurkat三株細胞均在15%胎牛血清的RPMI 1640培養液中,37 ℃,5% CO2飽和濕度條件下培養,1 ~ 2 d傳代一次。
2.3 溶液系統的配制
分別稱取異葉敗醬不同部位浸膏,加入DMSO溶液,使浸膏充分溶解,得到濃度為104μg·mL-1的粗提物溶液。加入完全培養基按比例稀釋,在超凈臺中用無菌濾膜過濾,得到粗提物濃度從低到高依次為10、20、40、80、100 μg·mL-1的溶液。單體化合物溶液的配制同上。
2.4 異葉敗醬對白血病細胞體外增殖的作用
將處于對數生長期的HL-60、K562、Jurkat三株細胞按照5000個/孔的數量分別接種于96孔板中,每孔加入細胞懸液50 μL。恒溫培養24 h后分別加入濃度為10、20、40、80、100 μg·mL-1的粗提物、單體化合物溶液及順鉑溶液50 μL。每株細胞均設置空白對照,空白對照組加入50 μL完全培養基,每組濃度梯度設置5個平行副孔。給藥后置于培養箱內培養48 h。48 h后每孔加入10 μL CCK-8溶液,輕輕振搖,使CCK-8溶液與細胞懸液充分混合。1 ~ 2 h(每株細胞時間略有差異)后在450 nm處檢測OD值,計算抑制率和IC50。
2.5 化合物3對K562細胞凋亡的影響
取處于對數生長期的K562細胞計數,按照1× 105的細胞數量接種于六孔板中,每孔2 mL,保證每孔細胞數目均等。分別在六個孔中加入完全培養液以及“2.3”項下配制好的化合物3溶液,使六孔板中每孔培養液中含有化合物3的的終濃度依次為0、10、20、40 μg·mL-1。將六孔板置于恒溫培養箱中,48 h后終止給藥。
離心收集細胞,PBS洗滌兩次后懸浮于500 μL Binding Buffer中,加入5 μL Annexin V-FITC和5 μL Propidium Iodide染色,避光反應,在流式細胞儀上檢測。
2.6 化合物3對K562細胞周期的影響
按“2.5”項下方法收集細胞后,制備細胞濃度為1×106·mL-1的單細胞懸液,4 ℃條件下用70%乙醇固定8 h,洗去固定液后加入100 μL RNase A溶液,37 ℃水浴30 min后用400 μL PI染色30 min,流式細胞儀檢測。
2.7 統計學分析
采用SPSS統計軟件,數據以(x± s )表示,組間比較采用方差齊性檢驗和Dunnett-t檢驗,以P < 0.05為差異具有統計學意義。
3 結果
3.1 異葉敗醬對白血病細胞的體外抑制作用
3.1.1 異葉敗醬粗提物對白血病細胞的抑制作用 給予細胞不同濃度的粗提物刺激后,不同細胞的生長均受到不同程度的抑制。氯仿、乙酸乙酯、水三部分對于HL-60、K562、Jurkat細胞的抑制作用較為明顯,且這三部分對于細胞的抑制率均隨藥物濃度的增加而增強。細胞受到的抑制作用以IC50表示,詳見表1。
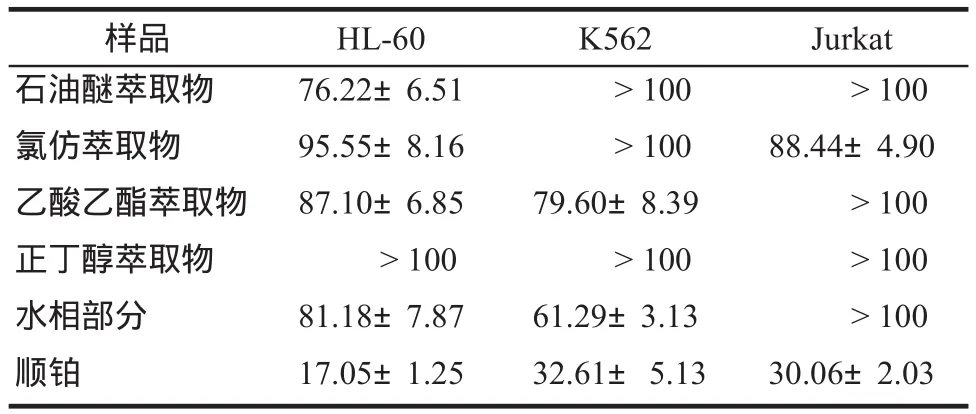
表1 異葉敗醬不同部位粗提物對白血病細胞的IC50. μg·mL-1, n = 5Tab 1 IC50of different extracts from Patrinia heterophylla Bunge. μg·mL-1, n = 5
3.1.2 單體化合物對白血病細胞的抑制作用 通過以上測試結果分析,以抗腫瘤藥物順鉑作為陽性對照,化合物2、3對HL-60、K562、Jurkat三株細胞均表現出了明顯的毒性抑制作用,尤其是化合物3對K562細胞株的抑制作用優于陽性藥物順鉑。其它化合物對三株白血病細胞表現出不同的抑制作用,其中化合物1對HL-60細胞具有一定的抑制作用。同時,化合物對白血病細胞的抑制作用具有時間和劑量依賴性。細胞受到的抑制作用以IC50表示,詳見表2。
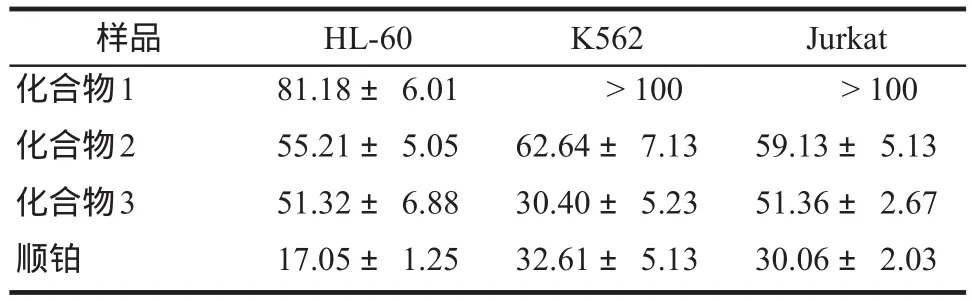
表2 異葉敗醬不同單體化合物對白血病細胞的IC50. μg·mL-1, n = 5Tab 2 IC50of different compounds from Patrinia heterophylla Bunge. μg·mL-1, n = 5
3.2 化合物3對K562細胞凋亡的影響
當不同濃度的化合物3作用于K562細胞48 h后,K562細胞出現不同程度的凋亡,早期凋亡率與化合物3濃度為0 μg·mL-1(對照組)相比具有顯著性差異(P < 0.01),詳見表3。
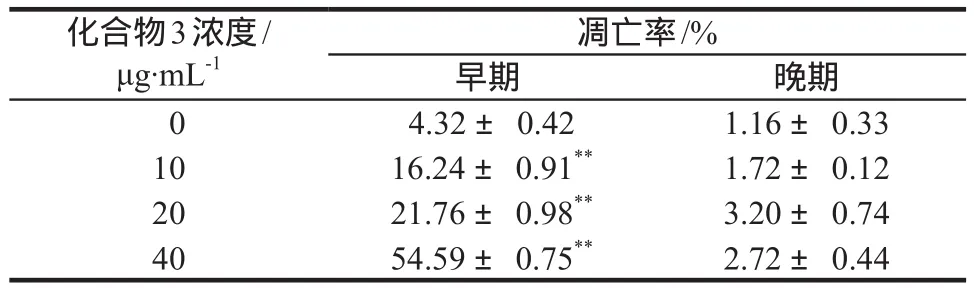
表3 K562細胞在化合物3作用下的凋亡情況Tab 3 Apoptosis of K562 cells in the action of compound 3
3.3 化合物3對K562細胞周期的影響
加藥培養48 h后,K562細胞在不同濃度藥物作用下的G1期比例依次為42.34%、52.48%、59.48%、64.72%,細胞周期檢測結果顯示化合物3可將K562細胞的生長阻滯在G1期,與化合物3濃度為0 μg·mL-1(對照組)相比,差異具有顯著性(P < 0.01),同時S期所占比例相應降低。詳見表4。
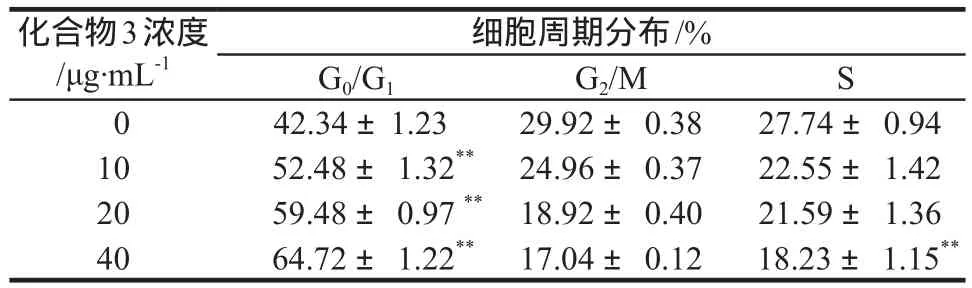
表4 不同濃度化合物3作用下K562的細胞周期. n = 3Tab 4 Cell cycle of K562 cells in the action of compound 3. n = 3
4 討論
現代實驗研究結果表明,有毒中藥可通過抑制腫瘤細胞生長,誘導腫瘤細胞凋亡,逆轉腫瘤細胞耐藥性等機制發揮抗白血病作用[5-6]。異葉敗醬作為墓頭回的藥源植物,在臨床治療白血病方面發揮了重要的作用。敗醬屬植物中含有環烯醚萜類成分,環烯醚萜是一類具有環戊烷結構的單萜小分子化合物,廣泛存在于龍膽科、木犀科、茜草科、玄參科等雙子葉植物中,有抗炎、抗腫瘤、抑制DNA合成的生物活性[7-8]。國內外均可見環烯醚萜類成分抗腫瘤作用的報道[9-11]。程衛東等[12]研究了墓頭回提取液對K562細胞增殖的影響,認為墓頭回對于K562細胞有顯著的抑制增殖作用,但此抑制作用是否因通過抑制酪氨酸激酶的活性產生,仍有待進一步的研究。楊波等[13]研究了墓頭回中環烯醚萜酯對于小鼠S180肉瘤、H22肝癌的體內抗腫瘤作用,認為環烯醚萜酯類成分能夠誘導腫瘤細胞凋亡和抑制腫瘤微血管,這很可能是該類成分在體內外發揮抗腫瘤作用的機制。
本實驗通過CCK-8法研究了異葉敗醬粗提物以及其中3個環烯醚萜類化合物對于白血病細胞的體外毒性抑制作用,并用流式細胞儀檢測了K562細胞在化合物3作用下的周期和凋亡變化。實驗結果表明,異葉敗醬不同部位粗提物對于腫瘤細胞的抑制作用是不同的。除正丁醇部位外,其余部位均對HL-60細胞有明顯的抑制作用;乙酸乙酯部位和水部位對K562細胞毒性作用明顯;只有氯仿部位對Jurkat細胞有較好的毒性抑制作用,其余各部位對其效果并不顯著。而對于不同細胞來說,各個部位對于細胞抑制率的平均值也是不相同的,HL-60細胞對異葉敗醬不同部位粗提物的作用比較敏感,受到的抑制作用最為明顯,K562次之,Jurkat細胞所受的抑制作用最弱。細胞所受毒性作用與藥物作用濃度表現出明顯的劑量相關性。
單體化合物對于K562、HL60兩株細胞的抑制作用更為顯著,而對于Jurkat細胞的抑制作用并不理想。其中化合物3對K562的抑制作用優于陽性藥順鉑。進一步研究表明,化合物3作用后,K562細胞早期凋亡和晚期凋亡比率都明顯上升,細胞增殖的進程在G1期受到阻滯,體外增殖率降低。實驗證明,一些化合物以及尚未進行分離純化的部位具有很好的選擇性腫瘤細胞毒活性,本實驗對于植物資源抗腫瘤中藥的研發具有一定的參考價值。但是中藥成分復雜,其藥效作用的發揮具有多靶點、多向調節的特點,異葉敗醬化學成分抗腫瘤作用的確切機制仍需進一步研究。
[1] 肖志堅,郝玉書.白血病的診斷與分型現況[J].中華內科雜志,2001,40(4):275-278.
[2] 楊小娜,郭建美,姚海英,等.中醫藥治療白血病的研究進展[J].現代中西醫結合雜志,2016,25(10):1134-1137.
[3] 劉云召,石晉麗.墓頭回的本草考證[J].中醫藥學報,2011,39(2):120-122.
[4] 張覃沐.國內治療白血病藥物研究概況[J].新醫學,1978,9(2):81-85.
[5] 賴蕓,陳子珺.有毒中藥抗白血病的作用及機制研究進展[J].中成藥,2016,38(4):875-879.
[6] 梁宇光,蘇佳,董瑞華,等.苞葉香茶菜庚素誘導人白血病細胞系HL-60凋亡的分子機制研究[J].中國藥物應用與監測,2010,7(1):12-16.
[7] 周長波.環烯醚萜類化學成分的藥理研究綜述[J].世界最新醫學信息文摘,2016,16(64):38.
[8] 賈詡.獨一味環烯醚萜苷對大鼠炎癥性腸病的治療作用及其機制研究[D].重慶:重慶醫科大學,2015.
[9] Abdullah FO, Hussain FH, Clericuzio M, et al. A new iridoid dimer and other constituents from the traditional kurdish plant Pterocephalus nestorianus Nábělek.[J]. Chem Biodivers, 2017, 14(3): e1600281-e1600288.
[10] 林玉.蜘蛛香環烯醚萜類抗肝癌作用及其機制初步研究[D].成都:西南交通大學,2015.
[11] 張寧寧,丁廣治.蜘蛛香中的環烯醚萜類成分及其生物活性研究進展[J].中國中藥雜志,2015,40(10):1893-1897.
[12] 程衛東,李立.墓頭回提取物誘導K562細胞凋亡的實驗研究[J].北京中醫藥大學學報,2007,30(1):51-53.
[13] 楊波,王一奇,程汝濱,等.墓頭回環烯醚萜酯提取部位抗腫瘤作用及機制研究[J].中草藥,2013,44(20):2884-2888.
Study on the inhibitory effect of extracts from Patrinia heterophylla Bunge on leukemic cells in vitro
LIU Li1,2, MU Li-hua2, LIU Ping2
(1. Shanxi University of Chinese Traditional Medicine, Taiyuan 030024, China; 2. Department of Clinical Pharmacology, PLA General Hospital, Beijing 100853, China)
Objective: To study the inhibitory effect of extract from Patrinia heterophylla Bunge on the proliferation of leukemic cells in vitro. Methods: Isolated compounds were obtained from the whole plant Patrinia heterophylla Bunge through the means of chromatographic separation. The leukemic cells HL-60, K562 and Jurkat were cultured with different concentrations of extract from Patrinia extracts and compounds. CCK-8 assay was used to detect the inhibition of those extracts and compounds on human leukemic cell HL-60, K562 and Jurkat. And the effect of compound 3 on K562 cell cycle and apoptosis were detected by flow cytometry. Results: Both extracts and monomeric compounds had a certain dosedependent inhibitory effect on the proliferation of leukemic cells. Different concentration of compound 3 could induce different degree of apoptosis of K562 cells. The early apoptosis rate was signif i cantly higher than that of the control group (P < 0.01). The percentage of cells in G0/G1phase increased from 42.34% to 59.48% and 64.72%, which was signif i cantly different from that of the control group (P < 0.01). Conclusion: The Patrinia heterophylla Bunge has obvious inhibitory effect on the proliferation of leukemic cells in vitro. Compound 3 can induce the apoptosis of K562 cells and block the cell cycle in G0/G1phase. The basis of antitumor pharmacological effects is likely to be related to the iridoid components.
Patrinia heterophylla Bunge; Leukaemia; Cell apoptosis; Iridoid
R96
A
1672 – 8157(2017)03 – 0150 – 04
2017-01-15
2017-03-17)
國家自然科學基金資助項目(31000153)
劉屏,女,研究員,研究方向:中藥化學與中藥藥理。E-mail:liuping301@126.com
劉俐,女,在讀碩士研究生,研究方向:中藥活性成分篩選。E-mail:zliuli0227@126.com

