eNOS解偶聯對大腦中動脈栓塞后大鼠神經血管單元的作用及機制
曾 靜, 李丹丹, 趙弘軼, 黃勇華, 張微微, 遲麗屹
eNOS解偶聯對大腦中動脈栓塞后大鼠神經血管單元的作用及機制
曾 靜1, 李丹丹2, 趙弘軼2, 黃勇華2, 張微微2, 遲麗屹3
目的 探討大鼠大腦中動脈栓塞模型中,內皮型一氧化氮合酶(eNOS)解偶聯對神經血管單元的作用及機制。方法 將80只雄性SD大鼠隨機分為假手術組(n=40)和大腦中動脈栓塞(MCAO)組(n=40)。參照Longa法制作MCAO模型。栓塞后6 h,通過蛋白印記法檢測缺血區eNOS不同偶聯狀態的表達情況及3-硝基酪氨酸(3-NT)的水平;通過尼氏染色比較缺血區神經元的形態及存活情況;通過免疫組織化學染色比較缺血區星形膠質細胞、微血管內皮細胞以及血腦屏障緊密連接對應的標記物GFAP、VWF、Occludin的表達水平;通過MRI的T2加權序列和動脈自旋標記(ASL)反應栓塞后腦組織病灶范圍及血流情況。結果 MCAO后栓塞部位在T2序列上呈高信號,在ASL序列上血流信號減低。eNOS二聚體/單體的比例明顯低于假手術組(P<0.05);3-NT的含量明顯高于假手術組(P<0.05)。尼氏染色顯示MCAO后神經元大量空泡形成,核固縮變性,數量顯著減少;免疫組化結果顯示,VWF、Occludin的表達較假手術組明顯減少,而GFAP則明顯增多(P<0.05)。結論 MCAO會導致eNOS解偶聯。eNOS解偶聯后NO合成受限,而具有毒性作用的3-NT產生增多,炎癥反應加重,從而對神經血管單元結構及功能產生破壞作用。
神經血管單元; 內皮型一氧化氮合酶; 3-硝基酪氨酸; 動脈自旋標記
腦卒中是全球范圍內第二大致死性疾病[1],在卒中發病的類型中,87%為缺血性卒中[2]。近30年來,針對缺血性卒中發生后腦細胞不可逆損傷的機制出現了大量的研究,重點探討了導致神經元死亡的原因以及使神經元抵御死亡的策略。總結過往腦卒中治療的得失,孤立地討論卒中發病過程中神經元細胞病理生理變化,局限地研究某種治療方案對神經元細胞的保護所用效果,所得的結果往往與臨床所見大相徑庭[3]。近來的研究著眼于通過血管和細胞機制來減輕組織損傷,研究血管系統與大腦細胞之間如何相互通訊。基于對血管和神經系統的功能的重新認識,形成了神經血管單元(neuro vascular unit,NVU) 的概念[4]。NVU的結構基礎是神經元、血腦屏障( blood brain barrier,BBB,包括內皮細胞、基底膜、星形膠質細胞的足突和周細胞)、小膠質細胞以及維持腦組織完整性的細胞外基質。
無論在分子、細胞水平,還是在整體動物模型上看,卒中發病后,不僅僅存在相應核心腦區供血中斷而引起的缺血缺氧以及能量代謝障礙,缺血半暗帶內神經元的隨之觸發的包括氧化應激、興奮性毒性、炎癥反應等各種病理生理改變也是卒中發病的重要機制和治療靶點[5]。其中一氧化氮合酶(nitric oxide synthase,NOS)-一氧化氮(NOS-NO)系統與卒中及其他神經退行性疾病關系密切,尤其是在缺血再灌注過程區域尤為明顯[6,7],是目前卒中致病機制研究的新熱點。NOS作為NO合成的限速酶,主要有3種異構體:內皮型一氧化氮和酶(eNOS)、神經性一氧化氮和酶(nNOS)、誘導型一氧化氮合酶(iNOS)。NOS-NO已被證實在中樞神經系統生理病理條件下發揮著重要作用,如缺血性腦卒中,NO可能由于細胞來源和缺血過程階段的不同而發揮的作用不同[8]。研究顯示,eNOS在維持腦血流量、防治神經元損傷以及血小板和白細胞的聚集和粘附,從而防止卒中的作用尤其突出[9~11]。在缺血后2~72 h,eNOS的表達顯著增加[12]。也有相關報道稱eNOS有單體和二聚體兩種偶聯狀態,二聚體可以減少局灶性腦缺血后NO以及超氧化物歧化酶的產生,而單體則可以增加缺血區超氧化物產生,從而加重腦損傷[13]。
1 材料和方法
1.1 實驗動物及材料 雄性清潔級SD大鼠,體重250±20g,購于軍事醫學科學院實驗動物中心,術前禁食24 h,自由飲水。Rabbit anti GAPDH antibody(GB11002,谷歌生物);eNOS(Ab-1177)antibody(21170,Signalway Antibody);Anti-nitrotytosine(N 0409,Sigma);vWF(H-300)(SC-14014,santa cruz,血管內皮細胞標記物);Occludin(H-279)(SC-5562,santa cruz,緊密連接標記物);Anti-GFAP antibody(ab7260,abcam,星形膠質細胞標記物); Goat anti-rabbit IgG-HRP(M21002,Abmart)。尼氏染色液(C0117,碧云天)。硅膠線栓(北京西濃科技有限公司)40根。SDS-PAGE凝膠配制試劑盒(P0012A,碧云天)。7.0T核磁(Bio Spec,首都醫科大學)。
1.2 方法
1.2.1 實驗分組及模型制作 將80只SD大鼠隨機分成兩組。MCAO組(40只):參照Longa等[14]制備大腦中動脈栓塞模型(middle cerebral artery occlusion,MCAO),10%水合氯醛400 mg/kg,腹腔注射麻醉,手術區域皮膚消毒,暴露頸總動脈(common carotid artery,CCA)、頸內動脈(ICA)以及頸外動脈(ECA),結扎CCA近心端及ECA,用血管鉗夾閉ICA,然后預留一根絲線(距離CCA分叉2 mm左右)打結不拉緊,然后在此絲線近心端將CCA剪一小口,將尼龍栓線從此口插入,進過CCA分叉進入ICA,插入深度以栓線頂端距離分叉(1.8±0.2)cm為宜,然后拉緊預留絲線固定線栓,剪斷多余栓線及絲線,縫合組織及皮膚。假手術組(40只):僅分離CCA、ICA、ECA,不結扎也不栓塞。
1.2.2 蛋白電泳 采用蛋白電泳(Western blot,WB)檢測梗死區域腦組織eNOS不同偶聯狀態及3-NT的表達。MCAO后6 h,每組各取10只處死,快速取腦,于缺血半暗帶周圍取等量腦組織,加入裂解液勻漿,至組織完全裂解,冰上孵育30 min,之后離心取上清液,按1∶4加入上樣緩沖液,煮沸10 min變性。然后進行SDS-聚丙烯酰胺凝膠電泳。于BIO-RAD顯影儀上顯影,結果采用Image J圖像軟件進行分析各條帶密度值。
1.2.3 免疫組化 采用免疫組織化學方法對星形膠質細胞、微血管內皮細胞及緊密連接的特異性標記物GFAP、VWF、Occludin進行染色。MCAO后6 h,每組取10只大鼠,水合氯醛腹腔注射麻醉,剪開腹腔、胸腔,充分暴露心臟,先后經心臟灌注500 ml生理鹽水及500 ml、4%多聚甲醛,完整取腦,依次用4%多聚甲醛、20%蔗糖、30%蔗糖固定腦組織。然后行冰凍切片(厚度為10 μm)。將切好的腦片在90 ℃抗原修復液中修復10 min,然后進行免疫組織化學染色,熒光顯微鏡拍照。
1.2.4 尼氏染色 采用尼氏染色法對神經元進行染色分析。制片過程同上。制作好的冰凍切片置于焦油紫中染色3 min,然后依次置入70%、80%、100%酒精中脫色各15 s,接著在二甲苯中透明15 s,用濾紙吸干,滴加樹脂膠封片。在光學顯微鏡下觀察。
1.2.5 MRI 采用7.0 T MRI評價栓塞效果及局部血流情況。術后6 h,進行核磁掃描,T2加權序列顯示栓塞的部位及范圍,動脈自旋標記(arterial spin-labeling,ASL)顯示栓塞部位血流。
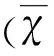
2 結 果
2.1 栓塞區域及血流 栓塞區域在T2序列上呈高信號,在ASL上血流信號減低甚至無血流(見圖1),表明MCAO造模成功。
2.2 eNOS單體、二聚體及3-NT的表達 MCAO組栓塞區域腦組織3-NT表達水平,明顯高于對照組,差距具有統計學意義(P<0.05);MCAO組與假手術組eNOS無明顯差異(P>0.05),表明eNOS在兩種情況下內皮細胞中的表達較恒定,eNOS二聚體/單體的比例在MCAO組明顯減少,差異具有統計學意義(P<0.05,見圖2)。
2.3 神經血管單元各組分的變化 尼氏染色結果顯示,MCAO組較假手術組神經元數量明顯減少,神經元皺縮變形(P<0.05,見圖3)。免疫組化染色,MCAO組,栓塞區GFAP陽性星形膠質細胞數明顯增多,表明炎癥反應加重;VWF陽性內皮細胞及Occludin陽性緊密連接明顯減少(P<0.05,見圖4)。

圖1 MCAO后6 h,假手術組和MCAO組MRI掃描。A、B為T2加權序列;C、D為ASL序列

圖2 MCAO后6 h,Western blot顯示MCAO組eNOS二聚體與單體的比值以及eNOS解偶聯時的催化產物3-NT與假手術組的差異

圖3 尼氏染色結果顯示MCAO后神經元大量空泡形成,核固縮變性,數量顯著減少

圖4 免疫熒光結果顯示,MCAO后6 h,GFAP陽性星形膠質細胞數量增多,VWF陽性內皮細胞及Occludin表達減少
3 討 論
2003年,美國學者Lo EH等[15]首次提出神經血管單元的概念,強調了內皮細胞、周細胞、星型膠質細胞、小膠質細胞、基膜、細胞外基質和神經元之間的動態相互作用,以及這種相互作用對卒中病理生理學的重要性,并將這一動態復合體稱為“NVU”[16]。薛強等[17]通過神經元、微血管內皮細胞以及星形膠質細胞體外共培養建立NVU模型,結果表明,該模型具有與在體相似的血腦屏障功能及在缺氧復氧損傷等的病理改變,NVU已經作為研究腦的病例生理、檢測新的藥物、尋找新的治療方法的焦點。大腦的正常生理功能依賴于中樞神經系統各組分之間相互協調,星形膠質細胞和神經元可以通過釋放多種物質如血管內皮生長因子、促紅細胞生成素、血管生成素等調節內皮細胞的遷移、增殖和再生[18]。
一氧化氮合酶與腦缺血缺氧損傷有著密切的聯系。腦卒中的病程中受多種因素的影響,而內源性NO產生增加對腦血管和神經元損傷發揮著重要作用[19]。很多研究證明NOS抑制劑(L-NAME)可以減少血腦屏障的破裂從而減輕腦急性缺血缺氧損傷[20]。但是,也有學者認為添加NO供體(L-精氨酸)可以通過擴張血管、增加局部腦血流來減輕缺血性腦損傷[21]。上述研究結果看似是矛盾的,實則是因為在不同的狀態下eNOS的結構不同,催化產物也大相徑庭。
內皮型一氧化氮合酶主要表達于內皮細胞,是正常生理條件下血管系統中NO的主要來源[22]。而在病理條件下,如高血壓[23]、糖尿病[24]、減壓病[25]等,eNOS出現功能障礙,二聚體解離為單體,則不能正常合成產生NO,而是產生大量的超氧陰離子,超氧陰離子再與NO結合生成ONOO-,進而產生細胞毒性作用。國內外對eNOS解偶聯進行了大量的研究。很多數據表明,心臟、腎臟以及其他器官在缺氧復氧損傷時,eNOS在這些器官處于解偶聯狀態。而eNOS解偶聯可以釋放毒性ROS、增加微血管的通透性、血栓形成,導致細胞水腫甚至凋亡[26],eNOS解偶聯還可以引起酪氨酸硝化,導致蛋白質功能減低或失活[27]。本文通過建立大腦中動脈栓塞模型,探究eNOS解偶聯對腦缺血缺氧損傷的作用及機制。
綜上,本研究結果顯示,大腦中動脈栓塞后,ASL顯示栓塞部位血流明顯減少,eNOS單體/二聚體的比例增加,而eNOS總量與對照組沒有明顯差異,表明eNOS發生解偶聯。尼氏染色結果顯示,栓塞區域神經元明顯減少。免疫組化結果提示MCAO后星形膠質細胞的標記分子GFAP增多,表明栓塞區域炎癥反應加重,內皮細胞及血腦屏障緊密連接的標記分子VWF及Occludin都減少,提示微血管內皮細胞及血腦屏障的結構受損。eNOS解偶聯(單體比例增加)作為一個非常重要的因素,通過減少栓塞部位血流、增加超氧化物產生、加重栓塞區域炎癥反應等機制,破壞神經血管單元的結構及功能,破壞血腦屏障的通透性。另外,eNOS解偶聯可能成為缺血性卒中一個新的治療靶點,干預該過程能否改善腦缺氧復氧損傷后神經血管單元的功能還有待于進一步研究。
[1]Arai K,Lok J,Guo S,et al.Cellular mechanisms of neurovascular damage and repair after stroke[J].Journal of Child Neurology,2011,26(9):1193-1198.
[2]Roger VL,Go AS,Lloyd-Jones DM,et al.Heart disease and stroke statistics-2011 update:a report from the American Heart Association.Circulation,2011,123:e18-e209.
[3]Liu Z,Chopp M.Astrocytes,therapeutic targets for neuroprotection and neurorestoration in ischemic stroke[J].Progress in Neurobiology,2015,144:103-120.
[4]del Zoppo GJ.The neurovascular unit in the setting of stroke[J].Intern Med,2010,267(2):156-171.
[5]Kitagawa K.CREB and cAMP response element-mediated gene expression in the ischemic brain[J].The FEBS,2007,274(13):3210-3217.
[6]Garry PS,Ezra M,Rowland MJ,et al.The role of the nitric oxide pathway in brain injury and its treatment-from bench to bedside[J].Experimental Neurology,2015,263:235-243.
[7]Lundberg JO,Weitzberg E,Gladwin MT.The nitrate-nitrite-nitric oxide pathway in physiology and therapeutics[J].Nature Reviews Drug Discovery,2008,7(2):156.
[8]Moro MA,Cardenas A,Hurtado O,et al.Role of nitric oxide after brain ischaemia[J].Cell Calcium,2004,36(3~4):265-275.
[9]Jiang MH,Kaku T,Hada J,et al.Different effects of eNOS and nNOS inhibition on transient forebrain ischemia[J].Brain Research,2002,946(1):139-147.
[10]Chen SH,Cheung RT.Neuropeptide Y and its receptor analogs differentially modulate the immunoreactivity for neuronal or endothelial nitric oxide synthase in the rat brain following focal ischemia with reperfusion[J].Journal of Biomedical Science Online,2005,12(2):267-278.
[11]Ayata C,Ma J,Meng W,et al.L-NA-sensitive rCBF augmentation during vibrissal stimulation in type Ⅲ nitric oxide synthase mutant mice[J].Journal of Cerebral Blood Flow & Metabolism Official Journal of the International Society of Cerebral Blood Flow & Metabolism,1996,16(4):539-541.
[12]Hua Q,Zhu X,Li P,et al.Refined qing kai ling,traditional Chinese medicinal preparation,reduces ischemic stroke-induced infarct size and neurological deficits and increases expression of endothelial nitric oxide synthase[J].Biological & Pharmaceutical Bulletin,2008,31(4):633-637.
[13]Yagita Y,Kitagawa K,Oyama N,et al.Functional deterioration of endothelial nitric oxide synthase after focal cerebral ischemia[J].Journal of Cerebral Blood Flow & Metabolism Official Journal of the International Society of Cerebral Blood Flow & Metabolism,2013,33(10):1532-1539.
[14]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[15]Lo EH,Dalkara T,Moskowitz MA.Mechanisms,Challenges and opportunities in stroke[J].Nat Rev Neurosci,2003,4(5):399-415.
[16]夏明武,秦 勇,劉祖欣.神經血管單元與腦缺血的研究進展[J].中國腦血管病雜志,2011,8(10):553-556.
[17]Qiang X,Yang L,Hongyi Q,et al.A novel brain neurovascular unit model with neurons,astrocytes and microvascular endothelial cells of rat[J].International Journal of Biological Sciences,2013,9(2):174.
[18]Haseloff RF,Blasig IE,Bauer HC,et al.In search of the astrocytic factor(s) modulating blood-brain barrier functions in brain capillary endothelial cells in vitro[J].Cellular and Molecular Neurobiology,2005,25:25-39.
[19]Mohammadi MT,Shidmoosavi SM,Dehghani GA.Contribution of nitric oxide synthase (NOS) in blood-brain barrier disruption during acute focal cerebral ischemia in normal rat[J].Pathophysiology,2012,19(1):13-20.
[20]Ding ZL,Marchand VCN,Plotkine M,et al.L-NAME reduces infarction,neurological deficit and blood-brain barrier disruption following cerebral ischemia in mice[J].European Journal of Pharmacology,2002,457(2-3):137.
[21]Dalkara T,Morikawa E,Panahian N,et al.Blood flow-dependent functional recovery in a rat model of focal cerebral ischemia.[J].Am J Physiol,1994,267(2):678-83.
[22]Bian K,Murad F.Nitric oxide (NO)-biogeneration,regulation,and relevance to human diseases[J].Frontiers in Bioscience,2003,8(1):264.
[23]Victorio JA,Clerici SP,Roberto P,et al.Spironolactone prevents endothelial nitric oxide synthase uncoupling and vascular dysfunction induced by β-adrenergic over stimulation:role of perivascular adipose tissue[J].Hypertension,2016,68(3):726-735.
[24]Youn JY,Zhou J,Cai H.Bone morphogenic protein 4 mediates NOX1-dependent eNOS uncoupling,endothelial dysfunction,and COX2 induction in type 2 diabetes mellitus[J].Molecular Endocrinology,2015,29(8):1123.
[25]林海珊,歐 敏,方以群.eNOS解偶聯對減壓病大鼠肺動脈內皮功能損傷的影響[J].解放軍醫學雜志,2015,40(6):502-506.
[26]Bauersachs J,Bouloumie A,Fraccarollo D,et al.Endothelial dysfunction in chronic myocardial infarction despite increased vascular endothelial nitric oxide synthase and soluble guanylate cyclase expression[J].Circulation,1999,100(3):292.
[27]Chen G L,Liu J,Bian K.Research progress on the relationship between protein specific oxidation and diseases[J].Chinese Pharmacological Bulletin,2009,25(5):561-565.
Effects and mechanism of eNOS uncoupling on the neurovascular unit in rats with middle cerebral artery occlusion
ZENGJing,LIDandan,ZHAOHongyi,etal.
(ShaanxiUniversityofChineseMedicine,Xianyang712046,China)
Objective To investigate the effect and mechanism of eNOS uncoupling on neurovascular unit in the rats model of middle cerebral artery occlusion.Method Eighty male SD rats were randomly distributed into two groups:sham operation and middle cerebral artery occlusion(MCAO).MCAO was made by Longa’s method.At 6 h after MCAO,the expression of uncoupling endothelial nitric oxide synthetase (eNOS) and 3-nitrotyrosine(3-NT) in the ischemic area were analysis by Western blotting.The survival of neurons in ischemic region was compared by Nissl staining.The expression of GFAP,VWF and occludin were represented astrocytes,endothelial cells and tight junction of blood brain barrier(BBB) were analyzed by immunohistochemistry.The range and blood flow of brain tissue were detected by MRI T2sequence and ASL sequence.Results After MCAO,the ischemic area showed low signal on T2sequence and the blood high signal decreased on ASL sequence.The ratio of eNOS dimer/monomer significantly decreased in MCAO group than in sham group and the expression of 3-NT significant increased in MCAO group.Immunohistochemistry showed that VWF and Occludin were decreased but GFAP increased.Conclusions MCAO may lead to uncoupling of eNOS dimers in the ischemic area.eNOS uncoupling restricted NO synthesis but increased the toxic effect of 3-NT,the inflammatory response is aggravated which can damage the structure and function of neurovascular unit.
Neurovascular unit; eNOS; 3-NT; ASL
1003-2754(2017)06-0500-04
2017-04-11;
2017-06-03
(1.陜西中醫藥大學,陜西 咸陽 712046;2.中國人民解放軍陸軍總醫院神經內科,北京 100700;3.中國人民解放軍第四五一醫院神經內科,陜西 西安 710054)
遲麗屹,E-mail:chi603@foxmail.com
R743.3
A

