黃芩苷膠囊治療醫院獲得性肺炎的臨床觀察
鄧嘉,王導新,梁愛玲,唐靜,向大開,何宗林
(1.重慶市江北區中醫院,重慶 400016;2.重慶醫科大學附屬第二醫院,重慶 400010)
黃芩苷膠囊治療醫院獲得性肺炎的臨床觀察
鄧嘉1,王導新2,梁愛玲1,唐靜1,向大開1,何宗林1
(1.重慶市江北區中醫院,重慶 400016;2.重慶醫科大學附屬第二醫院,重慶 400010)
目的:探討在常規抗感染基礎上聯合黃芩苷膠囊對醫院獲得性肺炎(HAP)的治療效果。方法:將60 例HAP患者按隨機數字法分為對照組和治療組。對照組先給予美洛西林舒巴坦抗感染治療,再根據臨床癥狀變化及培養結果選用敏感抗生素治療。治療組在對照治療基礎上加用黃芩苷膠囊治療,對比兩組患者炎性介質、細菌清除率及療效。結果:在第2天及第4天,黃芩苷治療組白介素-6(IL-6)及腫瘤壞死因子-α(TNF-α)水平均明顯低于對照組(P<0.05)。治療組共分離出細菌25株,清除22株,清除率為88.0%;對照組分離出細菌27株,清除21株,清除率為77.8%,治療組細菌清除率明顯高于對照組(P<0.05)。治療組總有效率為90.0%,對照組為83.3%,雖然治療組痊愈比例及總有效率有增加趨勢,但兩組間比較差異無統計學意義(P>0.05)。結論:黃芩苷膠囊聯合常規抗感染治療能夠減輕HAP早期炎癥反應,促進致病菌清除,對HAP有治療作用。
黃芩苷膠囊;醫院獲得性肺炎;炎性介質;臨床觀察
醫院獲得性肺炎(HAP)是醫院獲得性感染中最常見的種類,其發病率為所有住院患者的5‰~10‰,占所有重癥醫學科的醫院獲得性感染的25%,使用抗生素的HAP患者超過所有住院使用抗生素人數的50%以上[1]。目前致病耐藥菌的快速發展是目前臨床醫學面臨的重大挑戰之一。盡可能地減少抗生素尤其廣譜抗生素的使用時間,控制定植菌或耐藥菌的產生以及藥物毒副作用等附帶傷害是目前HAP治療的理念[2]。因此,我們在常規抗感染基礎上聯合黃芩苷膠囊治療HAP,觀察治療療效。報告如下。
1 資料與方法
1.1 一般資料
選取2015年7月—2016年4月住院期間發生HAP患者60 例,其中男38 例,女22 例;年齡62~89 歲;患者胸片提示單肺野或雙肺野斑片狀模糊影,其中單肺44 例(73.3%),雙肺16 例(26.7%);伴肺炎旁胸腔積液9 例(15%);基礎病為腦梗死18 例,骨折9 例,晚期惡性腫瘤8 例,心衰5 例,糖尿病6 例,高血壓14 例。將患者按隨機數字法分為對照組(常規治療組)和治療組(黃芩苷治療組),各30 例。兩組患者在性別、年齡、基礎疾病等方面比較差異均無統計學意義(P>0.05),有可比性。
1.2 診斷標準
根據中華醫學會呼吸病分會《醫院獲得性肺炎診斷和治療指南(草案)》[3]制訂的標準擬定。具體納入標準:第一,年齡:大于18周歲。第二,癥狀:發熱、咳嗽、痰量增加、痰液形狀改變、呼吸困難或呼吸急促,至少符合兩項以上。第三,體征及實驗室檢查:體溫升高、心率>120次/min、收縮壓<90 mm Hg(1 mm Hg=0.133 kPa)、肺部聽診聞及濕啰音、意識狀態改變、呼吸衰竭;血常規:白細胞(WBC)>10 000/μL或<4 000/μL;至少符合兩項以上。第四,胸部影像學檢查:新出現或進行性加重的肺內浸潤病灶、實變病灶,伴或不伴胸腔積液。第五,有血液標本及足夠的痰液標本送檢細菌培養(每兩天行相關標本細菌培養)。痰液標本留取方法:患者晨起漱口,深吸氣用力咳出第一口痰液,留于無菌容器中,及時送檢。血液標本留取方法:以肘靜脈為穿刺部位,每次采血8~10 mL,培養基與血液之比為10∶1。滿足所有以上1~5條為準。
1.3 排除標準
滿足以下之一者:入院時已存在下呼吸道感染,且入院后尚未治愈者;其他可能影響治療效果的肺部疾病(肺部原發腫瘤或轉移瘤、支氣管擴張癥、結節病、肺結核等);獲得性免疫缺陷綜合征患者;已接受>24 h抗生素治療(治療失敗或細菌培養結果提示病原菌對該抗生素耐藥除外)。
1.4 方法
1.4.1 治療方法
患者按隨機數字法分配入組。治療組在常規抗感染治療基礎上給予黃芩苷膠囊(江西普眾藥業有限公司,規格:每粒25 mg,國藥準字號H20052651),每次2粒,每日3次,口服。對照組給予常規抗感染治療。兩組抗常規感染治療方案均參見《醫院獲得性肺炎診斷和治療指南》,起始先給予美洛西林舒巴坦(海南通用三洋藥業有限公司,規格:每瓶3.75 g,國藥準字號H20030344)3.75 g,靜脈滴注,每8小時給藥一次,再根據臨床癥狀變化及培養結果選用敏感抗生素治療。兩組療程均為7~14 d。
1.4.2 觀察指標
觀察臨床癥狀(發熱天數、痰量變化情況等)、體征,記錄實驗室檢查結果(血常規、C-反應蛋白)、胸部影像學變化情況、痰液或血液培養結果。
1.4.3 腫瘤壞死因子-α、白介素-6水平測定
分別在患者入院后第1,2,4,7天早上8點抽取空腹血,離心獲取上清,按照酶聯免疫吸附測定法(ELISA)試劑盒說明書測定腫瘤壞死因子-α(TNF-α)、白介素-6(IL-6)水平。具體步驟如下:患者空腹采集血液標本,離心獲取血清,-80 ℃保存待檢測;將所用抗原用包被稀釋液稀釋到適當濃度,每孔抗原加入100 μL,置37 ℃ 4 h后棄去孔中液體;5%小牛血清置37 ℃封閉40 min;封閉結束后用洗滌液滿孔洗滌;將稀釋好的樣品加入酶標反應孔中,每孔100 μL,置于37 ℃ 40~60 min,然后洗滌;每孔加入酶標抗體100 μL,置于37 ℃ 45 min;用洗滌液洗滌3遍,每遍3 min;每孔加入底物液100 μL,置37 ℃避光放置3~5 min,加入終止液顯色;最后每孔加入終止液50 μL終止反應,于20 min內測定實驗結果。
1.5 療效評定標準
根據《抗菌藥物臨床研究指導原則》相關標準制訂。痊愈:癥狀、體征、實驗室檢查及病原學檢查均為陰性。顯效:癥狀、體征、實驗室檢查有1項未完全恢復,病原學檢查為陰性。無效:用藥72 h病情無好轉或加重。
1.6 統計學方法
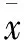
2 結 果
2.1 炎性介質的水平變化比較
兩組IL-6及TNF-α水平均隨治療時間逐漸下降。在入院第1天治療組IL-6及TNF-α水平與對照組比較差異無統計學意義(P>0.05);在第2天治療組IL-6水平較對照組下降約44.8%,TNF-α水平下降約26.9%,兩組間差異有統計學意義(P<0.05);在第4天治療組IL-6水平較對照組下降約15.6%,TNF-α水平下降約16.9%,兩組間差異有統計學意義(P<0.05);到第7天后兩組IL-6及TNF-α水平均明顯下降,但兩組間比較差異無統計學意義(P>0.05)(見表1)。
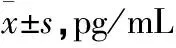
表1 兩組炎性介質水平的比較
2.2 細菌清除率比較
用藥前兩組細菌株數及種類無明顯差異(P>0.05)。治療組共分離出細菌25株,清除22株,清除率為88.0%;對照組分離出細菌27株,清除21株,清除率為77.8%。治療組細菌清除率明顯高于對照組,差異有統計學意義(P<0.05)(見表2)。
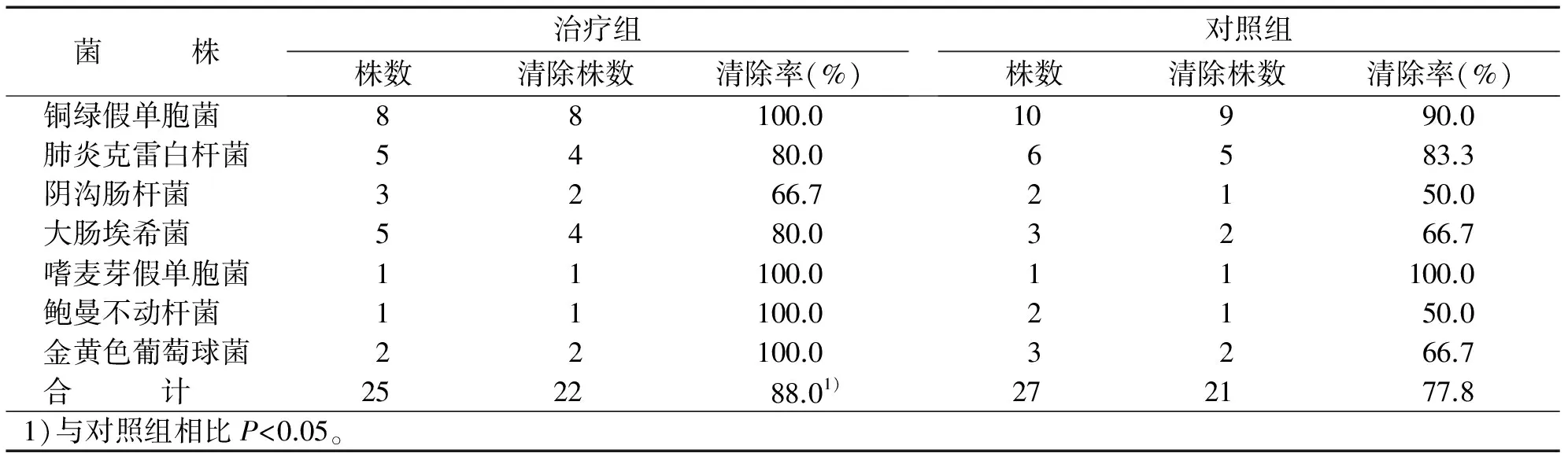
表2 兩組細菌清除率比較
2.3 療效比較
治療組總有效率為90.0%,對照組為83.3%,雖然治療組痊愈比例及總有效率有增加趨勢,但兩組間比較差異無統計學意義(P>0.05)(見表3)。
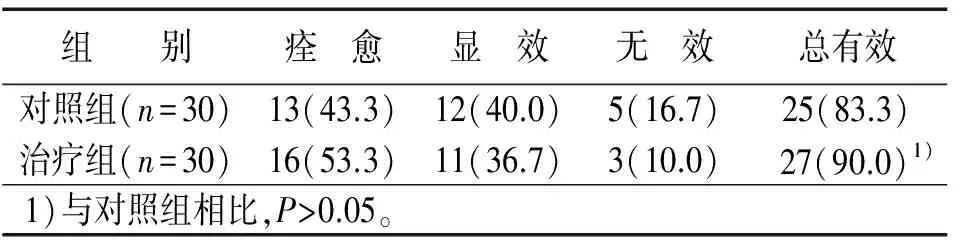
表3 兩組治療后療效比較 例(%)
2.4 不良反應
兩組間均未觀察到研究藥物相關不良反應。
3 討 論
在HAP感染病原菌中以細菌感染為最常見病原菌,占所有院內感染病原菌的90%以上。2005年美國胸科學會(ATS)在指南中將HAP根據起病時間分成早發和晚發兩組,認為晚發組常見多藥耐藥細菌,相對預后差,而早發組則相反[4]。但是根據我國2012年所作的國內HAP多中心流行病學調查結果顯示,無論早發還是晚發HAP,其致病細菌的分布并沒有顯著差別[5]。而近期來自亞洲及歐洲的一些流行病學調查結果也與我國的調查結果相似,提示早發和晚發HAP的病原菌均以多藥耐藥菌為主[6]。致病耐藥菌的快速發展是目前臨床醫學面臨的重大挑戰之一。根據歐美的連續監測結果看,除金葡菌有比較穩定的抗生素敏感性外,前述四種革蘭陰性菌在5年內對臨床常用的廣譜抗生素的敏感性評價下降了5%~10%[7]。而來自我國的HAP致病菌監測結果顯示,實際情況可能更嚴峻,銅綠假單胞菌及鮑曼不動桿菌對碳氫酶烯類的耐藥率均超過了70%,而金葡菌對苯唑西林的耐藥率超過了87%[5]。因此,HAP抗生素治療面臨巨大的壓力和挑戰。目前多藥耐藥菌的抗感染治療策略已由以前的“get it right the first time and hit hard up front”向“start smart,then focus”轉變[8]。后者的核心觀念是:避免不必要的抗生素使用,盡可能地減少抗生素尤其廣譜抗生素的使用時間,從而減少定植菌或耐藥菌產生以及藥物毒副作用等附帶傷害[2]。所以通過不同作用機制藥物的聯合作用,能夠減少抗生素的使用時間,改善HAP的治療預后。黃芩味苦、性寒,有清熱燥濕、瀉火解毒等功效,主要用于上呼吸道感染、肺熱咳嗽、肺炎、濕熱黃膽及痢疾等癥狀,臨床觀察發現黃芩的抗菌性強。在混合感染誘導的膿毒血癥豚鼠模型中,黃芩苷能夠顯著抑制TNF-α,IL-6,IL-10等炎性介質生成,同時抑制淋巴細胞凋亡,調節免疫[9]。探討黃芩苷調節炎癥的具體機制包括:第一,下調核因子KB激酶-α/β的磷酸化水平,抑制NF-kB活化[10];第二,抑制TLR-4 mRNA及蛋白表達水平[11];第三,高遷移率族蛋白B1(HMGB1)是內毒素致死效應的晚期重要炎癥介質,在膿毒癥小鼠體內試驗中,黃芩苷能夠改善小鼠生存率,同時抑制HMGB1水平,從而減少炎性介質釋放[12]。除此之外,在抗真菌及抗病毒方面,黃芩苷通過抑制琥珀酸脫氫酶和Ca2+-Mg2+ATP酶活性,上調胞內Ca2+濃度,破壞白色念珠菌的超微結構,從而促進白色念珠菌凋亡[13];還能抑制神經氨酸酶活性,影響流感病毒A(H1N1/H3N2)出芽繁殖,起到抗病毒作用[14]。但目前的國內外相關研究均限于細胞和動物實驗階段,到底黃芩苷在HAP臨床治療效果如何不清楚。在本研究中,在常規抗感染基礎上,黃芩苷膠囊能夠明顯降低HAP早期炎性介質水平,減輕炎癥反應,與前述相關研究結果一致,提示黃芩苷膠囊能夠調控HAP炎癥反應,有利于疾病恢復。HAP的常見致病菌:革蘭陰性菌以鮑曼不動桿菌、銅綠假單胞菌、肺炎克雷白桿菌及腸桿菌為主;革蘭陽性菌以金黃色葡萄球菌感染所占比例最高。本研究中HAP痰液或血液中培養出的細菌譜與之基本一致。黃芩苷在治療金黃色葡萄球菌、銅綠假單胞菌及肺炎克雷伯菌等耐藥菌方面有其特殊的作用。細胞及動物實驗表明,黃芩苷能顯著抑制青霉素結合蛋白2a(PBP2a)產生,從而抑制mecA基因表達,增加耐藥菌與β-內酰胺類抗生素的親和力[15];能夠抑制細菌生物膜的形成,并通過抑制細菌的群體感應調節系統,增加生物膜對抗生素的敏感性[16];同時,能夠降低細胞內活性氧簇的生成,抑制細菌DNA修復的SOS應答,從而減少多聚酶表達突變,抑制細菌對抗生素的耐藥性[17]。黃芩苷膠囊聯合常規抗感染治療明顯增加了致病菌清除率,但未發現特殊不良反應,提示黃芩苷膠囊在HAP治療中是有效且安全的。然而,在治療有效率方面,治療組與對照組相比雖然有升高的趨勢,但差異無統計學意義。可能的原因包括:第一,研究樣本較小,可能出現統計結果偏移,因此以后可考慮多中心大樣本的臨床研究;第二,本研究的黃芩苷膠囊使用劑量參考了其說明書中輔助治療急慢性肝炎的劑量,但在HAP治療中劑量到底如何尚未可知,且不同劑量的黃芩苷口服吸收度、血藥濃度及不同組織器官分布等問題也有待以后進一步探討。
總之,黃芩苷膠囊聯合常規抗感染治療能夠減輕HAP早期炎癥反應,促進致病菌清除,且無明顯不良反應,對HAP有治療作用。
[1]MASTERTON R G,GALLOWAY A,FRENCH G,et al.Guidelines for the management of hospital-acquired pneumonia in the UK:report of the working party on hospital-acquired pneumonia of the british society for antimicrobial chemotherapy[J].J Antimicrob Chemother,2008,62(1):5-34.
[2]DRYDEN M,JOHNSON A P,ASHIRU-OREDOPE D,et al.Using antibiotics responsibly:right drug,right time,right dose,right duration[J].J Antimicrob Chemother,2011,66(11):2 441-2 443.
[3]中華醫學會呼吸病學分會.醫院獲得性肺炎診斷和治療指南(草案) [J].中華結核和呼吸雜志,1999,22(4):201-203.
[4]American Thoracic Society,Infectious Diseases Society of America.Guidelines for the management of adults with hospital-acquired,ventilator-associated,and healthcare-associated pneumonia[J].Am J Respir Crit Care Med,2005,171(4):388-416.
[5]中華醫學會呼吸病學分會感染學組.中國九城市成人醫院獲得性肺炎微生物學與臨床特點調查[J].中華結核和呼吸雜志,2012,35(10):739-746.
[6]CHUNG D R,SONG J H,KIM S H,et al.High prevalence of multidrug-resistant nonfermenters in hospital-acquired pneumonia in Asia[J].Am J Respir Crit Care Med,2011,184(12):1 409-1 417.
[7]JONES R N.Microbial etiologies of hospital-acquired bacterial pneumonia and ventilator-associated bacterial pneumonia[J].Clin Infect Dis,2010,51 (Suppl 1):81-87.
[8]LEE B,BOUCHER H W.Targeting antimicrobial-resistant bacterial respiratory tract pathogens:it is time to get 'smart'[J].Curr Opin Pulm Med,2015,21(3):293-303.
[9]ZHU J,WANG J,SHENG Y,et al.Baicalin improves survival in a murine model of polymicrobial sepsis via suppressing inflammatory response and lymphocyte apoptosis[J].PLoS One,2012,7(5):35 523-35 528.
[10]DONG S J,ZHONG Y Q,LU W T,et al.Baicalin inhibits lipopolysaccharide-induced inflammation through signaling NF-kB pathway in HBE16 airway epithelial cells[J].Inflammation,2015,38(4):1 493-1 501.
[11]YE L,TAO Y,WANG Y,et al.The effects of baicalin on the TLR2/4 signaling pathway in the peripheral blood mononuclear cells of a lipopolysaccharide-induced rat fever model[J].Int Immunopharmacol,2015,25(1):106-111.
[12]WANG H,LIU D.Baicalin inhibits high-mobility group box 1 release and improves survival in experimental sepsis[J].Shock,2014,41(4):324-330.
[13]YANG S,FU Y,WU X,et al.Baicalin prevents candida albicans infections via increasing its apoptosis rate[J].Biochem Biophys Res Commun,2014,451(1):36-41.
[14]DING Y,DOU J,TENG Z,et al.Antiviral activity of baicalin against influenza A (H1N1/H3N2) virus in cell culture and in mice and its inhibition of neuraminidase[J].Arch Virol,2014,159(12):3 269-3 278.
[15]QIU J,NIU X,DONG J,et al.Baicalin protects mice from staphylococcus aureus pneumonia via inhibition of the cytolytic activity of α-hemolysin[J].J Infect Dis,2012,206(2):292-301.
[16]BRACKMAN G,COS P,MAES L,et al.Quorum sensing inhibitors increase the susceptibility of bacterial biofilms to antibiotics in vitro and in vivo[J].Antimicrob Agents Chemother,2011,55(6):2 655-2 661.
[17]PENG Q,ZHOU S,YAO F,et al.Baicalein suppresses the SOS response system of staphylococcus aureus induced by ciprofloxacin[J].Cell Physiol Biochem,2011,28(5):1 045-1 050.
Treatment effect of baicalin capsule in patients with hospital-acquired pneumonia
DENG Jia1,WANG Daoxin2,LIANG Ailing1,TANG Jing1,XIANG Dakai1,HE Zonglin1
(1.Chongqing Jiangbei Hospital of Traditional Chinese Medicine,Chongqing 400016;2.The Second Affiliated Hospital of Chongqing Medical University,Chongqing 400010,China)
Objective:To research the treatment effect of baicalin capsule in patients with hospital-acquired pneumonia (HAP).Methods:Sixty patients with HAP were randomly divided into two groups including normal control group and baicalin capsule treatment group.Normal control group firstly
mezlocillin sodium and sulbactam sodium for injection,then sensitive antibiotic substitued according to the results of bacterial cultures and the changes of clinical manifestations.Treatment group received baicalin capsules on the basis of the same treatment in normal control group.Tumor necrosis factor-α (TNF-α),interleukin (IL-6),bacterial eradication rate and curative effect were compared between two groups.Results:TNF-α and IL-6 level in baicalin capsule treatment group were significantly lower than these normal control group on day 2 and day 4 (P<0.05).Bacterial eradication rate in baicalin capsule treatment group (22/25,88%) was significantly incresed (P<0.05) when compared to normal control group (21/27,77.8%).Curative effect in baicalin capsule treatment group (90.0%) showed ascendant trend,whereas no significant difference was observed (P>0.05) compared to normal control group (83.3%).Conclusion:Baicalin capsule alleviates imflammation response on the early stage of HAP and increases bacterial eradication.This study provides insight into which patients with HAP might benefit from adjunctive baicalin capsule.
baicalin capsule;hospital-acquired pneumonia;inflammatory mediator;clinical observation
1671-8631(2017)06-0423-05
R563.8
A
2016-11-08
(本文編輯:王作利)
鄧嘉(1981— ),男,四川省富順縣人,博士學位,副主任醫師,主要從事呼吸危重癥的基礎和臨床方面的研究工作。

