不同氮處理下水稻劍葉葉寬的全基因組關聯分析
高易宏,燕金香,涂政軍,冷語佳,陳龍,黃李超,代麗萍,張光恒,朱麗,胡江,任德勇,郭龍彪,錢前,王丹英,曾大力
?
不同氮處理下水稻劍葉葉寬的全基因組關聯分析
高易宏,燕金香,涂政軍,冷語佳,陳龍,黃李超,代麗萍,張光恒,朱麗,胡江,任德勇,郭龍彪,錢前,王丹英,曾大力
(中國水稻研究所/水稻生物學國家重點實驗室,杭州 310006)
【目的】探索水稻劍葉葉寬調控及其對氮肥響應的遺傳機理,為氮高效水稻新品種的培育提供新的種質資源和基因標記。【方法】以134份水稻地方種質資源為關聯分析材料,通過基因組重測序發掘獲得了3 356 591個分布于全基因組的高密度SNP位點(single nucleotide polymorphism,SNP)。在大田栽培條件下,以施氮量為主區,品種為裂區的設計,設計低氮(不施氮肥,N0)、正常氮(純氮96 kg·hm-2,N1)和高氮(純氮192 kg·hm-2,N2)3種氮肥處理。于水稻成熟期分別調查水稻劍葉葉寬在低、中、高3種氮肥處理下的表現及響應,結合EMMAX軟件計算群體親緣關系矩陣和EIGENSOFT軟件分析群體結構,采用納入親緣關系矩陣及群體結構的混合線性模型開展全基因組關聯分析。【結果】水稻劍葉葉寬在N0、N1、N2 3種氮肥處理下均呈正態分布,并表現豐富的變異。劍葉葉寬受品種差異及氮水平的影響,且與施氮水平呈顯著正相關。在N0、N1、N2氮處理下共檢測到14個與劍葉葉寬顯著相關的SNP位點。其中,低氮處理下檢測到的SNP位點的最小等位基因頻率均大于0.46,表明此類SNP在關聯群體中廣泛存在;中氮和高氮水平下檢測到的SNP位點的最小等位基因頻率均較小,是一類較為稀有的SNP位點。位于第12染色體上的一個SNP(chr12:15 066 507)位點在正常氮及高氮處理下均被檢測到,在高氮處理下還檢測到的另一顯著性位點,其候選區間內包含一候選基因,該基因與業已報道的葉寬性狀相關基因同屬于細胞色素P450家族。根據不同氮處理下劍葉葉寬的響應,鑒定出20與低氮響應有關的SNP位點,8個位點與高氮響應有關。其中與高氮響應的顯著性位點中,位于第1染色體顯著性峰候選區間包含業已克隆的與氮素利用相關的基因。【結論】通過全基因組關聯分析共檢測到42個與劍葉葉寬及其在不同氮處理下葉寬響應相關的顯著性關聯位點。
水稻;全基因組關聯分析;葉寬;氮肥
0 引言
【研究意義】氮是植物生長發育中至關重要的營養元素,合理的氮肥施用將顯著的增加作物產量[1],氮營養供應不充足則會導致作物減產,而過量施用氮肥會導致環境污染等問題。因而氮素的高效利用是當前水稻育種關注的重要問題,通過選育氮高效吸收利用的水稻品種,從而減少田間氮肥施用以提高水稻產量已成為水稻育種的重要目標之一[2]。【前人研究進展】水稻的氮素利用效率(nitrogen use efficiency,NUE)受品種、氮肥用量、氮肥施用方法和土壤含氮量等因素的影響。近年來,通過對水稻氮響應相關突變體的研究和QTL定位等方式克隆與鑒定了多個與NUE相關的基因及位點。Zhang等[3]鑒定了一個位于第12染色體上有關氮耐受性的QTL位點,并克隆了。Hu等[4]通過在高世代回交群體分離鑒定了一個硝酸鹽轉運基因,該基因通過增強硝酸鹽的攝取、根向莖轉運和氮響應基因的表達從而提高氮素利用率。Sun等[5]通過分析RIL群體在不同氮濃度下株高和分蘗數的變化鑒定了一個水稻主效的NUE數量性狀位點,實為已報道的直立密穗基因,攜帶的植株表現出對氮吸收和同化的增強,從而增加水稻產量。在長期的進化過程中,植物形成了適應不同生存環境的生理機制和分子機理來響應環境的變化。在應對缺氮環境時,植物提高NUE的主要方式是通過提高氮的吸收、轉運、同化和再活化等方式,且與環境之間存在復雜的互作及遺傳網絡關系[6-9]。Tong等[10]通過在2種氮處理條件下的株高、穗數、葉綠素含量、干重、濕重和產量變化等指標鑒定了31個氮響應相關的QTL位點。Cho等[11]在兩種氮濃度下,通過水稻發育后期籽粒中氮含量、秸稈中氮含量、收獲指數等多個指標鑒定了多個氮響應相關的QTL位點。同樣,在不同的氮水平下水稻葉片呈現明顯的葉形變化,而水稻葉片的長、寬和厚的改變也直接影響水稻的光合作用[12]。殷春淵等[13]研究表明,氮肥處理對水稻葉片的影響主要表現在倒二葉葉長和劍葉葉寬2個特性上。因此,葉片形態結構的變化也是水稻對不同水平氮響應的指標。近年來,全基因組關聯分析(genome-wide association study,GWAS)成功的應用在一些模式生物研究和農作物的育種當中[14~18]。【本研究切入點】在水稻中,利用GWAS分析了包括產量、品質、抽穗期、株形等多種重要的農藝性狀,同樣也對病蟲害抗性等生物脅迫和鹽堿耐受性等非生物脅迫性狀進行了全基因組關聯分析,并鑒定了許多重要的SNP位點[14,16-17,19-22]。但是,與氮素利用相關的GWAS研究尚未見報道。【擬解決的關鍵問題】本研究通過選取134份來自不同地區的水稻品種作為關聯分析的群體,利用在不同氮肥條件下葉寬的變化,開展水稻葉寬及氮響應相關SNP位點分析,旨在為進一步揭示水稻葉片形態調控和氮素高效利用的生理機制提供基礎。
1 材料與方法
1.1 試驗材料
選擇保存于中國水稻所(CNRRI),國際水稻所(IRRI)種質資源庫及來自多個國家和地區的134個地方品種,其中包括41份來自國內各省農科院的地方品種;36份來自20個國家的地方品種;57份國內大面積推廣種植品種。
1.2 試驗設置及性狀考察
試驗于2015年在中國水稻研究所實驗基地(浙江,富陽)進行,試驗田土壤為水稻土(土壤含有機質36.9 g·kg-1、全氮2.73 g·kg-1、速效鉀104 mg·kg-1、速效磷52 mg·kg-1、堿解氮156 mg·kg-1,pH 6.24)。試驗設3個氮肥水平:低氮(N0,不另施氮肥)、正常氮(N1,純氮96 kg·hm-2)和高氮(N2,純氮192 kg·hm-2),以施氮量為主區,品種為裂區,3次重復。主區面積5.0 m×23.0 m,播種前將其做成3條畦寬1.5 m,溝寬25 cm,長23 m的畦。水稻種于畦上,每品種種植4行,每行6株,株行距為20 cm×20 cm。不同氮處理間作埂隔離,并用塑料薄膜覆蓋埂體,保證單獨排灌。
試驗用關聯群體于2015年5月10日采用點直播栽培,每穴播3—5粒種子,2葉1心時定苗2株/穴。以尿素為氮肥,按基肥﹕分蘗肥﹕穗肥 = 5﹕3﹕2分3次施入,其中基肥(播種前1 d)與分蘗肥(播種后25 d)統一施用,穗肥由于品種間生育期的差異,于孕穗始期分品種單獨施用。6月中旬至9月中旬每隔3d檢查品種的生育期,標記孕穗始期相近的品種,將穗肥小心撒于每個標記品種葉片上。為防止水分流動導致的串肥,穗肥施用期間(6月中旬至9月中旬)保持畦面濕潤但無水層,僅溝中有水。磷、鉀施用量為P2O575 kg·hm-2、K2O 150 kg·hm-2,其中磷肥為底肥一次施入,鈣、鎂、鉀肥按基、蘗肥各50%分2次施入。其他栽培管理措施同一般大田。
在抽穗后10 d對劍葉葉寬進行調查,每品種選取中間的6株無邊際效應的植株進行考察。參考王蘭等[23]方法量取每片葉的最寬處為葉寬,每株取主莖分別記錄劍葉的葉寬。
1.3 數據分析
1.3.1 性狀相關性分析 使用Excel 2010進行數據的錄入和整理,并計算其平均值和標準差。使用SAS 9.2進行進行不同氮處理下葉寬變化的相關分析和方差分析。
1.3.2 基因型測定 采用CTAB抽提法提取134份品種幼葉基因組DNA[24],檢測合格后用于高通量測序。每品種測序reads數據量在5Gb以上,相當于10×以上的基因組測序。從reads到SNP的檢測參考Zhou等[17]方法進行。SNP使用ANNOVAR (Version: 2013-08-23)軟件包進行注釋[25]。
1.3.3 群體結構與親緣關系分析 根據SNP信息,使用PHYLIP 3.68軟件包基于鄰接法構建品種間系統進化樹[26],使用在線工具iTOL(http://itol.embl.de/)進行進化樹的優化。使用EIGENSOFT軟件中的smartpca程序包進行主成分分析(PCA)[27]。
1.3.4 葉寬性狀的全基因組關聯分析 采用基于混合線性模型(mixed linear model,MLM)的EMMAX(Efficient Mixed-Model Association eXpedited)軟件包進行目標性狀與SNP標記間的關聯分析[20, 28],將EMMAX軟件計算的親緣關系K矩陣及基于EIGENSOFT軟件計算的群體結構Q納入分析模型中,關聯分析參數設定為:emmax -v,-d 10,-t,-p,-k,-c,-o。在考慮關聯分析群體大小和SNP數量的情況下,對于關聯分析的顯著性,采取10-6作為寬松閾值,而進一步的嚴格閾值采取Bonferroni校驗閾值[29]。
2 結果
2.1 3種氮處理條件下葉寬性狀多樣性及其變化
在134份材料中,劍葉葉寬表現豐富的變異,正常氮處理下變幅為9.93—29.00 mm。如木邦谷、羅大穗等地方品種表現為株型較大,分蘗少,成熟期葉片少,劍葉葉寬大于20 mm;而地方品種英德大葉拍、合江23等表現為株型小,成熟期葉片多,葉片呈細長狀,葉寬小于10 mm。由此表明,此關聯群體具有充分的表型變異,能夠進行基于葉寬的全基因組關聯分析。
對裂區設計整體進行方差分析,變異來源于氮肥使用量、品種及品種與氮肥交互作用的值均小于0.0001,而區組與氮處理間的交互作用為0.2444,這說明葉寬變異主要受氮處理及品種差異引起,不同品種在不同氮濃度下展現不同的葉寬變化。對134份品種成熟期劍葉寬調查結果表明,在低、中、高3種氮處理下,劍葉葉寬均呈正態分布(圖1-a—圖1-c),從頻率分布來看,中氮和高氮處理下劍葉寬為15—18 mm的品種明顯增多。在反映氮響應變化中,正常氮處理相對于低氮處理表現為葉寬變大,而相對于高氮處理變化要小(圖1-d)。相關性分析亦表明,氮處理與劍葉葉寬呈顯著正相關(表1),這表明,葉寬受外界氮水平的影響,且葉寬的變化能夠反映不同氮處理。
根據不同氮處理下葉寬相對變化,將葉寬變化分為四種響應模式(圖2-e)。有35.2%的品種表現為在高氮條件下葉寬增加而低氮條件下葉寬減小,有18.1%的品種在低氮和高氮條件下劍葉寬均增大,另有36.2%的品種在低氮和高氮條件下葉寬均減小,還有5.7%的品種在低氮條件下劍葉變寬而在高氮條件下反而變窄。由此可知,該關聯群體在不同氮處理下葉寬相對變化呈現豐富的變異,可以利用葉寬的相對變化來反映氮素利用效率。
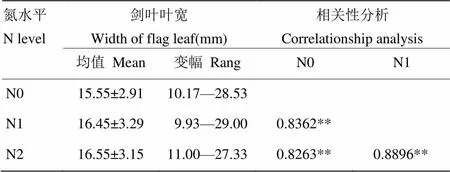
表1 不同氮濃度下葉寬統計及其相關性分析
*、**分別表示差異達到0.05 和 0.01 的顯著水平
*,** present significant at 5% and 1% probability levels respectively
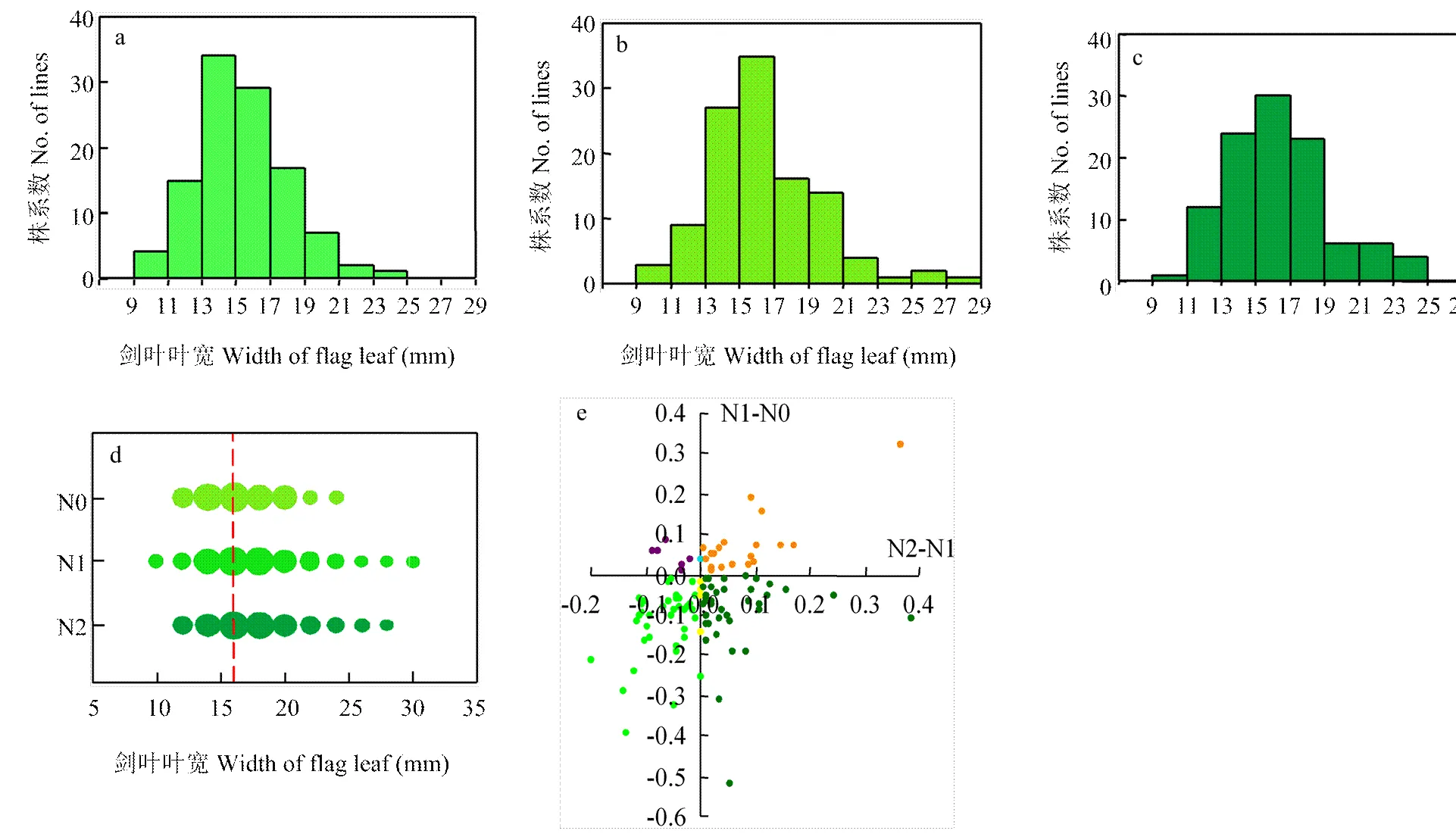
a、b、c分別為低氮、中氮和高氮條件下的葉寬分布;d:3種氮水平下葉寬分布的氣泡圖,氣泡寬度代表株系數,紅色虛線為3種氮條件下葉寬平均值;e:高氮脅迫下葉寬相對變化(N2-N1)和低氮脅迫下葉寬相對變化(N0-N1)的分布
2.2 關聯分析SNP標記
基于134份水稻的測序數據,結合使用BWA和GATK軟件進行SNP的提取,使用最小等位基因頻率大于0.03(MAF>0.03)進行SNP的過濾,最終提取到3 356 591個SNP位點,平均每kb有8.6個SNP位點。為進一步分析SNP位點信息,使用ANNOVAR軟件對SNP數據注釋(圖2),其中,有2 814個位點注釋為剪接位點相關,此類位點通過影響基因轉錄剪接的變化導致基因功能改變;409 387個SNP位點注釋到外顯子區,引起核酸編碼信息的改變,其中59%的SNP為非同義突變,造成編碼信息的改變,從而引起蛋白序列的變化;另外有12 221個位點注釋與終止密碼子相關,終止密碼子的缺失或增加會導致編碼蛋白移碼突變或提前終止。
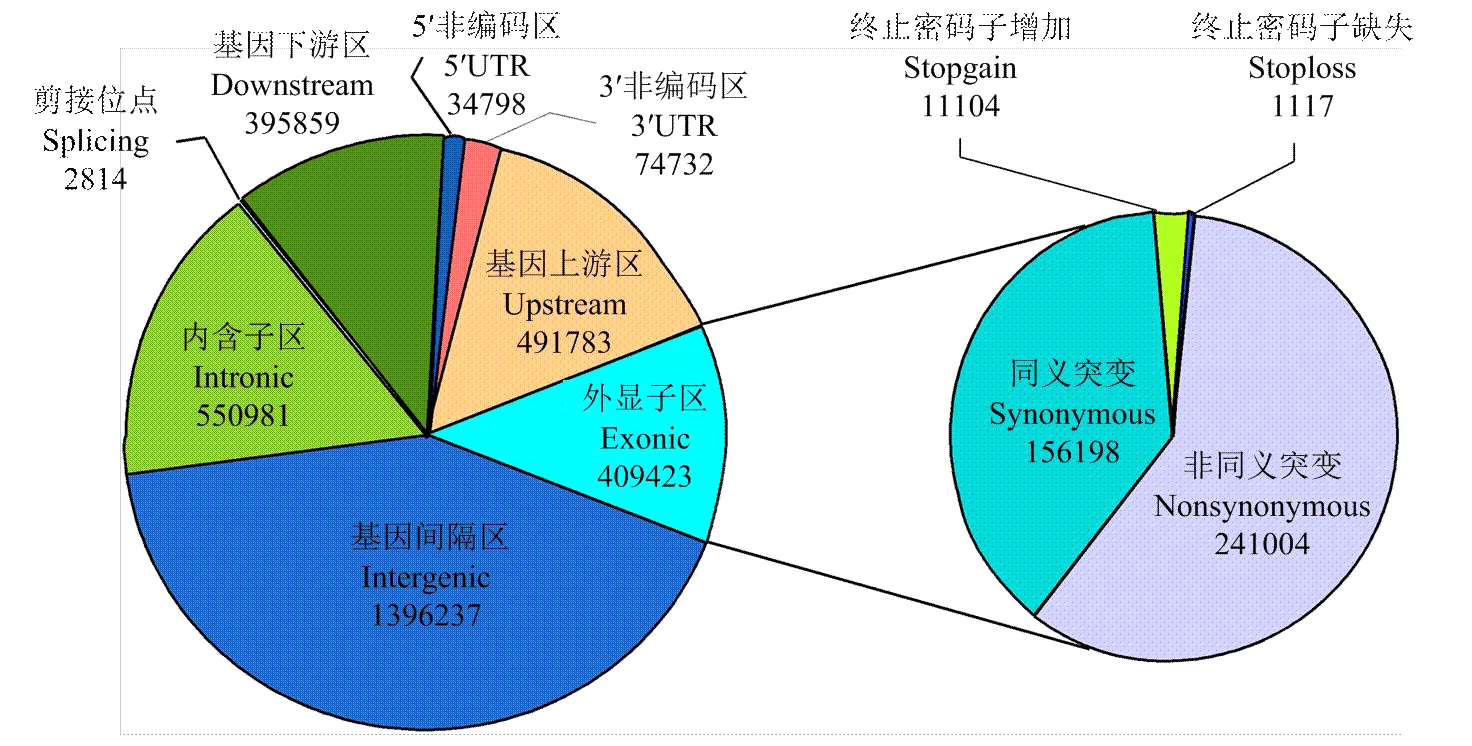
圖2 關聯分析SNP標記分布及其功能注釋
2.3 群體的遺傳結構分析
基于134品種重測序的SNP數據,開展親緣關系和系統進化分析。結果表明,此關聯群體主要分為秈稻和粳稻兩個亞群。由GAPIT軟件基于SNP計算得到的親緣關系系數表明,此134份水稻品種主要分為71份秈稻品種和63份粳稻品種,亞種內部分品種的親緣關系較近,形成小的亞群(圖3-a和圖3-b)。基于SNP數據計算品種間遺傳距離和NJ(Neighbor- joining)法構建系統發育樹表明,此關聯群體主要為秈粳之間的分歧(圖3-c)。主成分分析(principal component analysis,PCA)同樣也說明了此關聯群體秈粳分化的群體結構。此外,基于PCA三點圖可知,秈稻亞種間分化較為集中,粳稻亞種間存在不同程度的分化,較為分散,部分品種間存在小亞群結構(圖3-d)。
2.4 葉寬性狀的全基因組關聯分析
通過對不同氮處理條件下134份水稻成熟期劍葉葉寬的全基因組關聯分析表明,在不同氮處理條件下,與葉寬相關聯的SNP位點各不相同(表2)。以-log10(p)大于6為閾值,共檢測到14個與葉寬性狀顯著相關的SNP位點(圖4)。在低氮和中氮水平下,均檢測到6個顯著的SNP位點與葉寬性狀相關。而高氮水平只檢測到位于第12染色體上的2個顯著位點,其中一個位點與中氮水平一致,推測該調控葉寬的位點受氮水平影響較小。
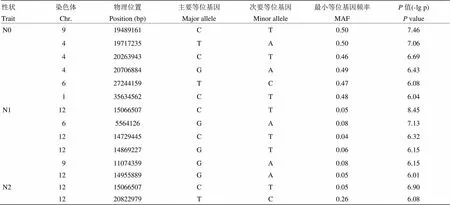
表2 3種氮處理下劍葉寬的關聯位點
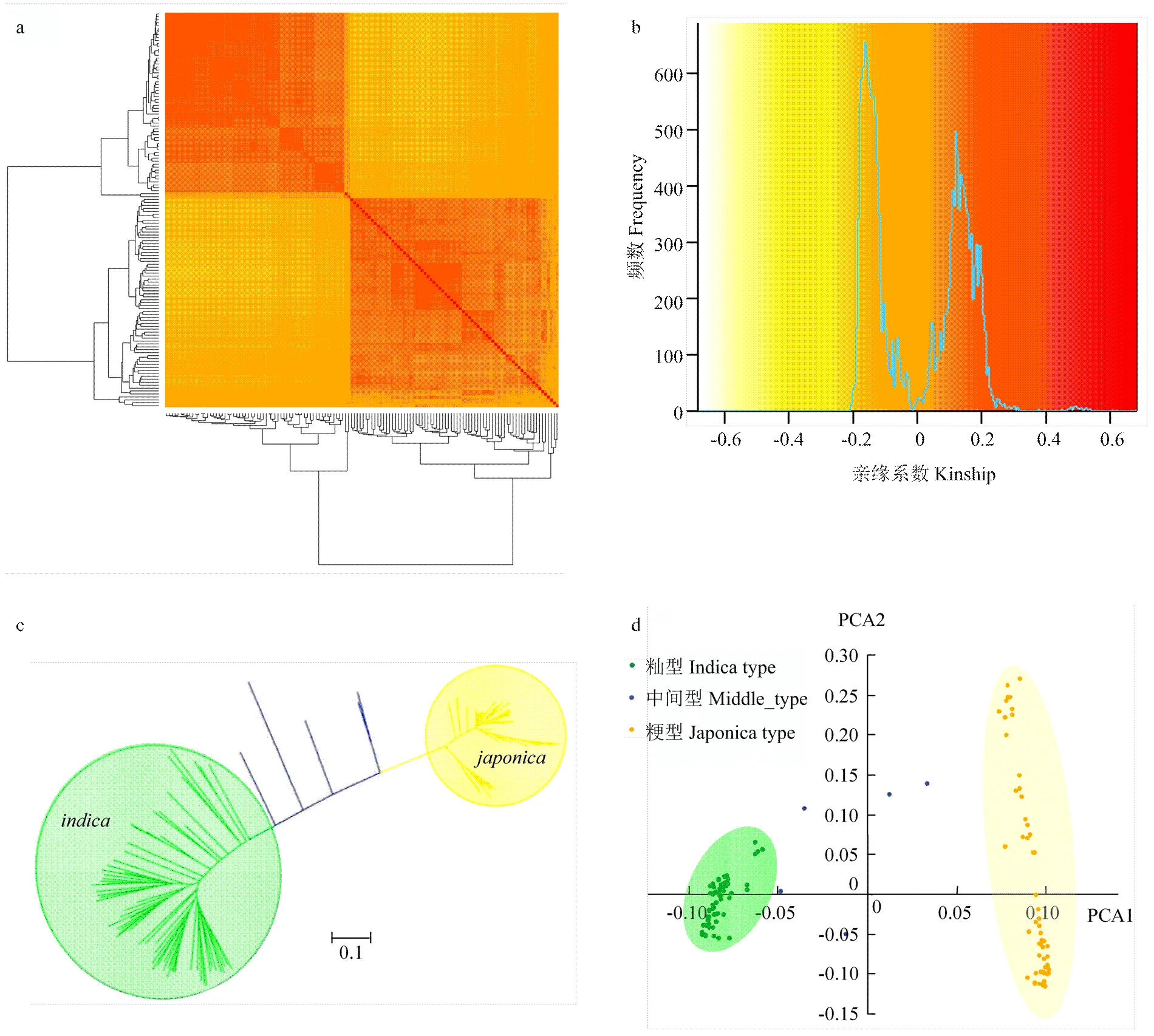
a、b:群體親緣關系分布圖;c:基于SNP標記構建的N-J樹;d:主成分分析(PCA)散點分布圖
在低氮水平下檢測到的顯著性SNP位點最小等位基因頻率均大于0.46,此類SNP在關聯群體中分布較為廣泛。而在中氮和高氮水平下檢測到的SNP位點最小等位基因頻率均較小,屬于一類較為稀有的突變位點。在中氮水平下,第12染色體上顯著性SNP位點的值(-lgp)為8.45,高于Bonferroni校正后的閾值水平。對中氮水平下葉寬性狀顯著關聯的位點進行候選基因分析時發現,位于第12染色體上的Chr12_14869227顯著位點±200 kb的候選區間內,包含一注釋為Cytochrome P450功能相關蛋白的候選基因,其與業已報道的葉寬性狀相關基因同屬于細胞色素P450家族(圖5)。編碼水稻BR生物合成途徑中的一個關鍵的BR-6氧化酶,該酶活下降的植株表現為BR缺乏癥狀,而使葉寬受到顯著的影響[30-31]。在高氮水平下,檢測到另一個位于第12染色體上顯著性關聯的峰,該區段包含已知的,編碼一個細胞壁生物合成和植株生長必須的糖基轉移酶家族的纖維素合酶類似蛋白(cellulose synthase-like,CSL),的突變導致水稻葉片變窄、半卷和矮化等表型[32-33]。
2.5 不同氮水平劍葉葉寬的全基因組關聯分析
進一步使用不同氮水平下葉寬的相對變化值來分析葉寬對氮水平的響應,共檢測到28個顯著的SNP位點,其中20個與低氮響應相關,8個與高氮響應相關(表3、圖6)。在低氮環境下,葉寬的響應位點比高氮環境下多,這與葉寬變化在低氮環境下表型變異豐富,而在高氮水平下葉寬變化不明顯有關。在高氮水平下,位于第7染色體上的顯著性位點Chr7_20639350,其-lg(p)為9.01,超過了Bonferroni檢驗閾值;另外,還檢測到位于第1染色體上的顯著性峰,該區段存在多個顯著性峰值點(圖7),在此區段內存在一個已知的,該基因與氮素利用相關,表現為葉片明顯早衰,氮的再活化作用被抑制[34-35],推測該基因為此檢測區間的主效基因。
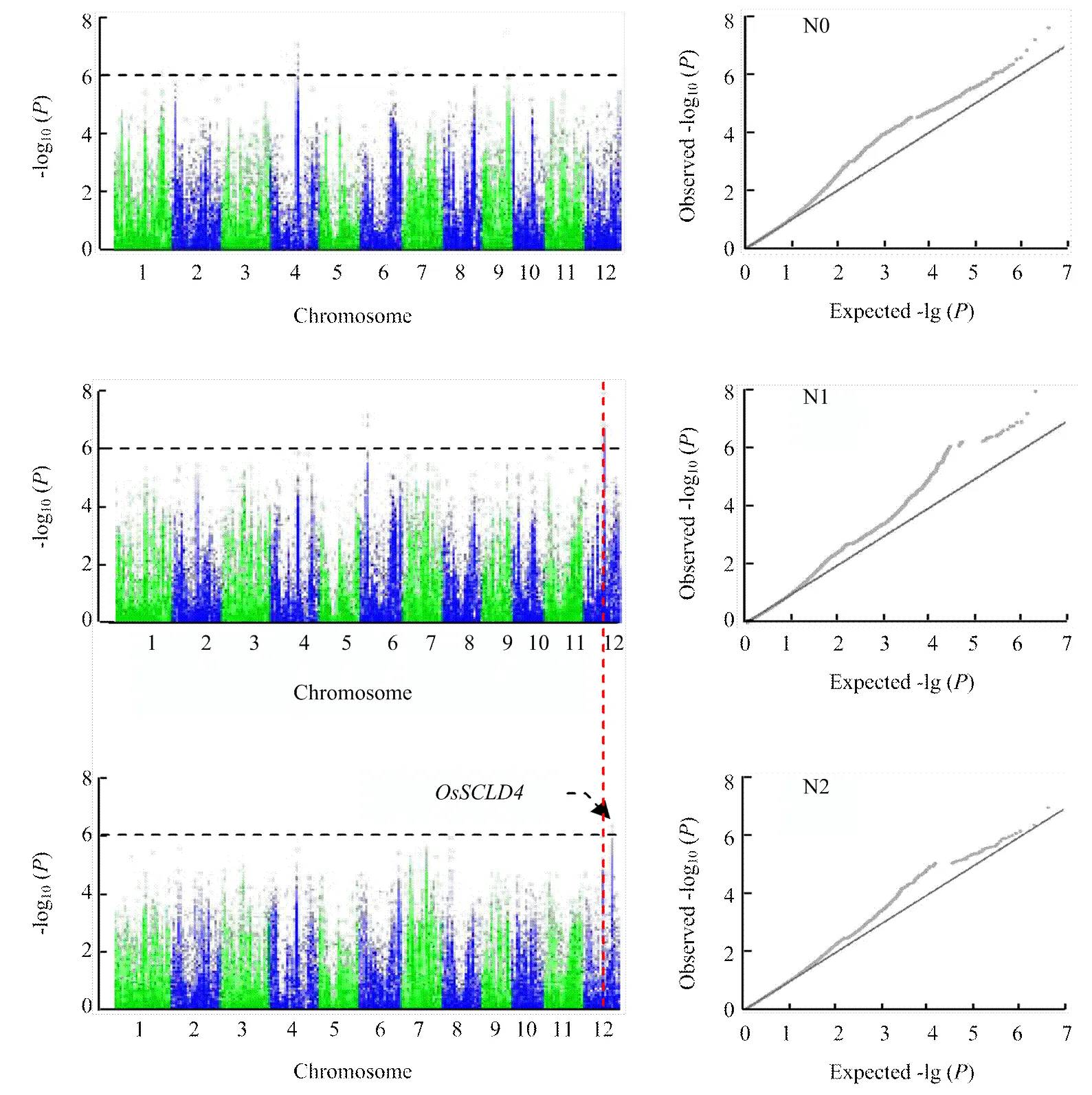
左側為曼哈頓分布點圖,右側為Q-Q圖;紅色虛線顯示為N1和N2水平下位于第12染色體共同的關聯位點。下同
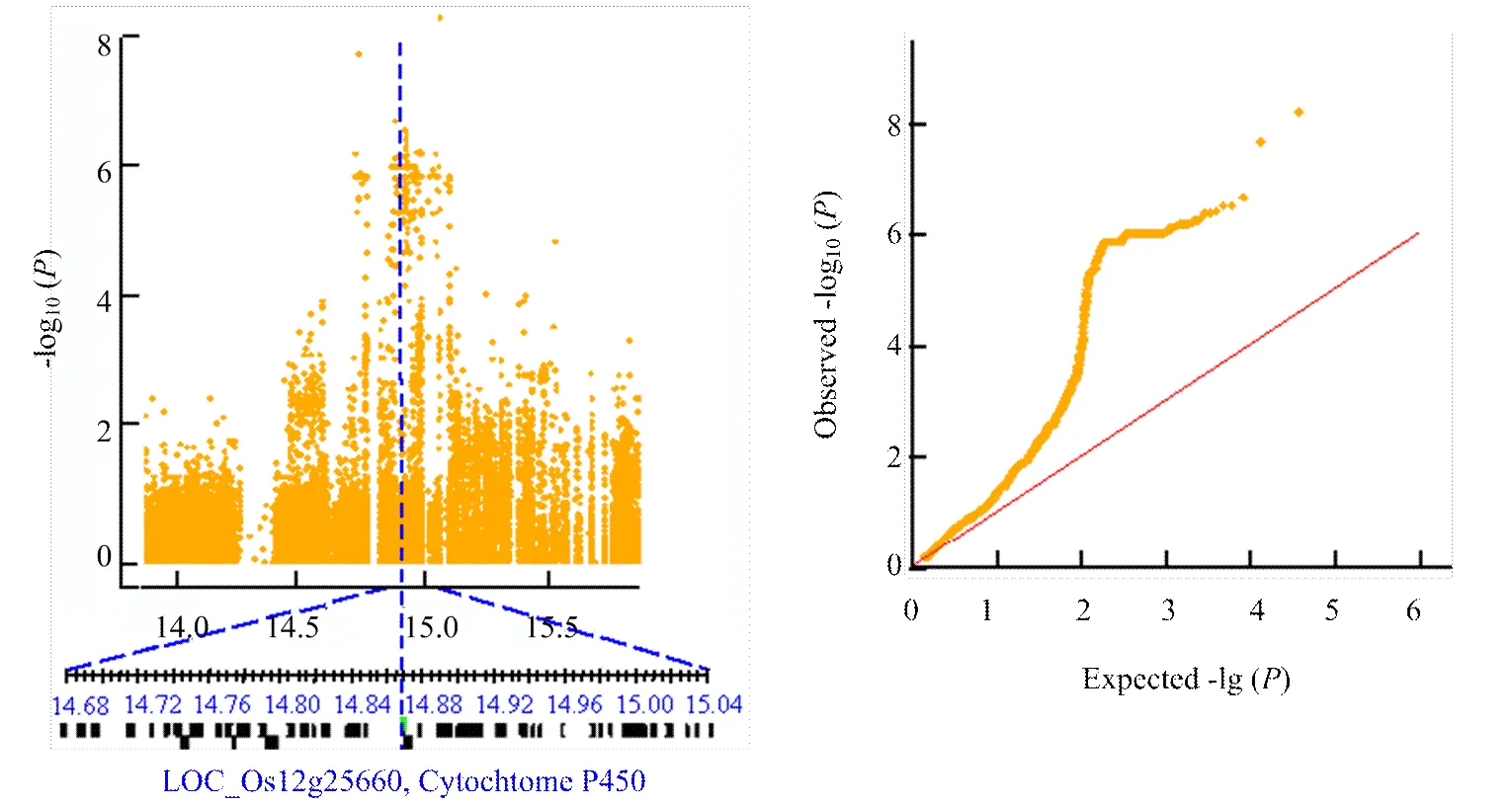
圖5 第12染色體上在N1水平下的關聯顯著位點候選區間分析
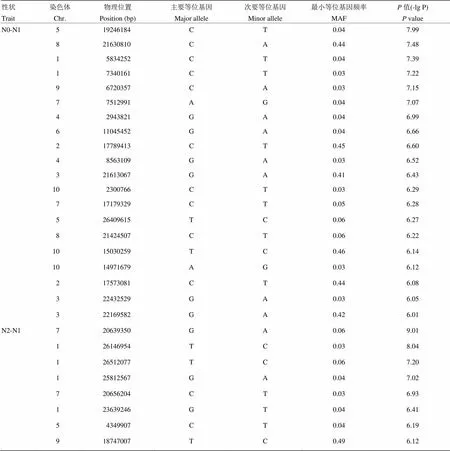
表3 低氮和高氮水平下劍葉葉寬變化的關聯位點
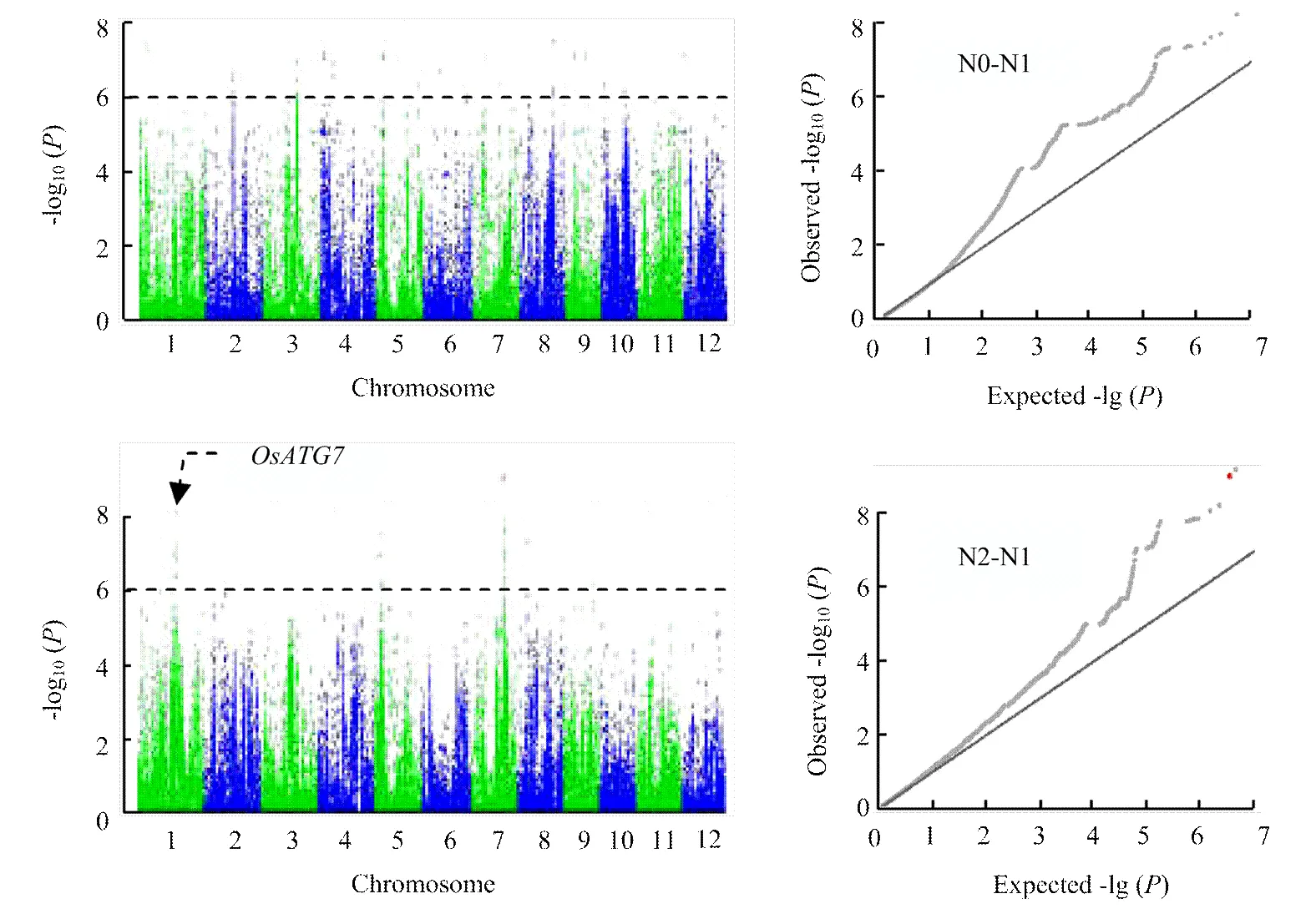
圖6 劍葉葉寬對低氮和高氮差異響應的全基因組關聯分析
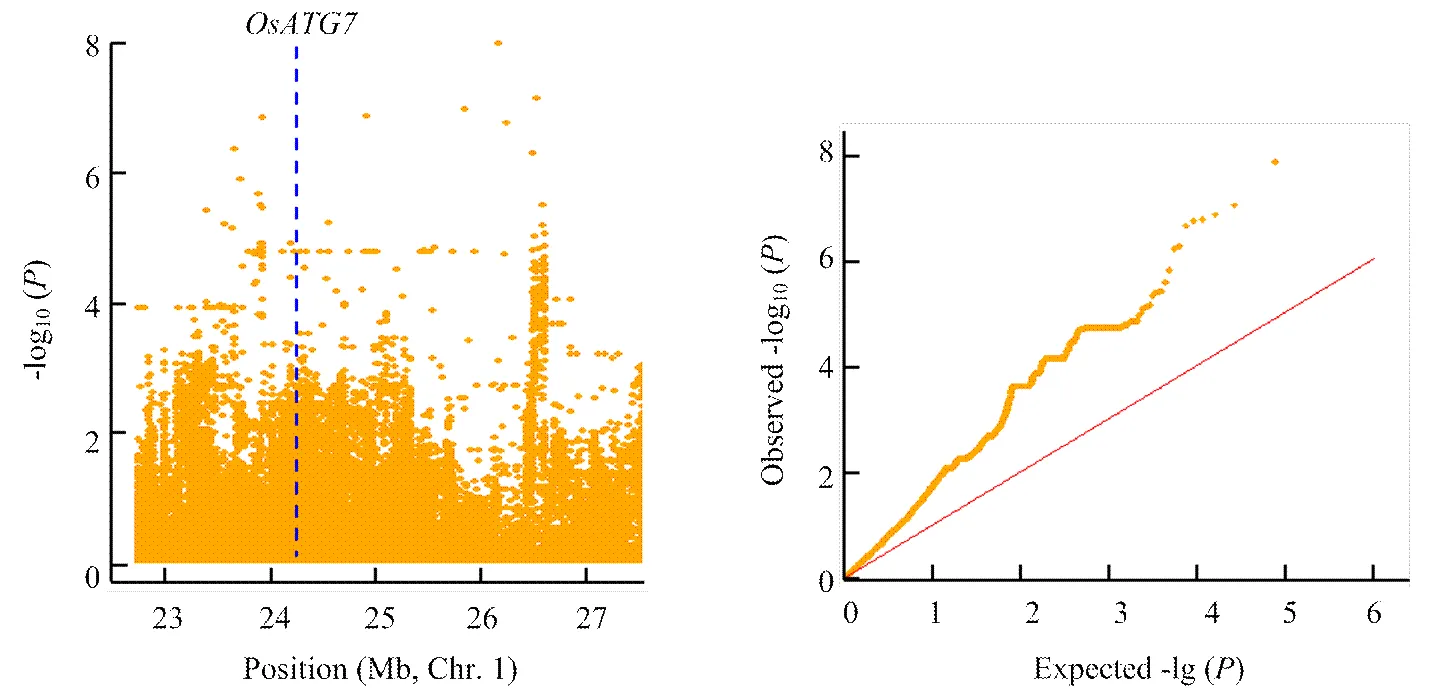
圖7 第1染色體上在N2水平的關聯顯著位點候選區間分析
3 討論
水稻成熟期劍葉形態是決定植株光合過程的受光面積和株型結構的關鍵因素,并進而影響灌漿期光合生物同化量的大小及水稻產量[36-37],因而改善水稻成熟期劍葉形態成為水稻保持優勢株型和高產的重要手段。但水稻葉片形態是復雜的受微效多基因控制的數量性狀,易受光、溫、水、肥等環境影響[38]。近年來,隨著GWAS在植物領域研究的應用,為發掘重要種質資源和快速鑒定新基因提供了新的分析工具[14,16]。
從GWAS的結果來看,水稻劍葉葉寬對氮肥脅迫的響應更為顯著。在低氮或高氮水平下檢測到的關聯位點遠多于正常氮肥氮肥水平下劍葉葉寬的關聯位點,尤其以低氮響應為甚,這可能與劍葉葉寬易受氮肥水平的影響以及不同種質資源對低氮或高氮的響應方式不同有關。因而,對于易受環境影響的性狀在開展GWAS分析時,最好能結合多環境下的分析或嚴格控制其他環境因素的影響。本研究采用3次重復的裂區設計,但沒有作多年/異地的重復,可能會對部分關聯位點的精準選擇產生影響。在進行秈粳型的群體進行關聯分析時,將BN (Balding-Nichols)矩陣納入基于MLM模型的關聯分析中,進行群體結構的校正,可以有效規避由于群體結構造成的影響,從而減少假陽性位點的產生。
氮素的同化和利用對植物至關重要,前人的研究結果來看,分別在第1、2、3、5、7、10、11、12染色體上存在已報道的與氮素相關QTL位點。其中,位于第2染色體的RM5812 標記與本研究的低氮脅迫下的檢測到的顯著性位點區間相近[39]。同樣,在低氮脅迫下檢測到的位于第3、第5染色體上的顯著性位點所在區間也有QTL位點報道過(http://archive.gramene.org/)。因此,基于顯著性的關聯位點,需要進一步對候選區間內的基因進行鑒定、分析和克隆。后期的進一步表達水平變化或基因敲除研究對關聯位點進行功能驗證十分重要,深入展開關聯候選基因的功能研究將有助于準確揭示水稻氮素利用遺傳機制奠定基礎。
4 結論
在不同氮肥水平下對水稻劍葉葉寬進行全基因組關聯分析,共檢測到的42個顯著的關聯位點中,其中14個與劍葉葉寬相關,28個與氮肥的響應相關。對所檢測到的位點進行候選區間分析,發現2個位于候選區間內分別調控水稻劍葉葉寬及氮響應的已知基因;檢測到多條染色體上的顯著位點與已報道與氮素利用相關QTL區間相近。此外,基于候選區間基因的功能注釋,檢測到1個與已知調控葉寬的同源基因。
致謝:中國科學院遺傳與發育生物學研究所田志喜研究員和李云海研究員為關聯分析提供指導及關聯群體材料,在此表示感謝。
References
[1] ANDREWS M, RAVEN J A, LEA P J. Do plants need nitrate? The mechanisms by which nitrogen form affects plants., 2013, 163: 174-199.
[2] ZHANG Q F. Strategies for developing green super rice., 2007, 104(42): 16402-16409.
[3] ZHANG Y J, TAN L B, ZHU Z F, YUAN L X, XIE D X, SUN C Q. TOND1 confers tolerance to nitrogen deficiency in rice., 2015, 81(3): 367-376.
[4] HU B, WANG W, OU S, TANG J, LI H, CHE R, ZHANG Z, CHAI X, WANG H, Wang Y, LIANG C, LIU L, PIAO Z, DENG Q, DENG K, XU C, LIANG Y, ZHANG L, LI L, CHU C. Variation in NRT1.1B contributes to nitrate-use divergence between rice subspecies., 2015, 47(7): 834-838.
[5] SUN H, QIAN Q, WU K, LUO J, WANG S, ZHANG C, MA Y, LIU Q, HUANG X, YUAN Q, HAN R, ZHAO M, DONG G, GUO L, ZHU X, GOU Z, WANG W, WU Y, LIN H, FU X. Heterotrimeric G proteins regulate nitrogen-use efficiency in rice., 2014, 46(2): 652.
[6] GALLAIS A, HIREL B. An approach to the genetics of nitrogen use efficiency in maize., 2004, 55(396): 295-306.
[7] HIREL B, LE GOUIS J, NEY B, GALLAIS A. The challenge of improving nitrogen use efficiency in crop plants: towards a more central role for genetic variability and quantitative genetics within integrated approaches., 2007, 58(9): 2369-2387.
[8] BI Y M, KANT S, CLARKE J, GIDDA S, MING F, XU J, ROCHON A, SHELP B J, HAO L, ZHAO R, MULLEN R T, ZHU T, ROTHSTEIN S J. Increased nitrogen-use efficiency in transgenic rice plants over-expressing a nitrogen-responsive early nodulin gene identified from rice expression profiling., 2009, 32(12):1749-1760.
[9] XU G, FAN X, MILLER A J. Plant nitrogen assimilation and use efficiency., 2012, 63(63): 153-182.
[10] TONG H H, MEI H W, YU X Q, XU X Y, LI M S, ZHANG SQ, LUO L J. Identification of related QTLs at late developmental stage in rice (L.) under two nitrogen levels., 2006, 33(5): 458-467.
[11] CHO Y I, JIANG W, CHIN J H, PIAO Z, CHO Y G, Mccouch S, Koh H J. Identification of QTLs associated with physiological nitrogen use efficiency in rice., 2007, 23(1): 72-79.
[12] 凌啟鴻. 作物群體質量. 上海: 上海科技出版社, 2000: 42-120.
LING Q H.. Shanghai: Shanghai Scientific and Technical Publishers, 2000: 42-120. (in Chinese)
[13] 殷春淵, 王書玉, 薛應征, 劉賀梅, 張栩, 孫建權, 王和樂, 胡秀明. 氮肥處理對新稻18號水稻產量及葉片形態特征的影響. 中國農業科技導報, 2012, 14(3): 101-106.
YIN Q Y, WANG Y S, XUE Y Z, LIU H M, ZHANG X, SUN J Q, WANG H L, HU X M. Effects of nitrogen treatment on rice yield and leaves conformation characteristics of 'Xindao No.18'., 2012, 14(3): 101-106. (in Chinese)
[14] ZHAO K, TUNG C W, EIZENGA G C, WRIGHT M H, ALI M L, PRICE A H, NORTON G J, ISLAM M R, REYNOLDS A, MEZEY J, MCCLUNG A M, BUSTAMANTE C D, MCCOUCH S R. Genome-wide association mapping reveals a rich genetic architecture of complex traits in., 2011, 2(1): 1020-1021.
[15] ATWELL S, HUANG YS, VILHJáLMSSON BJ, WILLEMS G, HORTON M, LI Y, MENG D, PLATT A, TARONE A M, HU T T, JIANG R, MULIYATI N W, ZHANG X, AMER M A, BAXTER I, BRACHI B, CHORY J, DEAN C, DEBIEU M, DE MEAUX J, ECKER JR, FAURE N, KNISKERN JM, JONES JD, MICHAEL T, NEMRI A, ROUX F, SALT DE, TANG C, TODESCO M, TRAW MB, WEIGEL D, MARJORAM P, BOREVITZ JO, BERGELSON J, NORDBORG M. Genome-wide association study of 107 phenotypes ininbred lines., 2010, 465(7298): 627-631.
[16] HUANG X H, WEI X H, SANG T, ZHAO Q, FENG Q, ZHAO Y, LI C, ZHU C, LU T, ZHANG Z, LI M, FAN D, GUO Y, WANG A, WANG L, DENG L, LI W, LU Y, WENG Q, LIU K, HUANG T, ZHOU T, JING Y, LI W, LIN Z, BUCKLER ES, QIAN Q, ZHANG Q F, LI J, HAN B. Genome-wide association studies of 14 agronomic traits in rice landraces., 2010, 42(11): 961-967.
[17] ZHOU Z K, JIANG Y, WANG Z, GOU Z, LYU J, LI W, YU Y, SHU L, ZHAO Y, MA Y, FANG C, SHEN Y, LIU T, LI C, LI Q, WU M, WANG M, WU Y, DONG Y, WAN W, WANG X, DING Z, GAO Y, XIANG H, ZHU B, LEE S H, WANG W, TIAN Z X. Resequencing 302 wild and cultivated accessions identifies genes related to domestication and improvement in soybean., 2015, 33(4): 408-414.
[18] WEN W, LI D, LI X, GAO Y, LI W, LI H, LIU J, LIU H, CHEN W, LUO J, YAN J. Metabolome-based genome-wide association study of maize kernel leads to novel biochemical insights., 2015, 5(2): 487-507.
[19] KUMAR V, SINGH A, MITHRA S V, KRISHNAMURTHY S L, PARIDA S K, JAIN S, TIWARI K K, KUMAR P, RAO A R, SHARMA S K, KHURANA J P, SINGH N K, MOHAPATRA T.Genome-wide association mapping of salinity tolerance in rice ()., 2015, 22(2): 133-145.
[20] WANG C, YANG Y, YUAN X, XU Q, FENG Y, YU H, WANG Y, WEI X. Genome-wide association study of blast resistance in indica rice., 2014, 14(1): 1-11.
[21] ZHU D, KANG H, LI Z, LIU M, ZHU X, WANG Y, WANG D, WANG Z, LIU W, WANG G L. A genome-wide association study of field resistance to magnaporthein rice., 2016, 9(1): 44.
[22] CHEN W, GAO Y, XIE W, GONG L, LU K, WANG W, LI Y, LIU X, ZHANG H, DONG H, ZHANG W, ZHANG L, YU S, WANG G, LIAN X, LUO J. Genome-wide association analyses provide genetic and biochemical insights into natural variation in rice metabolism., 2014, 46(7):714-721.
[23] 王蘭, 黃李超, 代麗萍, 楊窯龍, 徐杰, 冷語佳, 張光恒, 胡江, 朱麗, 高振宇, 董國軍, 郭龍彪, 錢前, 曾大力. 利用日本晴/9311重組自交系群體定位水稻成熟期葉形相關性狀QTL. 中國水稻科學, 2014, 28(6): 589-597.
WANG L, HUANG L C, DAI L P, YANG Y L, XUE J, LENG Y J, ZHANG G H, HU J, GAO Z Y, DONG G J, GUO L B, QIAN Q, ZENG D L. QTL analysis for rice leaf morphology at maturity stage using a recombinant inbred line population derived from a cross between nipponbare and 9311., 2014, 28(6): 589-597. (in Chinese)
[24] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA., 1980, 8(19): 4321-4325.
[25] Wang K, Li M, Hakonarson H. ANNOVAR: functional annotation of genetic variants from high-throughput sequencing data., 2010, 38(16): e164.
[26] Felsenstein J.PHYLIP-phylogeny inference package (version 3.2)., 1989, 5: 164-166.
[27] Price A L, Patterson N J, Plenge R M, Weinblatt M E, Shadick N A, Reich D. Principal components analysis corrects for stratification in genome-wide association studies., 2006, 38(8): 904-909.
[28] Kang H M, Sul J H, Service S K, Zaitlen N A, Kong S Y, Freimer N B, Sabatti C, Eskin E. Variance component model to account for sample structure in genome-wide association studies., 2010, 42(4): 348-354.
[29] Dudbridge F, Gusnanto A. Estimation of significance thresholds for genomewide association scans., 2008, 32(3): 227-234.
[30] MORI M, NOMURA T, OOKA H, ISHIZAKA M, YOKOTA T, SUGIMOTO K, OKABE K, KAJIWARA H, SATOH K, YAMAMOTO K, HIROCHIKA H, KIKUCHI S. Isolation and characterization of a rice dwarf mutant with a defect in brassinosteroid biosynthesis., 2002, 130(3): 1152-1161.
[31] HONG Z, UEGUCHI-TANAKA M, SHIMIZU-SATO S, INUKAI Y, FUJIOKA S, SHIMADA Y, TAKATSUTO S, AGETSUMA M, YOSHIDA S, WATANABE Y, UOZU S, KITANO H, ASHIKARI M, MATSUOKA M. Loss-of-function of a rice brassinosteroid biosynthetic enzyme, C-6 oxidase, prevents the organized arrangement and polar elongation of cells in the leaves and stem., 2002, 32(4): 495-508.
[32] LI M, XIONG G, LI R, CUI J, TANG D, ZHANG B, PAULY M, CHENG Z, ZHOU Y. Rice cellulose synthase-like D4 is essential for normal cell-wall biosynthesis and plant growth., 2009, 60(6):1055-1069.
[33] HU J, ZHU L, ZENG D, GAO Z, GUO L, FANG Y, ZHANG G, DONG G, YAN M, LIU J, QIAN Q. Identification and characterization of NARROW AND ROLLED LEAF 1, a novel gene regulating leaf morphology and plant architecture in rice., 2010, 73(3): 283-292.
[34] WADA S, HAYASHIDA Y, IZUMI M, KURUSU T, HANAMATA S, KANNO K, KOJIMA S, YAMAYA T, KUCHITSU K, MAKINO A, ISHIDA H. Autophagy supports biomass production and nitrogen use efficiency at the vegetative stage in rice., 2015, 168(1): 60-73.
[35] KURUSU T, KOYANO T, HANAMATA S, KUBO T, NOGUCHI Y, YAGI C, NAGATA N, YAMAMOTO T, OHNISHI T, OKAZAKI Y, KITAHATA N, ANDO D, ISHIKAWA M, WADA S, MIYAO A, HIROCHIKA H, SHIMADA H, MAKINO A, SAITO K, ISHIDA H, KINOSHITA T, KURATA N, KUCHITSU K. OsATG7 is required for autophagy-dependent lipid metabolism in rice postmeiotic anther development., 2014, 10(5): 878-888.
[36] LI Z K, PINSON S R, STANSEL J W, PATERSON A H. Genetic dissection of the source-sink relationship affecting fecundity and yield in rice (L.)., 1998, 4: 419-426.
[37] YUE B, XUE W Y, LUO L J, XING Y Z. QTL Analysis for flag leaf characteristics and their relationships with yield and yield traits in rice.2006, 33: 824-832.
[38] ZHU Y, CHANG L, TANG L, JIANG H, ZHANG W, CAO W. Modelling leaf shape dynamics in rice., 2009, 57(1): 73-81.
[39] Dai G J, Cheng S H, Hua Z T, Zhang M L, Jiang H B, Feng Y, Shen X H, Su Y A, He N, Ma Z B, Ma X Q, Hou S G, Wang Y R. Mapping quantitative trait loci for nitrogen uptake and utilization efficiency in rice (L.) at different nitrogen fertilizer levels., 2015, 14(3): 10404-10414.
(責任編輯 李莉)
Genome-wide association analysis on flag leaf width under different nitrogenlevels in rice
GAO YiHong, YAN JinXiang, TU ZhengJun, LENG YuJia, CHEN Long, HUANG LiChao, DAI LiPing, ZHANG GuangHeng, ZHU Li, HU Jiang, REN DeYong, GUO LongBiao, QIAN Qian, WANG DanYing, ZENG DaLi
(China National Rice Research Institute/State Key Laboratory of Rice Biology, HangZhou 310006)
【Objective】 The objective of this experiment is to study the genetic mechanism of flag leaf width and its response to different nitrogen fertilizer rates, and provide advantageous germplasm resources and genetic markers for the improvement of nitrogen use efficiency in rice breeding. 【Method】Based on re-sequencing of 134 rice landraces, a total of 3 356 591 SNPs distributed on the whole genome were identified. Three different nitrogen levels were assigned as the main plot in the split-plot design, and rice landraces are assigned at random to the subplots within each whole plot. Three nitrogen levels including low nitrogen (no nitrogen fertilizer), normal nitrogen (96 kg·hm-2) and high nitrogen (192 kg·hm-2) were applied under normal field cultivation, respectively. The EMMAX method was used to analyze the genetic relationship and EIGENSOFT was employed to detect the population structure. The mixed linear model was used to detect the potential genome-wide association between single nucleotide polymorphisms (SNPs) and the flag leaf width performance or response under low, medium and high nitrogen treatments. 【Result】The results showed that the flag leaf width displayed normal distribution in N0, N1 and N2 treatments, respectively. The variation of flag leaf width caused by the varietal differences and the different nitrogen levels, and the significant positive correlation between nitrogen fertilizer and flag leaf width were detected at all nitrogen levels. A total of 14 SNPs on five chromosomes presented significant association with the flag leaf width under three different nitrogen levels. The estimated minimum allele frequency was 0.46 at low nitrogen level, which indicate those loci are widely distributed in the association population. While the estimated minimum allele frequencies were lower at normal nitrogen and high nitrogen levels. One SNP located on chromosome 12 was found both at normal nitrogen and high nitrogen levels. Besides, another SNP on chromosome 12 was also detected at high nitrogen. Its flank contained a candidate gene, which belongs to the super-family of cytochrome P450. It is a homologous gene ofwhich was confirmed inregulating the flag leaf width in rice. Based on the variation of leaf width at different nitrogen levels, twenty SNPs and eight SNPs were identified to low nitrogen and high nitrogen response, respectively. Among them, the nitrogen utilization related gene,, was associated with high nitrogen response on chromosome 1. 【Conclusion】In this study, a total of 42 SNPs associated with flag leaf width and response to different nitrogen were identified based on the genome-wide association analysis.
; genome-wide association study; leaf width; nitrogen fertilizer
2017-01-12;接受日期:2017-04-05
國家自然科學基金(91435105、31661143006、31371581)、中國農業科學院科技創新工程項目
高易宏,E-mail:gaoyihong93@163.com。燕金香,E-mail:2911669220@qq.com。高易宏和燕金香為同等貢獻作者。通信作者曾大力,E-mail:dalizeng@126.com。通信作者王丹英,E-mail:wangdanying@caas.cn

