ω-3多不飽和脂肪酸對去勢大鼠骨微結構的改善
楊敏 蔣紅櫻 何振坤 曾怡 白彝華* 陳良敬
1. 昆明醫科大學第二附屬醫院腎臟內科,云南 昆明 650101 2. 溫州市中心醫院外科,浙江 溫州 325000
骨質疏松癥(osteoporosis,OP)是以骨量減低和骨微結構退化導致骨脆性增加,骨折風險性增加為特征的一種疾病[1]。絕經后OP是骨質疏松癥中最常見類型,與雌激素缺乏有關,并且約有 40%-50% 的50歲以上婦女可能發生絕經后骨質疏松性骨折[2],嚴重影響絕經后女性健康。目前尚無有效的方法再生已經丟失的骨小梁,因此,有效地延緩骨量減少速度,對預防絕經后女性骨質疏松癥和脆性骨折意義重大。ω-3多不飽和脂肪酸(polyunsaturated fatty acid,PUFA)來源于深海冷水魚類(如鮭魚、鯖魚、蹲魚、金槍魚等),安全無毒,主要成員有二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),目前在臨床方面主要用于降脂、抗凝、免疫營養支持和抗炎等[3]。近期有研究表明,骨代謝[4]、骨質疏松[5]與ω-3 PUFA關系密切。骨強度取決于骨密度和骨質量,骨強度下降是OP的根本特點。但是骨密度僅反映了骨強度的70%[1],并不能體現骨微結構,而后者是骨脆性的決定因素,可獨立于骨密度而起作用[6]。目前的研究多限于ω-3 PUFA對骨密度及生物力學指標的影響[7,8],有關ω-3 PUFA對骨微結構影響的研究極少。因此,本研究擬以去勢雌性大鼠為研究對象,觀察ω-3 PUFA對去勢大鼠骨微結構的影響,為更好地防治絕經后骨質疏松提供一定的實驗支持。
1 材料和方法
1.1 材料
SPF級11 w齡雌性大鼠30只,體重250±25 g,實驗動物由上海西普爾-必凱實驗動物公司提供,實驗動物許可證號:SCXK(滬)2006-0010;動物使用許可證號:SXK(滬)2006-0010。整個實驗中,所有大鼠自由進食和飲水,使用標準飼料,其中鈣含量為1.33%,磷含量為0.95%。動物飼養環境溫度為25±2℃,相對濕度50%~70%,12 h晝夜循環周期。ω-3 PUFA采用多烯酸乙酯膠丸,每粒含EPA乙酯和DHA乙酯(0.25g/丸)。國藥準字H20003082,由廈門魚肝油廠制造,產品批號為11354001。雌二醇(E2)試劑盒購于北京北方生物技術研究所。
1.2 分組及模型構建
所有雌性SD大鼠適應性喂養1 w后隨機分為假手術組、模型組和實驗組3組,每組10只。假手術組僅切除卵巢周圍脂肪組織(卵巢大小),其余兩組切除雙側卵巢。
1.3 實驗干預
術后恢復2 w開始干預。模型組和假手術組給予生理鹽水灌胃,量為1 mL/(100 g·d),實驗組給予ω-3 PUFA,量為150 mg/(kg·d),此劑量可改善生物力學性能、改善骨質高轉換狀態[8,9]。ω-3 PUFA與生理鹽水混合,按照1 mL/(100g·d)的量灌胃,干預12 w。每周稱量1次空腹體重,按體重調整用藥量。
1.4 指標檢測
干預12 w后,處死所有大鼠,經下腔靜脈采血,4℃離心分離血清用于檢測血鈣、磷、堿性磷酸酶(ALP)和雌激素水平。鈣、磷、ALP應用日本日立7080全自動生化分析儀測定。雌二醇采用放射免疫法測定,嚴格按使用說明操作。完整分離右側整段股骨,剔除肌肉組織,10%甲醛固定液固定24 h,轉75%乙醇過夜,應用micro-CT檢測骨密度和骨微結構參數,后者包括松質骨骨微結構參數(骨小梁體積比率(BV/TV)、骨小梁厚度(Tb.n)、骨小梁數目(Tb.N)、骨小梁間隙(Tb.sp)和皮質骨骨微結構參數(皮質體積比率(BV/TV)、皮質厚度(Cor·Th)和皮質骨的孔隙率。
1.5 統計學方法
使用SPSS16.0做統計分析,連續變量用平均數±標準差表示。在滿足總體方差齊性、樣本獨立及正態分布的前提下,按照one-way ANOVA的方法對總體均數進行統計分析,兩兩比較采用SNK法。所有的檢驗均為雙側檢驗,以P<0.05表示差異有統計學意義。
2 結果
2.1 一般情況
實驗過程中,假手術組1只大鼠因術后感染死亡,模型組1只大鼠因麻醉藥誤入下腔靜脈死亡,其余大鼠術后恢復及生活狀態良好。實驗結束時,各組大鼠總數為假手術組9只,模型組9只,實驗組10只。
2.2 各組之間骨代謝指標和E2比較
各組大鼠血清鈣、磷無顯著性差異。模型組、實驗組ALP水平均顯著高于假手術組,見表1。E2在3組之間存在顯著差異,表現為模型組水平最低,而假手術組水平最高,見表1。
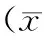
表1 3組大鼠骨代謝指標和雌二醇比較±s)Table 1 Comparison of bone metabolism indexes and estradiol levels among three groups (±s)
注:ALP:堿性磷酸酶;與假手術組相比,aP<0.05;與模型組相比,bP<0.05
Note:ALP:alkaline phosphatase; compared with Sham operation group,aP<0.05; compared with model,bP<0.05
2.3 ω-3PUFA對松質骨骨密度和骨微結構的影響
實驗組松質骨骨密度、BV/TV、Tb.Th和Tb.N均顯著低于假手術組,而Tb.Sp顯著高于假手術組;實驗組松質骨骨密度、BV/TV、Tb.Th和Tb.N均顯著高于模型組,而Tb.Sp顯著低于模型組,見表2。
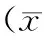
表2 3組大鼠松質骨骨密度及骨微結構指標比較±s)Table 2 Comparison of bone mineral density and microstructure of cancellous bone among three groups(±s)
注:BV/TV:骨小梁體積比率;Tb.Th:骨小梁厚度;Tb.N:骨小梁數目;Tb.Sp:骨小梁間隙;與假手術組相比,aP<0.05;與模型組相比,bP<0.05
Note:BV/TV:Trabecular bone volume ratio; Tb.N:trabecular number;aP<0.05,compared with Sham operation group;bP<0.05,compared with model
2.4 ω-3PUFA對皮質骨骨密度和骨微結構的影響
實驗組皮質骨骨密度、BV/TV和Cr.Th均顯著低于假手術組,而孔隙率顯著高于假手術組;實驗組皮質骨骨密度、BV/TV和Cr.Th均顯著高于模型組,而孔隙率顯著低于模型組,見表3。
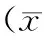
表3 3組大鼠皮質骨骨密度及骨微結構指標比較±s)Table 3 Comparison of bone mineral density and bone microstructure among three groups(±s)
注:BV/TV:骨皮質體積比率;Cr.Th:皮質厚度;與假手術組相比,aP<0.05;與模型組相比,bP<0.05
Note:BV/TV:Trabecular bone volume ratio; Cr.Th:cortical thickness;aP<0.05,compared with Sham operation group;bP<0.05,compared with model
3 討論
絕經后雌激素水平降低,雌激素的缺乏破壞了骨吸收和骨形成的平衡,導致骨吸收速度超過骨形成速度,因此絕經后骨質疏松癥屬于高轉換型骨質疏松。在本研究中,血清鈣磷水平無差異,而模型組的ALP水平顯著升高,提示骨形成增加,符合絕經后骨質疏松的機制[1]。隨著對骨質疏松機制認識的加深,治療骨質疏松癥的藥物研究也在不斷深入和完善。ω-3PUFA屬長鏈不飽和脂肪酸,目前在臨床方面主要用于降脂、抗凝、免疫營養支持和抗炎等[3]。近期有ω-3PUFA治療骨質疏松的報道,但是多從骨密度和營養的角度分析[7,9]。本實驗以去勢大鼠骨微結構作為切入點,探討ω-3PUFA對骨質疏松癥的防治作用。
高分辨率micro-CT是用于實驗室測量末梢骨的超高分辨率CT掃描機,可顯示橈骨和脛骨的小梁骨結構,并可對骨組織進行影像學三維重建和形態結構的分析,獲取描述骨內部微結構的參數。micro-CT所測的骨微結構參數指標如骨容積、骨小梁數目等能夠非常靈敏地反映骨質疏松的早期改變,甚至要早于傳統的骨組織計量學的相應指標[6]。本研究即是應用該技術對3組大鼠的股骨進行掃描、重構和分析,測量其骨密度、皮質骨和松質骨骨微結構變化。結果表明,無論是松質骨還是皮質骨,實驗組大鼠的骨量減少較模型組輕,這與近期國內外的研究[7,8,10]結果相似。本研究的一個重要結果是發現實驗組骨微結構顯著優于模型組,從骨微結構的角度證實ω-3PUFA對于骨質疏松的防治作用。通過降低骨量丟失和改善骨微結構,ω-3PUFA可改善骨礦密度和骨質量,從而提高骨強度,這對于預防骨質疏松及其最常見并發癥脆性骨折均具有重要意義。國外已有動物實驗[11]表明,ω-3 PUFA能夠增加蛋雞的骨強度,減少骨折發生。將來可進行臨床試驗進一步證實。
ω-3PUFA改善骨礦密度和骨質量的確切機制并不明確。Yao等[10]以去卵巢大鼠為研究對象并體外培養其破骨細胞,發現ω-3PUFA能夠顯著降低其抗酒石酸酸性磷酸酶活性,提示抑制破骨細胞的產生和活性可能是ω-3PUFA延緩去卵巢大鼠骨丟失的機制之一。Watkins 等[12]發現用EPA干預前成骨細胞系細胞MC3T3-E1 48 h后其骨形成標記物堿性磷酸酶水平顯著高于花生四烯酸,提示促進成骨細胞作用可能是ω-3PUFA改善骨量和骨微結構的另一機制。本研究比較了3組大鼠的雌激素水平,發現實驗組的雌激素水平較模型組有所改善,與錢康[7]的研究結果相似,提示改善雌激素水平也是ω-3PUFA防止骨質疏松的機制之一。
總之,本研究表明,ω-3 PUFA對去卵巢大鼠的骨微結構有一定的改善作用,這對于防治骨質疏松具有一定的意義。

