經顱多普勒超聲聯合小劑量rt-PA靜脈溶栓治療急性腦梗死的臨床研究
段磊 高志強 李娟 高俊風 劉瑋
?
經顱多普勒超聲聯合小劑量rt-PA靜脈溶栓治療急性腦梗死的臨床研究
段磊 高志強 李娟 高俊風 劉瑋
目的 觀察經顱多普勒超聲(TCD)聯合小劑量重組組織型纖維酶原激活劑(rt-PA)治療急性大腦中動脈閉塞性腦梗死的療效。方法 采用隨機分組方法,分為2組,2組患者在溶栓前均行TCD檢查確定責任血管為大腦中動脈,設TCD聯合小劑量rt-PA(0.6 mg/kg,最高總劑量50 mg)靜脈溶栓組30例,在溶栓開始后TCD持續監測2 h,單純rt-PA標準劑量0.9 mg/kg(最高總劑量90 mg)溶栓組30例,僅在溶栓前行TCD監測確定責任血管為大腦中動脈;2組患者根據TCD血流速度及頻譜形態判斷血管再通情況,臨床隨訪評定溶栓前后不同時間的NIHSS評分和Barthel指數。結果 TCD輔助小劑量rt-PA靜脈溶栓組血管再通率為70%,明顯高于對照組的30.0%,溶栓后2組NIHSS評分和Barthel指數評分存在顯著差異。結論 TCD持續監測聯合小劑量rt-PA靜脈溶栓治療急性腦梗死的臨床療效更佳。
急性腦梗死 TCD 重組組織型纖維酶原激活劑 靜脈溶栓
腦梗死治療主要為急性期使受損區域的血管再通以保持組織存活,盡可能改善患者的神經功能狀態,目前應用rt-PA 0.9 mg/kg標準治療劑量靜脈溶栓治療急性腦梗死為歐美國家唯一有循證醫學的方法,但仍存在較低再通率,且存在10.5%顱內出血的并發癥[1],使得rt-PA靜脈溶栓治療在臨床上得到的效果不理想,近年來Alexardrov等發現早期溶栓治療加用經顱多普勒超聲(TCD)監護后閉塞血管再通率明顯增高,此研究發現被美國心臟學會(AHA)評選為2004年十大研究進展之一[2-3]。本研究應用rt-PA 0.6 mg/kg靜脈溶栓治療急性腦梗死,并在溶栓過程中持續TCD監測,觀察其有效性,為急性腦梗死的治療提供新的有效途徑。
1 對象與方法
收集2011年12月~2016年4月在南京醫科大學第二附屬醫院神經內科住院治療的60例急性腦梗死患者,所有病例均符合全國第四屆腦血管病會議修定的診斷標準。患者入院前進行頭部CT檢查,CT影像無責任病灶,入選病例癱瘓肢體的肌力均為2級以下,無出血性疾病病史,符合rt-PA靜脈溶栓治療指征。在靜脈溶栓開始前應用國產理邦公司生產的便攜式經顱多普勒超聲檢測儀檢測患者雙側大腦中動脈的血流情況,當閉塞側大腦中動脈溶栓腦缺血分級(TIBI)為0~3級,符合大腦中動脈閉塞的病例組[4]。危險因素調查顯示高血壓病50例(83.3%)、糖尿病36例(60%)、TIA史8例(13.3%)、高脂血癥12例(20%)、心房纖顫7例(11.7%)、吸煙16(26.7%)例。按就診先后順序隨機分為rt-PA(0.9 mg/kg)對照組及TCD輔助小劑量rt-PA(0.6 mg/kg)溶栓組,每組各30例。rt-PA(0.9 mg/kg)對照組男15例,女15例,年齡57~74歲,平均年齡(62.7±12.3)歲,發病至開始溶栓時間為2~4.5 h,平均(3.8±1.4)h;TCD輔助小劑量rt-PA(0.6 mg/kg)溶栓組男19例,女11例,年齡56~72歲,平均年齡(61.5±11.4)歲,發病至開始溶栓時間為2.5~4 h,平均(3.3±1.1)h;治療過程中監測血壓、心率等生命體征。TCD應用經顱多普勒超聲頭架固定2 MHz超聲監護探頭,超聲發射功率預定為0.25 W/cm2,取樣容積為15 mm,探測深度為45~50 mm,在溶栓開始后持續2 h監測大腦中動脈閉塞部位的血流情況。對rt-PA(0.9 mg/kg)對照組患者亦佩帶超聲頭架,但僅在溶栓前及溶栓后2 h應用經顱多普勒超聲檢測2次血流情況,每次檢查持續時間短于3 min。閉塞血管再通的判定標準根據TCD血流速度及頻譜形態判定。TCD血流速度及頻譜形態恢復正常(TIBI5級)為完全再通,血流速度與溶栓前相比改善超過20 cm/s或波形改善大于TIBI 1個級差(如從無到微弱、微弱到低鈍等信號改善)為部分再通[4]。TCD輔助溶栓組觀察并記錄溶栓后血管再通的開始時間。
1.2 神經功能缺損評分和日常生活活動能力量表檢測 神經功能缺損評分采用美國國立衛生研究院卒中量表(NIHSS)評分,在溶栓前及溶栓后的2 h,30、90 d進行評定。反映殘疾水平的指標采用日常生活活動能力量表(Barthel指數),在溶栓后30、90 d進行評定。

2 結 果
2.1 2組患者溶栓前一般資料比較 2組患者的年齡、性別、危險因素、發病至開始溶栓時間相比無明顯差異(P>0.05),60例患者溶栓治療3 d內復查頭部CT均無顱內出血,共隨訪90 d,無脫落者。TCD輔助小劑量rt-PA(0.6 mg/kg)溶栓組溶栓前NIHSS評分為6.28分,平均(19.2±4.2)分;rt-PA(0.9 mg/kg)對照組溶栓前NIHSS評分為8.27分,平均(18.9±4.6)分;2組患者溶栓前的神經功能缺損程度相比無明顯差異(P>0.05)。
2.2 2組患者的血管再通率比較 rt-PA(0.9 mg/kg)對照組完全再通4例、部分再通5例,血管再通率30.0%(9/30)。TCD輔助小劑量rt-PA(0.6 mg/kg)溶栓組完全再通9例、部分再通12例,血管再通率70%(21/30),TCD輔助小劑量rt-PA(0.6 mg/kg)溶栓組血管再通率顯著高于對照組(χ2=5.57,P<0.05)。TCD輔助小劑量rt-PA(0.6 mg/kg)溶栓組再通開始時間為(31.3±11)min。
2.3 2組患者溶栓后不同時間NIHSS評分比較 2組患者溶栓后2 h,30、90 d NIHSS評分比較有顯著差異(P<0.05或P<0.01)(表1)。2組患者溶栓后30、90 d Barthel指數比較有明顯差異(P<0.05)(表2)。
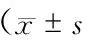
表1 2組患者溶栓后不同時間NIHSS評分比較,分)
注:與rt-PA(0.9 mg/kg)對照組比較,*P<0.05,▲P<0.01
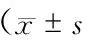
表2 2組患者溶栓后不同時間Barthel指數比較,分)
注:與rt-PA(0.9 mg/kg)對照組比較,*P<0.05
3 討 論
1982年挪威學者Rune Aaslid將能檢測到顱內動脈血流速度的經顱多普勒超聲儀器應用于臨床,其無創、迅速、可靠且可床旁操作的特點得到越來越多的肯定,有經驗的TCD操作人員可在數分鐘內完成大腦中動脈的血流檢測。經顱多普勒超聲儀的超聲能量的透顱率為10%~30%,輸出能量低于750 mW的診斷用TCD對人體是安全的,這個能量限值得到了美國食品藥品管理局(FDA)的批準[5]。本研究中TCD輔助小劑量rt-PA(0.6 mg/kg)溶栓組溶栓治療3d內復查頭部CT均無顱內出血,說明TCD輔助小劑量rt-PA靜脈溶栓治療是安全的,2 MHz輸出能量低于750 mW的診斷用TCD能將超聲能量傳到顱內血管[6]。本研究也發現即使殘留血流信號為分級最低時,TCD也能夠探測這些信號,表明超聲能量被傳遞到血栓部位。本研究中2組患者溶栓前的NIHSS評分分別為(18.9±4.6)和(19.2±4.2)分,2組間神經功能缺損嚴重程度統計學分析無顯著性差異。經過溶栓治療后rt-PA(0.9 mg/kg)對照組的血管再通率為30.0%,TCD輔助小劑量rt-PA(0.6 mg/kg)溶栓組的血管再通率為70%,兩組相比統計學有顯著性差異,表明有TCD持續監護輔助溶栓的情況下rt-PA的溶栓效果更好,且可以減少溶栓藥物用量。rt-PA靜脈溶栓速度取決于藥物的濃度及血栓與藥物的接觸面積。許多體內、體外的實驗證實了超聲波可增強溶栓藥物的溶栓作用,提高血管的再通率[7]。關于超聲波助溶的機制Francis研究小組認為血液中存在固有的微氣泡,在超聲能量作用下發生周期性膨脹和萎縮,在膨脹達到極限時崩潰,產生強大的剪切力破壞血栓表面,使表面發生空泡和撕裂樣改變,可使更多的血栓表面暴露在殘余血流中,從而加速血栓溶解[8]。
腦卒中后閉塞動脈再通的速度與早期癥狀改善和長期臨床預后有密切關系,腦梗死發生后應盡早改善和恢復缺血組織的有效供血以減輕神經元損傷,促進患者受損的神經功能的恢復。TCD可監測血管再通過程,確定血管開始再通的時間[9]。
本研究發現TCD輔助溶栓組閉塞血管再通開始時間為(31.3±11)min。TCD輔助小劑量rt-PA(0.6 mg/kg)溶栓組患者溶栓后2 h,30、90 d的NIHSS評分明顯低于rt-PA(0.9 mg/kg)對照組,溶栓后Barthel指數明顯高于rt-PA(0.9 mg/kg)對照組,這說明TCD輔助小劑量rt-PA(0.6 mg/kg)溶栓組患者的神經功能缺損恢復程度及殘疾水平要好于rt-PA(0.9 mg/kg)對照組。其臨床預后較好可能與超聲波增強了rt-PA的溶栓效能,促使血管提前再通有關。TCD輔助溶栓藥物溶栓治療腦梗死是近年來國外神經內科的研究熱點,國外的一些臨床研究已初步表明TCD可提高溶栓藥物的溶栓效能,促進血栓溶解,改善患者的臨床預后,具有廣闊的應用前景。本研究初步證明TCD有助于增強rt-PA的溶栓作用,在臨床上可以減少rt-PA靜脈用藥量,但尚需進一步擴大樣本量,進行多中心、雙盲、對照研究,為臨床上應用經顱多普勒超聲輔助rt-PA靜脈溶栓治療急性腦梗死提供進一步依據。
[1] 杜萬良.2007年成人缺血性卒中早期治療指南[J].中國卒中雜志,2007,2(7):614-621.
[2] Alexandrov AV,Demchuk AM,Felberg RA,et al.High rate of complete Recanalization and dramatic clinical recovery during tP A infusion when continuously monitored by 2-MHz transcranial Doppler monitoring[J].Stroke,2000,31(3):610-614.
[3] Alexandrova AV,Molina CA,Grotta JC,et al.Ultrasound-enhanced systemic thrombolysis for acute ischemic stroke[J].N Eng1 J M ed,2004,351(21):2170-2178.
[4] Demchuk AM,Burgin WS,Christou I,et al.Thrombolysis in brain ischemia (TIBI) transcranial Doppler flow grades predict clinical severity,early recovery,and mortality in patients treated with intravenous tissue plasminogen activator[J].Stroke,2001,32(1):89-93.
[5] Aaslid R,Markwalder TM,Nornes H.Noninvasive transcrnial Doppler ultrasound recording of low velocity in basal cerebral arteries[J].J Neurosurg,1982,57(3):769-774.
[6] Moehring MA,Voie AH,Spencer MP,et al.Investigation of transcranial Doppler(TCD) power output for potentiation of tissue plasminogen activator(WA)therapy in stroke[J].Ccrebrovasc Dis,2000,10(Suppl.1):9.
[7] Spenos KM.Acceleration of thrombolysis with ultrasound through the cranium in a flow model[J].Ultrasound Med Biol,2000,26(2):889-895.
[8] Francis CW,Blinc A,Lee S,et al.Ultrasound accelerates transport of recombinant tissue plasminogen activator into clots[J].Ultrasound Med Biol,1995,21(3):419-424.
[9] Alexandrov AV,Burgin WS,Demchuk AM,et al.Speed of intracranial clot lysis with intravenous tissue plasminogen activator therapy:sonographic classification and short-term improvement[J].Circulation,2001,103(24):2897-2902.
(2016-05-06收稿)
210011 南京醫科大學第二附屬醫院神經內科
R743.3
A
1007-0478(2017)01-0050-03
10.3969/j.issn.1007-0478.2017.01.013

