基于大鼠血清差異蛋白質組學小白杏杏仁油免疫調節作用研究
田洪磊 詹 萍 顏海燕 談思維,2 毛曉英
(石河子大學食品學院1,石河子 832000) (杭州職業病防治院2,杭州 310006)
基于大鼠血清差異蛋白質組學小白杏杏仁油免疫調節作用研究
田洪磊1詹 萍1顏海燕1談思維1,2毛曉英1
(石河子大學食品學院1,石河子 832000) (杭州職業病防治院2,杭州 310006)
采用iTRAQ標記及高效液相色譜-電噴霧串聯質譜(LC-ESI-MS/MS)技術對小白杏杏仁油干預試驗大鼠血清差異表達蛋白進行定量鑒定,并通過表達模式及代謝通路聚類對鑒定獲得的差異蛋白進行生化代謝途徑和信號轉導途徑分析。結果表明,小白杏杏仁油可能通過調節血清中結合珠蛋白(HP)、角蛋白(KRT10、KRT42)、微管蛋白α-8鏈(TUBA8)、免疫球蛋白重(k)鏈VⅢ區(VH26、MOPC63)、α-1-抗蛋白酶(SERPINA1)及T-激肽原(KNG1)等蛋白的表達水平,作用于金黃色葡萄球菌感染、吞噬體、致病性大腸桿菌感染、原發性免疫缺陷、補體和凝血級聯5條先天性免疫通路而展現其免疫調節作用。
小白杏杏仁油 蛋白質組學 免疫調節 代謝通路
現代分析技術與蛋白質組學相結合的方法可為天然產物生物學功能評價提供有力借鑒,其中串聯質譜或多維液相色譜聯用技術與同位素標記相對和絕對定量(iTRAQ)技術融合手段已成為蛋白質定性和定量研究的主要工具,該技術可對血清、細胞裂解液等絕大多數復雜樣本進行相對和絕對定量研究[1]。與雙向電泳(2-DE)、差異凝膠電泳(DIGE)及同位素親和標簽(ICAT)等傳統蛋白質組學中常用的蛋白分離鑒定技術相比,雖然相關方法結合質譜聯用亦可實現微量蛋白的分析鑒定,然而在精確定量差異蛋白方面存在缺陷[2],iTRAQ技術對8種以內的不同蛋白質樣品中個體蛋白氨基及側鏈氨基酸進行分別標記,可實現差異蛋白(P<0.05)的準確分析。血清作為機體疾病表征或功能物質干預作用的標志物直接載體,依托實驗動物或志愿人群血清樣本資源,通過血清蛋白質組學進行疾病發生機制及中藥或功能食品生物學功能研究引起了國內外相關研究領域的關注[3-4],將現代蛋白質組學分析技術與生物信息統計方法相結合可實現天然產物生物學功能的深入解析。
本研究建立免疫力低下大鼠模型,通過空白對照組(BS)、模型組(MC)、模型小白杏杏仁油樣品組(SF)實施免疫調節作用研究的基礎上,采用iTRAQ標記及高效液相色譜-電噴霧串聯質譜(LC-ESI-MS/MS)技術對差異表達蛋白進行定量鑒定,并通過表達模式聚類(EPC)及代謝通路(Pathway)等分析對鑒定獲得的差異蛋白進行功能詮釋,確定其參與的最主要生化代謝途徑和信號轉導途徑,通過共性差異蛋白作用通路及機制解析再次驗證小白杏杏仁油的抗氧化與免疫調節效果,并推測其他生物學功能。
1 材料與方法
1.1 材料與設備
小白杏杏仁油:石河子大學農產品加工與貯藏重點實驗室自制;四乙基溴化銨(TEAB) :美國應用生物系統公司(ABI);胰蛋白酶(250 U/mg) :Promega公司;低分子量標準蛋白(97、66、43、31、20、14 KDa):美國Sigma公司;其他試劑(均為分析純):國藥集團化學試劑有限公司。
5430R冷凍離心機:德國Eppendorf公司;VCX130超聲波細胞破碎儀:美國Sonics公司;iMark酶標儀:美國Bio-Rad公司;LC-2AD納升流速高效液相色譜在線檢測儀、LC-20AB高效液相色譜脫機檢測儀:日本島津公司;Triple TOF 5600質譜儀:美國AB SCIEX公司。
1.2 試驗方法
1.2.1 操作流程
操作流程圖見1。
圖1 試驗操作流程
1.2.2 免疫動物模型建立與血清采集
實驗大鼠由新疆醫科大學第一附屬醫院動物實驗中心提供(動物生產許可證號:SCXY(新)2011-0004),動物飼養在新疆醫科大學第一附屬醫院動物實驗中心動物飼養房(許可證號:SYXK(新)2010-0003) 內進行。采用環磷酰胺誘導的方法建立免疫力低下大鼠模型,具體方法參見文獻[5]。將實驗大鼠隨機分成3組(正常大鼠空白對照組BS、大鼠模型對照組MC及大鼠模型樣品喂養組SF),其中樣品喂養組每日按5 mL/100g灌胃,其他2組按相同體積生理鹽水灌胃對照,喂養28 d后采集檢測樣本。采用心臟取血—抗凝儲存的方法制備各組血漿樣品,在0 ℃條件下離心分離(3 000 r/min) 10 min,獲得待檢血清。
1.2.3 大鼠血清樣本的制備
稱取適量各組血清樣品,加入500 μL蛋白裂解液對蛋白進行溶解,然后分別添加濃度為1 mmol/L的PMSF溶液及2 mmol/L的EDTA溶液,旋渦反應5 min后添加濃度為10 mmol/L的DTT溶液,超聲處理15 min混勻后,經過25 000×g離心分離20 min后取上清液;在56 ℃條件下將制備上清液中加入終濃度為10 mmol/L的DTT溶液處理1 h,還原打開二硫鍵,而后加入終濃度為55 mmol/L的IAM溶液,暗室靜置45 min進行半胱氨酸的烷基化封閉,進而加入適量冷丙酮在-20 ℃條件下靜置2 h,隨后經過25 000×g離心分離20min丟棄上清液,將沉淀物在200 μL的TEAB(0.5 mol/L)中超聲溶解15 min,離心(25 000×g)分離20 min后取上清液,用于后期定量分析。采用ProteoMiner蛋白富集試劑盒法去除高豐度蛋白,蛋白質濃度測量方法參見文獻[6]。
1.2.4 大鼠血清樣本的酶解
配制12%的十二烷基硫酸鈉聚丙烯酰胺凝膠,各血清蛋白樣品分別與2×上樣緩沖液混合,95 ℃條件下加熱5 min。設置每個樣品上樣量為30 μg,Marker上樣量為10 μg,120 V穩壓電泳120 min,電泳結束后通過考馬斯亮藍染液染色2 h,并經脫色液脫色3~5次,每次脫色時間為30 min;各樣品精確取出100 μg蛋白,設置適宜的酶解體系(蛋白:酶=2∶1),在37 ℃條件下加入胰蛋白酶酶解4 h,后期再次按照預設比例補加胰蛋白酶1次,37 ℃條件下繼續酶解8 h。
1.2.5 iTRAQ標記及SCX分離
將胰蛋白酶消化后的體系分別用真空離心泵抽干肽段,并用0.5 mol/L的TEAB對制備肽段進行復溶。按照實驗手冊和相關報道進行不同肽段樣本的iTRAQ標記[7-8],模型組(MC)、模型小白杏杏仁油樣品組(SF) 及空白對照組(BS)酶解肽段分別采用115、117及119 iTRAQ標簽進行標記,室溫培養2 h后將標記后的各肽段樣品進行等量混合。
采用LC-20AB液相系統對樣品進行分離。分離柱選用SCX分離柱(Ultremex SCX,4.6×250 mm);洗脫條件如下:首先用4 mL buffer A (25%乙腈中NaH2PO4濃度為25 mmol/L,pH=2.7)將標記后抽干的混合肽段進行復溶,以1 mL/min的速率進行入柱梯度洗脫,再次采用buffer A洗脫10 min,然后循序混入5%~35%的buffer B (25%乙腈中NaH2PO4濃度為25 mmol/L,KCl濃度為1 mol/L,pH=2.7) 進而洗脫11 min,最終循序混入35%~80%的buffer B洗脫1 min,在214 nm吸光度條件下對整個洗脫過程進行監測,經過篩選可獲得12個組分,各組分分別用StrataX除鹽柱進行除鹽處理,冷凍抽干備用。
1.2.6 基于高分辨率阱質譜儀 (LTQ Orbitrap HCD) 的LC-ESI-MS/MS分析
采用buffer A (2% 乙腈,0.1% 蟻酸) 將抽干備用的各組分分別復溶至0.5 μg/μL,20 000×g離心10 min去除不溶物質,通過LC-20AD納升液相色譜儀進行分析。
分析條件:C18反相柱 (進樣部分:200 μm內徑×2 cm長度,洗提分離部分:75 μm內徑×10 cm長度)對各上樣 (10 μL,約5 μg) 組分實施反相分離。分離程序依次為:15 μL/min流速進樣4 min,采用洗滌梯度為2%~35% 的buffer B (98%乙腈,0.1%蟻酸) 以400 nL/min流速梯度洗滌44 min,相同設置洗滌梯度為35%~80% 進行線性洗提2 min,最終依次采用80% 的buffer B與buffer A分別洗柱4、1 min。
液相分離的肽段樣本進入高分辨率阱質譜儀進行檢測,結合高能量碰撞裂解模式對肽段進行篩選。離子源電壓設置為1.5 kV進行離子阱信號檢測,對離子阱內控制聚集量約為1×104個離子進行掃描(質荷比范圍為350~2 000 u) 鑒定。
1.2.7 數據庫選擇與檢索
基于蛋白質質譜屬性選擇合適數據庫,若檢測樣本來源于已測序生物,即直接選擇該物種數據庫;若為非測序生物樣本,則選擇與待測樣本最為相近的物種蛋白質組數據庫,試驗大鼠血清來源于已測序大鼠物種,選擇IPI.RAT.v3.87 (39 925 sequences)作為本研究數據庫,并結合蛋白質鑒定標準軟件Mascot2.3.02進行數據庫檢索。
2 結果與分析
2.1 血清樣本蛋白質電泳膠圖
正常大鼠空白對照組、大鼠模型對照組及大鼠模型樣品喂養組血清樣本蛋白質電泳膠圖見圖2。
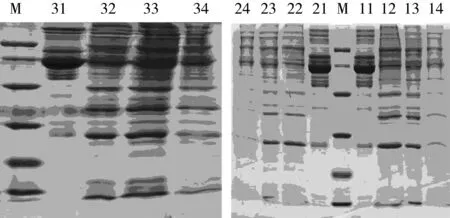
注:聚丙烯酰胺濃度12%;Marker(M):97、66、43、31、20和14 KDa,裝載量12 μg;每個樣品上樣量30 μg;11~14分別為去除高豐度蛋白前的MC試驗組、及其去除高豐度蛋白后的E1、E2、E3儲備樣;21~24分別為去除高豐度蛋白前的SF試驗組、及其去除高豐度蛋白后的E1、E2、E3儲備樣;31~34分別為去除高豐度蛋白前的BS試驗組、及其去除高豐度蛋白后的E1、E2、E3儲備樣。圖2 血清樣本蛋白質電泳膠圖
2.2 肽段匹配誤差評估
通過提高肽段母離子質量檢測的精確度能大幅度減少假陽性鑒定結果出現的概率,雖然通過LTQ-Orbitrap-Velos質譜儀所獲得的一級、二級質譜的質量精確度均小于3×10-6,但是為了防止鑒定結果遺漏等問題的出現,將數據庫檢索策略的肽段誤差控制在±10×10-6以內,通過圖3顯示的所有匹配肽段的相對分子量真實值與理論值之間的誤差分布情況分析,譜圖匹配質量誤差符合研究要求。
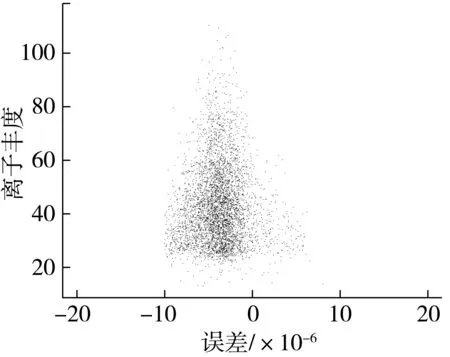
注:縱坐標表示肽段匹配偏差在一定范圍內的mascot 離子豐度(數量);橫坐標表示匹配到的肽段的檢測值和理論值之間的誤差。圖3 譜圖匹配質量誤差分布情況
2.3 對照組血清差異表達蛋白鑒定
在對各組血清樣本的低豐度蛋白進行同位素標記、強陽離子交換色譜柱及反相色譜柱分離的基礎上,通過LC-ESI-MS/MS分析共檢測到1 651個肽段,根據不同iTRAQ標簽組分的相對豐度實施對照組各肽段的相對定量,其定量結果采用其中一組相對于另一組的比值表示。在此基礎上,利用所得肽段進行蛋白質數據庫檢索與分析,獲得系列蛋白質豐度比不同的差異蛋白,對于豐度比接近于1的同一蛋白可視為此種蛋白在兩兩對比的兩組間沒有顯著變化,當蛋白質的豐度比(即差異倍數)達到1.2倍以上時,且經統計檢驗P<0.05,該蛋白可視為不同樣品對照組的差異蛋白質,依照此方案分析共得到251個差異蛋白質。通過免疫力低下模型組(MC)、模型小白杏杏仁油樣品組(SF)及空白對照喂養組(BS)3組試驗組中血清差異蛋白的兩兩比對,并對以上不同對照組所得的差異蛋白進行初步統計分析,發現相關生物功能蛋白均產生了較為明顯的差異,復雜血清蛋白體系多樣性改變的同時,存在共性變化的差異蛋白,其中3組對比組(MC/SF、MC/BS及SF/BS)中均有差異的共有14個差異蛋白(表1、圖4),共同差異蛋白的篩選與統計為后期Pathway及表達模式聚類分析等提供了先決條件,亦可為小白杏杏仁油免疫功能明晰提供充實的數據庫。
共性差異蛋白比較值對照分析看出,在對試驗大鼠進行免疫力低下模型處理后,相對于基礎喂養空白對照組,相關功能蛋白表達出現下調趨勢,或由于機體應激狀態的產生,導致結合珠蛋白(HP)、角蛋白(KRT)及免疫球蛋白重鏈V-Ⅲ區(VH26)等免疫力低下誘導急性期時相反應蛋白的明顯上調;在小白杏杏仁油對照干預作用條件下,相關共性差異蛋白指標均出現不同程度的調整。
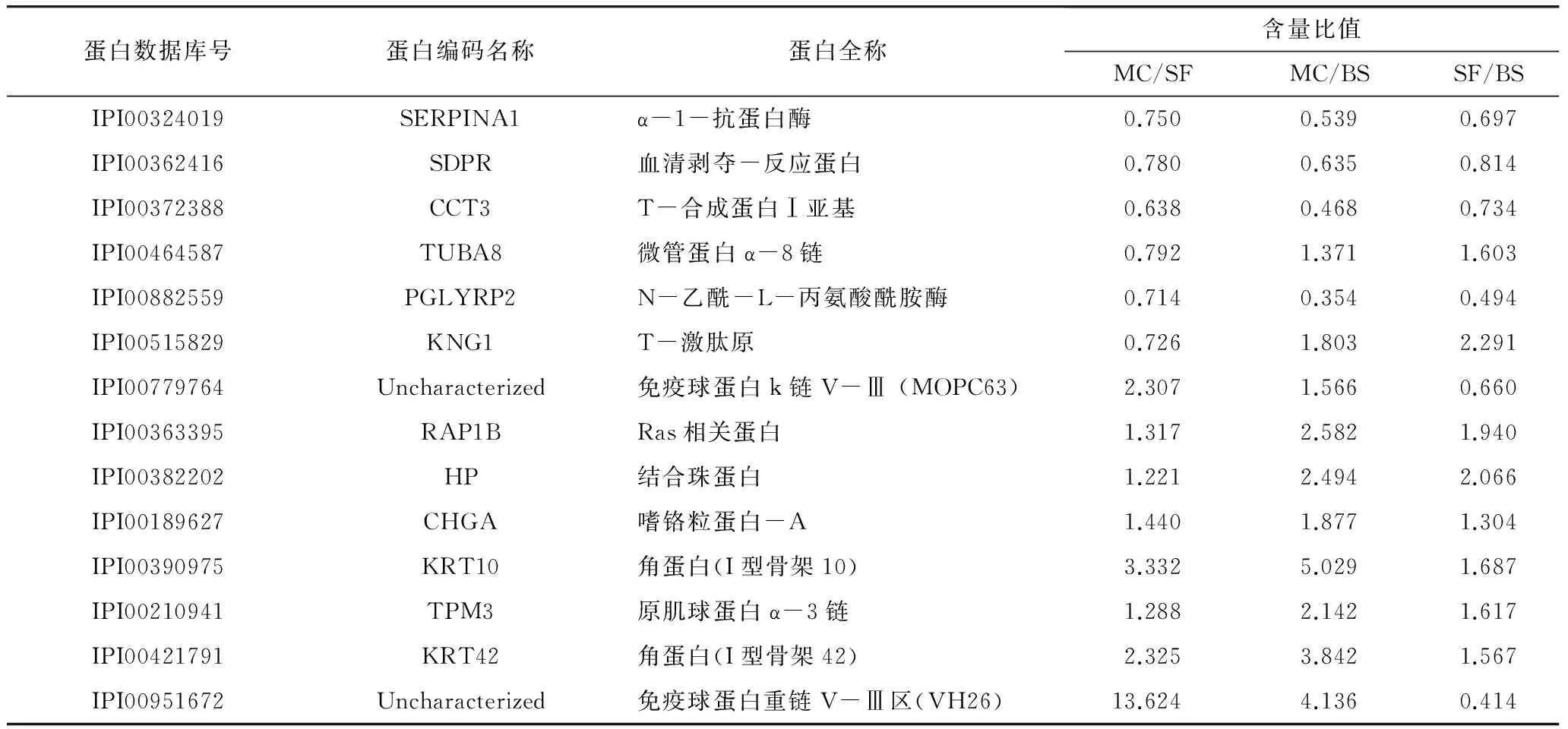
表1 各對照組中共性差異蛋白種類及其比值
注:BS為正常大鼠空白對照組,MC為大鼠模型對照組,SF為大鼠模型樣品喂養組。
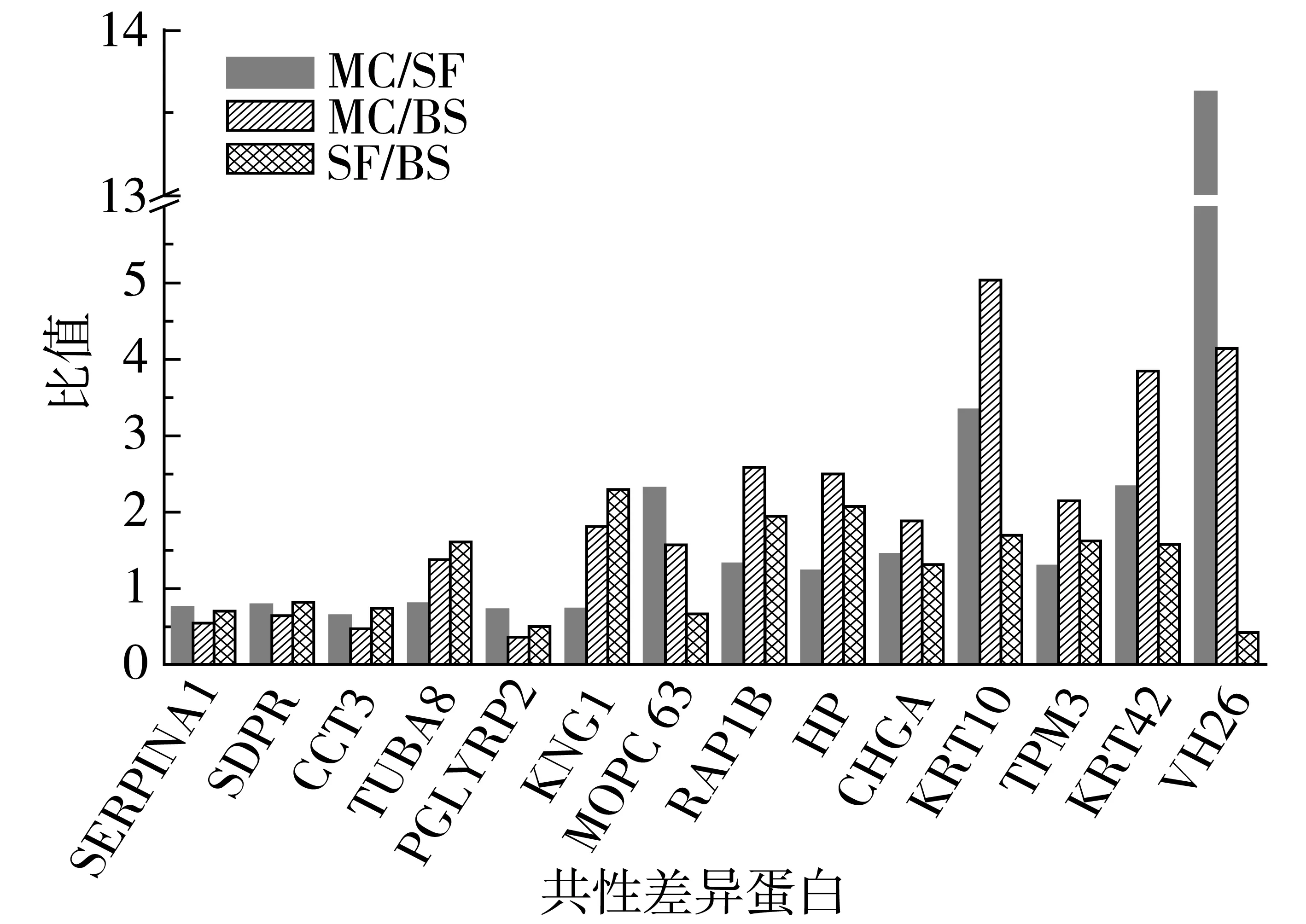
注:共性差異表達蛋白采用國際通用的蛋白編碼名稱表示。圖4 各比較組共性差異表達蛋白
2.4 對照組血清差異表達蛋白Pathway富集分析
為了深入解析小白杏杏仁油對實驗大鼠的生物學功能,本研究采用KEGG Pathway數據庫對所獲得的14種共性差異蛋白進行參與生化代謝途徑及信號轉導途徑分析,預期通過Pathway富集,明晰其主導作用機制或協同作用效果。
通過KEGG Pathway數據庫進行共性差異蛋白pathway檢索,獲得了V-Ⅲ區(VH26)、角蛋白(KRT10、KRT42)、結合珠蛋白(HP)、Ras相關蛋白(RAP1B)、原肌球蛋白α-3鏈(TPM3)、α-1-抗蛋白酶(SERPINA1)、微管蛋白α-8鏈(TUBA8)及T-激肽原(KNG1)、免疫球蛋白k鏈V-Ⅲ區(MOPC63)10種蛋白的相關作用通路,通路分析表明小白杏杏仁油對金黃色葡萄球菌感染通路、吞噬體通路、致病性大腸桿菌感染通路、原發性免疫缺陷通路、補體和凝血級聯5條先天性免疫通路作用最為頻繁(各通路包含共性差異蛋白數N>3),其他4種共性差異蛋白尚未有確定的作用通路。
結合比較組共性差異表達蛋白比較值分析,可能由于模型處理所造成的機體應激狀態,以及后期相關炎癥反應、易感染等現象的發生發展,免疫球蛋白重鏈V-III區(VH26)、I型角蛋白(KRT I)、結合珠蛋白(HP)、Ras相關蛋白(RAP1B)、原肌球蛋白α-3鏈(TPM3)等相關急性期時相反應蛋白在MC試驗組血液中的表達明顯增高,通過小白杏杏仁油平行干預作用后,相關急性期時相反應蛋白表達或免疫炎癥誘導重鏈突變區重排現象在SF試驗組中顯著下降,可以說明小白杏杏仁油對相關微生物感染及原發性免疫缺陷等通路具有一定的抑制與調控作用,但是與BS對照組相比,大部分相關差異蛋白表達水平仍略顯偏高。本次研究所涉及血清RAP1B蛋白在MC組中表達相對較高,但通過其在SF組中下調的表現可以預測小白杏杏仁油對機體應激狀態逆轉的輔助作用;同樣,平行對照組中原肌球蛋白α-3鏈(TPM3)的差異性表達亦引起了廣大學者的普遍關注,研究發現粥樣動脈硬化[9]、毒性視網膜損傷[10]等病理現象都伴隨著TPM3表達水平的提升,通過目前相關研究成果推斷,在被動免疫力低下大鼠模型(MC)構建后是否由于類似繼發性疾病的產生,而導致MC組血清TPM3的特異性表達,繼而可能基于小白杏杏仁油的干預作用趨于下調[11-12]。同時還發現可能由于小白杏杏仁油的干預而激發了α-1-抗蛋白酶(SERPINA1)、微管蛋白α-8鏈(TUBA8)及T-激肽原(KNG1)等差異蛋白的表達,從而輔助調控了與其相關的補體和凝血級聯等富集通路。共性差異蛋白的獲得與表達途徑解析為功能脂質體生物學功能構效關系深入研究奠定基礎。
3 結論
小白杏杏仁油免疫調控作用與血清蛋白表達中金黃色葡萄球菌感染、吞噬體、致病性大腸桿菌感染、原發性免疫缺陷、補體和凝血級聯5條先天性免疫通路具有緊密相關性。
小白杏杏仁油可能通過調控血清免疫球蛋白重(k)鏈V-III區(VH26 、MOPC63)、結合珠蛋白(HP)、角蛋白(KRT10、KRT42)、微管蛋白α-8鏈(TUBA8)、α-1-抗蛋白酶(SERPINA1)及T-激肽原(KNG1)等共性差異蛋白,而展現其免疫調控作用。
[1]謝秀枝, 王欣, 劉麗華, 等. iTRAQ 技術及其在蛋白質組學中的應用[J]. 中國生物化學與分子生物學報, 2011, 27(7): 616-621 Xie Xiuzhi, Wang Xin, Liu Lihua, et al. ITRAQ technology and its application in proteomics[J]. Chinese Journal of Biochemistry and Molecular Biology, 2011, 27(7): 616-621
[2]Manavalan A, Adav S S, Sze S K. iTRAQ-based quantitative secretome analysis of phanerochaete chrysosporium[J]. Journal of Proteomics, 2011, 75(2): 642-654
[3]Huang Z L, Wang H L, Huang H L, et al.iTRAQ-based proteomic profiling of human serum reveals down-regulation of platelet basic protein and apolipoprotein B100 in patients with hematotoxicity induced by chronic occupational benzene exposure[J]. Toxicology, 2012, 291(1-3): 56-64
[4]Huang Y P, Zhang X Y, Jiang W, et al. Discovery of serum biomarkers implicated in the onset and progression of serous ovarian cancer in a rat model using iTRAQ technique[J]. European Journal of Obstetrics & Gynecology and Reproductive Biology, 2012, 165(1): 96-103
[5]田洪磊, 張灝, 田豐偉. 小白杏杏仁油免疫調節及對S180肉瘤抑制作用研究[J]. 中國糧油學報, 2013, 28(2):55-59 Tian Honglei, Zhang Hao, Tian Fengwei. Study on the immunoregulatory activities and the inhibition effect on S180sarcom of Xiao-bai apricot almond oil[J]. Journal of the Chinese Cereals and Oils Association, 2013, 28(2): 55-59
[6]Carlsson N, Borde A, W?lfel S, et al.Quantification of protein concentration by the Bradford method in the presence of pharmaceutical polymers[J]. Analytical Biochemistry, 2011, 411(1): 116-121
[7]Link A J, Labaer J(編). 曾明, 等(譯). 冷泉港蛋白質組學實驗手冊[M]. 北京: 化學工業出版社, 2012: 56-170 Link A J, Labaer J (editors). Zeng Ming, et al (translators). Proteomics a cold spring harbor laboratory course manual[M]. Beijing: Chemical Industry Press, 2012: 56-170
[8]Qiao J J, Wang J X, Chen L, et al. Quantitative iTRAQ LC-MS/MS proteomics reveals metabolic responses to biofuel ethanol in cyanobacterial synechocystis sp.PCC6803 [J]. Journal of Proteome Research, 2012, 11(11): 5286-5300
[9]Mochizuki H, Nakamura K, Sato H, et al. Multiplex PCR and genescan analysis to detect immunoglobulin heavy chain gene rearrangement in feline B-cell neoplasms[J].Veterinary Immunology and Immunopathology, 2011, 143(1-2): 38-45[10]Kang J H, Ryu H S, Kim H T, et al. Proteomic analysis of human macrophages exposed to hypochlorite-oxidized low-density lipoprotein[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2009, 1794(3): 446-458[11]Chen J M, Zhu G Y, Xia W T, et al. Proteomic analysis of rat retina after methanol intoxication[J]. Toxicology, 2012, 293(1-3): 89-96
[12]Kelly E, Greene C M, Carroll T P, et al.Alpha-1 antitrypsin deficiency[J]. Respiratory Medicine CME, 2011, 4(1):1-8.
Immune Regulatory Activities of Small White Apricot Almond
Oil by Differentially Expressed Proteomics-Based Approach
Tian Honglei1Zhan Ping1Yan Haiyan1Tan Siwei1,2Mao Xiaoying1
(College of Food Science, Shihezi University1, Shihezi 832000)
(Hangzhou Hospital for the Prevention and Treatment of Occupational Diseases2, Hangzhou 310006)
Differentially expressed proteins of serum were quantitatively identified through iTRAQ labeling and high performance liquid chromatography-electrospray ionization tandem mass spectrometry (LC-ESI-MS/MS). The biochemical metabolic and signal transduction pathways of the differentially expressed proteins identified were conducted with expression pattern and metabolic pathway analysis. The results showed that small white apricot almond oil could demonstrate the immune regulatory activities with 5 innate immune pathways, including interactions with staphylococcus aureus infection, phagosome, pathogenic E. coli infection, primary immunodeficiency, complement and blood coagulation. The proteins expression levels, such as haptoglobin protein (HP), keratin (KRT10, KRT42), tubulin α-8 chain (TUBA8), V-III section of immunoglobulin heavy(k) chain (VH26,MOPC63), α-1-antiprotease (SERPINA1) and T-prokinin (KNG1), were closely related those innate immune pathways.
small white apricot almond oil (WAAO), proteomics, immunomodulatory, pathway
國家自然科學基金(31000766、31260374)
2015-07-05
田洪磊,男,1979年出生,副教授,食品科學
詹萍,女,1981年出生,副教授,食品風味化學、食品營養學 顏海燕,女,1974年出生,高級實驗師,食品營養學
R151.1
A
1003-0174(2017)02-0062-06

