高效排阻液相色譜法分析大豆7S和11S球蛋白的分子質量和純度
高雪麗 陳復生 張麗芬 郭興鳳 樊明濤
(河南工業大學糧油食品學院1,鄭州 450001) (許昌學院食品學院2,許昌 461000) (西北農林科技大學食品學院3,楊凌 712100)
高效排阻液相色譜法分析大豆7S和11S球蛋白的分子質量和純度
高雪麗1,2,3陳復生1張麗芬1郭興鳳1樊明濤3
(河南工業大學糧油食品學院1,鄭州 450001) (許昌學院食品學院2,許昌 461000) (西北農林科技大學食品學院3,楊凌 712100)
本文采用SE-HPLC法定量分析大豆7S和11S球蛋白的分子質量和純度。首先,對SE-HPLC的色譜條件進行優化,最佳的SE-HPLC色譜條件是:洗脫液(水/乙腈)70/30,洗脫液流速1.0 mL/min,進樣量10 μL。其次,繪制分子質量分析的標準曲線,分子質量標準曲線方程為Log (M)=-0.222 1x+3.878 9,線性相關系數為R2=0.996 9。以10倍信噪比確定定量限,得到7S(y=299.59x+3.771 2,R2=0.979 2)和11S(y=197.08x+4.148 5,R2=0.986 1)純度分析標準曲線方程。最后根據分子質量和純度分析的標準曲線方程計算大豆7S和11S球蛋白的分子質量和純度。將所提純的7S和11S樣品的分子質量與7S和11S標品特征峰分子質量進行比對,表明所提純樣品為7S和11S。本試驗所制得7S和11S的純度分別達到86.3%和92.0%。
高效排阻液相色譜 大豆7S和11S球蛋白 分子質量 純度
大豆蛋白根據生理功能,可分為貯藏蛋白和生物活性蛋白兩大類。貯藏蛋白約占蛋白質的75%左右,大豆7S球蛋白(β-伴大豆球蛋白,7S)和大豆11S球蛋白(11S)占大豆貯藏蛋白的80%多,它們與大豆制品的加工性質關系比較密切[1-4]。因此,為了研究大豆7S和11S球蛋白的性質及其在食品加工中的應用,需對其進行分離提純。近年來,國內外有關大豆7S和11S球蛋白分離純化的研究較多[5-15]。這些研究大多針對大豆7S和11S組分的得率、蛋白質含量,而對于最終樣品的純度、分子質量鑒定較少,或只采用SDS-PAGE電泳法進行鑒定。
蛋白質的定量鑒定方法很多,如SDS-PAGE電泳法、等電聚焦電泳法、N-末端氨基酸殘基分析、高效液相法等。由于蛋白質數量多,性質相似者在所難免,一個條件下兩個蛋白質不能分開的可能性是很大的,選用任何一種鑒定方法都不能完全確定蛋白質的純度,必須同時采用2~3種不同的純度鑒定法才能確定[16]。高效排阻液相色譜(size exclusion-high-performance liquid chromatography, SE-HPLC)是定性和定量分析貯藏蛋白的有效方法,通過對蛋白質進行SE-HPLC分析,可以定量蛋白質的分子質量分布及純度,且檢測靈敏度高、速度快[17-18]。其測定提取蛋白的原理是通過樣品色譜柱中的固定相,把樣品溶在流動相里,經過色譜柱,樣品會在流動相與固定相之間徘徊,不同性質貯藏蛋白,在各相中停留的時間比例也不同,就造成速度不同,最后到達檢測器的時間就不同,在顯示器上的圖形就會出峰,實現分離[19-21]。
本研究采用SE-HPLC法定量分析大豆7S和11S球蛋白的分子質量和純度,對于大豆7S和11S球蛋白提取中的定量鑒定有參考價值。
1 材料與方法
1.1 試驗材料
脫脂豆粉(TSF),蛋白質質量分數54.2%:鄭州同創益生食品有限公司;SDS:天津市光復精密化工;鹽酸:洛陽市昊華公司;三氨基甲烷(Tris):上海市山浦化工有限公司;甘氨酸(氨基乙酸):天津市科密歐化學試劑有限公司;AP(過硫酸銨):洛陽市化學試劑廠;15~600 Ku 蛋白標品(808541,色譜級)、大豆7S球蛋白標品(C5868,色譜級)、大豆11S球蛋白標品(G3171,色譜級):Sigma公司;其他化學試劑(分析純):鄭州新風化學試劑有限公司。
1.2 主要儀器
D-37520真空冷凍干燥機:德國Kendro公司;2300K全自動凱氏定氮儀:瑞典FOSS TECATOR公司;HMS-3C型精密酸度計:臺州市新恩精密糧儀器有限公司;D-37520型高速冷凍離心機:德國Kendro公司;2300K全自動凱氏定氮儀:瑞典FOSS TECATOR公司; 1200高效液相色譜儀:安捷倫科技有限公司(中國);SEC G4000SW高效排阻液相色譜柱:日本TSK公司。
1.3 試驗方法
1.3.1 大豆7S和11S球蛋白的提取
大豆7S和11S球蛋白的提取方法參照文獻[22]。
1.3.2 高效排阻液相色譜(SE-HPLC)法分析條件的優化
采用SE-HPLC,用 TSK SEC 4000 柱對標準蛋白進行分離。洗脫液為色譜純乙腈和水(含0.05%三氟乙酸)(V/V),采樣時間為18 min。在214 nm的波長下進行蛋白質的檢測。標準蛋白的分子質量(ku)為:核糖核酸酶A(13.7)、卵清蛋白(44.3)、醛縮酶(150)和甲狀腺球蛋白(670)。每個樣品平行測量3次。所有待測樣溶液進行SE-HPLC分析前,需經過0.45 μm的PVDF過濾器過濾。
1.3.2.1 洗脫液(水/乙腈)比例的優化
開始采樣后,控制流速1.0 mL/min,進樣量15 μL,洗脫液水/乙腈分別為60/40、68/32、70/30、72/28和80/20進行試驗。每個條件平行測量3次。采集數據,進行分析和對比,確定洗脫液(水/乙腈)的比例。
1.3.2.2 洗脫液流速的優化
開始采樣后,將條件設置為:進樣量15 μL,洗脫液(水/乙腈)70/30,流速分別為0.7、0.8、0.9、1.0、1.1、1.2 mL/min,進行試驗。每個條件平行測量3次。采樣分析,進行分析和對比,確定最佳流速。
1.3.2.3 進樣量的優化
開始采樣后,將條件設置為:流速1.0 mL/min,洗脫液(水/乙腈)70/30,進樣量分別為10、15、20 μL,進行試驗。每個條件平行測量3次。采樣分析,進行分析和對比,確定最佳進樣量。
1.3.3 SE-HPLC法定量分析大豆7S和11S球蛋白的分子質量
1.3.3.1 大豆7S和11S球蛋白分子質量分析標準曲線的繪制
取1.3.2中蛋白標準品,根據1.3.2的優化結果,設置SE-HPLC分離條件。采集分析,對SE-HPLC分離條件優化效果進行驗證。并繪制標準蛋白分子質量對數與保留時間的線性擬合圖。
1.3.3.2 大豆7S和11S球蛋白分子質量的分析
準確稱取提純后的7S和11S 20.0 mg(精確到0.1 mg),置于50 mL容量瓶中,用色譜純水溶解、定容,配制成質量濃度為400 μg/mL的待測樣溶液。根據1.3.2的優化結果,設置SE-HPLC分離條件,采集分析。得到7S和11S的SE-HPLC色譜圖,根據1.3.3.1中的標準曲線,對7S和11S的分子質量進行分析。
1.3.4 SE-HPLC法定量分析大豆7S和11S球蛋白的純度
1.3.4.1 大豆7S和11S球蛋白標準工作溶液配制
7S和11S標準工作溶液:準確稱取5.0 mg(精確到0.1 mg)標準品,置于不同的10 mL容量瓶中,用色譜純水溶解、定容,配制成質量濃度為500μg/mL的標準工作溶液;準確移取0.04、0.1、0.2、0.4 mL 7S或11S標準工作溶液,分別加入0.96、0.9、0.8、0.6 mL色譜純水,即得濃度分別為20、50、100、200 μg/mL的系列標準工作溶液。
1.3.4.2 大豆7S和11S球蛋白純度分析標準曲線的繪制
取1.3.4.1中質量濃度分別為20、50、100、200、500 μg/mL的系列7S和11S標準工作溶液,根據1.3.2中的優化結果,設置SE-HPLC分離條件,采集分析。得到標準蛋白濃度與峰面積的線性擬合曲線方程。
1.3.4.3 大豆7S和11S球蛋白純度的分析
準確稱取提純后的7S和11S 20.0 mg(精確到0.1 mg),置于50 mL容量瓶中,用色譜純水溶解、定容,配制成質量濃度為400 μg/mL的待測樣溶液。根據1.3.2中的優化結果,設置SE-HPLC分離條件,采集分析。得到7S和11S的SE-HPLC色譜圖,對色譜圖中7S和11S峰面積進行積分,根據1.3.4.2中的標準曲線方程,對7S和11S的純度進行定量。
1.3.5 統計分析
利用 GraphPad Prism 5和Origin 8.5軟件作圖,采用 SASV 8 分析系統對數據進行統計分析。
2 結果與討論
2.1 SE-HPLC分析條件的優化
2.1.1 洗脫液(水/乙腈)比例的優化
水/乙腈分別為60/40、68/32、70/30、72/28、80/20的SE-HPLC色譜圖見圖1。
由圖1a可知,當水/乙腈為60/40時,4種蛋白,核糖核酸酶A(13.7)、卵清蛋白(44.3)、醛縮酶(150)和甲狀腺球蛋白(670)中,僅3種組分有明顯的出峰。色譜峰從左向右依次為醛縮酶(150)、卵清蛋白(44.3)、核糖核酸酶A(13.7)。而分子質量較大的甲狀腺球蛋白(670)雖有出峰趨勢,但不明顯。當水/乙腈為70/30時(圖1c),4種組分均獲得了良好的分離效果。然而,當水/乙腈為72/28、80/20時(圖1d、e),分子質量較大的組分的出峰不明顯。
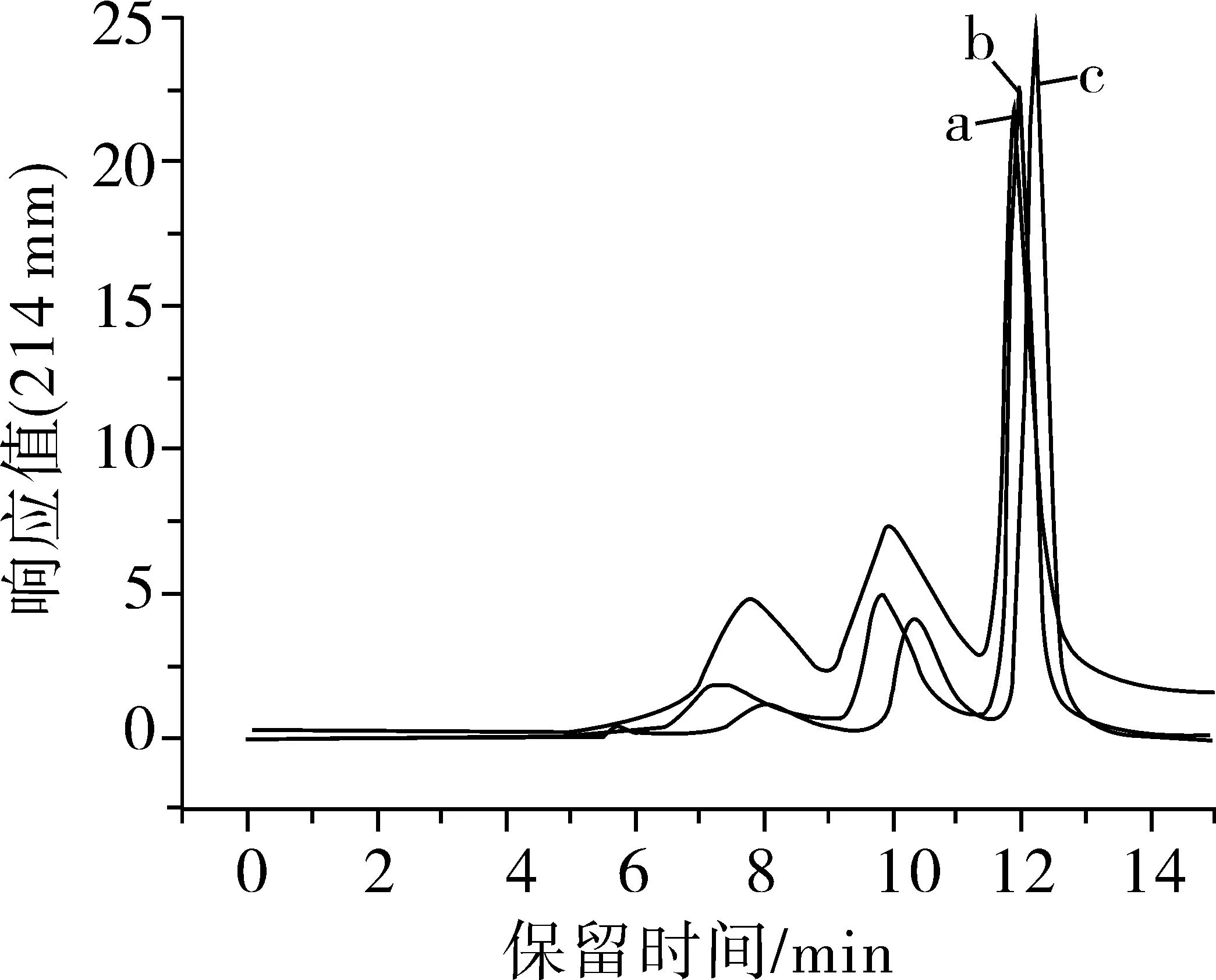
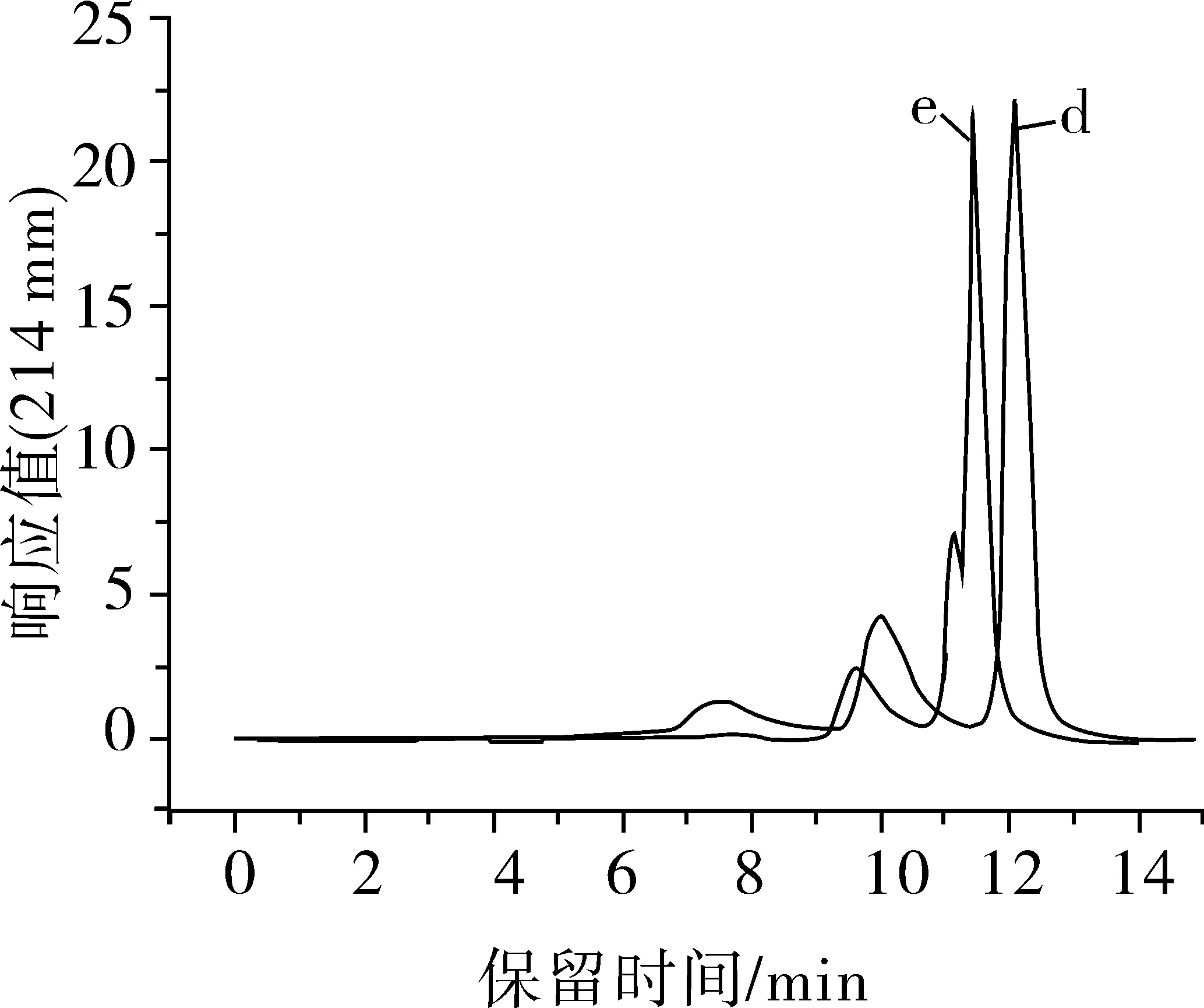
圖1 不同水/乙腈的SE-HPLC色譜圖
因此可知,隨著水/乙腈混合溶液中水分比例的增大,液相色譜對4種蛋白組分的分離效果也呈現先增加后降低的趨勢。這是因為蛋白質是生物大分子,有親水基團和疏水基團組成,具有一定的極性,水/乙腈不同,洗脫液極性不同,只有合適的洗脫液極性才有利于蛋白質在液相中的分離。當洗脫液水/乙腈為70/30時,分離效果較好,4種組分都出現在色譜圖中,得到有效的分離,峰型也較好。因此在后續試驗中選擇洗脫液水/乙腈為70/30。
2.1.2 進樣量的優化
進樣量分別為10、15、20 μL的SE-HPLC色譜圖見圖2。隨著進樣量的逐漸增大,洗脫峰的響應值在逐漸增加。當進樣量為10 μL時,得到SE-HPLC色譜圖峰型較好,響應值也適中。當進樣量繼續增大到為15、20 μL時,得到SE-HPLC色譜圖反而峰型不好,峰的分離度也受到一定的影響,另外,進樣量大也對標品造成浪費,增加試驗的成本。響應值太低影響峰的觀察,也難以區分樣品峰和含有微量雜質的雜質峰。因此本試驗確定的最佳進樣量為10 μL。
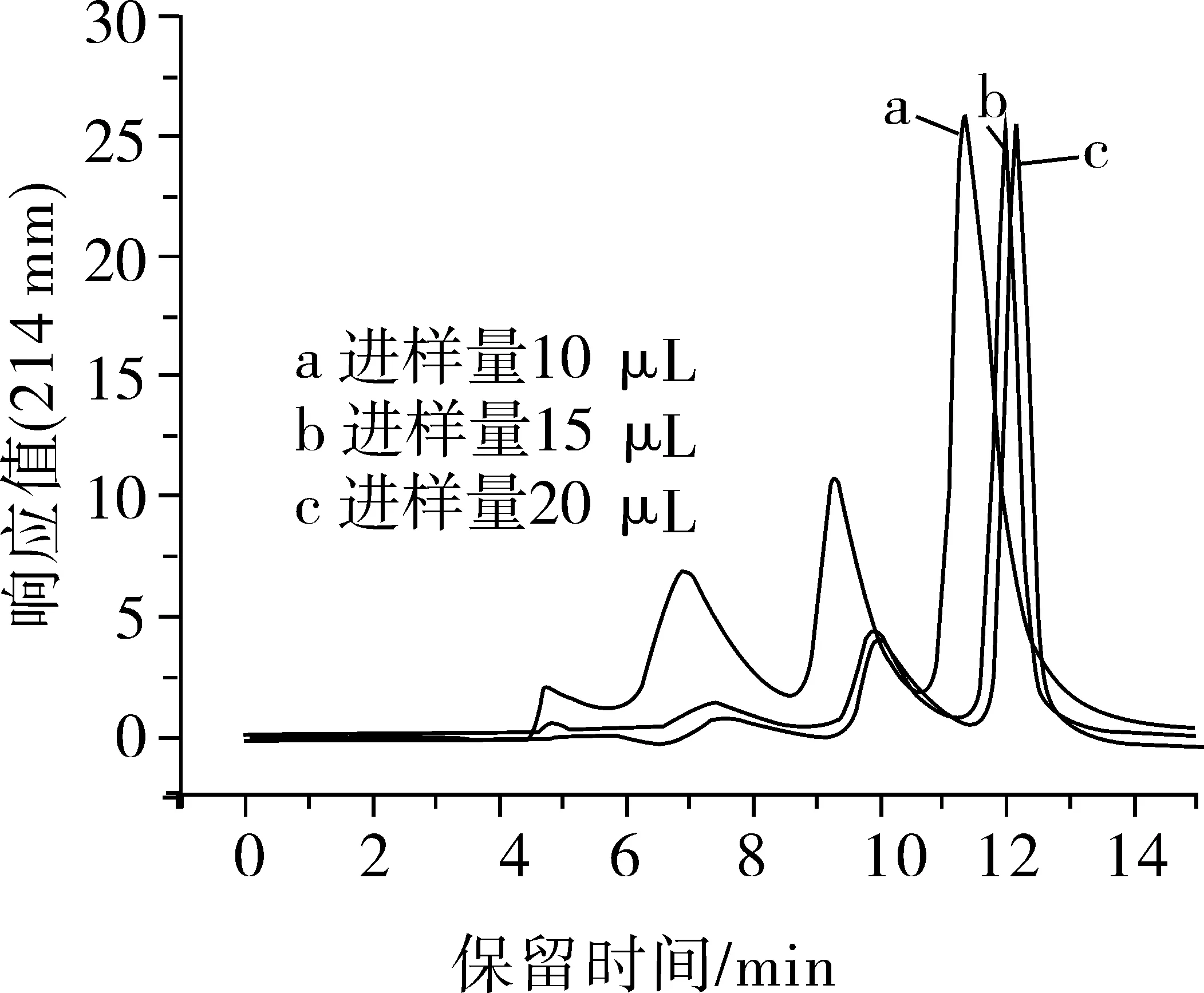
圖2 不同進樣量的SE-HPLC色譜圖
2.1.3 洗脫液流速的優化
圖3是洗脫液流速分別為0.8、0.9、1.0、1.1、1.2 mL/min的SE-HPLC色譜圖。由圖3可知,隨著洗脫液流速的逐漸增大,洗脫峰出來的時間在逐漸縮短。洗脫液流速過小,峰的保留時間就大,增加檢測時間。洗脫液流速過大,峰的保留時間就小,影響峰的分離效果。本試驗所選的幾個洗脫液流速對峰型的影響不大。隨著洗脫液流速的逐漸增大,離縱軸最近的峰的峰型也有微量的變化。綜合分析,選取洗脫液流速為1.0 mL/min。
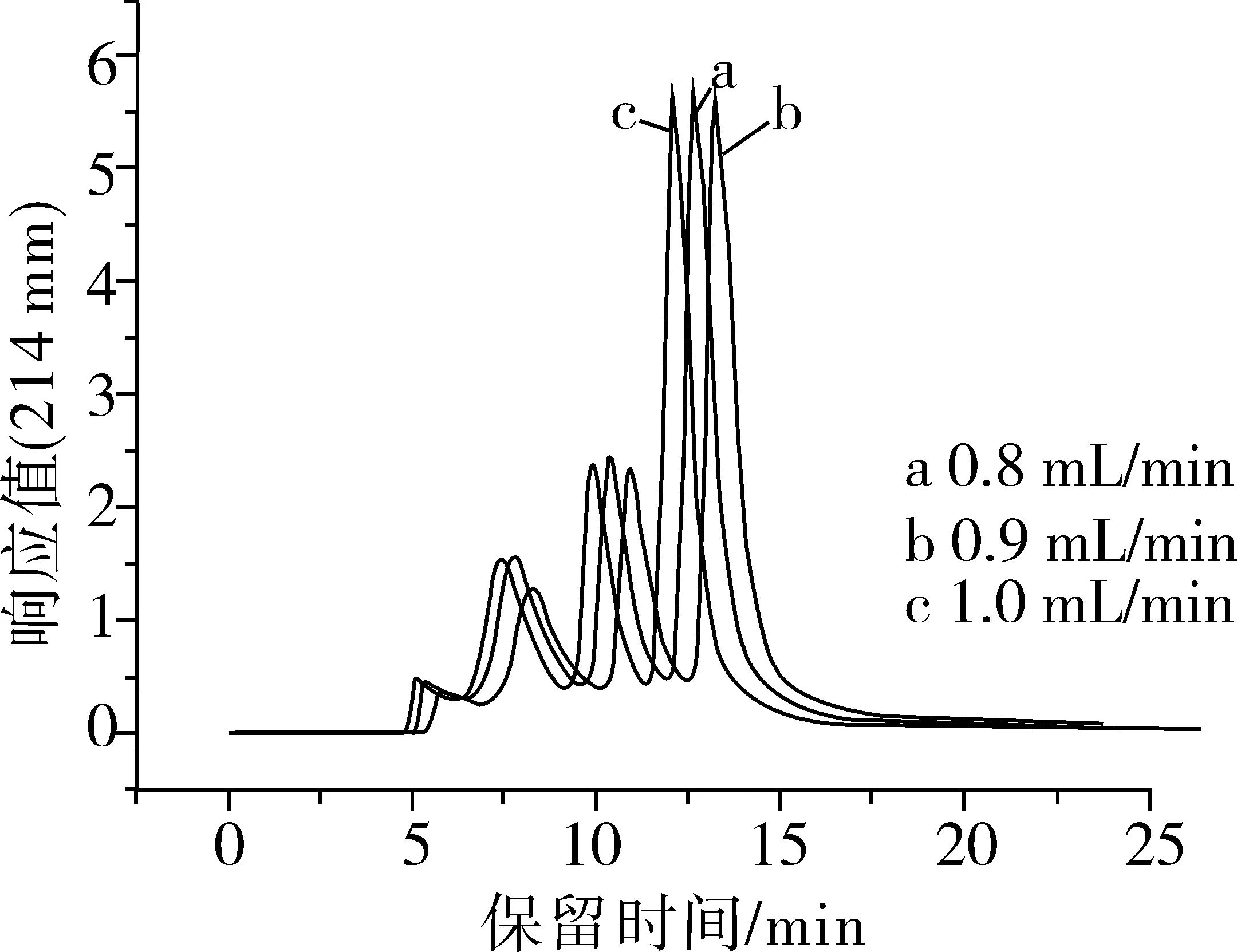

圖3 不同洗脫液流速的SE-HPLC色譜圖
因此,最佳的SE-HPLC色譜條件為:洗脫液(水/乙腈)70/30,洗脫液流速1.0 mL/min,進樣量為10 μL。
2.1.4 驗證試驗
按照上述最佳SE-HPLC色譜條件進行采樣。標準蛋白的SE-HPLC色譜圖見圖4。
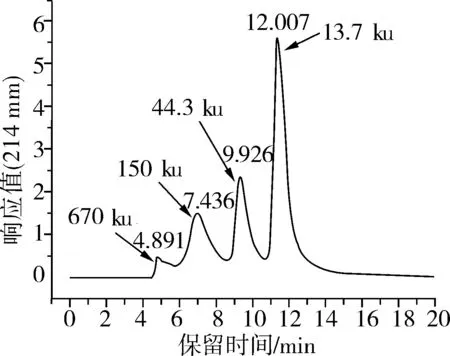
圖4 最優條件下的SE-HPLC色譜圖
由圖4可以看出,在優化的SE-HPLC色譜條件下,標品得到很好的分離,峰型較好,采樣時間適中,重復試驗表明該條件下進樣得到的SE-HPLC色譜圖重復性很好。可以在此優化條件下對樣品進行分子質量及純度的鑒定。
2.2 SE-HPLC法定量分析大豆7S和11S球蛋白的分子質量
2.2.1 分析大豆7S和11S球蛋白分子質量的標準曲線方程
根據圖4最優條件下的SE-HPLC色譜圖中標準蛋白的保留時間,繪制標準蛋白分子質量對數與出峰保留時間做線性擬合圖,得到標準蛋白分子質量對數與出峰保留時間的線性擬和方程Log (M)=-0.222 1x+3.878 9,相關系數為R2=0.996 9。
2.2.2 大豆7S和11S球蛋白分子質量分析
在以上試驗得到的最佳SE-HPLC色譜條件下,對7S和11S標品及提純樣品進行采樣。得到7S和11S標品及提純樣品的SE-HPLC色譜圖,結果見圖5。由圖5a可以看出,11S標品出現2個峰,7S標品出現1個峰,從出峰個數上可以看出7S標品的純度較高一些,這與標品說明書介紹的純度相一致。7S和11S是大豆蛋白的2個主要組分。11S的酸性亞基和一個基礎的肽通過二硫鍵連接在一起,11S的分子質量約為360 000 Ku,約占大豆蛋白總量25%~35%,由6個不同的亞單位(多肽)組成的非糖蛋白,每個亞單位分別由1個酸性亞基和1個堿性亞基B通過二硫鍵連接而成。7S的分子質量約為180 000 Ku,由 α、α’ 和 β亞基組成,約占大豆蛋白30%~35%[4, 14]。將7S和11S標品的SE-HPLC色譜圖中出峰的保留時間代入蛋白分子質量對數及出峰的保留時間的線性擬合方程,Log (M)=-0.222 1x+3.878 9,得到7S和11S的分子質量與上述一致。
圖5b為所提純的7S和11S樣品的SE-HPLC色譜圖,7S和11S的SE-HPLC色譜圖中最大的峰與7S和11S標品特征峰出峰時間一致,表明所提純樣品為7S和11S。

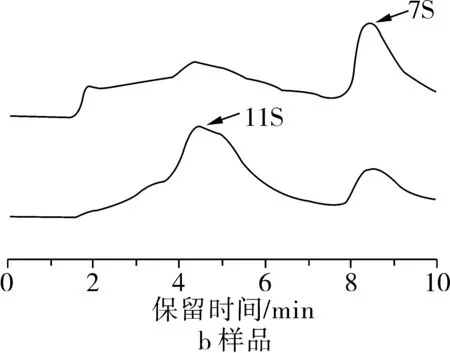
圖5 7S和11S標品、樣品的SE-HPLC色譜圖
2.3 SE-HPLC法定量分析大豆7S和11S球蛋白的純度
按1.3.4的方法進行試驗,以10倍信噪比確定定量限,得到7S和11S純度分析標準曲線方程,結果見表1。7S和11S均具有良好的線性關系(R2>0.970 0),說明用該標準曲線方程分析結果具有可靠性,可用于實際樣品的分析。按1.3.4.3的方法進行試驗,將得到峰面積帶入表1中的線性方程求得7S和11S的含量(相對于7S和11S標品),進而求得7S和11S的純度。本試驗所制得7S和11S的純度分別達到86.3%和92.0%。
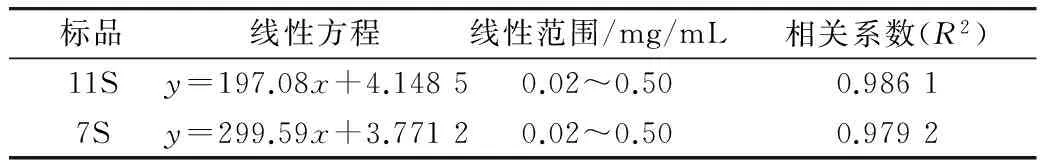
表1 7S和11S含量分析的線性方程、線性范圍、相關系數
3 結論
本研究采用SE-HPLC法定量分析大豆7S和11S球蛋白的分子質量和純度,提供了一種快速鑒定大豆7S和11S球蛋白分子質量和純度的方法,對SE-HPLC的色譜條件進行優化,結果表明最佳的SE-HPLC色譜條件是:洗脫液(水/乙腈)70/30,洗脫液流速1.0 mL/min,進樣量10 μL。采用SE-HPLC法分析7S和11S的分子質量,分子質量標準曲線方程為Log (M)=-0.222 1x+3.878 9,線性相關系數為R2=0.996 9。將所提純的7S和11S樣品的分子質量與7S和11S標品特征峰分子質量進行比對,表明所提純樣品為7S和11S。根據優化的色譜條件對7S和11S標品進行采樣,以10倍信噪比確定定量限,得到7S(y=299.59x+3.771 2,R2=0.979 2)和11S(y=197.08x+4.148 5,R2=0.986 1)純度分析標準曲線方程,該標準曲線方程可以用于7S和11S純度的分析。本試驗所制得7S和11S的純度分別達到86.3%和92.0%。
[1]Nishinari K, Fang Y, Guo S, et al. Soy proteins: A review on composition, aggregation and emulsification[J]. Food Hydrocolloids, 2014 (39): 301-318
[2]Klein B P, Perry A K, Adair N. Incorporating soy proteins into baked products for use in clinical studies[J]. The Journal of Nutrition, 1995, 125(3 Suppl): 666S-674S
[3]Leiner I E. Nutritional aspects of soy protein products[J]. Journal of The American Oil Chemists’ Society, 1977, 54(6): 454A-472A
[4]Delwiche S R, Pordesimo L O, Panthee D R, et al. Assessing glycinin (11S) and beta-conglycinin (7S) fractions of soybean storage protein by near-infrared spectroscopy[J]. Journal of The American Oil Chemists, Society, 2007, 84(12): 1107-1115
[5]李成賢. 大豆球蛋白、β-伴球蛋白的分離提取及對豬外周血淋巴細胞增殖和免疫功能的影響[D].成都:四川農業大學, 2007 Li C X. Isolation and extraction of glycinin and β-conglycinin and the influence of the extract on the proliferation and immune function of weaning young pigs peripheral bloodLymphocytomacells in vitro culture[D]. Chengdu: Sichuan Agricultural University, 2007
[6]徐君. 大豆球蛋白和β-伴球蛋白對小鼠腸上皮細胞營養生理功能的影響與分子機理研究[D]. 成都:四川農業大學, 2009 Xu J. The Influence of the extracted soybean glycinin and β-conglycinin on the function and molecular mechanism of miceintestinal-epithelial cells in primary cultivation[D]. Chengdu: Sichuan Agricultural University, 2009
[7]宋佳, 陳野, 鄭曉晨, 等. 大豆11S和7S球蛋白提取工藝優化研究[J]. 食品研究與開發, 2013, 2: 77-81 Song J, Chen Y, Zheng X C, et al.Study on extraction process optimization of soybean 11S and 7S globulin[J]. Food Research and Development, 2013, 2: 77-81
[8]黃行健. 酶解大豆蛋白功能特性、結構及在肉糜中的應用[D]. 武漢: 華中農業大學, 2010 Huang X J. Function character and strueture of hydrolyzed protein and application in pork paste[D]. Wuhan: Huazhong Agricultural University, 2010
[9]張明成. 大豆蛋白中7S與11S組分的分離方法[J]. 綏化學院學報, 2014, 5: 150-153 Zhang M C. Separation method of 7S and 11S from soy protein[J]. Journal of Suihua University, 2014, 5: 150-153
[10]Teng Z, Liu C, Yang X Q, et al. Fractionation of soybean globulins using Ca2+and Mg2+: A comparative analysis[J]. Journal of The American Oil Chemists’ Society, 2009, 86(5): 409-417
[11]Arone A G, Fasolin L H, Perrechil F D A, et al. Influence of drying conditions on the gelling properties of the 7S and 11S soy protein fractions[J]. Food and Bioproducts Processing, 2013, 91(2): 111-120
[12]Deng K Q, Huang Y R, Hua Y F. Isolation of glycinin (11S) from lipid-reduced soybean flour: effect of processing conditions on yields and purity[J]. Molecules, 2012, 17(3): 2968-2979
[13]Liu C, Wang H, Cui Z, et al. Optimization of extraction and isolation for 11S and 7S globulins of soybean seed storage protein[J]. Food Chemistry, 2007, 102(4): 1310-1316[14]Zhao X, Chen F, Xue W, et al. FTIR spectra studies on the secondary structures of 7S or 11S globulins from soybean proteins using AOT reverse micellar extraction[J]. Food Hydrocolloids, 2008, 22(4): 568-575
[15]朱曉燁, 遲玉杰, 劉紅玉. 大豆蛋白7S和11S組分分離方法的優化[J]. 食品工業科技, 2011(7): 267-269, 273 Zhu X Y, Chi Y J, Liu H Y. Optimization of separation method of 7S and 11S in soy protein[J]. Science and Technology of Food Industry, 2011, 7: 267-269, 273
[16]田琨. 大豆蛋白的結構表征及應用研究[D]. 上海: 復旦大學, 2010 Tian K. Structure characterization and applieation of soy protein [D]. Shanghai: Fudan University, 2010
[17]Oszvald M, Tomoskozi S, Larroque O, et al. Characterization of rice storage proteins by SE-HPLC and micro z-arm mixer[J]. Journal of Cereal Science, 2008, 48(1): 68-76[18]李永紅, 裴德寧, 陶磊, 等. 重組人干擾素α2a成品中蛋白含量體積排阻高效液相色譜法的建立[J]. 中國生物制品學雜志, 2013, 8: 1175-1178 Li Y H, Pei D N, Tao L, et al. Development of size exclusion-high performance liquid chromatography method for determination of protein content in final product of recombinant human interferon α2a[J]. Chinese Journal of Biologicals, 2013, 8: 1175-1178
[19]Mu W M, Zhang D F, Xu L, et al. Activity assay of his-tagged E. coli DNA photolyase by RP-HPLC and SE-HPLC [J]. Journal of Biochemical and Biophysical Methods, 2005, 63(2): 111-124
[20]Nordqvist P, Johansson E, Khabbaz F, et al. Characterization of hydrolyzed or heat treated wheat gluten by SE-HPLC and C-13 NMR: Correlation with wood bonding performance[J]. Industrial Crops and Products, 2013(51): 51-61
[21]Tian Y Q, Li Y, Xu X M, et al. A novel size-exclusion high performance liquid chromatography (SE-HPLC) method for measuring degree of amylose retrogradation in rice starch[J]. Food Chemistry, 2010, 118(2): 445-448
[22]高雪麗, 陳復生, 張麗芬, 等. 大豆7S和11S球蛋白對面團特性及饅頭品質的影響[J]. 現代食品科技, 2014(10): 13-18 Gao X L, Chen F S, Zhang L F, et al. Effects of 7S and 11S soy protein on the qualities of dough and chinese steamed bread[J]. Modern Food Science and Technology, 2014(10): 13-18.
Molecular Weight and Purity of Soy 7S, 11S Globulin Analyzed by Size Exclusion-High-Performance Liquid Chromatography
Gao Xueli1,2,3Chen Fusheng1Zhang Lifen1Guo Xingfeng1Fan Mingtao3
(College of Food Science and Technology,Henan University of Technology1, Zhengzhou 450001) (College of Food Science, Xuchang University2, Xuchang 461000) (College of Food Science, Northwest A&F University3, Yangling 712100)
In this paper, the molecular weight and purity of soy 7S, 11S globulin were quantificationally analyzed by SE-HPLC. Firstly, the optimization of the SE-HPLC chromatographic conditions were carried out, and the optimal SE-HPLC chromatographic conditions were: eluant (water/acetonitrile) 70/30, flow rate of eluant 1.0 mL/min, sample size 10 μL. Secondly, the standard curve of molecular weight analysis was drawn, and the standard curve equation of molecular weight was Log (M)=-0.222 1x+3.878 9, and the linear correlation coefficient wasR2=0.996 9. With the 10 times signal-to-noise ratio quantitative limit, the standard curve equation of 7S molecular purity (y=299.59x+3.7712,R2=0.979 2) and 11S molecular purity (y=197.08x+4.1485,R2=0.986 1) were obtained. Finally, this study provided a quick identification method of the molecular weight and purity of soy 7S, 11S globulin. The purity of 7S or 11S was respectively 86.3% and 92.0%.
size exclusion-high-performance liquid chromatography, soy 7S and 11S globulin, molecular weight, purity
863計劃(2013AA102208-5),“十二五”國家科技支撐計劃(2014BAD04B10)
2015-07-18
高雪麗,女,1982年出生,博士,食品蛋白質資源開發及利用
陳復生,男,1963年出生,教授,食品蛋白質資源開發及利用 樊明濤,男,1963年出生,教授,生物技術、食品蛋白質資源開發及利用
TS21
A
1003-0174(2017)02-0098-06

