雞蛋溶血巴斯德菌藥敏試驗及氨基酸代謝研究
魏 超,周 虹,郭靈安,代曉航,劉 煒
(四川省農業科學院分析測試中心, 四川 成都 610066)
?
雞蛋溶血巴斯德菌藥敏試驗及氨基酸代謝研究
魏 超,周 虹,郭靈安,代曉航,劉 煒
(四川省農業科學院分析測試中心, 四川 成都 610066)
【目的】探討雞蛋中溶血性微生物進來源及生物安全性。【方法】采用特異性培養基在雞蛋中分離一株溶血性微生物,對其進行生化鑒定、16SrDNA進行測序并聚類分析,采用7類9種抗生素抗性試驗對溶血微生物進行藥敏試驗,對其進行發酵底物蛋白質和游離氨基酸研究。【結果】生化鑒定與16rDNA鑒定分離的溶血性微生為溶血巴斯德菌,藥敏試驗結果表明氨基糖苷類抗生素對此菌有一定的抑制作用,但青霉素鈉、羅紅霉素和喹諾酮類抗生素環丙沙星對此菌無抑制效果,底物發酵實驗結果為溶血巴斯德菌的代謝對蛋白質總量影響不大,但可升高發酵培養基中部分游離氨基酸的含量。【結論】雞蛋中存在非常見致病微生物的污染,并且部分抗生素對致病微生物已無抑制作用,雞蛋中的微生物可以改變底物結構,相關部門應加強對新鮮雞蛋微生物污染的控制,關注罕見致病菌及條件致病菌引起的危害。
溶血巴斯德菌;16SrDNA;藥敏試驗;氨基酸及蛋白質代謝
【研究意義】在雞蛋存偶爾會爆發多種致病微生物的感染,為其食用安全埋下隱患,本實驗在雞蛋中發現溶血性微生物,對其進行鑒定、耐藥試驗和代謝分析旨在對其安全食用及衛生防控提供依據。【前人研究進展】溶血巴斯德桿菌(Pasteurellahaemolytica)屬于巴斯德菌屬(Pasteurella) ,是一種革蘭氏陰性,無動力,無芽孢的短桿或球桿菌,是存在于牛、綿羊、山羊等反芻動物以及其他多種動物上呼吸道的常在菌和機會致病菌[1-2]。由巴斯德氏菌屬引起的感染性疾病中,以出血敗血性巴斯德氏菌所致者較多見,溶血性巴斯德氏菌和其他巴斯德氏菌很少引起人類疾病,但溶血性巴斯德氏菌感染人體后癥狀大多表現較重[3-5]。我國已報道多例雞、鴨、鵝等家禽感染此菌患病的案例[6-8],但在蛋中檢測出溶血巴斯德桿菌還未有報道。【本研究切入點】本實驗在雞蛋中分離一株溶血巴斯德桿菌,經生化鑒定為溶血曼海姆菌或溶血巴斯德菌,對此株微生物進行16SrDNA進行測序并聚類分析,此菌與巴斯德菌同源性為100 %與曼海姆菌同源性為94 %,因而判定為溶血巴斯德菌,對其進行藥敏試驗和氨基酸變化分析,為研究微生物的耐藥性和生物代謝提供理論依據。【擬解決的關鍵問題】對雞蛋中溶血性微生物的研究旨在研究微生物對雞蛋食用安全及后游產業的影響,其結果將為該類條件致病菌的研究提供一定的科學依據。
1 材料與方法
1.1 材料與試劑
1.1.1 材料 雞蛋(成都市某超市)。
1.1.2 儀器與試劑 微生物生化鑒定:法國生物梅里埃公ATB細菌鑒定儀,試劑條ID 32 E,微生物培養純化所用培養基為廣東環凱。
抗生素藥敏片:氯霉素,復方新諾明,羅紅霉素,鏈霉素,環丙沙星,慶大霉素,卡那霉素青霉素,土霉素,氯霉素,復方新諾明,慶大霉素,卡那霉素(Oxoid公司,Ф6mm)
蛋白質測定采用kjetltec 2400全自動凱氏定氮儀。氨基酸測定采用S433D氨基酸分析儀德國sykam(賽卡姆)。
分子生物學鑒定試劑 MasterMix 購于成都博瑞克生物技術有限公司; 引物為微生物16SrDNA通用引物27f,1492r 由上海英駿生物技術公司合成,測序為上海立菲生物技術有限公司。
1.2 分離鑒定
雞蛋樣品均質后,取25 g于無菌均質袋中,加入225 mL緩沖蛋白質水,拍擊30 min ,36 ℃培養18 h,增菌液劃線血平板36 ℃培養24 h,培養基觀察菌落特征。
對典型溶血微生物血平板進行純化擴菌,挑取血平板上純化菌落至比濁管,振蕩分散,調至0.5麥氏濁度,裝填ID 32 E試劑條,由ATB系統自動檢測、數據分析并給出最終結果。
1.3 微生物的分子鑒定
采用25 μl反應體系, 反應體系為MasterMix 12.5 μl; 27f和1492r 引物各1 μl、模板DNA 1 μl、加ddH2O 至25 μl。反應條件為: 預變性95 ℃ 5 m in;94 ℃ 30 s、60 ℃ 30 s、72 ℃ 30 s,共進行35個循環;72 ℃ 7 min。電泳結果進行分析,PCR產物直接測序,測序結果采用DNAMAN,MEGA6.0軟件進行處理分析。
1.4 抗生素抗性試驗
純菌菌落在生理鹽水中制成0.5個麥氏混懸液,取1 mL于空白培養皿中,傾注15 g營養瓊脂進行混菌,待培養基凝固后用藥敏紙貼于培養基表面,(36±1) ℃倒置培養24~48 h。
1.5 發酵液蛋白質及氨基酸含量的測定
純菌菌落在生理鹽水中制成0.5個麥氏混懸液,分別取1 mL接種于培養基BHI和5 %雞蛋液的BHI培養基,36 ℃漩渦震蕩培養24 h。
稱取2.5 g發酵液于凱氏定氮儀測定含氮量,用公式蛋白質含量(g)=氮(g)×6.25計算發酵液中蛋白質的百分含量。
稱取發酵液1.0 g于磺基水楊酸沉淀蛋白質,發酵液經濾紙過濾后,水浴鍋上揮發為干物質,采用0.02 mol/mL鹽酸水溶液1 mL進行復溶解后進樣測定游離氨基酸含量,未接種培養基為空白對照。
2 結果與分析
2.1 菌落形態及生化鑒定
此株細菌在血平板上培養24 h后菌落特征為菌落淺灰色、光滑濕潤,有明顯β溶血圈,氧化酶試驗陽性;革蘭氏染色鏡檢結果為G-球桿菌。ATB生化鑒定分析結果見表1,其ID %為95.3,T值(表示其生化反應結果與該菌最典型生化譜的接近程度,ID值為待檢菌在整個數據庫中應屬于哪個分類單位)為0.58,判定為溶血滿海姆菌或溶血巴斯德菌,評語為好的鑒定。
2.2 分子鑒定
由于微生物生化全自動鑒定系統給此株微生物雙結果鑒定,所以利用微生物16SrDNA鑒定方法對此株微生物進行輔助鑒定,采用通用引物27f(5-AGAGTTTGATCCTGGCTCAG-3)和1492r(5-TACGGCTACCTTGTTACGACTT-3)對其16SrDNA進行擴增測序,其測序結果編號為W2014-7-1285,在GENEBANK上下載編號分別為:AY O78998.1、AY 362926.1、AY 507116.1、JF 706218.1、NR 024897.1、NR 024899.1、NR 1144448.1 3組曼海姆菌(Mannheimia)和4組巴斯德菌(Pasteurella)典型序列與其進行同源性聚類分析,分析圖譜見圖1,由圖1可以看出,分離微生物與巴斯德菌株同源性98 %~100 %,與曼海姆菌的同源性94 %~97 %,且巴斯德菌同屬不同種之間同源性較高,可以判定此株微生物為溶血性巴斯德菌。

表1 溶血巴斯德菌生化鑒定
注:“-”表示陰性,“+”表示陽性。
Note:‘-’means negative, ‘+’ means positive.
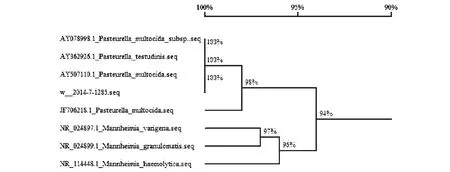
圖1 溶血巴斯德菌同源樹Fig.1 Homology tree of Pasteurella haemolytica
2.2 藥敏試驗
采用9種人用或獸用常見抗生素進行藥敏試驗,其中氨基糖甙類抗生素采用卡那霉素、鏈霉素、慶大霉素;β-內酰胺類抗生素采用青霉素鈉;大環內酯類抗生素采用羅紅霉素;磺胺類抗生素采用復方新諾明;四環素類抗生素采用土霉素;氯霉素類抗生素采用氯霉素,喹諾酮類抗生素采用環丙沙星。按照藥敏試驗抗性標準抑菌圈直徑(毫米)判定敏感度:0為不敏,10以下為低敏,10~14為中敏,15~20為高敏,20以上為極敏(表2)。β內酰胺類抗生素青霉素鈉、大環內酯類抗生素羅紅霉素、喹諾酮類抗生素環丙沙星對溶血巴斯德菌均無抑制作用,微生物對幾種氨基糖甙類抗生素極敏,對復方新諾明和氯霉素也表現極敏。
2.3 溶血巴斯德菌發酵液蛋白質及氨基酸代謝
蛋白質測定總含量(表3)略有降低但減低幅度不大,即微生物的發酵不會影響整體底物蛋白質的總含量。在蛋白質總含量差異不大的條件下進行游離氨基酸測定,添加蛋液和非添加蛋液的兩種發酵培養條件下游離氨基酸的含量普遍略有升高(圖2,表4),但其中精氨酸(ARG)和絲氨酸(SER)含量有所降低,對γ-氨基丁酸(γ-Aba)測定也出現發酵液中的含量降低,表明微生物發育過程中會利用培養基中的這3種氨基酸。溶血巴斯德菌會微量改變底物的物質結構,利用部分必須氨基供自身生長繁殖同時也釋放或改變一些氨基酸組份。
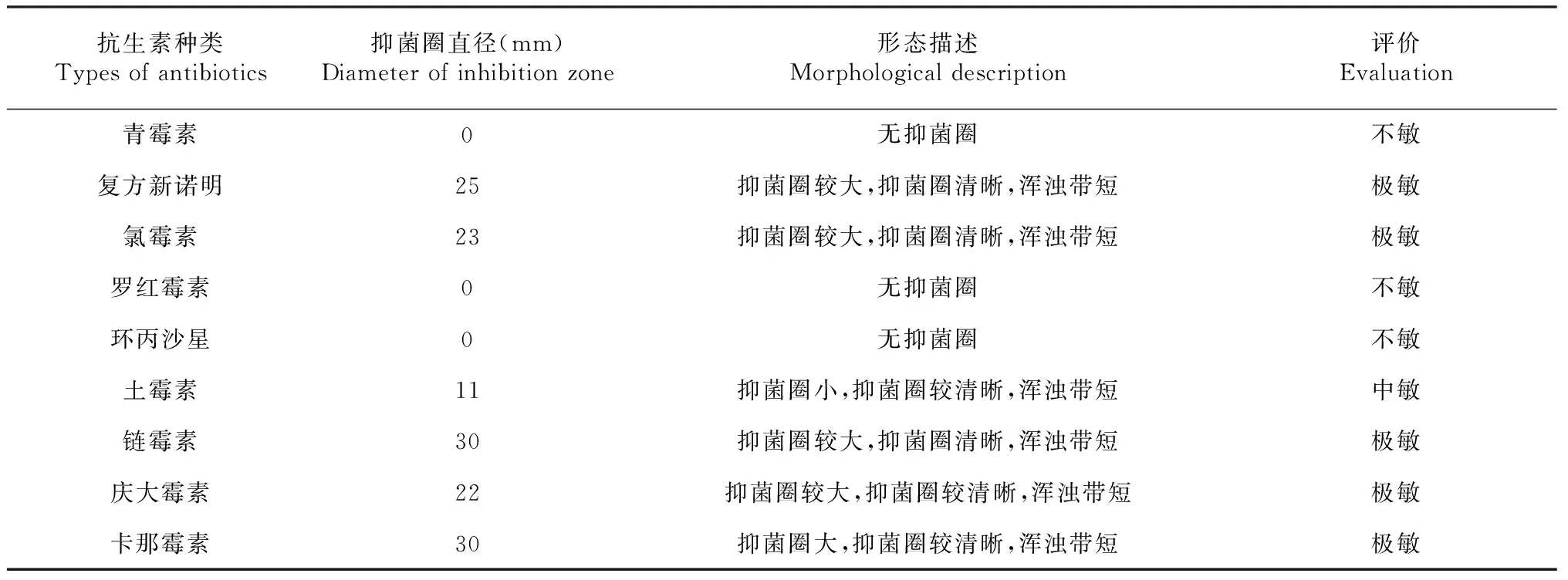
表2 溶血巴斯德菌藥敏試驗
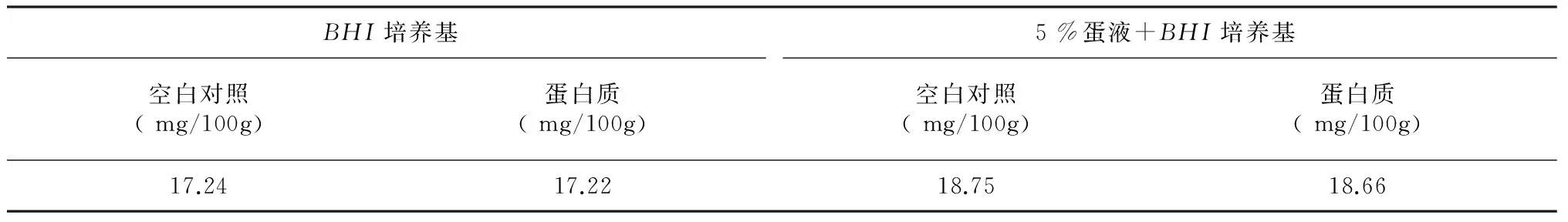
表3 溶血巴斯德菌發酵液蛋白質含量
3 討 論
3.1 溶血巴斯德菌的鑒定
本實驗生化檢測采用的是梅里埃的全自動鑒定系統,試劑條為ID 32E ,雖然進行了32個生化反應,且鑒定結果評價為好,但還是出現雙結果鑒定,由于溶血性曼氏桿菌和性巴氏桿菌在形態大小、染色特性等方面較相似,從而為這兩種細菌的準確鑒定造成不便。溶血巴斯德菌和溶血曼海姆菌都是牛羊等反芻動物致病菌之一,并且兩種菌經常同時侵染個體,兩者同時檢出并難以區別。本實驗對雞蛋中分離微生物進行16SrDNA測序,并與GENEBANK下載巴斯德菌和曼海姆菌進行同源分析,不同種巴斯德菌16SrDNA相對保守且與曼海姆菌16SrDNA有一定差異,可見分子生物學方法可以將2種不同屬微生物分開,建立一種可以同時快速、準確檢測和鑒定溶血性曼氏桿菌和溶血巴氏桿菌的方法具有重要的應用價值。
3.2 溶血巴斯德菌的致病性
從雞蛋中分離的溶血性巴斯德菌在血平板上有較明顯的β溶血現象,溶血性多為病原微生物所產生的毒素類物質而導致機體紅細胞及其他有核細胞裂解。巴斯德氏菌屬引起感染性疾病中,以出血敗血性巴斯德氏菌所致者較多見,溶血性巴斯德氏菌很少引起人類疾病,但溶血性巴斯德氏菌感染后癥狀大多表現較重。溶血巴斯德桿菌主要有4種毒力因子:菌毛、多糖莢膜、內毒素(LPS)及白細胞毒素(LKT),致毒因子的含量與比例也與培養基底物氨基酸含量有一定關系。藥敏試驗表明,此株溶血巴斯德菌對多種抗生素產生抗性,這與日常抗生素類藥物濫用不無關系。
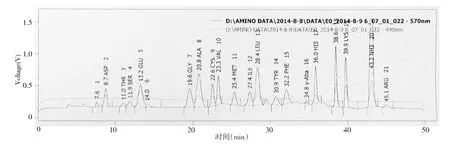
圖2 氨基酸分析圖譜Fig.2 AA analysis graph

氨基酸種類BHI培養基5%蛋液+BHI培養基游離氨基酸(mg/100g)游離氨基酸空白對照(mg/100g)游離氨基酸(mg/100g)游離氨基酸空白對照(mg/100g)ASP0.4080.3710.3400.333THR0.3000.2840.0610.304SER0.1230.3610.1040.106GLU0.7530.7040.7340.636GLY0.3540.3160.3450.309ALA0.5810.5600.7000.557CYS0.1770.1700.6290.141VAL0.3680.3630.4210.392MET0.3290.3050.3240.290ILE0.3040.2910.3250.317LEU0.9541.0020.8560.967TYR0.3200.3180.3300.299PHE0.4850.0220.5010.431HIS0.5370.5050.5790.616LYS0.7110.7300.7370.676ARG0.9681.0270.2700.861PRO0.00270.00240.1040.093合計7.6747.3317.3607.328γ-Aba0.0270.0210.0300.020
4 結 論
雞蛋中分離的溶血巴斯德菌有溶血性,且對多種抗生素耐藥,且可改變底物氨基酸組成結構對雞蛋的營養成分和生物安全埋下隱患。我國已報道多例雞、鴨、鵝等家禽感染此菌患病的案例,在雞蛋中還是首次檢出,在雞蛋的日常食用過程中,多以煎煮等加工熟食為主,但某些家庭喜好未完全煮熟的“糖心蛋”,這些為雞蛋的食用安全埋下隱患。因此,應加強對新鮮雞蛋微生物污染的控制,嚴格動物的飼養管理,除了檢測常規致病性微生物外,也應該多關注罕見致病菌及條件致病菌,為研究、發現及控制做好數據儲備工作。
[1]Hiraku Sasaki, Eiichi Kawamoto, et al. Comparative analysis of Pasteurella pneumotropica isolates from laboratory mice and rats[J]. Antonie van Leeuwenhoek,2009,95:311-317.
[2]蘇戰強,杜曉杰,姚 剛,等.牛源溶血性巴氏桿菌的分離鑒定.[J].中國畜牧獸醫,2013,40(5):58-60.
[3]S. M. Dabo, J. D. Taylor, A. W. Confer.Pasteurellamultocidaand bovine respiratory disease[J].Anim Health, 2007,8(2):129-150.
[4]F. Dziva, A P. Muhairwa, M. Bisgaard,et al. Diagnostic and typing options for investigating diseases associated withPasteurellamultocida[J].Vet Microbiol,2008,128(1-2):1-22.
[5]吳 彪,陳所賢.溶血巴斯德菌致敗血癥1例[J].中國熱帶醫學,2008,8(1):74-75.
[6]劉華英,俞純芳,呂壽英,等.雞溶血性巴氏桿菌的分離與鑒定[J].四川畜牧獸醫,1995(4):16-17.
[7]張華智,何秀苗.大腸桿菌與溶血性巴氏桿菌混合感染鴨的診治[J].廣西畜牧獸醫,2008,24 (4):214-215.
[8]相啟安, 孔慶東, 王忠杰. 一例鵝溶血性巴氏桿菌病的診治[J].中國畜禽種業,2012,12 :135.
(責任編輯 李 潔)
Study on Susceptibility Testing and Amino Acid Metabolism ofPasteurellahaemolyticain Eg
WEI Chao, ZHOU Hong, GUO Ling-an, DAI Xiao-hang, LIU Wei
(Analysis and Testing Center of Sichuan Academy of Agricultural Sciences, Sichuan Chengdu 610066,Chian)
【Objective】The study aims to explore the origin and biosafety of hemolytic microorganisms in eggs. 【Method】Isolated from the eggs by specific culture medium, a hemolytic microorganism was biochemically identified, and 16SrDNA sequencing and cluster analysis was also conducted on it. Resistance tests of seven kinds of and nine species of antibiotics were used to carry out the susceptibility testing of the hemolytic microorganism, and the proteins and free amino acids in the fermentation substrate were studied. 【Result】The isolated hemolytic microorganism was identified as Mannheimia haemolytica or Pasteurella haemolytica by biochemical identification and 16SrDNA identification. The results of susceptibility testing showed that except aminoglycosides, penicillin of β-lactams antibiotics, roxithromycin of macrolides antibiotics and Ciprofloxacin of 4-quinolones antibiotics had no inhibitory effect on the microorganism. The experimental results of fermentation substrate show that metabolism of hemolytic Pasteurella haemolytica has little effect on the total protein amount, however, it can increase the content of some free amino acids. 【Conclusion】There are non-common pathogenic microorganisms in the eggs, on which some antibiotics have no inhibitory effect and the microorganisms can change the structure of the substrate. Therefore, the relevant departments should strengthen the control of microbial contamination of fresh eggs and pay close attention to the hazards caused by non-common pathogenic microorganisms and conditional pathogenic microorganisms.
Pasteurellahaemolytica;16SrDNA;Susceptibility test; AA and protein metabolism
1001-4829(2017)6-1335-05
10.16213/j.cnki.scjas.2017.6.017
2016-06-13
國家農產品質量安全風險評估重大專項(GJFP201 601302)
魏 超(1985-),女,助理研究員,碩士研究生,主要從事食品農產品微生物檢測及相關風險評估,E-mail:cc123qqq@163.com。
S858.31
A

