抗吡蟲啉褐飛虱種群對天敵黑肩綠盲蝽抗性發(fā)展的影響
凌 炎,黃 芊,蔣顯斌,尹文兵,龍麗萍*,黃鳳寬,黃所生,吳碧球,李 成
(1.廣西農(nóng)業(yè)科學(xué)院植物保護(hù)研究所/廣西作物病蟲害生物學(xué)重點(diǎn)實驗室,廣西 南寧 530007;2.廣西農(nóng)業(yè)科學(xué)院水稻研究所,廣西 南寧 530007;3.廣東新景象生物工程有限公司,廣東 廣州 510635)
?
抗吡蟲啉褐飛虱種群對天敵黑肩綠盲蝽抗性發(fā)展的影響
凌 炎1,黃 芊2,蔣顯斌2,尹文兵3,龍麗萍2*,黃鳳寬1,黃所生1,吳碧球1,李 成1
(1.廣西農(nóng)業(yè)科學(xué)院植物保護(hù)研究所/廣西作物病蟲害生物學(xué)重點(diǎn)實驗室,廣西 南寧 530007;2.廣西農(nóng)業(yè)科學(xué)院水稻研究所,廣西 南寧 530007;3.廣東新景象生物工程有限公司,廣東 廣州 510635)
【目的】了解褐飛虱對吡蟲啉產(chǎn)生極高水平抗性后對其主要捕食性天敵黑肩綠盲蝽抗性發(fā)展的影響,為協(xié)調(diào)化學(xué)防治與生物防治的關(guān)系提供科學(xué)依據(jù)。【方法】分別用對吡蟲啉敏感的褐飛虱種群(SN種群)和極高抗種群(RN種群)連續(xù)飼養(yǎng)黑肩綠盲蝽25代以及用吡蟲啉對黑肩綠盲蝽連續(xù)誘導(dǎo)25代,每隔5代分別測定黑肩綠盲蝽的敏感性和酶活性。【結(jié)果】 SNCF25種群的敏感性變化不大;RNCF25種群的LC50值是原來的1.53倍;誘導(dǎo)(INCF25)種群LC50值是原來的1.66倍。SNC、RNC和INC的黑肩綠盲蝽種群F5、F10、F15、F20、F25代的酯酶和谷胱甘肽轉(zhuǎn)移酶活性變化與抗性倍數(shù)的變化不一致,而多功能氧化酶活性變化與抗性倍數(shù)的變化較一致。【結(jié)論】黑肩綠盲蝽對吡蟲啉的抗性發(fā)展較慢,其抗性發(fā)展與酯酶和谷胱甘肽轉(zhuǎn)移酶的活性變化無關(guān),與多功能氧化酶活性的變化成正相關(guān)。
吡蟲啉;褐飛虱;黑肩綠盲蝽;抗性發(fā)展
【研究意義】褐飛虱[Nilaparvatalugens(St?l)]在全世界分布廣泛,是水稻生產(chǎn)國的主要害蟲之一,具有遷飛性、暴發(fā)性和毀滅性等特點(diǎn)。在褐飛虱的綜合防控技術(shù)體系中,化學(xué)防治一直以來是控制褐飛虱的最有效途徑。由于化學(xué)農(nóng)藥的長期大量使用,許多國家和地區(qū)的褐飛虱均已對多種殺蟲劑產(chǎn)生了不同程度的抗性[1-2]。2005年中國褐飛虱大發(fā)生的主要原因之一就是褐飛虱對吡蟲啉產(chǎn)生了極高水平抗性。黑肩綠盲蝽[Cyrtorhinuslividipennis(Reuter)]是水稻產(chǎn)區(qū)褐飛虱、白背飛虱[Sogatellafurcifera(Horvath)]和黑尾葉蟬[Nephotettixnigropictus(St?l)]的重要捕食性天敵,主要捕食卵和低齡若蟲,在褐飛虱種群自然控制中起著非常重要的作用[3]。因此,了解褐飛虱對吡蟲啉產(chǎn)生極高水平抗性后,對其主要捕食性天敵黑肩綠盲蝽抗性發(fā)展的影響,對協(xié)調(diào)化學(xué)防治與生物防治的關(guān)系具有重要的意義。【前人研究進(jìn)展】昆蟲對殺蟲劑產(chǎn)生抗性后,其生理生化指標(biāo)也可能發(fā)生變化,從而影響寄主與其天敵內(nèi)分泌的相互關(guān)系,最終影響到寄生昆蟲對相應(yīng)藥劑的敏感性。李元喜研究表明寄主抗藥性對菜蛾絨繭蜂有不利影響,用抗性寄主飼育的菜蛾絨繭蜂在寄生敏感寄主時仍表現(xiàn)一定的耐藥性,有利于該蜂抗藥性的發(fā)展,即寄主-寄生蜂之間在抗藥性方面存在協(xié)同進(jìn)化[4]。Chilcutt在研究寄生抗Bt小菜蛾的菜蛾絨繭蜂的結(jié)繭率時發(fā)現(xiàn)類似現(xiàn)象,說明寄主抗藥性對寄生昆蟲的不利影響在其它殺蟲劑中也同樣存在;從進(jìn)化的角度來看,害蟲和天敵是一對斗爭的統(tǒng)一體,當(dāng)害蟲受殺蟲劑作用而產(chǎn)生抗性時,天敵也會對殺蟲劑產(chǎn)生抗性[5]。據(jù)初步統(tǒng)計,國內(nèi)外報道了至少44 種天敵對某一種或幾種殺蟲劑產(chǎn)生了抗藥性,其中18 種擬寄生昆蟲,12 種植綏螨,6 種草蛉,4 種瓢蟲,此外還有管巢蛛、姬螋、姬獵蝽、花蝽、癭蚊等[6]。Mason在研究寄生斑潛蠅(Liriomyzaspp.)的貝氏潛蠅姬小蜂(Diglyphusbegini)及Baker研究寄生米象(Sitophilusozyae)的米象金小蜂(Anisopteromaluscalandrae)時,發(fā)現(xiàn)寄生昆蟲的LC50值或抗性倍數(shù)比寄主的高[7-8]。這結(jié)果表明寄生昆蟲有可能比寄主具有更高的抗性。【本研究切入點(diǎn)】協(xié)調(diào)化學(xué)防治與生物防治的關(guān)系一直是害蟲綜合治理中的重要問題。針對如何合理利用天敵和化學(xué)殺蟲劑治理易對殺蟲劑產(chǎn)生抗性的害蟲已有一些研究[9-11],但有關(guān)昆蟲抗藥性對其天敵藥劑敏感性的影響研究甚少。【擬解決的關(guān)鍵問題】以極高抗吡蟲啉的褐飛虱種群和敏感種群為材料,研究抗吡蟲啉褐飛虱種群對其主要捕食性天敵黑肩綠盲蝽抗性發(fā)展的影響,為保護(hù)和利用黑肩綠盲蝽,協(xié)調(diào)化學(xué)防治與生物防治的關(guān)系提供科學(xué)依據(jù)。
1 材料與方法
1.1 試驗材料
1.1.1 供試水稻 供試水稻品種TN1來自國際水稻研究所,廣西農(nóng)業(yè)科學(xué)院植物保護(hù)研究所實驗室自留種。將TN1水稻種子催芽,播于網(wǎng)室的水泥槽內(nèi),30 d左右移栽于塑料盆(φ16 cm×14 cm)內(nèi),每盆約10 根苗。
1.1.2 供試?yán)ハx 褐飛虱抗性種群從田間采集并經(jīng)測定篩選獲得,對吡蟲啉抗性倍數(shù)達(dá)1000倍以上;敏感種群由浙江省農(nóng)業(yè)科學(xué)院植物保護(hù)與微生物研究所植保工程研究室提供,在不接觸任何藥劑的條件下一直用TN1水稻苗飼養(yǎng)繁殖而得;黑肩綠盲蝽從廣西農(nóng)業(yè)科學(xué)院植物保護(hù)研究所網(wǎng)室內(nèi)飼養(yǎng)褐飛虱敏感種群的養(yǎng)蟲籠內(nèi)采集。抗性和敏感褐飛虱種群均用分蘗期的TN1水稻品種飼養(yǎng)。
將分蘗期的盆栽苗去除黃葉和小的分蘗,并用自來水小心地將稻苗清洗干凈,每兩盆放于一個養(yǎng)蟲籠內(nèi),每個養(yǎng)蟲籠內(nèi)接足夠數(shù)量的產(chǎn)卵期褐飛虱雌成蟲(褐飛虱抗性種群RN和敏感種群SN分開,并做好標(biāo)記),每2 d將產(chǎn)卵蟲移到另外的養(yǎng)蟲籠產(chǎn)卵,得到的產(chǎn)卵苗用于飼養(yǎng)黑肩綠盲蝽,連續(xù)飼養(yǎng)25代。
1.1.3 供試藥劑 96.04 %吡蟲啉原粉:拜耳作物科學(xué)有限公司提供。
1.2 試驗方法
1.2.1 黑肩綠盲蝽對吡蟲啉的敏感性測定方法 采用藥膜法并加以改進(jìn)[12]。即在預(yù)備試驗的基礎(chǔ)上,用丙酮將殺蟲劑等比稀釋成4~6個濃度。在閃爍瓶(φ2.5 cm×5.5 cm)中加入0.5 mL藥液,每處理重復(fù)3次,以丙酮為對照。加好藥液后閃爍瓶平放在水平桌面上滾動,使閃爍瓶內(nèi)側(cè)形成均勻的藥膜。丙酮揮發(fā)后(2.5 h)每瓶接10頭3齡中期黑肩綠盲蝽,瓶子橫放,讓試蟲在藥膜上爬行3 h,然后轉(zhuǎn)入有孕穗期連根(用脫脂棉包住并加水保濕)稻莖(高約10 cm)的礦泉水瓶中(倒放),再接入20~30頭1~2齡褐飛虱若蟲作為食料。用海綿塞封住瓶口。最后將試蟲置于(26±1)℃,光照16 L/8 D的光照培養(yǎng)箱中,3 d后檢查死蟲數(shù)。
1.2.2 吡蟲啉抗性誘導(dǎo) 用上一代的LC50值處理試蟲,方法與藥劑敏感性測定相同,處理過的試蟲用敏感褐飛虱的卵飼養(yǎng)。
1.2.3 酶活性測定 ①酯酶活性測定:參照Han等[13]方法,取雌蟲1 頭,用 0.5 mL磷酸緩沖液(0.02 mol/L,pH=7.0)勻漿,然后在 4000 r·min-1,4 ℃下離心15 min,上清液為酯酶酶液,取100 μl酯酶酶液加到酶標(biāo)板孔中,然后再加入50 μl α-醋酸萘酯(2 mmol/L)和固藍(lán)RR鹽(1.5 mmol)混合液,在酶標(biāo)儀上 450 nm處測OD值。用α-萘酚作標(biāo)準(zhǔn)曲線,根據(jù)所測定的OD值,在標(biāo)準(zhǔn)曲線上計算產(chǎn)物生成量。各處理重復(fù)40次。②谷胱甘肽轉(zhuǎn)移酶活性測定:參照Kao等(1989)[14]方法,取5 頭雌蟲于0.4 mL磷酸緩沖液(0.1 mol/L,pH=8.0)中冰浴勻漿,10 000 r·min-1,4 ℃下離心10 min。以1,2-二氯-4-硝基苯(DCNB)作底物,3 mL反應(yīng)體系中含1 mmol/L還原型谷胱苷肽(GSH)和DCNB,0.1 mol/L磷酸緩沖液(pH=8.0),0.1 mL酶液。25 ℃反應(yīng) 5 min后,以磷酸緩沖液作為對照,于紫外可見分光光度計 344 nm處測定光密度值,每處理設(shè)3 次重復(fù)。③多功能氧化酶氧-脫甲基酶活性測定:參照Sang等(1984)[15]方法,取 15 頭雌蟲加1.5 mL磷酸緩沖液(0.1 mol/L,pH=7.8,含1 mmol/L α-苯基硫脲、α-苯基磺酰氟及EDTA,0.1 mmol/L,4-二硫蘇糖醇,10 %苷油)冰浴勻漿,10 000 r·min-1,4 ℃下離心 10 min,上清液作酶液用。取 1 mL磷酸緩沖液,1 mL酶液,0.01 mL對硝基苯甲醚(0.1 mol/L,用丙酮配制),2.5 mg NADPH,定容至 25 mL。置氣浴搖床中于 37 ℃搖晃反應(yīng) 30 min,加入 1 mL鹽酸溶液(1 mol/L)終止反應(yīng)。加 5 mL氯仿萃取,取 3 mL氯仿層與 3 mL NaOH溶液(0.5 mol/L)混合后,再取NaOH層于400 nm處測定光密度值。用對硝基苯酚制作標(biāo)準(zhǔn)曲線,每處理重復(fù)3次。④可溶性蛋白含量測定:參照Bradford[11],采用考馬斯亮藍(lán)G-250法測定,以牛血清蛋白(BSA)制作標(biāo)準(zhǔn)曲線。
2 結(jié)果與分析
2.1 不同黑肩綠盲蝽種群對吡蟲啉的敏感性
從表1可見,黑肩綠盲蝽CF0經(jīng)褐飛虱敏感種群(SN)飼養(yǎng)25代后,敏感性變化不大;經(jīng)褐飛虱抗性種群(RN)飼養(yǎng)25代后,敏感性有所下降,LC50值是原來的1.53倍;經(jīng)吡蟲啉抗性誘導(dǎo)25代后,敏感性也有所下降,LC50值是原來的1.66倍。從結(jié)果看黑肩綠盲蝽不管是經(jīng)褐飛虱抗性種群飼養(yǎng)還是用吡蟲啉誘導(dǎo),抗藥性上升均較慢。
2.2 不同黑肩綠盲蝽種群的酯酶活性變化
從表2可見,RNC、SNC和誘導(dǎo)黑肩綠盲蝽種群F5、F10、F15、F20、F25代的酯酶活性均變化不大,同種群間差異不顯著,與F0代的黑肩綠盲蝽酯酶活性差異也不顯著,各酯酶活性變化與抗性倍數(shù)的變化不一致。由此推測,黑肩綠盲蝽的抗性與酯酶活性變化相關(guān)性不大。
2.3 不同黑肩綠盲蝽種群的谷胱甘肽轉(zhuǎn)移酶活性變化
從表3~4可見,以DCNB和CDNB為酶促反應(yīng)底物時,RNC、SNC和誘導(dǎo)的黑肩綠盲蝽種群F5、F10、F15、F20、F25代的谷胱甘肽轉(zhuǎn)移酶活性均有波動,同種群間存在差異顯著性,與F0代的黑肩綠盲蝽谷胱甘肽轉(zhuǎn)移酶活性差異也顯著,但各谷胱甘肽轉(zhuǎn)移酶活性變化與抗性倍數(shù)的變化不一致。由此推測,黑肩綠盲蝽的抗性與谷胱甘肽轉(zhuǎn)移酶活性變化相關(guān)性不大。
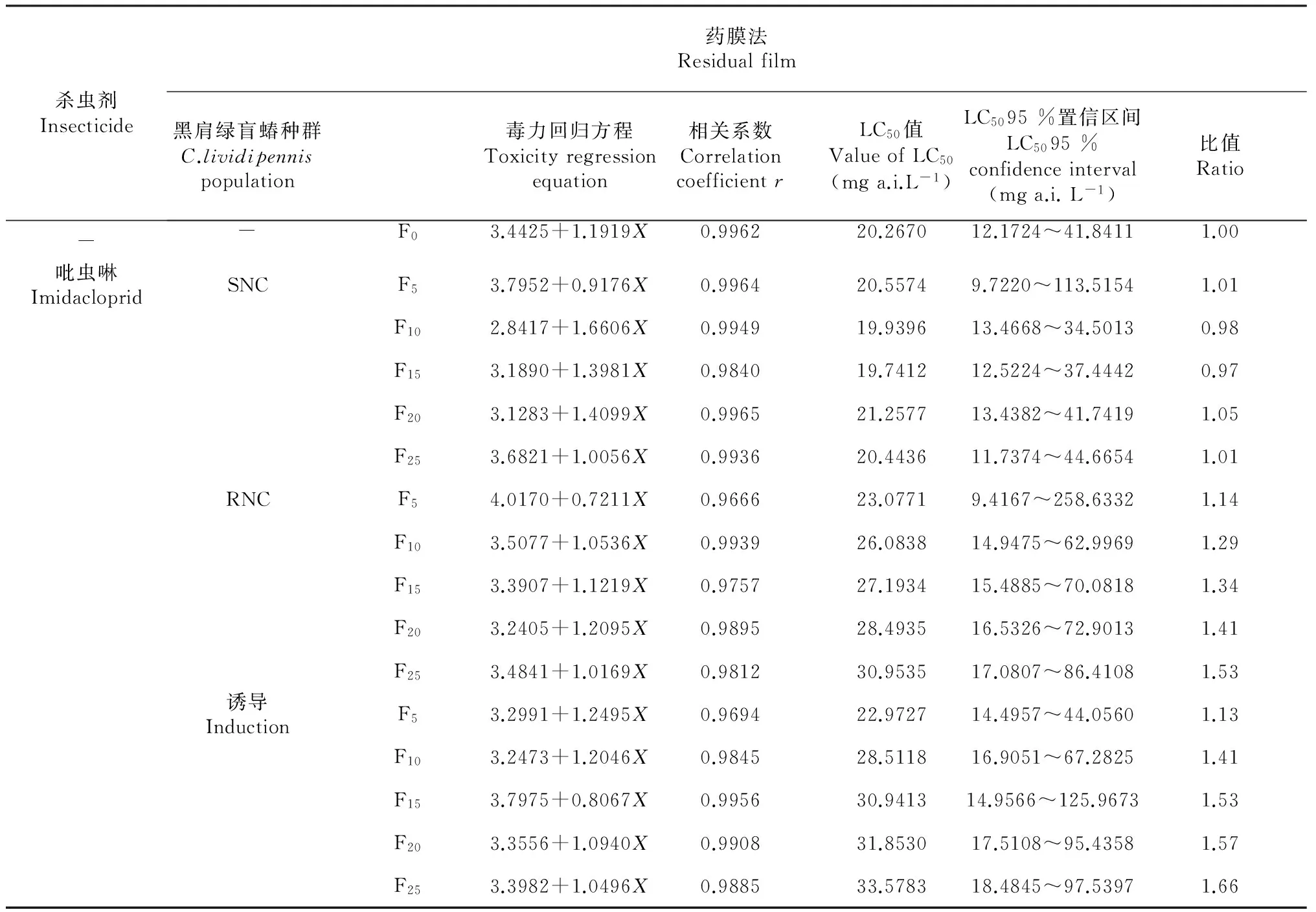
表1 不同黑肩綠盲蝽種群對吡蟲啉的敏感性
注:比值=各種群的LC50值/F0的LC50值;F0、F5、F10、F15、F20、F25表示第0、5、10、15、20、25代,下同。 Note: Ratio = the LC50of the each population /the LC50of the F0;The F0,F5,F10,F15,F20,F25show gen0,gen5,gen10,gen15,gen20,gen25.The same as below.
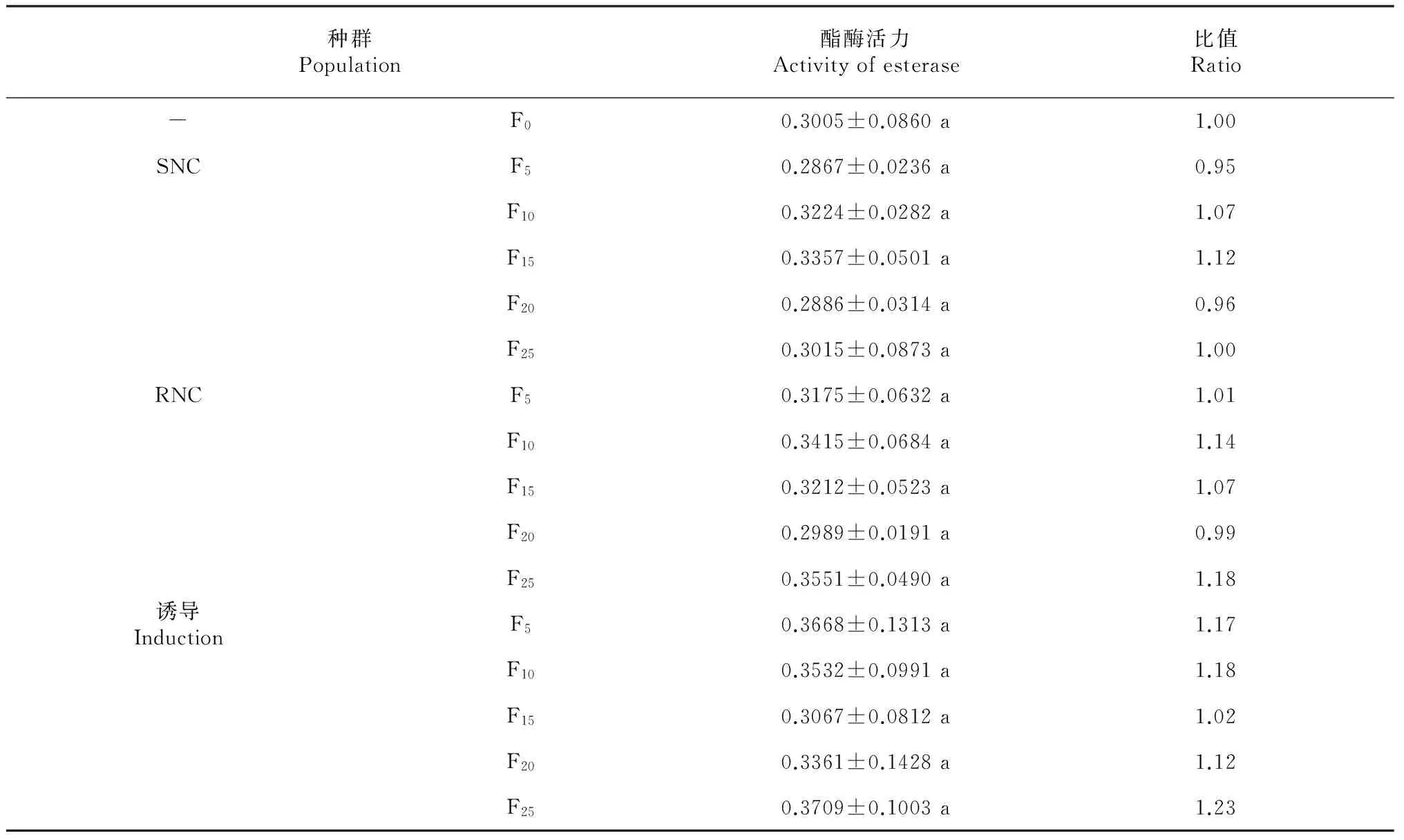
表2 不同黑肩綠盲蝽種群的酯酶活力
注:不同字母表示0.05水平下差異顯著。下同。
Note: Different letters show significance of difference at 0.05 level.The same as below.
表3 不同黑肩綠盲蝽種群谷胱甘肽轉(zhuǎn)移酶活力
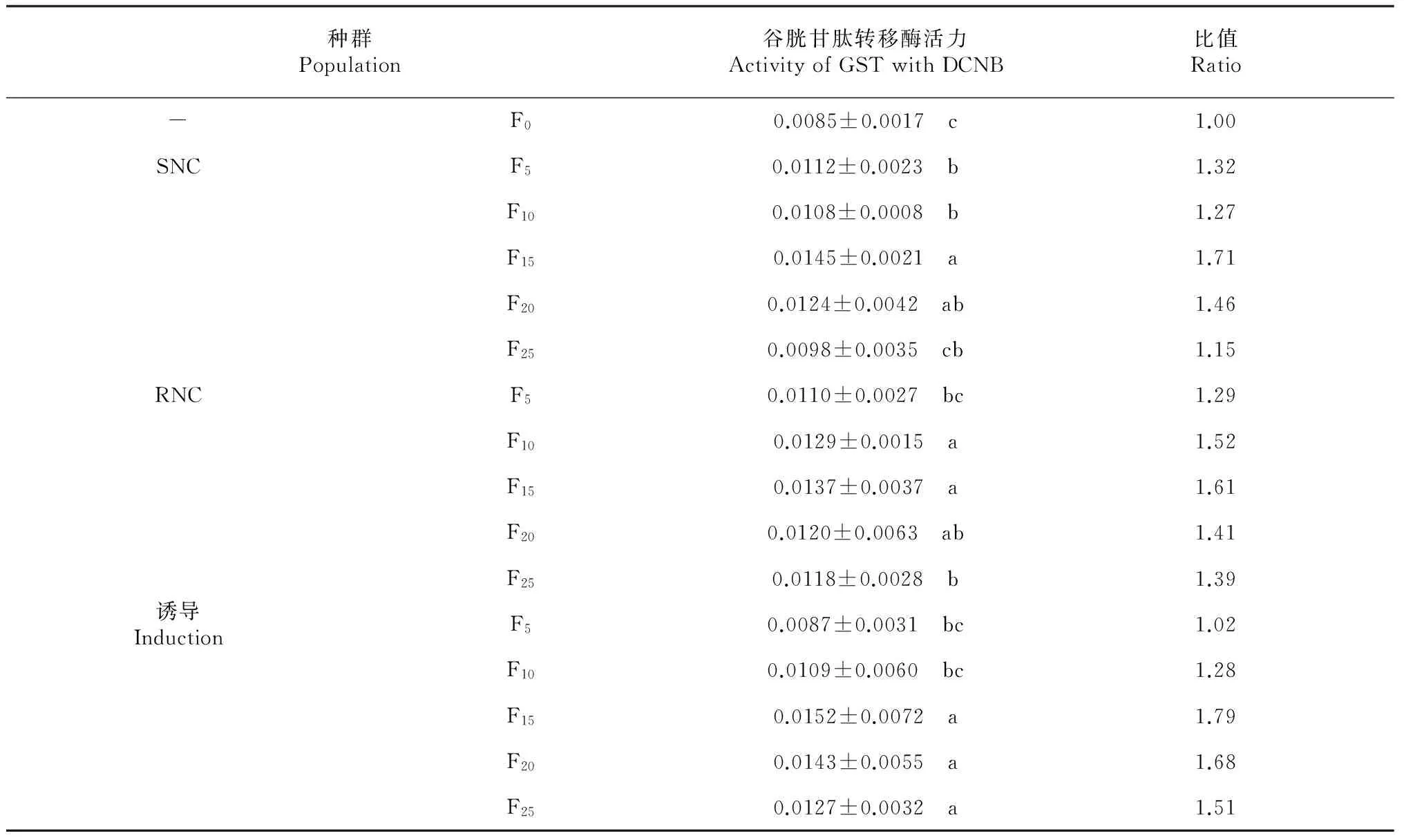
Table 3 The activity of GST in different C. lividipennis populations with DCNB fundus substand [△OD min-1mg-1, (mean±SE)]
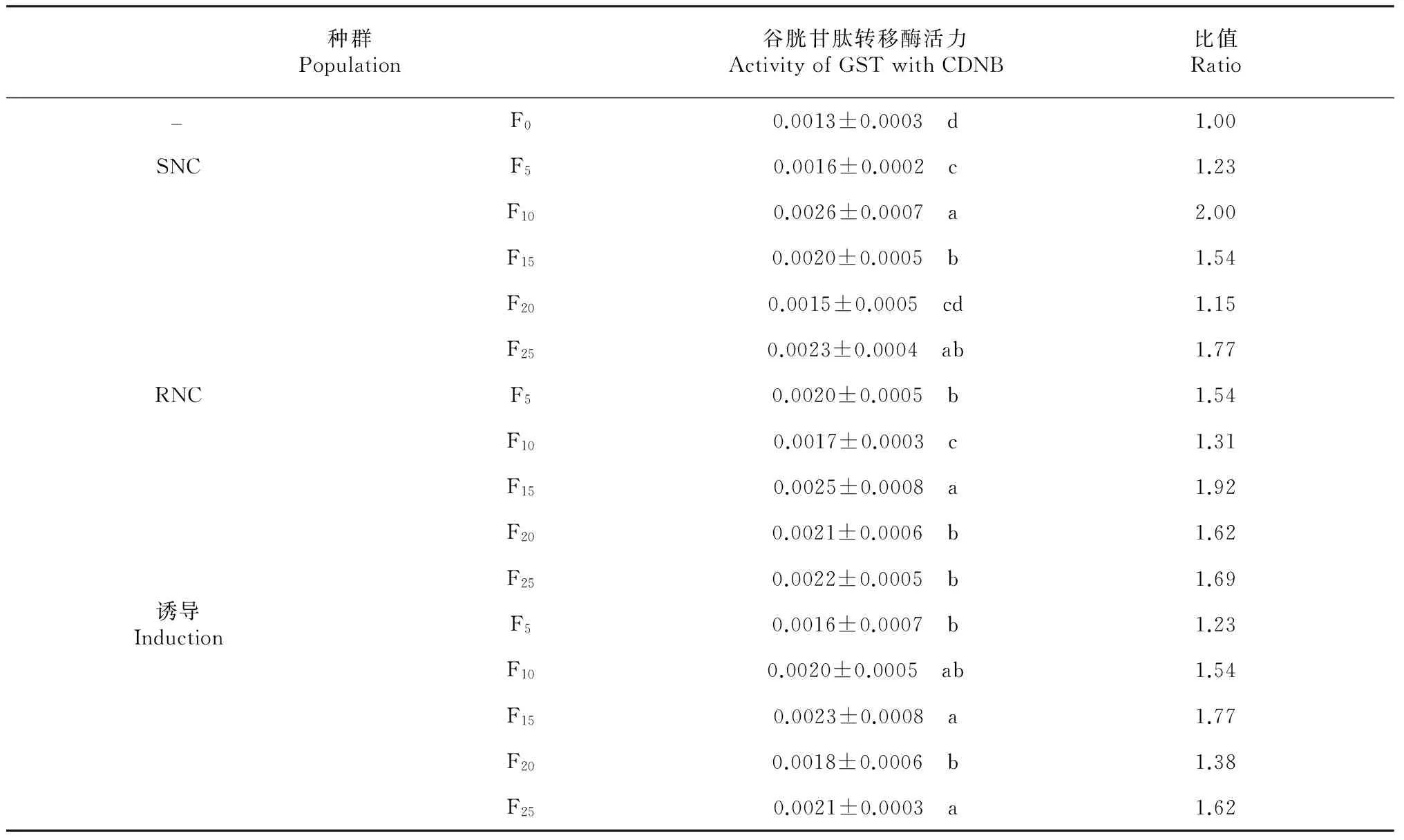
表4 不同黑肩綠盲蝽種群谷胱甘肽轉(zhuǎn)移酶活力
2.4 不同黑肩綠盲蝽種群的多功能氧化酶活性變化
從表5 可見,SNC、RNC和誘導(dǎo)黑肩綠盲蝽種群F5、F10、F15、F20、F25代的多功能氧化酶活性均有所變化,除SNC種群外,另外2個種群同種群間差異顯著性,與F0代的黑肩綠盲蝽多功能氧化酶活性差異也顯著,且各多功能氧化酶活性變化與抗性倍數(shù)的變化較一致。由此推測,黑肩綠盲蝽的抗性與多功能氧化酶活性變化相關(guān)性較大。
表5 不同黑肩綠盲蝽種群多功能氧化酶活力
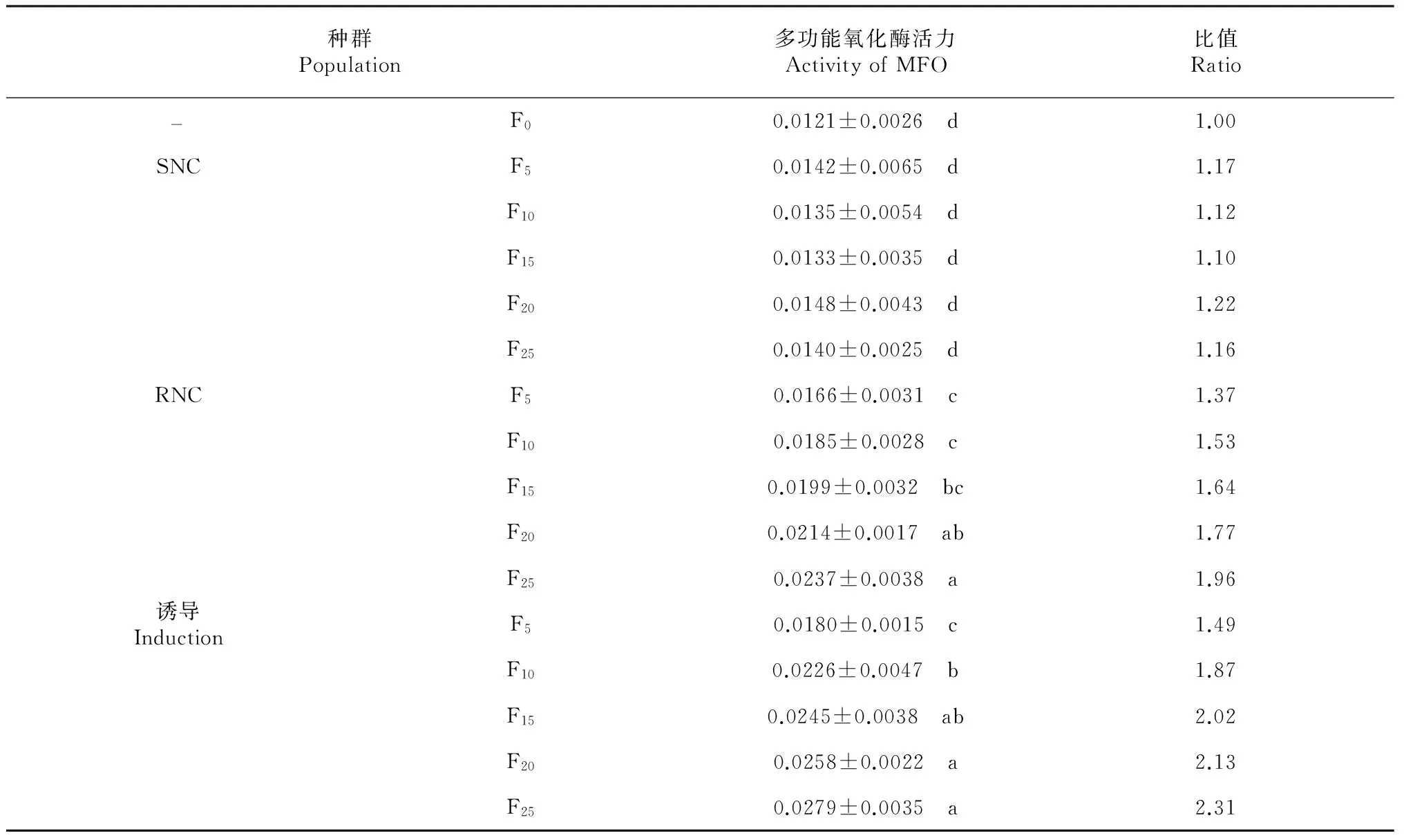
Table 5 The activity of MFO in different C. lividipennis populations [nmolmin-1mg-1, (mean±SE)]
3 討 論
本研究發(fā)現(xiàn)黑肩綠盲蝽CF0無論是經(jīng)抗吡蟲啉褐飛虱種群(RN)飼養(yǎng)25代還是經(jīng)吡蟲啉抗性誘導(dǎo)25代,敏感性均變化不大,LC50值不到原來的2倍,說明黑肩綠盲蝽不管是捕食抗吡蟲啉的褐飛虱還是直接用吡蟲啉來誘導(dǎo),抗性上升都比較慢。原因可能為:一是抗吡蟲啉的褐飛虱體內(nèi)所含的吡蟲啉劑量較低,加上黑肩綠盲蝽自身的代謝作用,所以抗性上升較慢;二是抗性篩選時,與采用的是藥膜法有一定關(guān)系,藥劑只作用于蟲體的表面,很少劑量直接進(jìn)入蟲體內(nèi)有關(guān);三是本研究采集的黑肩綠盲蝽可能不含有或很少含有對吡蟲啉有抗性的基因,因此篩選的過程中較難產(chǎn)生抗性,以上原因有待進(jìn)一步的研究。
酯酶(Es)、谷胱甘肽S-轉(zhuǎn)移酶(GSTs)和多功能氧化酶(MFOs)是昆蟲體內(nèi)3種重要的解毒酶,在昆蟲內(nèi)源化合物的合成、信號傳導(dǎo)及外源化合物和農(nóng)藥代謝等方面起著重要的作用,是目前昆蟲對多種農(nóng)藥產(chǎn)生抗性的主要原因[16]。Es是昆蟲體內(nèi)一類重要的解毒酶,屬水解酶,能水解酯鍵,主要參與有機(jī)磷類、氨基甲酸酯類和部分?jǐn)M除蟲菊酯類殺蟲劑的解毒代謝,通過阻斷作用來分解外源有毒有害物質(zhì)進(jìn)行解毒,或通過螯合作用與有毒物質(zhì)相結(jié)合,使有毒物質(zhì)無法達(dá)到作用靶標(biāo),其活性的改變與昆蟲的抗性有關(guān)[14]。在抗性品系昆蟲中,酯酶活性增高被認(rèn)為是水解酶介導(dǎo)的抗性主要機(jī)理之一[17]。GSTs是催化還原型谷胱甘肽(glutathione,GSH)與各種親電子化合物進(jìn)行親核加成反應(yīng)的一類酶。GSTs 能夠使親電化合物親水性增加,使其易于排出體外[18]。在昆蟲體內(nèi),GSTs 不僅參與了多種植物次生物質(zhì)的代謝[19],還參與了殺蟲劑的代謝[20]。MFOs由多個組份組成, 其中細(xì)胞色素P450 是該酶系的核心部分, 在整個酶系的氧化代謝過程中起著末端氧化作用,在昆蟲的生長發(fā)育、昆蟲對寄主植物的適應(yīng)性及對殺蟲劑的抗藥性中起著重要作用。潘文亮等研究發(fā)現(xiàn)棉蚜抗性與羧酸酯酶和谷胱甘肽S-轉(zhuǎn)移酶活力升高有關(guān)[21],楊煥青等研究發(fā)現(xiàn)羧酸酯酶、谷胱甘肽S-轉(zhuǎn)移酶和乙酰膽堿酯酶比活力的升高是引起棉蚜對吡蟲啉產(chǎn)生抗性的主要生化原因[22]。Puinean等研究指出桃蚜和褐飛虱對吡蟲啉抗性的產(chǎn)生主要與P450單加氧酶活性的提高有關(guān)[23-24],Shi等也認(rèn)為棉蚜對吡蟲啉的抗性可能是由于棉蚜P450 單加氧酶對吡蟲啉解毒能力提高所致[25]。本研究發(fā)現(xiàn)黑肩綠盲蝽SNC、RNC和誘導(dǎo)種群F5、F10、F15、F20、F25代的Es和谷胱甘肽轉(zhuǎn)移酶(GST)活性變化與抗性倍數(shù)的變化不一致,而MFO活性變化與抗性倍數(shù)的變化較一致,因此認(rèn)為黑肩綠盲蝽對吡蟲啉的抗性與ES和GST的活性變化無關(guān),而與(MFO)活性的變化成正相關(guān)。這與劉澤文(2003)研究的褐飛虱對吡蟲啉的抗性與多功能氧化酶活性的變化成正相關(guān)有相似之處。這可能與黑肩綠盲蝽的ES和GST不參與吡蟲啉的解毒代謝及非靶標(biāo)酶有關(guān)。另外,有關(guān)不同昆蟲對同種藥劑的解毒代謝差異有待進(jìn)一步研究。
4 結(jié) 論
黑肩綠盲蝽對吡蟲啉的抗性發(fā)展較慢,其抗性發(fā)展與ES和GST的活性變化無關(guān),與MFO活性的變化成正相關(guān)。
[1]凌 炎,黃鳳寬,龍麗萍,等. 中國和越南褐飛虱抗藥性研究[J].應(yīng)用昆蟲學(xué)報,2011,48(5):1374-1380.
[2]Garrood W T,Zimmer C T,Gorman K J,et al. Field-evolved resistance to imidacloprid and ethiprole in populations of brown planthopperNilaparvatalugenscollected from across South and East Asia[J]. Pesticide Biochemistry and Physiology,2016,72(1):140-149.
[3]陳建明,程家安,何俊華. 溫度和食物對黑肩綠盲蜻發(fā)育、存活和繁殖的影響[J]. 昆蟲學(xué)報,1994,37(l):63-70.
[4]李元喜,劉樹生,唐振華. 寄主抗藥性對菜蛾絨繭蜂抗藥性發(fā)展的影響[J]. 昆蟲學(xué)報, 2002b,45(5):597-602.
[5]Chilcutt C F,Tabashnik B E. Host-mediated competition between the pathogenBacillusthuringiensisand the parasitoidCotesiaplutellaeof the diamond back moth (Lepidoptera: Plutellidae)[J]. Environmental Entomology,1997a,26(1):38-45.
[6]馮 濤,彭 宇,劉鳳想,等. 昆蟲天敵抗藥性研究進(jìn)展[J]. 昆蟲天敵,2002,24(4): 180-184.
[7] Mason G A,Johnson M W. Tolerance to permethrin and fenvalerate in hymenopterous parasitoids associated withLiriomyzaspp. (Diptera:Agromyzidae)[J]. Journal of Economic Entomology,1988,81(1):123-126.
[8]Baker J E,Throne J E. Evaluation of a resistant parasitoid for biological control of weevils in insecticide treated wheat[J]. Journal of Economic Entomology,1995,88 (6):1570-1579.
[9]Havron A,Kenan G, Rosen D. Selection for pesticide resistance inAphytis. Ⅱ.A.lingnanensis,a parasite of the California red scale[J]. Entomologia Experimentalis et Applicata,1991,61:229-235.
[10]Zchori-Fein E,Roush R T, Sanderson J P. Potential for integration of biological and chemical control of greenhouse whitefly (Homoptera:Aleyrodidae)usingEncarsiaformosa(Hymenoptera:Aphelinidae)and abamectin[J]. Environmental Entomology, 1994,23 (5):1277-1282.
[11]Brodford M M. Arapidand sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72:248-254.
[12]孫定煒. 殺蟲劑對褐飛虱捕食性天敵黑肩綠盲蝽的影響研究[D].南京農(nóng)業(yè)大學(xué)碩士論文, 2007.
[13] Han Z J,Moores G D,Jan D,et al. Association between Biochemical Markersand Insecticide Resistance in the Cotton Aphid,Aphigossynii Glover[J]. Pesticide Biochemistry and Physiology,1998,62(3):164-171.
[14]Kao L R, Motoyama N, Dauterman W C. The purification and characterization of esterase from insecticide resistance and susceptible house flies[J]. Pesticide Biochemistry and Physiology,1989,23:228-239.
[15]Sang C,Soderlund D M. Monooxygenase activity of tobacco budworm(HeliothisvirescenesF.)larvae: tissue distribution and optimal assay conditions for the gut activity[J]. Comparative Biochemistry and Physiology,1984,79(3):407- 411.
[16]Konanz S. Characterization of mechanisms of resistance to common insecticides in noctuid pest species and resistance risk assessment for the new lepidopteran specific compound flubendiamide[D]. Stuttgart: University Hohenheim,2009.
[17]周斌芬,唐振華,高菊芳.昆蟲代謝抗性的研究進(jìn)展[J]. 農(nóng)藥,2008,47(5):313-323.
[18]Rushmore T H,Pickett C B. Glutathione S-transferases, structure,regulation,and therapeutic implications[J]. The Journal of Biological Chemistry,1993,268(16):11475-11478.
[19]Motoyama N,Dauterman W C. Glutathione Stransferases: their role in the metabolism of organophosphorus insecticides[J]. Review of Biochemistry Toxicology,1980(2):49-69.
[20]Yu S J. Consequences of induction of foreign compounds metabolizing-enzyme in insects[M] //Brattsten L B,Ahmad S. Molecular Aspects of Insect-Plant Association. New York:Plenum Press,1986.
[21]楊煥青,王開運(yùn),王紅艷,等. 抗吡蟲啉棉蚜種群對吡蚜酮等藥劑的交互抗性及施藥對其生物學(xué)特性的影響[J]. 昆蟲學(xué)報,2009,52(2):175-182.
[22]潘文亮,黨志紅,高占林. 棉蚜抗吡蟲啉品系和敏感品系主要解毒酶活性比較[J]. 昆蟲學(xué)報,2003,46(6):793-796.
[23]Puinean A M,Denholm I,Millar N S,et al. Characterisation of imidacloprid resistance mechanisms in the brown planthopper,Nilaparvatalugens(St?l)(Hemiptera: Delphacidae)[J]. Pesticide Biochemistry and Physiology,2010a,97(2):129-132.
[24]Puinean A M,F(xiàn)oster S P,Oliphant L,et al. Amplification of a cytochrome P450 gene is associated with resistance to neonicotinoid insecticides in the aphidMyzuspersicae[J]. Plos Genetics,2010b,6:e1000999.
[25]Shi X B,Shi X G,Wang H Y,et al. Crossresistance of the imidacloprid-resistant population of Aphis gossypii Glover (Homoptera: Aphididae)to other neonicotinoid insecticides and changes in activities of related enzymes[J]. Acta Entomologica Sinica,2011,54(9):1027-1033.
(責(zé)任編輯 溫國泉)
Effects of Feeding Imidacloprid ResistantNilaparvatalugenson Resistance Development ofCyrtorhinuslividipennis(Reuter)
LING Yan1,HUANG Qian2,JIANG Xian-bin2,YIN Wen-bin3,LONG Li-ping2*,HUANG Feng-kuan1,HUANG Suo-sheng1,WU Bi-qiu1,LI Cheng1
(1.Plant Protection Research Institute, Guangxi Academy of Agricultural Sciences/Guangxi Key Laboratory for Biology of Crop Diseases and Insect Pests, Guangxi Nanning 530007, China;2.Rice Research Institute, Guangxi Academy of Agricultural Sciences, Guangxi Nanning 530007, China; 3.Guangdong New Scene Bioengineering Company, Guangdong Guangzhou 510635, China)
【Objective】The influence ofNilaparvatalugensto resistance development of it's main natural predatorsCyrtorhinuslividipennisafterNilaparvatalugensproduceed highly resistant to imidacloprid was studied in order to provide scientific basis for coordinating the relationship between chemical control and biological control.【Method】Cyrtorhinuslividipenniswas fed for 25 generations byNilaparvatalugenssensitive(SN)or high level resistance(RN)to imidacloprid population, and set induced population as control (with imidacloprid, constantly for 25 generations). Then the sensitivity and enzyme activity ofCyrtorhinuslividipenniswere determined for every 5 generations.【Result】There was little change for the sensibility of SNCF25, while the LC50of RNCF25was 1.53 times higher than the original, and that of INCF25was 1.66 times higher. For the F5, F10, F15, F20, F25generations of SNC, RNC, and INC population ofCyrtorhinuslividipennis, the changes between resistance ratio and the activity of esterase or glutathione S-transferase were not concurrent, but the changes of mixed function oxidase activity were concurrent with the resistance ratio.【Conclusion】The development ofCyrtorhinuslividipennisresistance to imidacloprid was slow, which was not related to the change of esterase and glutathione transferase activity and positively correlated with the change of mixed function oxidase activity.
Imidacloprid;Nilaparvatalugens;Cyrtorhinuslividipennis;Resistance development
1001-4829(2017)6-1369-07
10.16213/j.cnki.scjas.2017.6.023
2017-03-21
國家自然科學(xué)基金項目(31560510;31360437);廣西作物病蟲害生物學(xué)重點(diǎn)實驗室基金項目(16-ST-5);廣西農(nóng)業(yè)科學(xué)院基本科研業(yè)務(wù)專項項目(2015YT18,2016YM30,2016JZ23)
凌 炎(1980-),瑤族,女,廣西平南人,碩士,副研究員,主要研究方向為農(nóng)業(yè)昆蟲與害蟲防治,*為通訊作者:龍麗萍,E-mail:longlp@sohu.com。
S476.2
A

