胃癌組織中miR-185檢測的臨床價值及與Vav3-Rac1通路的關系
檀碧波 李勇 范立僑 劉艷麗 劉慶偉
·論著·
胃癌組織中miR-185檢測的臨床價值及與Vav3-Rac1通路的關系
檀碧波 李勇 范立僑 劉艷麗 劉慶偉
目的 探討胃癌及癌旁正常胃黏膜中微小RNA145(miR-185)、Vav3、Rac1基因的表達情況及關系。方法 熒光實時定量PCR技術檢測100例胃癌組織及80例癌旁正常胃黏膜中miR-185、Vav3、Rac1基因mRNA的表達情況。比較胃癌及癌旁正常胃黏膜組織中這3種基因mRNA的表達差異;繪制受試者工作曲線(ROC曲線);分析miR-185、Vav3、Rac1基因mRNA表達與患者生物學特征的關系;分析胃癌組織中miR-185與Vav3、Rac1的關系。結果 胃癌組織中miR-185的表達低于癌旁正常胃黏膜組織,而Vav3、Rac1的mRNA表達則明顯高于癌旁正常胃黏膜組織(P<0.05)。miR-185、Vav3、Rac1的ROC曲線最佳cut-off值分別為0.3440、0.3346、0.2944。miR-185的表達與胃癌的浸潤深度、分化及淋巴結轉移有關;Vav3、Rac1的表達與胃癌的分化及淋巴結轉移有關(P<0.05)。Spearman相關分析顯示,在胃癌組織中miR-185與Vav3、Rac1存在負相關,Vav3與Rac1存在正相關(P<0.05)。結論 胃癌組織中miR-185表達明顯降低且與胃癌的生物學特征有關,miR-185可能通過抑制Vav3-Rac1通路而參與了胃癌進展的調控過程。
微小RNA-185;胃腫瘤;Vav3;Rac1;生物學特征
胃癌是我國常見惡性腫瘤,其發病率居于各種惡性腫瘤第二位,僅次于肺癌;死亡率居第三位,僅次于肺癌和肝癌,嚴重威脅人民健康[1]。雖然有關胃癌的診治措施已研究多年。且已取得不少成果,但胃癌總的治療效果還遠不令人滿意,患者大多預后較差[2]。因此,探討胃癌發病機制并對于明確病因、尋找標志物、確定治療靶基因有重要價值。胃癌的基因調控過程是復雜的網絡式調控,近年來微小RNA(microRNA,miR)在胃癌中發揮的作用已引起了關注,成為本領域研究的熱點。目前發現,多種miRs在胃癌的各進程中發揮了重要作用,研究顯示miR-29c、miR-124、miR-135a and miR-148a、miR-421、miR-7等在預測胃癌淋巴結轉移及預后等方面具有重要價值[3-5],說明在胃癌的進展過程中miRs發揮了重要作用。本課題組前期研究發現對胃癌細胞株的miR-185表達進行調控可以改變腫瘤細胞的凋亡狀態,還可以使腫瘤細胞的耐藥特性發生變化[6,7]。這提示miR-185參與了胃癌的生物學進程,但在臨床胃癌組織中miR-185檢測的情況及價值還不明確。因此本研究以臨床胃癌患者為研究對象,應用熒光實時定量聚合酶鏈反應(fluorescence real time quantitative polymerase chain reaction,QPCR)技術檢測了100例胃癌組織及80例癌旁正常胃黏膜組織中miR-185的表達情況,繪制了受試者工作曲線(ROC曲線),并分析了miR-185表達與胃癌患者生物學特征的關系。為初步了解miR-185在胃癌中可能的調節機制,本研究同時檢測了Vav3、Rac1的表達,并分析了miR-185與Vav3、Rac1的關系,為深入探討miR-185參與胃癌調控的研究提供了一定的臨床依據。
1 資料與方法
1.1 一般資料 選擇2015年1~12月于河北醫科大學第四醫院外三科診治的胃癌手術患者100例,其中男76例,女24例;年齡32~81歲,平均年齡(60.19±8.63)歲。所有患者于腫瘤切除后盡快取腫瘤組織1.0 cm×1.0 cm×0.5 cm,同時于距腫瘤邊緣>3 cm處取外觀正常的胃黏膜組織。胃癌及黏膜組織均一式兩份,一份送常規病理檢查,確定是否符合實驗要求(腫瘤組織要求病理診斷明確為腺癌,癌旁正常胃黏膜要求無癌細胞檢出);另一份以PBS漂洗干凈后置于液氮中,盡快轉至超低溫冰箱于-80℃保存。患者的病理學特征:腫瘤均為腺癌,中高分化腺癌67例,低分化(未分化)腺癌33例;腫瘤未侵犯漿膜者32例,侵犯漿膜者68例;存在陽性淋巴結轉移者78例,淋巴結轉移陰性者22例;存在遠處轉移者11例,無遠處轉移者89例;血管神經受侵犯者65例,無侵犯者35例;按UICC第7版腫瘤TNM分期Ⅰ~Ⅱ期者42例,Ⅱ~Ⅳ期58例。本研究得到醫院醫學倫理委員會批準,并取得所有入組者的知情同意。
1.2 入選與排除標準
1.2.1 入選標準:①患者年齡>18歲;②初次確診的胃癌患者,且接受手術治療;③患者手術前未接受放療、化療、生物治療、靶向治療等措施;④患者均手術切除了原發病灶。
1.2.2 排除標準:①術后復發的胃癌患者;②合并其他惡性腫瘤的患者;③應用激素、免疫抑制劑等藥物的患者;④不能配合或不同意參加研究的患者。
1.3 主要試劑與儀器 miR-185、Vav3、Rac1及內參照基因U6、GAPDH的QPCR引物由北京天根生化科技公司合成。QPCR檢測試劑盒、QPCR試劑及反轉錄試劑盒均購自北京天根生化科技公司。熒光定量PCR儀(7300型)為美國ABI公司產品。
1.4 QPCR實驗檢測miR-185、Vav3、Rac1基因mRNA表達情況 組織研磨破碎后提取總RNA,對總RNA的濃度和純度進行鑒定后進行反轉錄,合成目的基因的cDNA。取反轉錄產物2 μl進行PCR反應。PCR反應體系組成為20 μl:2×miRcute miRNA Premix (或SYBR Green Mix)10 μl,目的基因的上下游引物各0.5 μl,反轉錄產物2 μl,RNase-Free ddH2O 7 μl。循環參數設置:94℃預變性,2 min,循環參數:94℃ 20 s模板變性,60℃ 34 s退火、延伸,共循環40次。結束后由軟件自動進行循環閾值(CT)讀取,以目的基因與內參基因的相對表達量代表目的基因表達強度。
2 結果
2.1 miR-185與Vav3、Rac1基因mRNA在胃癌組織、癌旁正常胃黏膜組織中的表達 QPCR結果顯示,胃癌組織、癌旁正常胃黏膜組織中miR-185、Vav3、Rac1基因mRNA表達差異有統計學意義(P<0.05)。胃癌組織中miR-185的表達低于癌旁正常胃黏膜組織,而Vav3、Rac1的mRNA表達則明顯高于癌旁正常胃黏膜組織(P<0.05)。見表1。
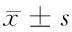

類別miR-185Vav3mRNARac1mRNA胃癌組織(n=100)0.2780±0.08170.4272±0.13200.3833±0.1238癌旁組織(n=80)0.3751±0.12400.2695±0.09590.2058±0.0775t值-6.30638.958411.1865P值<0.01<0.01<0.01
2.2 胃癌組織中miR-185、Vav3、Rac1基因mRNA的ROC曲線結果 結果顯示,miR-185的ROC曲線最佳cut-off值為0.3440,曲線下面積0.735,其敏感度和特異度分別為58.8%、81.0%;Vav3的ROC曲線最佳cut-off值為0.3346,曲線下面積0.835,其敏感度和特異度分別為77.0%、77.5%;Rac1的ROC曲線最佳cut-off值為0.2944,曲線下面積0.892,其敏感度和特異度分別為75.0%、88.7%。見圖1。

圖1 miR-185、Vav3、Rac1基因mRNA的ROC曲線結果
2.3 胃癌組織中miR-185、Vav3、Rac1基因mRNA與胃癌生物學特征的關系 χ2檢驗結果顯示,miR-185的表達與胃癌的zz浸潤深度、分化及淋巴結轉移有關(P<0.05);Vav3、Rac1的表達與胃癌的分化程度及淋巴結轉移情況有關(P<0.05)。見表2。

表2 miR-185、Vav3、Rac1基因的mRNA在胃癌組織表達與生物學特征的關系 例
2.4 胃癌組織中miR-185、Vav3、Rac1基因mRNA表達的相關性 Spearman結果顯示,miR-185與Vav3、Rac1存在負相關(r=-0.3622,P<0.01;r=-0.2854,P=0.004),Vav3與Rac1存在正相關(r=0.5221,P<0.01)。
3 討論
胃癌在我國為高發的惡性腫瘤,由于胃癌無特異性臨床癥狀,因而很難早期發現并治療。胃癌進展迅速,手術后易復發及轉移,目前尚無針對胃癌的特效治療方法,因而胃癌預后較差,5年生存率不足40%[8,9]。在胃癌的進展過程中,許多與胃癌調控相關的分子發揮了重要作用,其中微小RNA(microRNA,miR)與胃癌的關系已受到越來越多的關注。miRs的功能是通過靶向抑制作用,抑制受其調控的一組靶基因的表達。有研究發現,多種miRs在胃癌進展中發揮了重要的調節作用。Li等[10]研究發現,miR-183在胃癌中可以通過調控PDCD4而促進腫瘤進展,發揮了原癌基因的作用。Wu等[11]研究顯示,miR-18a可以通過抑制缺氧誘導因子1-α(hypoxia-inducible factor-1α,HIF-1α)的表達而調節胃癌細胞的凋亡及侵襲能力。另外Xu等[12]研究還發現miR-532可以通過調節RUNX3參與胃癌進展。這些都表明miRs在胃癌的進展中發揮了重要作用。miR-185也是miRs成員之一,有研究顯示,miR-185在胃癌中表達下降,與胃癌進展關系密切[13]。我們的前期研究也發現,促進胃癌細胞中miR-185表達可以促進胃癌細胞凋亡;還發現提高胃癌細胞中的miR-185表達可以改善胃癌細胞對化療藥物的敏感性,抑制miR-185表達可以使胃癌細胞對化療藥物的敏感性降低[6-8]。但這些研究大多為基礎研究,miR-185在胃癌組織中的表達及調控機制報道少見。本研究結果顯示,miR-185在胃癌組織中表達低于癌旁正常胃黏膜組織,且miR-185在兩種組織中表達存在正相關,提示miR-185表達下降可能是胃癌發生的因素之一,但具體情況還有待深入分析。
為了評價miR1-185檢測的臨床價值,本研究進一步對miR-185水平進行了分析,繪制了受試者工作曲線(receiver operator characteristic curve,ROC),對胃癌組織中miR1-185的檢測價值進行了評價。結果顯示,miR-185的ROC曲線最佳cut-off值為0.3440,曲線下面積0.735,其敏感度和特異度分別為58.8%、81.0%。我們按此標準將miR-185分為強表達及弱表達,并與胃癌患者的生物學特征進行分析,結果發現miR-185的表達與胃癌的腫瘤浸潤深度、分化及淋巴結轉移有關,浸潤更深、分化程度差、存在淋巴結轉移的患者miR-185水平更低。這提示miR-185可能參與了胃癌的進展及轉移,并且在轉移過程中其水平進一步降低,檢測胃癌組織miR-185有可能對預測腫瘤轉移有幫助。
為初步探討miR-185在胃癌中發揮的調控機制,本研究同時檢測了胃癌組織及癌旁正常胃黏膜組織中Vav3、Rac1基因mRNA表達情況。Vav3基因是原癌基因家族Vav的成員之一,參與許多信號轉導通路的調控,對腫瘤細胞的增殖、侵襲、遷移有調節作用[13-15]。本課題組前期研究發現,胃癌細胞中Vav3表達增高,對胃癌細胞的生長、遷移等有促進作用[16]。我們的前期研究還發現,Vav3表達增高對胃癌細胞的凋亡有抑制作用,還能導致胃癌細胞耐藥[17,18]。Rac1是直接受Vav3調控的基因,可以由Vav3激活[19],Vav3-Rac1通路在胃癌細胞調控中發揮了重要作用。本研究發現,胃癌組織、癌旁正常胃黏膜組織中Vav3、Rac1基因mRNA表達存在差異,Vav3、Rac1的mRNA表達則明顯高于癌旁正常胃黏膜組織,在胃癌及癌旁正常胃黏膜組織中這兩種基因的表達均存在正相關,提示這兩種基因表達的增強可能與胃癌發生有關。我們同樣也繪制了胃癌中Vav3、Rac1水平的ROC曲線,結果發現Vav3的ROC曲線最佳cut-off值為0.3346,曲線下面積0.835,其敏感度和特異度分別為77.0%、77.5%;Rac1的ROC曲線最佳cut-off值為0.2944,曲線下面積0.892,其敏感度和特異度分別為75.0%、88.7%。Vav3的表達與胃癌的分化及淋巴結轉移有關;Rac1的表達與胃癌的分化及淋巴結轉移有關。這些結果顯示Vav3、Rac1基因與胃癌關系密切,值得深入研究。
本文應用Spearman相關分析研究了miR-185與Vav3-Rac1通路基因在胃癌組織中的關系,結果發現,在胃癌組織中miR-185與Vav3、Rac1均存在負相關,提示miR-185對Vav3、Rac1可能存在抑制作用,miR-185可能通過抑制Vav3、Rac1表達而抑制了胃癌的進展,但具體情況還有待相關基礎研究予以證實。
綜上所述,本研究發現miR-185在胃癌組織中表達低于癌旁正常胃黏膜,其表達降低可導致腫瘤分化方向停滯,侵襲能力增強。研究miR-185在胃癌中的表達規律對探討胃癌進展機制、發現新的靶基因有重要意義。同時本研究還發現miR-185與Vav3-Rac1通路的表達有關,提示miR-185可能通過調節該通路而參與了胃癌的進展。但本文樣本量不大,且沒有進行機制分析,這些在今后的研究中準備進一步完善,在胃癌診治領域做出貢獻。
1 Chen W,Zheng R,Zuo T,et al.National cancer incidence and mortality in China,2012.Chin J Cancer Res,2016,28:1-11.
2 Lordick F,Terashima M.Gastric cancer adjuvant therapy.Best Pract Res Clin Gastroenterol,2016,30:581-591.
3 Liu L,Ye JX,Qin YZ,et al.Evaluation of miR-29c,miR-124,miR-135a and miR-148a in predicting lymph node metastasis and tumor stage of gastric cancer.Int J Clin Exp Med,2015,8:22227-22236.
4 Liu H,Gao Y,Song D,et al.Correlation between microRNA-421 expression level and prognosis of gastric cancer.Int J Clin Exp Pathol,2015,8:15128-15132.
5ChenWQ,HuL,ChenGX,etal.RoleofmicroRNA-7indigestivesystemmalignancy.WorldJGastrointestOncol,2016,8:121-127.
6 李勇,檀碧波,趙群,等.抑制miR-185對人胃癌細胞株SGC7901藥物敏感性影響的機制探討.中華腫瘤防治雜志,2015,22:1347-1351.
7 李勇,檀碧波,范立僑,等.胃癌耐藥細胞株SGC7901/阿霉素中miR-185的表達及對細胞多藥耐藥性的影響.中國全科醫學,2015,18:2101-2104.
8Laz?rDC,T?banS,CornianuM,etal.Newadvancesintargetedgastriccancertreatment.WorldJGastroenterol,2016,22:6776-6799.
9B?gerC,BehrensHM,R?ckenC.Ki67-anunsuitablemarkerofgastriccancerprognosisunmasksintratumoralheterogeneity.JSurgOncol,2016,113:46-54.
10LiC,DengL,ZhiQ,etal.MicroRNA-183FunctionsasanoncogenebyregulatingPDCD4ingastriccancer.AnticancerAgentsMedChem,2016,16:447-455.
11WuF,HuangW,WangX.microRNA-18aregulatesgastriccarcinomacellapoptosisandinvasionbysuppressinghypoxia-induciblefactor-1αexpression.ExpTherMed,2015,10:717-722.
12XuX,ZhangY,LiuZ,etal.miRNA-532-5pfunctionsasanoncogenicmicroRNAinhumangastriccancerbydirectlytargetingRUNX3.JCellMolMed,2016,20:95-103.
13TsuboiM,TaniuchiK,FurihataM,etal.Vav3islinkedtopoorprognosisofpancreaticcancersandpromotesthemotilityandinvasivenessofpancreaticcancercells.Pancreatology,2016,16:905-916.
14ChoCY,LeeKT,ChenWC,etal.MST3promotesproliferationandtumorigenicitythroughtheVAV2/Rac1signalaxisinbreastcancer.Oncotarget,2016,7:14586-14604.
15ChenX,ChenSI,LiuXA,etal.Vav3oncogeneisupregulatedandapoorprognosticfactorinbreastcancerpatients.OncolLett,2015,9:2143-2148.
16TanB,LiY,ZhaoQ,etal.InhibitionofgastriccancercellgrowthandinvasionthroughsiRNA-mediatedknockdownofguaninenucleotideexchangefactorVav3.TumourBiol,2014,35:1481-1488.
17TanB,LiY,ZhaoQ,etal.InhibitionofVav3couldreversethedrugresistanceofgastriccancercellsbydownregulatingJNKsignalingpathway.CancerGeneTher,2014,21:526-531.
18 檀碧波,李勇,范立僑,等.抑制Vav3基因表達對胃癌細胞凋亡抑制蛋白及腫瘤多藥耐藥性的影響.第二軍醫大學學報,2015,36:136-141.
19Menacho-MárquezM,NogueirasR,FabbianoS,etal.ChronicsympathoexcitationthroughlossofVav3,aRac1activator,resultsindivergenteffectsonmetabolicsyndromeandobesitydependingondiet.CellMetab,2013,18:199-211.
Clinical significance of miR-185 detection in gastric cancer tissues and its relationship with Vav3-Rac1 pathway
TANBibo,LIYong,FANLiqiao,etal.
TheThirdDepartmentofSurgery,TheFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China
Objective To investigate the expression and relationship of miR-185,Vav3,Rac1 gene in gastric cancer tissues and adjacent normal tissues.Methods The expression levels of miR-185,Vav3,Rac1 mRNA were detected by fluorescence real time quantitative polymerase chain reaction (QPCR) assay in 100 cases of gastric cancer tissues and 80 cases of adjacent normal tissues.The expression differences of miR-185,Vav3,Rac1 were compared between gastric cancer tissues and adjacent normal tissues.The ROC curve was completed with data,and the correlation between the expressions of miR-185, Vav3,Rac1 mRNA and biological characteristics of patients was analyzed.Moreover the correlation among miR-185,Vav3,Rac1 in gastric cancer tissues was analyzed. Results The expression levels of miR-185 in gastric cancer tissues were obviously lower than those in adjacent normal tissues,however,the expression levels of Vav3,Rac1 mRNA were significantly higher than those in adjacent normal tissues (P<0.05). The optimized cut-off value of miR-185,Vav3,Rac1 under ROC curve was 0.3440,0.3346,0.2944,respectively. The expression of miR-185 was closely correlated to depth of invasion,differentiation extent and lymphatic metastasis of gastric cancer,moreover, the expressions of Vav3 and Rac1 mRNA were closely related with differentiation extent and lymphatic metastasis of gastric cancer (P<0.05). Spearman correlation analysis showed that there was an negative correlation between miR-185 and Vav3,miR-185 and there was a positive correlation between Vav3 and Rac1 (P<0.05).Conclusion The expression levels of miR-185 are obviously decreased in gastric cancer tissues,moreover,which are closely correlated to biological characteristics of gastric cancer,and miR-185 may be involved in progression of gastric cancer by regulating Vav3-Rac1 pathway.
miR-185; gastric cancer; Vav3; Rac1; biological characteristics
10.3969/j.issn.1002-7386.2017.17.001
項目來源:國家自然科學基金面上項目(編號:81372580);河北省自然科學基金面上項目(編號:H2016206173);河北省科學技術研究與發展支撐計劃項目(編號:14277779D);河北省醫科科學研究重點課題計劃(編號:20160176)
050011 石家莊市,河北醫科大學第四醫院外三科(檀碧波、李勇、范立僑、劉慶偉);中國人民解放軍白求恩國際和平醫院病理科(劉艷麗)
李勇,050011 石家莊市,河北醫科大學第四醫院外三科;
E-mail:Li_yong_hbth@126.com
R 735.2
A
1002-7386(2017)17-2565-05
2017-02-22)

