川芎嗪聯合來氟米特對膠原誘導關節炎大鼠血小板活化和炎癥反應的影響?
白菁安,邊艷琴,牛旭艷,樊丹平,呂 誠,姜 淼,趙 寧△
(1. 中國中醫科學院中醫臨床基礎醫學研究所,北京 100700; 2. 上海中醫藥大學附屬曙光醫院,上海 201203)
【實驗研究】
川芎嗪聯合來氟米特對膠原誘導關節炎大鼠血小板活化和炎癥反應的影響?
白菁安1,邊艷琴2,牛旭艷1,樊丹平1,呂 誠1,姜 淼1,趙 寧1△
(1. 中國中醫科學院中醫臨床基礎醫學研究所,北京 100700; 2. 上海中醫藥大學附屬曙光醫院,上海 201203)
目的:探討川芎嗪聯合來氟米特對膠原誘導關節炎大鼠血小板活化和炎癥反應的影響。方法:將50只SD大鼠隨機取10只作為正常組,其余制備大鼠關節炎模型,將成模大鼠分為模型組(CIA組)、川芎嗪組(TMP組)、來氟米特組(LEF組)、川芎嗪聯合來氟米特組(T+L組),各藥物干預組分別給予相應藥物,計算關節炎指數并觀察關節病理變化,檢測血清CRP及PDGF- BB水平,血漿GMP- 140及VCAM- 1水平。結果:與正常組比較,CIA組大鼠關節滑膜出現明顯細胞增生、炎細胞浸潤、血管翳形成浸入軟骨, CRP及PDGF- BB水平、GMP- 140及VCAM- 1水平均顯著上升;與CIA組比較,各藥物干預組大鼠關節病理變化中滑膜增生、炎性細胞浸潤、血管翳和骨破壞形成均有改善,大鼠關節炎指數均減小,雙后肢關節紅腫程度評分均降低,CRP、 PDGF- BB蛋白水平、GMP- 140水平及VCAM- 1水平均降低,其中聯合用藥組效果優于TMP組和LEF組。結論:川芎嗪聯合來氟米特能夠顯著抑制膠原誘導關節炎大鼠的血小板活化和炎癥反應,對于RA患者具有潛在的應用價值。
類風濕性關節炎;膠原誘導關節炎;川芎嗪聯合來氟米特;血小板活化
類風濕關節炎(rheumatoid arthrits,RA) 是一種以關節滑膜慢性炎癥反應、滑膜增生、血管翳形成進而侵蝕關節軟骨及骨組織為基本病理改變的疾病。來氟米特是世界公認的治療RA的常用藥物[1],可以減輕RA炎癥反應和對關節的破壞。但臨床研究發現,對于血小板活化性高的RA患者,目前單純應用來氟米特治療效果并不甚滿意[2]。但有研究表明,利用活血化瘀法聯合來氟米特治療類風濕關節炎,可提高來氟米特治療效果[3]。
現代研究發現,血瘀證與血小板活化關系非常密切[4],血小板黏附、活化、聚集進而導致血栓形成,被認為是血瘀證形成的基本病理生理基礎[5],不僅如此,血瘀證更是RA基本病機之一[6]。現代研究發現,血瘀證與炎癥之間有密切聯系。通過抑制血小板活化,改善血瘀證,減低炎癥反應的發生,可能是很多具有活血化瘀性質中藥抗炎的分子基礎[7]。故本研究嘗試用來氟米特聯合具有降低血小板活化功能的活血化瘀藥川芎嗪[8]作用于II型膠原誘導的關節炎大鼠,觀察川芎嗪聯合來氟米特對動物模型血小板活化的影響。
1 材料
1.1 動物
6周齡SPF級雄性SD大鼠,由軍事醫學科學院提供(合格證號SCXK(京)2007- 004)。
1.2 試劑
磷酸川芎嗪片購自燕京藥業有限公司(批號090912),來氟米特購自福建匯天生物藥業有限公司(批號120904),大鼠GMP- 140ELISA 試劑盒購自Elabscience公司(批號10043450)。II型膠原(批號120440)、不完全弗氏佐劑(IFA)(批號120449)購自Chondrex公司,大鼠CRP的ELISA試劑盒(批號109551062)、PDGF- BB的ELISA試劑盒(批號106627009)購自eBioscience公司。
1.3 模型制備
實驗第1天取適量牛Ⅱ型膠原將其溶于0.1M乙酸,配成濃度2 mg/ml Ⅱ型膠原溶液,4 ℃過夜。此溶液再與等量不完全弗氏佐劑混合,充分乳化后以滴加于水中不擴散為度。取乳化后的混合物按200 μg Ⅱ型膠原/只大鼠于尾根部皮下免疫,1周后按100 μg Ⅱ型膠原/只于尾根部皮下加強免疫1次。正常組以等量生理鹽水于尾根部進行皮下假免疫。加強免疫7 d后,至少1個足趾關節出現發紅、腫脹的大鼠,即判定為造模成功。
1.4 分組及給藥
將50只雄性SD大鼠按體質量分層,隨機取10只作為正常組,其余40只采用牛II型膠原誘導制備大鼠關節炎模型,對成模大鼠(40只)按組織腫脹程度采用分層隨機方法分為模型組(CIA組)、川芎嗪組(TMP組)、來氟米特組(LEF組)、川芎嗪+來氟米特組(T+L組)各10只,加強免疫后7 d開始給藥。TMP組給予川芎嗪(25 mg/kg/d)、LEF組給予來氟米特(10 mg/kg/d),T+L組給予川芎嗪+來氟米特藥物(TMP25 mg/kg/d+LEF10 mg/kg/d),CIA組和正常組給予同等容積的蒸餾水。灌胃給藥每天1次,持續4周,并每隔2 d進行1次稱重。實驗過程動物始終保持在12 h光照、12 h黑暗、溫度20~22 ℃、濕度控制在45%~65%之間,給藥期間正常供給飼料和飲水。
1.5 取材
末次給藥后當天大鼠禁食不禁水,第2天稱重后,3%戊巴比妥鈉腹腔注射麻醉,腹主動脈取血,一部分收集于含有2%EDTA- Na2抗凝劑的抗凝管中,4 ℃ 3000rpm離心10 min,收集上層血漿置于-80℃保存備用;其余收集于離心管中,3000 rpm 4 ℃離心15 min取血清,-80℃保存、備用。取雙側后肢踝關節,剔除關節周圍軟組織,置于福爾馬林液固定備用。
2 方法
2.1 指標檢測
2.1.1 關節炎指數(Arthritis index,AI) 于給藥第1、8、12、16、20、24、28天分別對各大鼠雙后足關節紅腫程度進行AI評分。評分方法參照5級評分法評價[9],將2只后踝關節的病變程度累計積分,計算出關節炎指數,每個動物最大為8 分。
2.1.2 踝關節病理觀察 將各組大鼠踝關節在含10%EDTA- Na2的脫鈣液中脫鈣,時間約持續2個月,期間每3 d更換1次脫鈣液。脫鈣完成后,用10%甲醛固定,然后酒精逐級脫水,二甲苯透明,石蠟包埋、切片,常規HE染色。
2.1.3 ELISA檢測 恢復試劑盒至室溫,確定所需微孔條數目及相關試劑用量。Wash Buffer(20×)稀釋、Assay Buffer(20×)稀釋、標準品稀釋、樣品稀釋、標準品、待測樣本、空白孔加樣,1×Biotin- Conjugate配制及加樣;室溫孵育、洗板,1×HRP配制及加樣,室溫孵育及洗板;TMB底物溶液顯色,Stop Solution終止顯色,酶標儀檢測OD值。
2.2 統計學方法
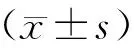
3 結果
3.1 各組大鼠關節炎指數變化
圖1顯示,在給藥初各組大鼠之間AI評分比較差異無統計學意義。隨著造模時間的延長,從給藥第8天開始,所有大鼠AI值開始出現下降趨勢。與CIA組比較,在給藥第12天開始,T+L組大鼠AI值開始出現顯著降低(P<0.01);在給藥第16天開始,TMP、LEF和T+L組大鼠AI值均顯著低于CIA組(P<0.05或P<0.01),且一直持續至給藥結束;在給藥第28天時,與TMP、LEF組比較T+L組大鼠AI值顯著降低,差異有統計學意義(P<0.05)。T+L組從給藥第12天開始到給藥結束,AI值均顯著低于CIA組,相較LEF組下降趨勢較穩定,表明川芎嗪聯合來氟米特對CIA作用起效早,療效較穩定。

圖1 各組大鼠關節炎指數評分注:與CIA組比較:*P<0.05,**P<0.01
3.2 各組大鼠關節病理變化
圖2顯示,正常組大鼠關節結構完整,未見滑膜增生及血管翳形成,關節面平整光滑;與正常組比較,CIA組大鼠滑膜細胞大量增生,滑膜增厚,大量炎性細胞浸潤,血管翳大量形成并向軟骨內侵襲,關節融合成片,關節結構被破壞,關節腔明顯變窄;與CIA組比較,TMP組、LEF組和T+L組大鼠關節滑膜增生、炎性細胞浸潤和血管翳形成均有改善,骨破壞明顯減輕,尤以T+L組作用更顯著。

圖2 各組大鼠關節病理變化(HE染色 ×100)注:A:正常組;B:CIA組;C:TMP組;D:LEF組;E:T+L組

組別鼠數CRP(μg/ml)PDGF-BB(ng/ml)GMP-140(ng/ml)VCAM-1(ng/ml)正常組10453.95±176.1853.79±20.4142.61±8.07167.62±36.23CIA組10844.44±159.95a134.14±36.54a104.52±14.14a456.48±74.31aTMP組10653.66±113.33b87.68±21.37b52.09±12.45b232.80±28.48bLEF組10563.27±88.78b68.06±36.71b91.74±10.35284.35±57.21bT+L組10489.66±88.94b59.32±22.08b56.07±10.61b224.68±81.21b,c,d
注:與正常組比較:aP<0.01;與CIA組比較:bP<0.05;與TMP組比較:cP<0.05;與LEF組比較:dP<0.01
3.3 各組大鼠血清CRP和PDGF- BB蛋白水平、血漿VCAM- 1蛋白水平和GMP- 140水平變化
表1顯示,與正常組比較,CIA大鼠血清CRP和PDGF- BB蛋白水平、血漿VCAM- 1蛋白水平和GMP- 140水平均顯著上升(P<0.01);與CIA組比較,TMP、LEF、T+L組大鼠血清CRP和PDGF- BB水平均顯著下降(P<0.05);T+L組與TMP、LEF組比較有下降趨勢,但差異無統計學意義(P>0.05);與CIA組比較,TMP、T+L組大鼠血漿GMP- 140水平均顯著下降(P<0.05),LEF組大鼠血漿GMP- 140水平與CIA大鼠比較差異無統計學意義(P>0.05);與CIA組比較,TMP、LEF、T+L組大鼠血漿VCAM- 1水平均顯著下降(P<0.01);與TMP、LEF組比較,T+L組大鼠血漿VCAM- 1水平均顯著下降(P<0.05);TMP組與LEF組比較,VCAM- 1變化差異無統計學意義(P>0.05)。
4 討論
RA屬于中醫“痹癥”范疇。血瘀證是RA的基本病機之一。“血瘀”在RA發病過程中既可以成為主要的發病因素,又可作為其主要的病理機制而貫穿于整個疾病的始終[10]。現代研究發現,血瘀證與血小板活化密切相關,血小板的活化參與了血瘀證的發生發展過程,是血瘀證產生的重要病理生理基礎[6]。
膠原誘導關節炎(collagen- induced arthritis,CIA)模型在關節腫脹、滑膜炎、骨膜新骨形成、關節股侵蝕和骨丟失等方面與人類RA非常接近,是研究人類RA和其他自身免疫性關節炎理想的動物模型[11]。
CRP在感染、炎癥、組織損傷后主要由肝細胞大量分泌產生釋放入血[12],是臨床評價RA病情活動及療效的重要指標,在臨床被廣泛使用[13]。
GMP- 140被認為是血小板活化的特異性標志物[14]。GMP- 140可以介導內皮細胞與中性粒細胞及單核細胞的黏附功能,介導白細胞在內皮細胞上滾動,引起炎癥反應同時激活血小板微顆粒,釋放促炎因子IL- 1、IL- 6等炎性因子和更多的GMP- 140[15],由此循環往復地促使RA滑膜炎癥持續存在和病情的進展。
血管細胞間黏附分子(vascular adhesion molecule- 1,VCAM- 1)在非炎癥狀態表達很低,當受到炎癥刺激時,與表達在單核細胞和嗜酸性粒細胞表面的α4β1整合素結合,使單核細胞、白細胞被捕獲并黏附在內皮細胞表面,聚集于炎癥局部。RA最重要的病理特征是持續存在的滑膜炎,具體表現為滑膜組織中炎性細胞的大量浸潤和血管翳的形成,而黏附分子包括VCAM- 1和GMP- 140在炎性細胞向滑膜組織浸潤侵襲中均發揮重要作用,是介導RA滑膜炎癥過程中單核細胞與內皮細胞之間黏附的主要介質[16]。
血小板源生長因子(platelet- derived growth factor, PDGF)可以顯著加重RA關節炎癥,促進滑膜襯里層細胞的增生及加速骨破壞等作用[17]。PDGF還有很強的致炎性,可以促進IL- 1β誘導PGE2的合成增加,促進TNF- α上調滑膜細胞中IL- 8的表達,促進單核細胞、中性粒細胞活化并增強吞噬細胞吞噬能力等作用[18-19]。
有研究表明,激活的血小板脫顆粒是信號級聯放大的過程[20],其中a顆粒包含大量黏附蛋白、細胞因子、生長因子以及黏附受體,釋放入血后引起炎癥反應、細胞黏附等作用,從而放大血小板激活,募集外周血小板聚集,且可促進血栓的穩定[21]。另外研究表明,血小板活化能夠誘導RA中單核細胞表型向促炎表型轉變,促使單核細胞- 血小板聚合物的形成,誘導促炎因子瀑布式釋放,尤其對處于活動期的RA患者,血小板活化對單核細胞的誘導作用更加明顯[22]。由此可見,血小板活化與炎癥反應之間相互影響,炎癥反應可以誘導血小板活化,血小板活化也可以加速炎癥反應的發生。在RA中,炎性反應與血小板活化之間相互作用,形成一個炎癥- 血小板活化網絡,共同影響RA疾病的進展。
本研究結果顯示,CIA大鼠GMP- 140、VCAM- 1和PDGF- BB表達均顯著升高,提示CIA大鼠血小板活化和炎癥反應的發生,川芎嗪聯合來氟米特可以顯著降低GMP- 140、VCAM- 1和PDGF- BB,結果顯示川芎嗪聯合來氟米特可能通過顯著抑制血小板活化和炎癥反應的發生治療RA,這與大鼠AI評分、關節病理及血清CRP水平結果一致,提示對于RA患者具有潛在的應用價值。
[1] SEHGAL VN, VERMA P.Leflunomide:dermatologic perspective[J].The Journal of dermatological treatment, 2013,24(2):89- 95.
[2] 查青林,何羿婷,盧毓雄,等.血小板數量與中西醫治療類風濕關節炎療效關系的探討[J].中國中西醫結合雜志,2007,27(1):29- 32.
[3] 張荒生,段波.活血化瘀法聯合來氟米特片、美洛昔康分散片治療類風濕關節炎臨床療效觀察[J].遼寧中醫藥大學學報,2011,13(11):181- 182.
[4] 陳可冀,薛梅,殷惠軍.血小板活化與冠狀動脈粥樣硬化性心臟病和血瘀證的關系[J].首都醫科大學學報,2008,29(3):266- 269.
[5] 石志蕓,施賽珠,李曉明,等.血小板活化在腎小球疾病進展和中醫血瘀證中的關聯研究[J].中醫研究,1999,12(3):14- 16.
[6] 姚茹冰,蔡輝,郭郡浩.論血瘀與類風濕關節炎發病及治療的相關性[J].河北中醫,2009,31(5):771- 773.
[7] 馬曉娟,殷惠軍,陳可冀.血瘀證與炎癥相關性的研究進展[J].中國中西醫結合雜志,2007,27(7):669- 672.
[8] HEU JR,KAN YC,HUANG WC,et al. Mechanisms involved in the antiplatelet activity of tetramethylpyrazine in human platelets[J].Thromb Res,1997,NOV1;88(3):259- 270.
[9] CHANG M,ROWLAND CM,GARCIA VE,et al.A Large- Scale Rheumatoid Arthritis Genetic Study Identifies Association at Chromosome 9q33.2[J].Plos Genet,2008,4(6):100- 107.
[10] 何玲,胡蔭奇.類風濕性關節炎與血瘀證關系探討[J].中國中醫基礎醫學雜志,2000,6(6):40- 42.
[11] MIOSSEC P. An update on the cytokine network in rheumatoid arthritis[J]. Current opinion in rheumatology, 2004, 16(3):218- 222.
[12] RHODES B, FURNROHR BG, VYSE TJ. C- reactive protein in rheumatology: biology and genetics[J].Nat Rev Rheumatol,2011,7(5):283- 290.
[13] FUNOVITS J,ALETAHA D,BYKERK V, et al.The 2010 American College of Rheumatology/European League Against Rheumatism classification criteria for rheumatoid arthritis:methodological report phase I[J].Annals of the rheumatic diseases,2010,69(9):1589- 1595.
[14] ARNETT FC,EDWORTHY SM,BLOCH DA,et al.The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis[J]. Arthritis and rheumatism,1988,31(3):315- 324.
[15] FUNOVITS J,ALETAHA D,BYKERK V,et al.The 2010 American College of Rheumatology/European League Against Rheumatism classification criteria for rheumatoid arthritis: methodological report phase I[J].Annals of the rheumatic diseases, 2010, 69(9):1589- 1595.
[16] GROBER JS,BOWEN BL,EBLING H,et al. Monocyte- endothelial adhesion in chronic rheumatoid arthritis.In situ detection of selectin and integrin- dependent interactions[J].The Journal of clinical investigation,1993,91(6):2609- 2619.
[17] VAN BAARSEN LGM,WIJBRANDTS CA,TIMMER TCG,et al.Synovial Tissue Heterogeneity in Rheumatoid Arthritis in Relation to Disease Activity and Biomarkers in Peripheral Blood[J].Arthritis and rheumatism, 2010,62(6):1602- 1607.
[18] CHEON H,SUN YK,YU SJ,et al.Platelet- derived growth factor- AA increases IL- 1beta and IL- 8 expression and activates NF- kappaB in rheumatoid fibroblast- like synoviocytes[J].Scandinavian journal of immunology,2004,60(5):455- 462.
[19] ROSENGREN S,BOYLE DL,FIRESTEIN GS.Acquisition,culture,and phenotyping of synovial fibroblasts[J]. Methods in molecular medicine,2007,135:365- 375.
[20] LI ZY,DELANEY MK,O'BRIEN KA,et al.Signaling During Platelet Adhesion and Activation[J].Arterioscl Throm Vas,2010,30(12):2341- 2349.
[21] REN QS,YE SJ,WHITEHEART SW.The platelet release reaction.just when you thought platelet secretion was simple[J].Curr Opin Hematol,2008,15(5):537- 541.
[22] RONG MY,WANG CH,WU ZB,et al.Platelets induce a proinflammatory phenotype in monocytes via the CD147 pathway in rheumatoid arthritis[J]. Arthritis Res Ther, 2014,16(6):478- 483.
Effect of Ligustrazine Combined with Leflunomide on Platelet Activation and Inflammatory Response in Collagen Induced Arthritis Rats
BAI Jing- an1, BIAN Yan- qin2, NIU Xu- yan1, FAN Dan- ping1, LV Cheng1, JIANG Miao1, ZHAO Ning1△
(1.Institute of Basic Research in Clinical Medicine,China Academy of Chinese Medical Sciences,Beijing 100700,China; 2. Shuguang Hospital,Shanghai University of Traditional Chinese Medicine,Shanghai 201203,China)
Objective: To explore the effect of combination therapy of tetramethylpyrazine(TMP) with leflunomide (LEF) on collagen induced arthritis(CIA) rats. Methods: Totally 50 male SD rats were stratified by body weight.Ten of them were randomly recruited as the normal control group.The rest 40 were established rheumatoid arthritis(RA) model.Forty successfully model rats were randomly divided into 4 groups,i.e.,the CIA group,the TMP group, the LEF group,and the TMP plus LEF group,10 in each group.Each drug intervention group was used corresponding scheme.Observing each joint pathological changes of rats, Serum Levels of CRP and PDGF- BB,and plasma levels of GMP- 140 and VCAM- 1 were detected.Results Compared with normal control group, the joint synovial of CIA rats appear obvious cell proliferation, inflammatory cells infiltration, pannus formation in cartilage. Serum levels of CRP and PDGF- BB,and plasma levels of GMP- 140 and VCAM- 1 were significantly increased. Compared with the CIA group, the drug intervention group rats joint pathological changes in synovial hyperplasia, inflammatory cells infiltration and pannus formation were improved, bone destruction significantly was reduced, T + L group effect is more significant. Arthritis index of rats were decreased of T + L combination group is better than TMP and LEF group. Double joint swelling, hind limbs of rats AI scores are less.Compared with TMP and LEF group, T + L AI value combination group rats significantly reduced; Serum levels of CRP and PDGF- BB were lower, and T + L effect is better than that of TMP and LEF group; plasma levels of GMP- 140 and VCAM- 1 were lower, T + L effect is superior to TMP and LEF group. Conclusion Combination of TMP with LEF could significantly inhibit platelet activation and inflammatory reaction of collagen induced arthritis rats,which has potential application value for RA patients.
Rheumatoid arthritis; Collagen induced arthritis; Combination therapy of tetramethylpyrazine with leflunomide; Platelet activation
國家自然科學基金面上項目(81573845)-從EphB/ephrinB2逆向信號調控滑膜及骨髓中破骨細胞分化探討腎虛在絕經后RA發展中的作用;中國中醫科學院基本科研業務費自主選題資助項目(Z0412)-川芎嗪聯合氟米特治療類風濕關節炎療效分子機制研究
白菁安(1985-),女,北京人,實習研究員,醫學碩士,從事類風濕關節炎的病證關聯研究。
R285.5
B
1006- 3250(2017)07- 0953- 04
2017- 01- 24
△通訊作者:趙 寧,副研究員,醫學博士,從事類風濕關節炎的病證關聯研究,Tel:15801013626,E- mail:zhaon2003@163.com。

