電針對APP/PS1雙轉基因小鼠學習記憶能力及LC3Ⅱ、P62表達水平的影響
高 楊,李麗娜,毛穎秋,周英奕,張學婷,張 磊,薛衛國
(北京中醫藥大學,北京100029)
電針對APP/PS1雙轉基因小鼠學習記憶能力及LC3Ⅱ、P62表達水平的影響
高 楊,李麗娜,毛穎秋,周英奕,張學婷,張 磊,薛衛國*
(北京中醫藥大學,北京100029)
目的 研究電針對APP/PS1雙轉基因小鼠自噬相關蛋白LC3Ⅱ及受體蛋白P62相關的作用機制。方法 將7月齡APP/PS1雙轉基因小鼠隨機分為模型組、電針治療組,以同窩轉基因陰性小鼠為正常對照組。電針治療組予電針涌泉、百會,15 min/次,隔日1次,治療6周,利用Morris水迷宮檢測各組小鼠學習記憶能力以及用Western blot法檢測小鼠海馬區域LC3Ⅱ及P62蛋白的表達。結果 水迷宮結果顯示,模型組與正常對照組比較,逃避潛伏時增加(P<0.01);WB結果顯示,與對照組相比,模型組LC3Ⅱ表達增強,P62表達減弱(P<0.05);與模型組相比,針刺組LC3Ⅱ表達減弱,P62表達增強(P<0.05)。結論 APP/PS1轉基因鼠存在神經元自噬途徑功能亢進,電針可能通過抑制自噬水平,從而改善學習記憶功能。
阿爾茨海默病;APP/PS1;LC3Ⅱ;P62
阿爾茨海默病(AD),又稱老年性癡呆,是一種病因不明的中樞神經系統進行性變性疾病,臨床表現為獲得性認知功能障礙[1]。其主要由大量異常折疊的β淀粉樣蛋白(Aβ)在腦組織中沉積所形成的老年斑引起[2]。細胞內Aβ的降解主要在溶酶體中進行[3]。AD的腦內缺陷是由自噬體逆行運輸至溶酶體,從而觸發營養不良和變性腫脹的軸突上大量自噬泡的聚集[4]。因此,自噬被認為是產生Aβ的一個新途徑[5]。近年來,電針防治AD的療效已得到肯定,治療AD的機制研究也取得新進展。中醫認為癡呆以“腎虛濁阻”為主要病機[6],故治以“益腎祛濁”法[7],電針百會、涌泉,以AD病理中期的7月齡APP/PS1小鼠為研究對象,觀察研究其自噬相關蛋白LC3Ⅱ和自噬底物P62的變化以及針刺對其表達的影響,旨在揭示針刺是否通過早期干預自噬水平從而改善AD學習記憶能力,以期為針灸臨床防治AD奠定理論基礎。
1 材料與方法
1.1 動物模型與分組
1.1.1 動物 選取健康清潔級,5月齡,雄性APP/PS1雙轉基因小鼠為AD動物模型14只。同窩同性別同月齡轉基因陰性鼠7只為正常對照組。體質量(26.8±4.5) g,由南京大學模式動物研究所提供。本實驗經北京中醫藥大學實驗動物倫理委員會批準。
1.1.2 分組 小鼠滿5月齡時稱重排序,利用隨機數表分組,將APP/PS1雙轉基因小鼠14只,分為模型組(M)7只、電針治療組(A)7只,同窩APP/PS1雙轉基因陰性雄性小鼠7只為陰性對照組(W)。
1.1.3 干預方法 電針治療組:將小鼠固定于操作臺上,對照小鼠針灸穴位圖譜及動物解剖學方法,取百會、涌泉穴。選用北京中研太和醫藥公司生產的一次性針灸針,規格0.25 mm×13 mm。針具與穴位常規消毒后刺入2~3 mm,百會穴行手針,雙涌泉穴小幅度捻轉后接入韓式電針儀,采用疏密波,頻率1/50 Hz,強度0.5 mA,以針柄微顫,動物保持不掙扎為度。針刺持續15 min/次,隔日1次。共治療6周。模型組、正常對照組:以相同方法用鼠袋束縛15 min,隔日1次,共束縛6周。
1.2 試劑與儀器 Ⅰ抗:兔源LC3B抗體(美國,Sigma,L7543),兔源P62抗體(美國,Sigma,P0067),鼠源GAPDH(北京中杉金橋,TA-08);Ⅱ抗:鼠源辣根過氧化物標記生物素(北京中杉金橋,ZB-2301),羊源辣根過氧化物標記生物素(北京中杉金橋,ZDR-5307);BCA蛋白定量試劑盒(北京普利萊);酶標儀(Biocell,中國);電泳、電轉儀(Bio-Rad,美國);一次性使用無菌針灸針(0.25 mm×13 mm,北京中研太和醫藥有限公司);韓氏(HANs)LH202H型穴位神經刺激儀(北京華衛產業開發公司)。
1.3 實驗方法
1.3.1 小鼠學習記憶能力檢測 采用Morris水迷宮法檢測各組小鼠的學習記憶能力。各組小鼠針刺6周后進行測試,水溫保持在(22±2)℃,將1個隱藏的平臺浸入1 cm水面之下。各組小鼠連續訓練4 d,以第1、2、4象限池壁中點為出發點,將小鼠面向池壁輕放入水中,允許小鼠尋找平臺的時間為最大60 s,且允許其在平臺上停留30 s,記錄小鼠找到平臺所需要時間,即為潛伏期。
1.3.2 WB檢測小鼠腦海馬LC3Ⅱ與P62的表達 蛋白提取:稱取海馬濕重,加入RIPA裂解液(100 mg/ 1 mL)于冰上充分勻漿,4 ℃、12 000 r/min,離心15 min,然后將上清液轉移到1.5 mL離心管中。
BCA法測上清液蛋白濃度,將蛋白樣品和樣品緩沖液以4∶1的比例混合,95 ℃恒溫水浴5 min。12%的分離膠及5%濃縮膠SDS-PAGE分離膠電泳,100 V,2 h;轉至0.22厚PVDF膜,100 V,60 min。用5%脫脂奶粉加入PBST配置封閉液,室溫搖床封閉2 h。加入一抗,一抗用封閉液稀釋(兔抗鼠LC3B,1∶2 000;兔抗鼠,1∶2 000;抗鼠GAPDH,1∶2 000),4 ℃孵育過夜。PBST漂洗3次,每次5 min。加入二抗,用PBS稀釋二抗(山羊抗兔HRP-IgG,1∶2 000;山羊抗鼠HRP-IgG,1∶5 000),室溫下搖床1.5 h。PBST清洗3次。將ECL發光液滴加至膜上,避光,室溫孵育3 min。暗室內進行X光膠片曝光,顯影、定影,灰度掃描后分析,對各組的LC3Ⅱ、P62分別與GAPDH的灰度值進行相對性比較。
1.4 統計學處理 SPSS 20.0統計軟件進行分析,所有數據用均數±標準差(x±s)表示。若各組數據呈現正態分布,且方差齊,進行單因素方差分析,若方差不齊,用非參數檢驗。Morris水迷宮數據采用重復測量方差分析。以P<0.05為有統計學意義。
2 結果
2.1 Morris水迷宮行為學檢測結果
2.1.1 定位航行實驗 見表1。
2.1.2 空間探索實驗穿越平臺次數及平臺象限停留時長 見表2。
2.2 WB檢測結果 見表3。
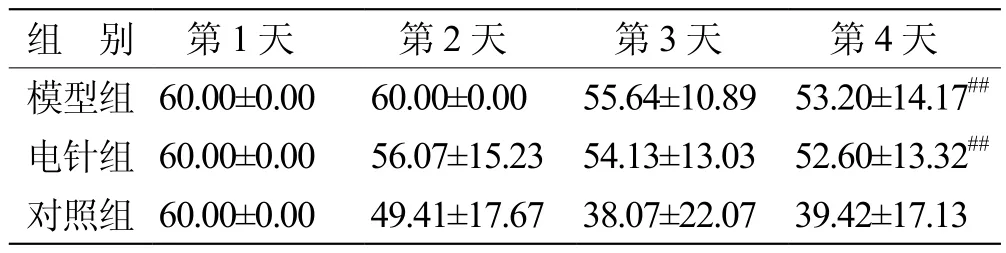
表1 定位航行實驗第一象限(遠離目標象限)入水點逃避潛伏期時的比較(x±s ,n=7)

表2 空間探索實驗第一象限入水點穿越平臺位置次數、平臺象限停留時長的比較(x±s ,n=7)

表3 電針對7月齡APP/PS1鼠LC3II、P62相對表達量的影響(x±s ,n=7)
3 討論
由Aβ聚集和沉積而成的老年斑(SP)是AD腦部典型的病理特征之一[8],被認為是AD發病的始動因素[9]。Aβ由淀粉蛋白前體蛋白(APP)經β-分泌酶和早老素1(PS1)/ γ-分泌酶相繼切割產生[10]。本實驗所用小鼠同時攜帶“瑞典家族”突變的APPswe與PS△E9基因,隨月齡增加出現認知功能的進行性損害,腦組織出現SP沉積及神經元丟失,因此,APP/PS1雙轉基因小鼠是研究AD病理機制及藥物篩選的理想動物模型[11]。本實驗模型組小鼠認知功能的退化,同時也證實了Aβ沉積在AD中扮演了極為重要的角色。
自噬是細胞利用溶酶體降解自身受損的細胞器和錯誤折疊的蛋白質等有害大分子物質的重要途徑[12]。然而,當自噬功能發生障礙時,自噬被過度激活,其異常活躍而亢進的功能將會反作用于AD的發病。研究發現自噬泡(包括自噬體和自噬溶酶體)中富含APP、Aβ及γ-分泌酶,自噬被過度激活可引起Aβ增多,因此自噬泡被認為是產生Aβ的溫床[13]。LC3 II的水平可以反映自噬體和自噬泡的數量,因此常被用作自噬體的指示和標記物。本研究中模型鼠腦中LC3Ⅱ水平的增加是自噬被激活的有力證據。本課題組前期實驗觀察到APP/PS1小鼠腦內Aβ沉積加重,可能系不成熟自噬泡聚集增加,Aβ降解受阻而導致Aβ的沉積增多所致[14-15]。
本研究中7月齡APP/PS1小鼠較之轉基因陰性鼠LC3Ⅱ表達增高、P62降低,同期實驗還證實該轉基因小鼠Aβ水平增高。7月齡APP/PS1小鼠處于AD病程中期,該階段學習記憶能力已經發生負向性改變。同時腦內產生過多的Aβ及其他有害物質,使得神經元內的自噬水平處于高度激活狀態,因而LC3Ⅱ水平增加,而自噬溶酶體降解通路尚未發生故障,可見P62相應減少。因此,在AD病理中期,抑制自噬可能起到一定的保護作用,以其達到治未病的目的。
針刺百會、涌泉兩穴是根據“益腎去濁,開竅醒神”為治療AD的基本法則所制定。本研究觀察了針刺對APP/PS1小鼠學習記憶能力的影響及自噬相關蛋白LC3Ⅱ與P62表達的變化,WB結果表明:轉基因小鼠海馬區中的自噬相關蛋白LC3Ⅱ升高,P62表達減少;同期ELISA實驗轉基因數Aβ水平高于陰性鼠。而針刺能下調LC3Ⅱ,同時增加了P62的表達,其行為學指標得以改善。表明針刺百會、涌泉“益腎祛濁”法治療AD的生物學基礎可能是通過明顯下調LC3Ⅱ,誘導P62表達來平衡細胞內自噬狀態,從而降低腦內有毒物質及Aβ水平,達到改善學習記憶能力,提高認知能力的效果。但針刺對自噬影響的確切機制尚需深入研究,以及對自噬相關通路還有待進一步闡明,以求其明確而更有效的作用靶點。
[1]中華中醫藥協會. 中醫內科常見病診療指南西醫疾病部分[M]. 北京:中國中醫藥出版社, 2008.
[2]BARTH JM,KOHLER K.How to take autophagy and endo -cytosisup a notch [J].Biomed Res Int, 2014:960803.
[3]WAKABAYASHI K, MIKI Y. Deposition and clearance of betaamyloid in the brain. [J]. Brain Nerve 2013, 65(12): 1433.
[4]SONIAC,CORREIA,PAULAI,et al.Autophagyin Alzheimer’s disease: A Cleaning ServiceOut-of-order [J].Toxicity and Autophagy in NeurodegenerativeDisorders,2015(9):123-142.
[5]薛衛國, 張忠, 許紅,等.電針對APP轉基因鼠神經元自噬途徑的影響[J]. 針刺研究, 2014, 39 (4): 272-277.
[6]張田麗,安紅梅. 輕度認知障礙的中醫藥防治[J]. 中華中醫藥學刊, 2015,33(2):333-335.
[7]李芙,李麗娜,王鑫. 電針“百會”“涌泉”對APP/PS 1雙轉基因小鼠海馬β淀粉樣蛋白及低密度脂蛋白受體相關蛋白-1水平的影響[J]. 針刺研究, 2015,40(1):30-34,55.
[8]WANG YR, LIU YH, LIANG CR, et al. Expression profile of p75NTR and its relationship with formation of amyloid plaques in the brain of Alzheimer’ s disease patients[J]. Med JChin PLA, 2014, 39(5): 379-382.
[9]GUO XH, LU H, NIU RN, et al. Detection of serum matrix metalloproteinase 2 and 9 in patients with Alzheimer disease[J]. Zhengzhou Univ(Med Sci), 2014, 49(1): 137-139.
[10]ZHAO FENGLI, QIAO PERIFENG, YAN NING, et al. Hydrogen sulfide selectively inhibits γ-Secretase activity and decreases mitochondrial Aβ production in neurons from APP/PS1 transgenic mice[J].Neurochemical Research, 2016, 41(5): 1145-1159.
[11]DICKEY C A, LORING J F, MONTGOMERY J, et al. Selectively reduced expression of synaptic plasticity-related genes in amyloid precursor protein plus presenilin-1 transgenic mice[J]. Journal of Neuroscience, 2003, 23(12): 5219-5226.
[12]楊璟輝,高曉剛,傅志仁.自噬在肝臟免疫耐受中的作用機制研究進展[J].解放軍醫學雜志, 2014,39(6):503-506.
[13]OHTA K, MIZUNO A, UEDA M, et al. Autophagy impairment stimulates PS1 expression and gamma-secretase activity[J]. Autophagy, 2010, 6(3):345-352.
[14]馬泰,孫國平,李家斌.細胞自噬的研究方法[J].生物化學與生物物理進展, 2012,39(3):204-209.
[15]高堂珂,步青云,高楊,等. 電針對7月齡APP/PS1雙轉基因鼠行為學及海馬微血管壁Aβ沉積影響的研究[J].上海針灸雜志, 2016,35(4):1-5.
Effect of electroacupunctureure intervention on learning and memory ability, LC3Ⅱ and P62 Expression level of APP/PS1 transgenic mice
GAO Yang, LI Lina, MAO Yingqiu, ZHOU Yingyi, ZHANG Xueting, ZHANG Lei, XUE Weiguo*
(Beijing University of Chinese Medicine, Beijing 100029, China)
Objective To investigate the effect of electroacupunctureure on learning and memory ability and its mechanism related to autophagic receptor P62 in APP/PS1 Transgenic mice. Methods The 7-monthold APP / PS1 transgenic mice were randomly divided into model group and EA treatment group and negative transgenic mice were selected into the nomal control group. EA was applied to“Baihui”and“Yongquan”for 15min,once every other day for 6 weeks.The learning-memory ability was detected by using Morris water maze testing, hippocampal LC3Ⅱand P62 were detected using Western blot(WB). Results Results of Morris water maze test showed that the escape latency of model group increased compared with the control group (P<0.01), WB results showed that compared with the control group, the model group LC3Ⅱ expression enhanced, P62 expression decreased (P<0.05); compared with the model group, EA group LC3Ⅱ expression was decreased, P62 expression increased (P<0.05). Conclusion EA intervention can improve learning and memory abilities in APP transgenic model mice, which may contribute to its effect in inhibiting neuronal autophagy.
Alzheimer’s disease; APP/PS1; LC3Ⅱ; P62
R245.31
A
2095-6258(2017)04-0523-04
2016-9-10)
10.13463/j.cnki.cczyy.2017.04.003
國家自然科學基金資助項目(81273826)。
高 楊(1990 -),女,碩士研究生,主要從事針灸治療腦病機理研究。
*通信作者:薛衛國,男,博士研究生導師,電話-3718809670,電子信箱-snowmanxue@126.com

