經尿道灌注干細胞白血病重組基因慢病毒對糖尿病膀胱病變豚鼠膀胱功能的影響
余運運,王勤章,王子雄,錢彪,丁國富,徐浩,張思源
(石河子大學醫學院第一附屬醫院,新疆石河子832000)
·基礎研究·
經尿道灌注干細胞白血病重組基因慢病毒對糖尿病膀胱病變豚鼠膀胱功能的影響
余運運,王勤章,王子雄,錢彪,丁國富,徐浩,張思源
(石河子大學醫學院第一附屬醫院,新疆石河子832000)
目的 探討經尿道灌注干細胞白血病重組(SCL)基因慢病毒對糖尿病膀胱病變(DCP)豚鼠膀胱功能的改善作用。方法 采用單次腹腔注射鏈脲佐菌素(STZ)法建立豚鼠糖尿病模型,培養12周后建立DCP模型。選取DCP豚鼠20只,隨機分為模型組、SCL組各10只。取未造模的10只作為對照組。各組麻醉后經尿道插入自制尿管,排空尿液,對照組和模型組均經尿管灌注PBS液0.2 mL,SCL組經尿管灌注最佳感染復數(MOI)的SCL基因慢病毒0.2 mL(2×107IU)。灌注后結扎尿管,保留膀胱灌注液2 h。灌注后28 d時用代謝籠收集三組24 h尿量;行尿動力學檢測,于膀胱排尿后即刻測殘余尿量、最大膀胱容量、排尿期最大逼尿肌壓、單次排尿周期灌注量、膀胱順應性。切除完整膀胱,排盡尿液后稱量膀胱濕重。結果 與對照組相比,模型組和SCL組24 h尿量、膀胱濕重、最大膀胱容量、殘余尿量均增加,最大逼尿肌壓、膀胱順應性均降低(P均<0.05);與模型組相比,SCL組24 h尿量、膀胱濕重、最大膀胱容量、殘余尿量均降低,最大逼尿肌壓、膀胱順應性均增加(P均<0.05)。結論 經尿道灌注SCL慢病毒能夠顯著改善DCP豚鼠的膀胱功能,為治療DCP提供了新的途徑與方法。
糖尿病膀胱病變;慢病毒;干細胞白血病基因;膀胱功能;Cajal間質細胞;豚鼠
糖尿病膀胱病變(DCP)是糖尿病導致的泌尿系統慢性并發癥之一,發病率占糖尿病患者的25%~85%[1]。其臨床特征表現為膀胱充盈功能受損,膀胱容量增大,收縮功能降低和殘余尿量增加,嚴重影響患者的生活質量[2]。目前認為其發病機制包括神經功能障礙、逼尿肌功能改變和膀胱上皮功能障礙等,是多因素共同作用的結果[3]。近年研究發現,膀胱逼尿肌存在一種類似胃腸道的Cajal間質細胞(ICC),命名為膀胱ICC細胞,并推測該細胞就是膀胱的起搏細胞,能夠調控逼尿肌的收縮。進一步研究發現,高糖環境導致的膀胱內ICC細胞功能受損和數量減少是DCP的發病機制之一[4]。膀胱ICC細胞能夠特異性表達酪氨酸蛋白激酶生長因子受體(c-kit),c-kit 基因轉錄調控區存在干細胞白血病基因(SCL)結合位點,SCL能夠通過c-kit基因啟動子調節c-kit表達。研究發現,SCL過表達能上調c-kit的表達[5]。但目前,對于SCL在DCP治療中的作用尚無明確認識。2016年2~8月,我們對DCP豚鼠經尿道灌注SCL基因重組慢病毒,探討其對DCP膀胱功能的改善作用,為臨床治療DCP奠定理論基礎。
1 材料與方法
1.1 實驗動物及材料 普通級荷蘭種健康雄性豚鼠60只,6~8周齡,體質量250~350 g,購自新疆醫科大學動物實驗中心。鏈脲佐菌素(STZ,Sigma公司);檸檬酸與檸檬酸鈉(上海化工試劑公司);烏拉坦(國藥集團化學試劑有限公司);血糖儀及試紙(美國強生公司);SCL慢病毒(上海吉凱恩公司);尿動力學檢測儀(加拿大Laborie公司);大小鼠代謝籠(型號B6-10,江蘇蘇州市蘇杭科技器材有限公司);眼科手術剪;自制豚鼠用尿管(由麻醉用的硬膜外導管改良而成,每次使用前后消毒滅菌)。
1.2 SCL基因慢病毒表達載體的構建及重組慢病毒的包裝 對 SCL基因質粒進行PCR 擴增,上游引物序列為 5′-GAGGATCCCCGGGTACCGGTCGCCACCATGACCGAGCGGCCGCCGAG-3′,下游引物序列為5′-TCACCATGGTGGCGACCGGCCGAGGGCCGGCTC-CATC-3′。將人SCL基因質粒的PCR擴增產物提純,通過In-Fusion轉換酶的催化作用將人SCL基因質粒的PCR產物與GV287-EGF結合,形成重組質粒GV287-EGFP/SCL,即含人SCL基因慢病毒載體。提取重組質粒GV287-EGFP/SCL陽性克隆菌落PCG模板上的交換轉化產物,直至長出菌落后加入到10 μL培養基混勻,抽取1 μL混合物設置模板,通過PCF法進行基因擴增,與陽性轉化子對接后分裝測序。以293T細胞為包裝細胞,制備編碼慢病毒的重組病毒質粒及2種輔助包裝原件載體質粒,3種質粒分別進行高純度無內毒素提純,按照Lipofectamine2000轉染試劑盒使用說明轉染293T細胞,轉染8 h后更換為完全培養基,培養48 h,收集含人SCL基因慢病毒載體的細胞上清液,對其濃縮后得到高低度的含人SCL基因慢病毒載體濃縮液,熒光法在293T細胞中測定病毒滴度為2×108IU。
1.3 動物模型制備及分組方法 60只豚鼠適應性喂養1周后,隨機選取50只,禁食12 h后按200 mg/kg單次腹腔注射1%的STZ(0.1 mol/L、pH 4.4的枸櫞酸緩沖液)制備糖尿病模型。全價飼養6周后剪耳法檢測隨機血糖,以隨機血糖連續4周≥16.7 mmol/L為糖尿病模型制備成功。糖尿病模型誘導成功后繼續全價飼養6周,參考糖尿病豚鼠DCP標準[6,7],STZ單次腹腔注射12周后88. 89%的糖尿病豚鼠發生DCP病變,建立較為可靠的DCP動物模型。選取DCP豚鼠20只,采用隨機數字表法分為模型組、SCL組各10只。未造模的10只作為對照組,給予等量的枸櫞酸緩沖液單次腹腔注射。
1.4 SCL基因慢病毒轉染方法 各組禁食水6 h,200 g/L烏拉坦1.5 g/kg麻醉后經尿道插入自制尿管,排空尿液。對照組和模型組均經尿管灌注PBS液0.2 mL,SCL組灌注最佳感染復數(MOI)的SCL基因慢病毒0.2 mL(2×107IU)[8]。灌注后結扎尿管,保留膀胱灌注液2 h。
1.5 24 h尿量、膀胱濕重檢測 慢病毒灌注后28 d時,用代謝籠收集三組豚鼠24 h尿量;在尿動力學檢測結束后,切除完整膀胱,排盡尿液后稱量膀胱濕重。
1.6 尿動力學檢查 烏拉坦麻醉生效后,仰臥固定,碘伏消毒下腹部,恥骨上作切口顯露膀胱。兩個41/2號留置針分別自膀胱頂刺入,其中一個與微量泵相連,另一個與尿動儀壓力感受器相連,結扎兩側輸尿管。37 ℃生理鹽水以0.25 mL/min的速度進行膀胱灌注,進行充盈性膀胱測壓。連續記錄10個排尿周期,待膀胱排尿后即刻測殘余尿量。最大膀胱容量為單次充盈周期膀胱灌注量與殘余尿量之和。排尿期最大逼尿肌壓及單次排尿周期灌注量均取10個排尿周期中各指標的均值。膀胱順應性為單次充盈周期膀胱灌注量與充盈期膀胱內壓力變化的比值。以上各項參數均取3次實驗的平均值。
2 結果
2.1 各組24 h尿量及膀胱濕重比較 與對照組比較,模型組和SCL組24 h尿量及膀胱濕重均增加(P均<0.05);與模型組比較,SCL組24 h尿量及膀胱濕重均降低(P均<0.05)。見表1。
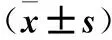
表1 各組24 h尿量、膀胱濕重比較
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05。
2.2 各組尿動力學參數比較 與對照組比較,模型組和SCL組最大膀胱容量、殘余尿量均增加,最大逼尿肌壓、膀胱順應性均降低(P均<0.05)。與模型組比較,SCL組最大膀胱容量、殘余尿量均降低,最大逼尿肌壓、膀胱順應性均增加(P均<0.05)。見表2。
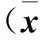
表2 各組尿動力學參數比較±s)
注:與對照組比較,*P<0.05;與模型組比較,#P<0.05。
3 討論
DCP是糖尿病的常見并發癥之一,其進展呈隱匿性,在糖尿病早期即可發生,隨著病程的延長膀胱功能損傷進行性加重[9,10]。Satriano等[11]研究認為,DCP膀胱肥大可能是尿量增多的適應性結果。而殘余尿量增多與逼尿肌和膀胱順應性降低有關,表明膀胱逼尿肌收縮和舒張功能受損是膀胱失代償的結果。本研究結果顯示,與對照組相比,模型組24 h尿量及膀胱濕重均增加,考慮為糖尿病利尿狀態下,膀胱代償性增生所致,長期進展導致膀胱出現結構和功能損害;與對照組比較,模型組最大膀胱容量、殘余尿量均增加,最大逼尿肌壓、膀胱順應性均降低,提示DCP豚鼠出現膀胱功能受損,表現為最大膀胱容量、殘余尿量明顯增加,最大逼尿肌壓、膀胱順應性降低。
研究發現,膀胱ICC細胞具有維持逼尿肌的起搏功能和膀胱張力、協調逼尿肌運動功能[12,13]。ICC細胞在被抑制的情況下,膀胱逼尿肌收縮功能明顯下降。ICC細胞膜上c-kit與其配體干細胞因子(SCF)結合后可啟動SCF/c-kit信號通路,該信號通路在維持ICC細胞表型和功能中具有重要作用[14]。DCP患者膀胱內ICC細胞SCF/c-kit信號傳導受阻,可導致ICC細胞功能受損、數量減少或消失。而SCL基因是c-kit上游重要的調控基因,能夠作用于c-kit基因的啟動子,具有強烈的促進c-kit表達的作用。研究發現,SCL 過表達可使 c-kit 表達升高,并對SCF 反應性恢復正常,修復受損的SCF/c-kit信號通路[15]。于建超等[16]通過SCL基因重組慢病毒高效地轉染了體外培養的豚鼠膀胱ICC,并成功介導SCL在ICC中的表達。周建民等[17]以腺病毒為載體,將SCL基因導入體外高糖環境培養的ICC,成功上調c-kit mRNA和蛋白的表達,顯著改善了ICC的形態以及功能損害,提示通過促進DCP膀胱中ICC細胞表型和功能的恢復,進而改善膀胱功能是可行的。本研究發現,與模型組相比,SCL組24 h尿量及膀胱濕重均降低,最大膀胱容量、殘余尿量均減少,最大逼尿肌壓、膀胱順應性均增加,提示SCL組豚鼠排尿效率顯著提高,膀胱功能得到一定程度的改善,表明SCL基因重組慢病毒能夠改善DCP豚鼠的膀胱功能。其作用機制可能與上調c-kit表達,逆轉SCF/c-kit信號通路相關,進而促進DCP膀胱中ICC細胞表型和功能的恢復。
基因治療是DNA或RNA水平上人為地將某些外源性的基因導入相應的靶細胞,從而獲得表達繼而產生特定的生物學效應,以達到治療的目的[18]。腺病毒、腺相關病毒、慢病毒以及非病毒載體等均可將目的基因整合至靶細胞,其中以慢病毒載體轉染效率最高、容量大,能夠感染原代細胞和非分裂細胞,保證轉導的基因長期穩定表達,且無病毒蛋白的表達,自身免疫反應小,應用越來越廣泛。傳統的基因治療多通過血管導入基因載體,這樣基因載體可通過血流分布至全身,造成一定程度的浪費,且安全性差。近年來,通過膀胱灌注途徑進行基因治療泌尿系統上皮腫瘤已在國內外廣泛應用。研究[8]表明,通過尿道將腺病毒等基因載體灌入小鼠膀胱內后,膀胱腫瘤細胞內能夠檢測到目的基因的蛋白產物,且未發現在肝、肺等其他組織表達,因此本研究構建的SCL基因重組慢病毒經由尿道途徑灌注入膀胱內,可在保證較高轉染率的同時,避免肝、腎等其他部位的毒性反應,也減少慢病毒的浪費。
綜上所述,經尿道灌注將SCL基因慢病毒轉染豚鼠DCP膀胱后,能夠顯著改善DCP豚鼠的膀胱功能,為治療DCP提供了新的途徑與方法。
[1] Shi Z. Prevalence of diabetes among men and women in China[J]. N Eng J Med, 2010,362(25):1090-1100.
[2] 石小霄,王艷濱,王瑞雪,等.糖尿病膀胱病的發病機制及診斷[J].中國綜合臨床,2015,31(4):368-369.
[3] 羅豐偉,黎瑋.糖尿病膀胱功能障礙的研究進展[J].臨床薈萃,2016,31(6):689-692.
[4] McCloskey KD. Interstitial cells in the urinary bladder-localization and function[J]. Neurourol Urodyn, 2010,29(1):79-82.
[5] Perrotte P, Wood M, Slaton JW, et al. Biosafety of in vivo adenovirus-p53 intravesical administration in mice[J]. Urology, 2000,56(1):155-159.
[6] 李維仁,王勤章,丁國富,等.豚鼠糖尿病膀胱模型的建立[J].現代泌尿外科雜志,2008,13(5):368-370.
[7] 羅廣承,何志華,羅建珍,等.構建糖尿病膀胱病豚鼠模型及其尿動力學評價[J].中國組織工程研究,2014,18(7):1063-1068.
[8] 魏艷青,王江平,王勤章,等.經尿道灌注慢病毒轉染豚鼠膀胱的研究[J].天津醫藥,2015,43(11):1275-1277.
[9] 王東文,雙衛兵,吳博威.糖尿病膀胱尿動力學及逼尿肌功改變的相關性研究[J].中華泌尿外科雜志,2006,27(5):314-317.
[10] Sasaki K, Yoshimura N, Chancellor MB. Implications of diabetes mel1itus in urology[J]. Clin Urol North Am, 2003,30(1):1-12.
[11] Satriano J. Kidney growth, hypertrophy and the unifying mechanism of diabetic complications[J]. Amino Acids, 2007,33(2):331.
[12] Smet PJ, Jonavicius J, Marshall VR, et al. Distribution of nitric oxide svnthase immunoreactive nerves and identincation of the ceuular targets of nitric oxide in guinea-pig and human unary bladder by cGMP immunohistochemistry[J]. Neumscience,1996,71(2):337-348.
[13] Anderson UA, Carson C, McCloskev KD. KCNO currents and their conttibution to resting membrane potential and excitability of interstitial cells d cajal from the guinea pig bladder[J]. J Uml, 2009,182(3):330-336.
[14] Wang DW, Shuang WB, Wu BW. The relationship between urodynamic findings and detrusor changes of diabetic cystopathy [J]. Chinese J Urolo, 2006,27(5):314-317.
[15] Li F, Zhang L, Li C, et al. Adenovirus-mediated stem cell leukemia gene transfer induces rescue of interstitial cells of Cajal in ICC- loss mice[J]. Int J Colorectal Dis, 2010,25 (5):557-566.
[16] 于建超,王勤章,王江平,等.含人干細胞白血病基因慢病毒載體轉染Cajal樣間質細胞的效果研究[J]. 中國全科醫學,2016,19 (15) :1796-1802.
[17] 周建民,丁國富,王勤章,等.應用 AdMax 載體系統構建 SCL基因重組腺病毒表達載體[J].中國現代醫學雜志,2011,21(17): 1949-1952.
[18] 劉業六,張逖,楊曉鐘,等.可調控慢病毒介導白細胞介素-12治療結腸癌的研究[J].中華實驗外科雜志,2014,31(8):1749-1751.
國家自然科學基金資助項目 (81360120)。
王勤章(E-mail: wqz1969@sina.com)
10.3969/j.issn.1002-266X.2017.30.008
R587.2
A
1002-266X(2017)30-0030-03
2017-03-12)

