妊娠期糖尿病患者外周血Sfrp5、FoxM1水平與胰島素抵抗的關系
孟莉
(蘇州大學附屬第一醫院,江蘇蘇州215006)
妊娠期糖尿病患者外周血Sfrp5、FoxM1水平與胰島素抵抗的關系
孟莉
(蘇州大學附屬第一醫院,江蘇蘇州215006)
目的 探討妊娠期糖尿病(GDM)患者血清分泌型卷曲相關蛋白5(Sfrp5)、血漿Fox基因家族成員FoxM1水平與胰島素抵抗的關系。方法 選擇GDM患者56例(GDM組)及正常產婦56例(對照組),采集空腹靜脈血檢測空腹胰島素(FINS)、空腹血糖(FPG),并計算胰島素抵抗指數(HOMA-IR),分別采用ELFSA法和實時熒光PCR法檢測血清Sfrp5水平及血漿FoxM1 mRNA水平,并分析其與HOMA-IR的相關性。結果 GDM組血清FPG、FINS、HOMA-IR和血漿FoxM1 mRNA水平均高于對照組(P均<0.05),GDM組血清Sfrp5水平低于對照組(P<0.05)。GDM患者HOMA-IR與血清Sfrp5水平呈負相關(r=-0.571,P<0.01),與血漿FoxM1 mRNA水平呈正相關(r=0.613,P<0.01)。結論 GDM患者血清Sfrp5水平降低且與胰島素抵抗呈負相關,血漿FoxM1水平增加且與胰島素抵抗呈正相關。
妊娠期糖尿病;胰島素抵抗;FoxM1基因;分泌型卷曲相關蛋白5
妊娠期糖尿病(GDM)指孕婦在孕前無糖尿病或僅有糖耐量減退,在妊娠期發生的糖尿病[1],是危害母體和胎兒健康的常見妊娠合并癥[2]。流行病學調查顯示,我國GDM發生率為1%~5%[3]。除了對孕婦本身的遠期危害外,GDM也可對圍產期胎兒造成危害,導致流產、胎兒宮內生長受限、巨大兒、新生兒低血糖、新生兒呼吸窘迫綜合征等[4]。目前尚不清楚GDM的發病機制,研究表明胰島素抵抗在GDM所致的不良結局中發揮重要作用[5]。血清分泌型卷曲相關蛋白5(Sfrp5)是脂肪因子的一種,具有增加胰島素敏感性、調節血糖的作用[6]。Fox基因家族成員FoxM1是調控細胞周期和有絲分裂的重要基因,近期研究發現其可能參與了胰島素抵抗[7]。2014年1月~2016年1月,我們檢測了56例GDM患者血清Sfrp5及血漿FoxM1 mRNA的表達情況,并分析其與胰島素抵抗的關系。
1 資料與方法
1.1 臨床資料 選擇同期在我院產檢的GDM患者56例為GDM組,年齡22~38(30.55±4.13)歲,孕周(38.8±1.4)周。GDM診斷標準參照人民衛生出版社出版的《婦產科學》(第8版)[2]。納入標準:①初產婦;②單胎活產;③無不良生活嗜好;④孕期未使用過皮質激素;⑤非人工輔助生育;⑥孕期在我院進行連續產檢。排除標準:①孕前有糖尿病及糖尿病家族史;②胎兒畸形;③合并高血壓、肝腎功能不全、多囊卵巢綜合征、內分泌疾病等。選擇同期在我院體檢的糖耐量正常產婦56例為對照組,年齡與GDM組配對,排除孕前BMI≥24 kg/m2和糖尿病家族史,且空腹血糖<7 mmol/L、任意血糖<11.0 mmol/L。兩組產婦年齡、孕周具有可比性。本研究經過醫院倫理委員會審查,所有研究對象自愿簽署知情同意書。
1.2 血糖檢測及胰島素抵抗水平測算 抽取兩組空腹肘靜脈血2 mL,應用Cobase601全自動電化學發光分析儀檢測空腹胰島素(FINS)、FPG。計算穩態模型胰島素抵抗指數(HOMA-IR)=FPG×FINS/22.5。
1.3 血清Sfrp5水平檢測 兩組患者于清晨空腹時采集肘靜脈血4 mL,離心取血清。采用ELISA法檢測血清Sfrp5水平,試劑盒購自美國R&D公司,操作嚴格按照說明書進行。
1.4 血漿FoxM1 mRNA檢測 采用德國QIAGEN公司的全血RNA試劑盒提取血漿RNA,采用美國Bio-Rad公司的RT-PCR試劑盒逆轉錄合成cDNA,采用Bio-Rad公司的SYBR定量PCR試劑盒進行實時熒光定量PCR檢測FoxM1 mRNA。引物和內參基因均通過GenBank檢索得到,由TAKARA公司合成。mRNA表達水平采用2-ΔΔCt法進行計算。
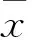
2 結果
2.1 兩組血清FPG、FINS、HOMA-IR、Sfrp5及血漿FoxM1 mRNA水平比較 GDM組血清FPG、FINS、HOMA-IR和FoxM1 mRNA表達水平均高于對照組(P均<0.05),GDM組血清Sfrp5水平低于對照組(P<0.05)。見表1。
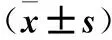
表1 兩組血清FPG、FINS、HOMA-IR、Sfrp5及血漿FoxM1 mRNA水平比較
2.2 GDM患者血清Sfrp5、血漿FoxM1 mRNA水平與胰島素抵抗的相關性 GDM患者HOMA-IR與血清Sfrp5水平呈負相關(r=-0.571,P<0.01),與血漿FoxM1 mRNA水平呈正相關(r=0.613,P<0.01)。
3 討論
GDM的發病原因與2型糖尿病(T2DM)相同,與胰島素抵抗和胰島β細胞功能降低有關[8]。目前許多學者認為,胰島素抵抗可能先于胰島β細胞功能降低[9]。妊娠過程中大量孕酮、雌激素、胰島素酶等抵抗胰島素活性的激素增加,這些激素結合到靶組織上,可降低胰島素的敏感性,導致孕婦出現一過性的、生理性的胰島素抵抗狀態,機體為了補償胰島素水平的“相對不足”而上調胰島素釋放水平,當代償分泌的胰島素仍不足以調節血糖時,則出現糖耐量異常[9],繼而發生GDM。GDM患者的糖代謝在產后能回復正常,但會增加將來患T2DM的風險,約60%的GDM產婦最終發展為T2DM[10]。本研究發現,GDM組血清FPG、FINS、HOMA-IR均高于對照組,提示GDM患者的血糖水平及HOMA-IR增高,可能與胰島素抵抗有關。
妊娠期孕婦攝入能量增加,為胎兒生長提供能量和營養,同時也為母體儲存能量,若沒有良好的飲食指導,很容易出現脂肪快速積累。目前研究證實,脂肪組織除了儲存能量外,還可能是體內重要的且十分活躍的內分泌器官,其分泌的多種脂肪因子直接或間接參與了體內多種代謝[11]。Sfrp5是最近研究比較多的一種脂肪因子,動物研究發現其在肥胖小鼠血清中降低,給正常小鼠注入Sfrp5后,可增加胰島素敏感性,促進葡萄糖攝入和脂肪合成[12]。研究發現,糖尿病患者脂肪組織中的Sfrp5基因表達水平顯著降低[13]。本研究發現,GDM組血清Sfrp5水平低于對照組,且GDM患者HOMA-IR與血清Sfrp5水平呈負相關,表明GDM患者體內Sfrp5分泌受到影響,可能是導致胰島素抵抗的一個重要因素,Sfrp5表達下調是胰島素抵抗的特征表現。
胰島素抵抗的發生除了胰島素敏感性降低,可能還與胰島細胞的增殖改變有關。FoxM1是Fox家族的成員,是與細胞增殖密切相關的轉錄因子,在具有分裂活性的細胞內高表達,對調控細胞周期和有絲分裂起重要作用[8]。在多種腫瘤細胞中發現FoxM1異常高表達,且與預后不良具有相關性。最新的研究顯示,FoxM1可能參與了胰島素抵抗的發展過程,當GDM患者體內出現胰島素敏感性降低時,FoxM1表達上調,促進胰島β細胞增生,分泌更多胰島素以代償胰島素敏感性降低的影響[14]。此外,FoxM1并不是作為單一因素影響胰島細胞,當FoxM1表達上調時,會激活一系列與胰島β細胞增殖、分泌及血糖調節有關的基因。已有研究發現,在肥胖患者胰島組織中FoxM1基因及其靶基因表達水平均顯著增高[15],且FoxM1基因的表達水平與患者BMI具有相關性。本研究發現,GDM患者血漿FoxM1 mRNA水平增高,并且與GDM患者HOMA-IR呈正相關,提示FoxM1基因表達水平增加參與了GDM的發病過程,并且與GDM的發展密切相關。
綜上所述,GDM患者血清Sfrp5水平降低且與胰島素抵抗呈負相關,血漿FoxM1水平增加且與胰島素抵抗呈正相關;血漿Sfrp5和FoxM1 mRNA可用于早期發現和診斷GDM,二者之間的關系和作用機制還有待進一步研究。
[1] 王璇,陳廷美,于德純,等.IADPSG標準下妊娠期糖尿病發病率及危險因素調查[J].實用醫學雜志,2014,30(8):1318-1320.
[2] 羅靜,常青,王廷洲,等.新妊娠期糖尿病診斷標準與圍生期母兒結局分析[J].實用婦產科雜志,2012,28(9):755-758.
[3] 蔡慧華,何援利,王雪峰,等.糖化血紅蛋白聯合空腹血糖檢測在妊娠期糖尿病篩查中的應用價值[J].實用婦產科雜志,2014,30(3):205-208.
[4] 趙旭,李嶸娟.時間-空間相關成像技術用于評估妊娠期糖尿病孕婦胎兒心臟收縮功能的臨床研究[J].中國計劃生育學雜志,2014,22(6):417-420.
[5] 段娥,李英勇.補充維生素D對妊娠期糖尿病孕婦胰島素抵抗的影響[J].中國婦幼保健,2014,29(9):1449-1451.
[6] Tumurbaatar B, Poole AT, Olson G, et al. Adipose tissue insulin resistance in gestational diabetes[J]. Metab Syndr Relat Disord,2017,15(2):86-92.
[7] 潘寶龍,馬潤玫.脂肪因子Vaspin體外表達與妊娠期糖尿病胰島素抵抗研究[J]. 實用醫學雜志,2016,32(19):3123-3126.
[8] Shirakawa J, Fernandez M, Takatani T, et al. Insulin signaling regulates the FoxM1/PLK1/CENP-A pathway to promote adaptive pancreatic β cell proliferation[J].Cell Metab, 2017,25(4):868-882.
[9] 任茜,馬宇航,黃倩芳,等.血清甘油三酯對初診妊娠期糖尿病患者胰島β細胞功能及胰島素抵抗的影響[J].中華糖尿病雜志,2014,6(9):640-644.
[10] 韓一栩.兩種血糖監測方法在妊娠期糖尿病和2型糖尿病合并妊娠患者中的應用效果觀察[J].海南醫學,2015,26(14):2122-2124.
[11] Grkem A, Küükler FK, Torul C, et al. Are adipokines associated with gestational diabetes mellitus[J]. J Turk Ger Gynecol Assoc, 2016,17(4):186-190.
[12] Oztas E, Ozler S, Ersoy E, et al. Prediction of gestational diabetes mellitus by first trimester serum secreted frizzle-related protein-5 levels[J]. J Matern Fetal Neonatal Med, 2016,29(9):1515-1519.
[13] Hu Z, Deng H, Qu H. Plasma SFRP5 levels are decreased in Chinese subjects with obesity and type 2 diabetes and negatively correlated with parameters of insulin resistance[J]. Diabetes Res Clin Pract, 2013,99(3):391-395.
[14] Banerjee RR, Cyphert HA, Walker EM, et al. Gestational diabetes mellitus from inactivation of prolactin receptor and MafB in islet β-cells[J]. Diabetes, 2016,65(8):2331-2341.
[15] Davis DB, Lavine JA, Suhonen JI, et al. FoxM1 is up-regulated by obesity and stimulates beta-cell proliferation[J]. Mol Endocrinol, 2010,24(9):1822-1834.
江蘇省科技計劃發展項目(BK2014189)。
10.3969/j.issn.1002-266X.2017.30.014
R714.25;R587.1
B
1002-266X(2017)30-0048-03
2017-02-10)

