不同葡萄糖轉運途徑相關基因的過表達對菌株葡萄糖代謝及產物合成的影響
劉冬冬,張偉國,徐建中,田成福
(江南大學 生物工程學院,工業生物技術教育部重點實驗室,江蘇 無錫,214122)
研究報告
不同葡萄糖轉運途徑相關基因的過表達對菌株葡萄糖代謝及產物合成的影響
劉冬冬,張偉國*,徐建中*,田成福
(江南大學 生物工程學院,工業生物技術教育部重點實驗室,江蘇 無錫,214122)
磷酸烯醇式丙酮酸-葡萄糖磷酸轉移酶系統(phosphoenolpyruvate-dependent glucose phosphotransferase system, PTSGlc)和不依賴于PTSGlc系統葡萄糖轉運系統在葡萄糖轉運和磷酸化過程中起重要作用。該文通過在葡萄糖代謝緩慢的L-賴氨酸產生菌Corynebacteriumglutamicum(C.glutamicum) ZL-8中過表達肌醇透性酶基因(iolT1)、葡萄糖激酶基因(ppgk)和EIIGlc基因(ptsG),研究葡萄糖轉運途徑相關基因對葡萄糖代謝速率、L-賴氨酸及副產物合成的影響。與出發菌株C.glutamicumZL-8相比,重組菌C.glutamicumZL-8/pECXK-99E-ppgk-iolT1(葡萄糖激酶酶活力提高了768%)和C.glutamicumZL-8/pDXW-8-ptsG(PTSGlc系統酶活力提高了62.7%)葡萄糖消耗速率分別提高了16.7%和27.3%,L-賴氨酸產量分別提高了24.7%和16.4%。此外,有機酸和氨基酸分析結果表明,過表達不同葡萄糖轉運途徑基因對有機酸(丙酮酸、乳酸和乙酸)和副產物氨基酸(丙氨酸、纈氨酸、天冬氨酸)具有不同的影響。
谷氨酸棒桿菌;葡萄糖轉運途徑;葡萄糖代謝速率;L-賴氨酸
L-賴氨酸是人體及動物自身不能合成的必需氨基酸之一,廣泛應用于飼料添加劑、食品添加劑及醫藥中間體等方面[1]。自1960年經紫外誘變選育了1株產L-賴氨酸的谷氨酸棒桿菌缺陷型變異株,從此開始了發酵法生產L-賴氨酸[2]。目前用于選育L-賴氨酸生產菌的出發菌株多為谷氨酸棒桿菌(Corynebacteriumglutamicum)及其亞種,如黃色短桿菌(Brevibacteriumflavum)、乳酸發酵短桿菌(Brevibacteriumlactofermentus)等,而發酵生產L-賴氨酸糖質原料主要是葡萄糖。
在谷氨酸棒桿菌中,葡萄糖的吸收形式主要通過磷酸烯醇式丙酮酸-葡萄糖磷酸轉移酶系統(phosphoenolpyruvate-dependent glucose phosphotransferase system, PTSGlc)[3]以基團轉移的方式進行(圖1)。PTSGlc系統是葡萄糖特異性轉運和磷酸化途徑,是由酶I (EI)、HPr和EIIGlc組成的磷酸傳遞鏈[4]。首先EI以PEP為磷酸供體自身發生磷酸化,EI將來自PEP的磷酰基團依次傳遞給HPr、EIIGlc和葡萄糖,最后將葡萄糖磷酸化為葡萄糖-6-磷酸。其中,EIIGlc主要參與葡萄糖轉運,是由2個親水性胞質結構域(IIA和IIB)和跨膜結構域IIC(通常由約350個氨基酸殘基形成6或8個跨膜螺旋)組成單肽鏈蛋白[5]。
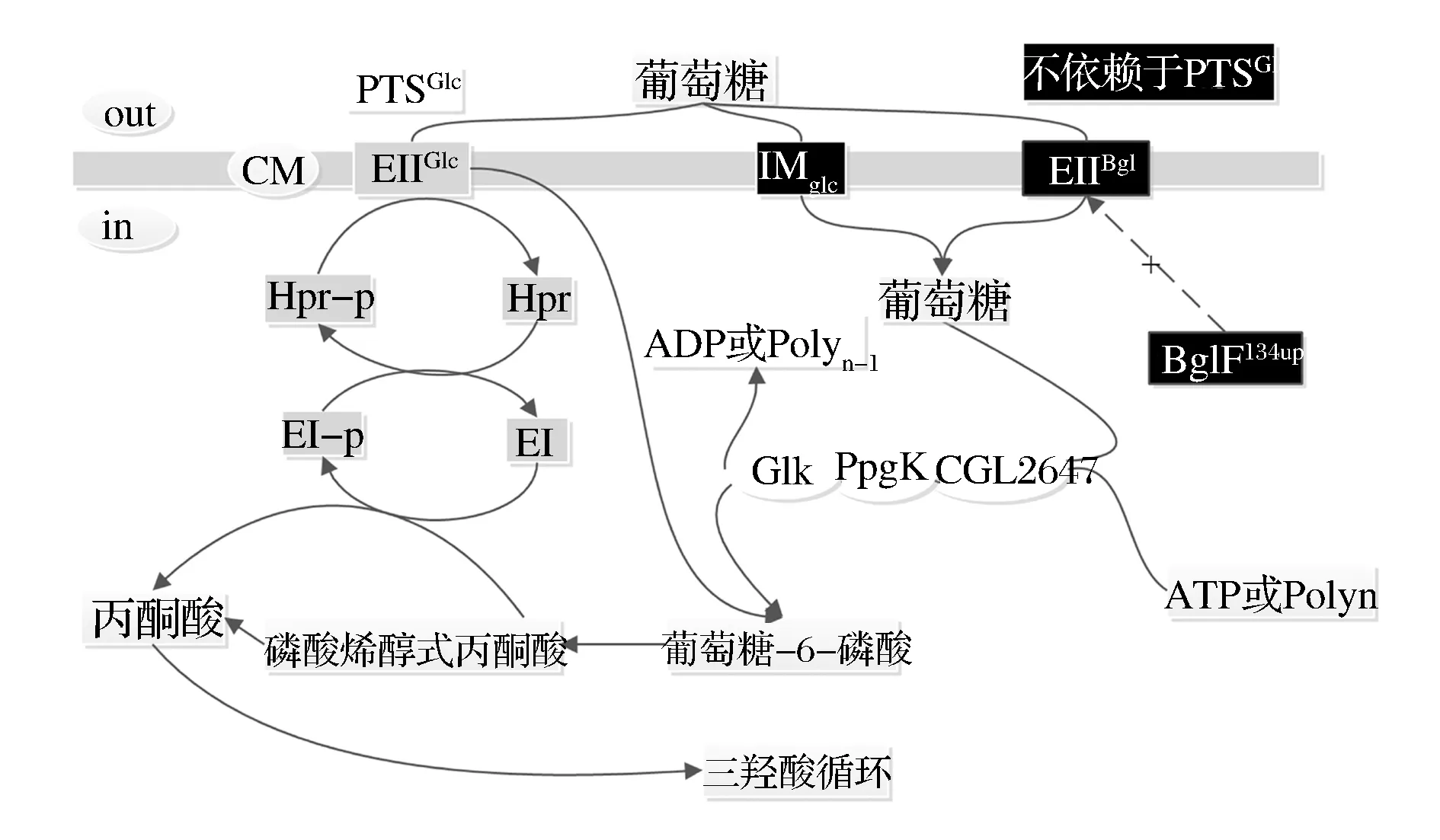
圖1 谷氨酸棒桿菌中葡萄糖轉運途徑簡圖[13]Fig.1 Glucose transport systems in C. glutamicum
隨著對糖代謝的研究深入,近年來有研究者發現谷氨酸棒桿菌中存在著不依賴于PTSGlc系統葡萄糖轉運途徑。2011年IKEDA等[6]在谷氨酸棒桿菌中發現了不依賴PTSGlc系統葡萄糖轉運途徑,該途徑由肌醇透性酶IolT1/IolT2(由基因iolT1和iolT2編碼)和葡萄糖激酶(分別由ppgk和glk編碼的PpgK和GlK)組成。此外,2015年IKEDA等[7]又在C.glutamicumATCC 31833中發現了另一條由EIIbglF透性酶和葡萄糖激酶組成葡萄糖轉運途徑(圖1)。PTSGlc系統在參與葡萄糖轉運和磷酸化過程中,需要大量消耗L-賴氨酸前體物質磷酸烯醇式丙酮酸(PEP),并產生乙酸、乳酸等抑制菌體生長;而不依賴PTSGlc系統葡萄糖轉運途徑中,葡萄糖激酶是以ATP或多聚磷酸(polyphosphate, PolyP)為磷酸供體,不需要消耗PEP。另有研究表明,強化不依賴PTSGlc系統葡萄糖轉運途徑利用葡萄糖,可有效減小葡萄糖轉運速率,使胞內糖酵解和檸檬酸循環之間的碳流代謝處于較為平衡狀態,進而減少乳酸和乙酸分泌[8-10],使菌體生長代謝較為平衡,積累更多的目的產物。張傳志[11]、蔡恒等[12]研究表明,通過過表達iolT1和ppgk基因,可以提高目的產物苯丙氨酸、丁二酸產量,而在一定程度上降低副產物乳酸和乙酸等的積累。
本研究通過在C.glutamicumZL-8中過量表達來源于C.glutamicumATCC 13032的ptsG、iolT1和ppgk基因,分析出發菌株C.glutamicumZL-8及重組菌C.glutamicumZL-8/pECXK-99E-ppgk-iolT1和C.glutamicumZL-8/pDXW-8-ptsG在搖瓶發酵時葡萄糖消耗速率和L-賴氨酸產量,同時分析了發酵液中副產物,如有機酸和其他氨基酸的產量變化。研究結果可為基于遺傳改造葡萄糖轉運途徑選育高產L-賴氨酸等氨基酸生產菌株提供理論依據。
1 材料與方法
1.1實驗材料與試劑
1.1.1 菌株和質粒
C.glutamicumZL-8、E.coliJM109、E.coliBL21,穿梭表達質粒pDXW-8、pECXK-99E均為本研究室保藏,重組質粒pDXW-8-ptsG、pECXK-99E-ppgk-iolT1為本研究構建。
1.1.2 主要試劑
限制性內切酶EcoRI、XbaI、KpnI、pstI、sacI,T4DNA連接酶、TaqDNA聚合酶、DNA Marker均購于寶生物工程有限公司,PCR相關試劑、基因組DNA提取試劑盒、DNA凝膠回收試劑盒、PCR產物純化試劑盒、質粒小量提取試劑盒和膜蛋白提取試劑盒均購于上海生工生物工程有限公司,其他試劑均為國產分析純。
1.1.3 培養基
LB培養基(g/L):蛋白胨 10,酵母粉 5,NaC1 10,pH 7.0。
LBG培養基(g/L):蛋白胨 10,酵母粉5,NaC1 10,葡萄糖 5,pH 7.0。
Epo培養基(g/L):蛋白胨 10,酵母粉 5,甘氨酸 30,異煙肼 4,NaCl 10,Tween 80 1,用于制備C.glutamicum感受態細胞。
完全培養基(g/L):葡萄糖 5,蛋白胨 10,牛肉浸膏 10,NaCl 5,瓊脂 20。
種子培養基(g/L):葡萄糖 25,玉米漿 30,甜菜糖蜜 8,(NH4)2SO42,KH2PO42,MgSO4·7H2O 0.8,FeSO4·7H2O 0.025,MnSO40.025,硫胺素 0.001 1,生物素0.000 35,煙酰胺0.012 5,CaCO330。pH 7.0~7.2,0.1 MPa滅菌20 min。50 mL種子培養基裝于500 mL三角瓶中,接種搖瓶培養,30℃、100 r/min 培養20~24 h。
發酵培養基(g/L):葡萄糖 80,(NH4)2SO445,玉米漿 20,甜菜糖蜜12,K2HPO41,KH2PO41,MgSO4·7H2O 1.5,FeSO4·7H2O 0.02,MnSO40.02,硫胺素0.000 45,生物素0.000 85,煙酰胺0.008,CaCO340。pH 7.0~7.2,90 kPa滅菌10 min,5 mL種子液轉接到裝有50 mL發酵培養基的500 mL的搖瓶中,30 ℃、100 r/min發酵60 h。
1.2實驗方法
1.2.1 葡萄糖轉運途徑相關基因克隆及表達載體pDXW-8-ptsG、pECXK-99E-ppgk-iolT1的構建
根據NCBIC.glutamicumATCC 13032的全基因組核酸序列中葡萄糖轉運途徑相關基因序列(NCBI Reference Sequence: NC_003450.3)設計ptsG(NCgl130)、ppgk(NCgl1835)、iolT1(NCgl0178)的引物,并分別在基因ptsG和ppgk上游引物中引入合成的SD序列。各基因引物見表1。
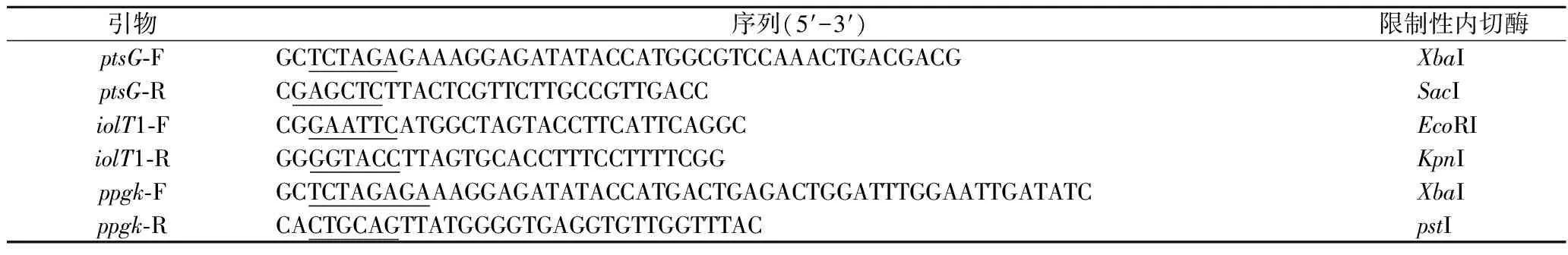
表1 本研究使用的引物
提取C.glutamicumATCC 13032基因組DNA為模板,PCR擴增獲得目的基因片段ptsG、iolT1、ppgk,各基因PCR擴增相關信息見表2。所得各基因片段經膠回收、酶切、與具有相同酶切末端的線性化質粒22℃連接過夜,轉化E.coliJM109,經過抗性平板篩選,挑取轉化子菌落PCR,選取較亮條帶對應單菌落進行液體培養,提取質粒進行酶切驗證(圖2),經測序驗證正確。
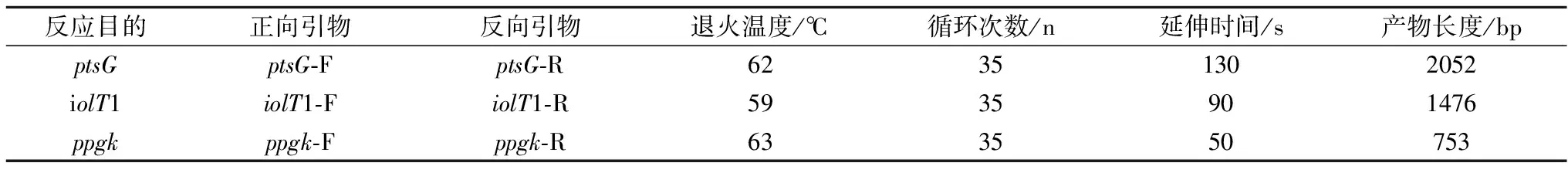
表2 研究中PCR反應相關信息
1.2.2 重組菌C.glutamicumZL-8/pDXW-8-ptsG和C.glutamicumZL-8/pECXK-99E-ppgk-iolT1的構建
根據vander Rest等建立的方法[14]采用電轉化法將構建成功的重組表達載體pDXW-8-ptsG和pECXK-99E-ppgk-iolT1電轉化至C.glutamicumZL-8中,在卡那霉素終質量濃度為25 μg/mL的LBHIS固體平板上30 ℃培養36 h,挑選陽性轉化子并液體培養,提取質粒進行單雙酶切驗證(圖2),驗證正確后得到重組菌C.glutamicumZL-8/pDXW-8-ptsG和C.glutamicumZL-8/pECXK-99E-ppgk-iolT1。
1.2.3 酶蛋白在谷氨酸棒桿菌中的表達
谷氨酸棒桿菌粗酶液制備[15]:離心收集菌體,所得菌體用50 mmol/L冰冷的KH2PO4(pH 7.0)洗滌2次,然后菌懸液通過超聲破碎(100個循環,工作2 s,間歇3 s),經4 ℃、10 000 r/min離心30 min除去細胞碎片,上清液即為粗酶液。所得上清液用于葡萄糖激酶酶活力的測定和SDS-PAGE分析;由于基因iolT1和ptsG編碼的蛋白IolT1和EIIGlc為膜蛋白,因此谷氨酸棒桿菌膜蛋白的提取是利用購自生工生物工程(上海)股份有限公司的膜蛋白提取試劑盒,然后用于SDS-PAGE分析。其中,EIIGlc酶活通過測定PTSGlc系統酶活性間接反映。
1.2.4 葡萄糖激酶活性測定[16]
反應體系體積為1 mL,反應組成包括10 mmol /L葡萄糖、0.5 mmol/L NADP、4.5 mmol /L MgCl2、10 mmol/L PolyP20、5 mmol/L β-巰基乙醇及0.5 U 6-磷酸葡萄糖脫氫酶。采用分光光度計法測定并繪制NADPH在340 nm的標準吸光曲線;然后取20 μL粗酶液催化反應體系,分別測定反應體系含10 mmol/L PolyP20和不含PolyP20時的吸光度D340 nm之差 (ΔD340 nm),根據標準吸光曲線計算NADPH生成量。1個酶活力(U)定義為:每分鐘催化生成1 μmol/L葡萄糖-6-磷酸所需的酶量。
1.2.5 PTSGlc系統酶活性測定
菌體預處理[17]:培養獲得的菌體用0.2% KCl洗滌2次,然后加入5 mL含10%聚乙二醇6 000、二硫蘇糖醇(30 mmol/L)和Tris-HCl(pH7.5,100 mmol/L)溶液重懸;向上述菌體中添加200 μL甲苯進行滲透,隨后于室溫下劇烈攪拌1min;最后得到的菌體用Tris-HCl緩沖液(pH7.5,100 mmol/L)洗滌2次,并用1 mL相同緩沖液重懸,用于測定PTSGlc系統酶活性。
酶活性測定[18]:反應組成包括Tris-HCl緩沖液(pH7.5,100 mmol/L)、PEP(10 mmol/L)、MgCl2(5 mmol/L)、二硫蘇糖醇(30 mmol/L)、葡萄糖(10 mmol /L)、20 μL菌體處理液,反應體系總體積為0.5 mL(未添加葡萄糖時體積為0.45 mL)。反應體系在30℃預培養10 min,添加0.05 mL葡萄糖(100 mmol/L)開始反應,反應溫度30 ℃、反應時間10 min,然后加入0.1 mL 30%偏磷酸終止反應。經過離心得到含有丙酮酸的上清液進行下一步實驗。偶聯反應組成:TES-NaOH緩沖液(0.5 mol/L,pH7.5)、NADH(0.15 mmol /L)50 μg乳酸脫氫酶(LDH)和0.1 mL PTSGlc反應上清液,反應總體積2.1 mL。反應添加LDH前后分別測定在340 nm處吸光度。采用分光光度計法測定并繪制NADH在340 nm的標準吸光曲線。1個酶活力(U)定義為:每分鐘催化生成1 μmol丙酮酸所需酶量。
1.2.6 分析方法
菌體濃度測定:將發酵液稀釋26倍,測定562 nm處的吸光值。
葡萄糖測定:將發酵液離心(9 000×g,2 min)除去CaCO3及菌體,然后稀釋100倍,經生物傳感分析儀SBA-40C(山東省科學院生物研究所)測定。
有機酸含量測定:發酵液中有機酸含量的測定參照文獻[19]采用高效液相色譜法。
氨基酸含量測定:發酵液中氨基酸含量測定參照文獻[20]采用氨基酸自動分析儀。
葡萄糖吸收速率測定:在初始葡萄糖為80 g/L的發酵培養基中,接種量為10%,每2 h取樣測定發酵液中葡萄糖含量,計算葡萄糖消耗速率。
2 結果與分析
2.1表達載體和重組菌株的構建
以C.glutamicumATCC 13032基因組為模板,PCR擴增獲得基因ptsG、iolT1和ppgk,先后經過純化、酶切、與具有相同酶切末端表達載體酶連、轉化E.coliJM109、菌落PCR,挑取陽性轉化子,經液體培養提取質粒,質粒單雙酶切及PCR進行驗證(圖2A),各基因片段大小正確(表2),以構建質粒載體為模板擴增各基因,測序比對正確,證明重組表達載體pECXK-99E-ppgk-iolT1、pDXW-8-ptsG構建成功。
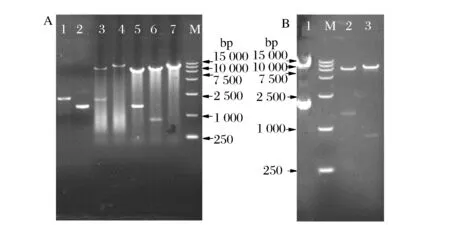
A:M-DL15000 Marker; 1-基因ptsG PCR產物;2-基因iolT1 PCR產物;3-pDXW-8-ptsG SacI+SacII雙酶切產物ptsG;4-pDXW-8-ptsG SacI 單酶切產物;5-pECXK-99E-ppgk-iolT1 KpnI+EcoRI雙酶切產物iolT1;6-pECXK-99E-ppgk-iolT1 KpnI+pstI雙酶切產物ppgk;7-pECXK-99E-ppgk-iolT1 EcoRI 單酶切產物 B-1 ZL-8/pDXW-8-ptsG SacI+ SacII雙酶切產物ptsG;2-pECXK-99E-ppgk-iolT1 KpnI+EcoRI雙酶切產物iolT1;3-pECXK-99E-ppgk-iolT1 KpnI+pstI雙酶切產物ppgk圖2 PCR產物及質粒pDXW-8-ptsG、pECXK-99E-ppgk-iolT1單雙酶切驗證Fig.2 Enzyme digestion and PCR analysis of the recombinant plasmid pDXW-8-ptsG, pECXK-99E-ppgk-iolT1
將構建成功的重組表達載體pDXW-8-ptsG、pECXK-99E-ppgk-iolT1電轉化至C.glutamicumZL-8中,在卡那霉素終質量濃度為25 μg/mL的LBHIS固體平板上30 ℃培養36 h,挑取陽性克隆菌鏡檢,液體培養提取質粒進行酶切驗證(圖2B),由圖2B可知,重組菌C.glutamicumZL-8/pDXW-8-ptsG、C.glutamicumZL-8/pECXK-99E-ppgk-iolT1構建成功。
2.2不同葡萄糖轉運途徑相關基因在C.glutamicumZL-8中酶活性測定及SDS-PAGE分析
為了確定外源基因ppgk、iolT1和ptsG是否在ZL-8中正常表達,本文利用SDS-PAGE及酶活測定實驗驗證(如圖3),從3A中可以看出,在大小26.7 kDa有條帶明顯變粗且顏色加深,與基因ppgk編碼蛋白PpgK大小一致,酶活測定分析重組菌粗酶液酶活力為0.27 U/mL,較出發菌株提高了768%,說明外源基因ppgk在C.glutamicumZL-8中成功表達;從圖3B中可以看出,在54 kDa及72.6 kDa各處有一條帶,且顏色稍深,分別與基因iolT1和ptsG編碼膜蛋白IolT1、EIIGlc大小一致,EIIGlc活性可通過PTSGlc系統酶活性間接反映,預處理菌株測定PTSGlc系統酶活力,重組菌PTSGlc系統酶活力為2.21 U/mL,較出發菌株提高了62.7%,由此說明外源基因iolT1和ptsG在C.glutamicumZL-8中成功表達。
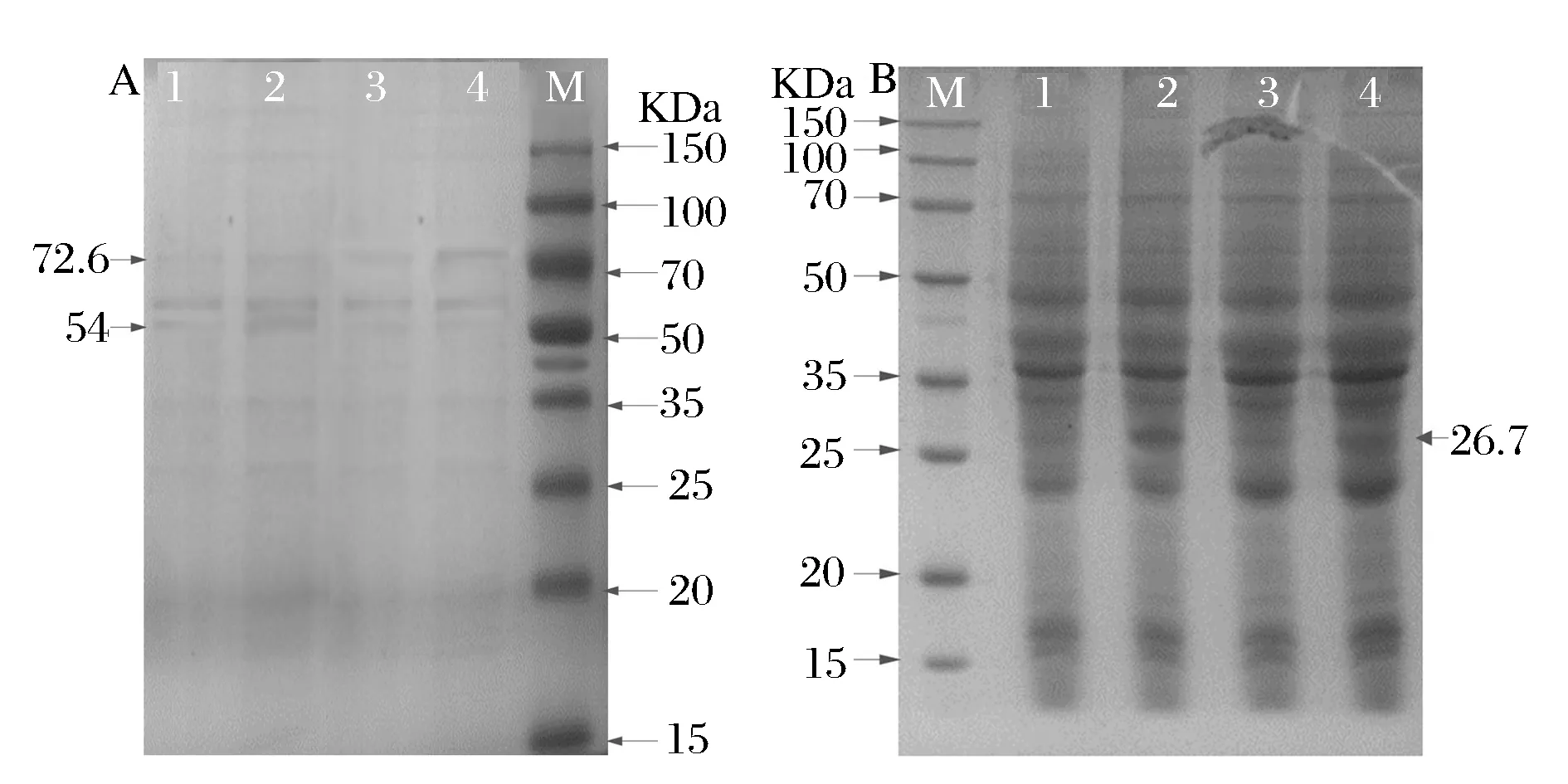
M-蛋白質標準分子量Marker;A:1-C. glutamicum ZL-8/pECXK-99E-ppgk-iolT1未經IPTG誘導膜蛋白;2-C. glutamicum ZL-8/pECXK-99E-ppgk-iolT1經IPTG誘導膜蛋白; 3-C. glutamicum ZL-8/pDXW-8-ptsG未經IPTG誘導膜蛋白;4-C. glutamicum ZL-8/pDXW-8-ptsG經IPTG誘導膜蛋白;B:1-C. glutamicum ZL-8/pECXK-99E-ppgk未經IPTG誘導全細胞蛋白;2-C. glutamicum ZL-8/pECXK-99E-ppgk經IPTG誘導全細胞蛋白;3-C. glutamicum ZL-8/pECXK-99E-ppgk-iolT1未經IPTG誘導全細胞蛋白;4-C. glutami-cum ZL-8/pECXK-99E-ppgk-iolT1經IPTG誘導全細胞蛋白圖3 C. glutamicum ZL-8中外源基因ptsG、iolT1和ppgk 蛋白表達電泳驗證圖Fig. 3 The electrophoresis of protein encoded by ptsG,olT1 and ppgk gene in C. glutamicum ZL-8
2.3不同葡萄糖轉運途徑相關基因過表達對菌體生長的影響
出發菌株C.glutamicumZL-8為葡萄糖代謝緩慢的L-賴氨酸產生菌,葡萄糖消耗速率緩慢。為了強化菌株的葡萄糖代謝能力,在出發菌株中過量表達葡萄糖轉運途徑相關基因ptsG、iolT1和ppgk,研究不同葡萄糖轉運相關基因的過表達對菌體生長的影響。出發菌株和重組菌株搖瓶種子(圖4A)和發酵生長曲線(圖4B)。

表3 重組谷氨酸棒桿菌中蛋白酶活性測定
注:“-”沒有檢測。
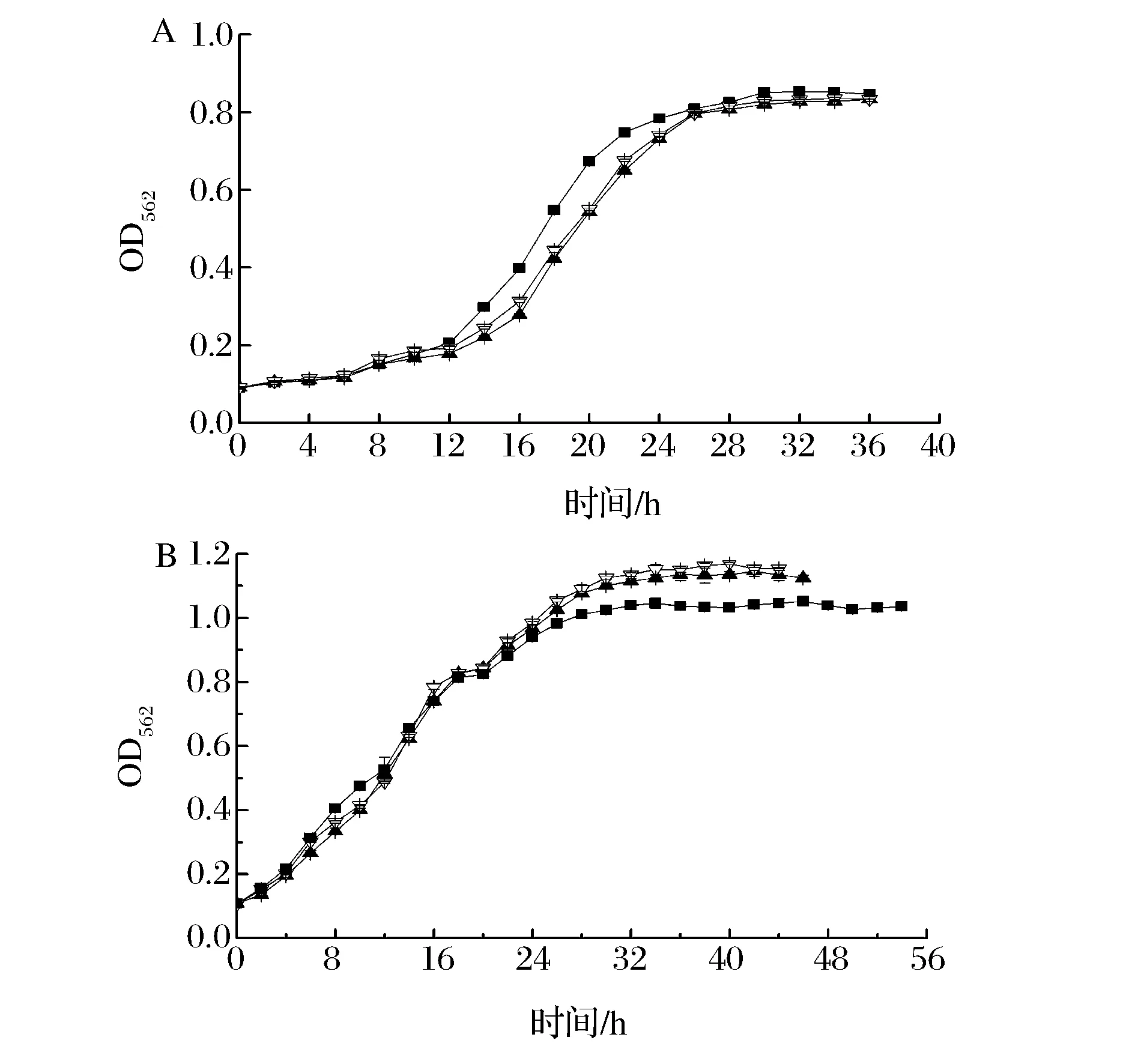
■-C. glutamicum ZL-8;▲-C. glutamicum ZL-8/pECXK-99E-ppgk-iolT1;▽-C. glutamicum ZL-8/pDXW-8-ptsG圖4 出發菌株和重組菌株菌體生長曲線Fig.4 The growth curve of the oringinal and recombinant strains
由圖4A可知,重組菌與出發菌株生長趨勢基本一致,但生長較為緩慢,并且最終菌體生物量也略低。由于搖瓶種子培養期間未添加誘導劑,重組菌中外源基因未表達及表達載體對菌體生長具有一定的抑制作用[21],致使重組菌生長相對緩慢。從圖4B可以看出,添加終濃度為1 mmol/L異丙基-β-D-硫代半乳糖苷(Isopropyl β-D-1-thiogalactopyranoside, IPTG)前(接種培養12 h時添加),出發菌株生長快于重組菌株;發酵16 h至發酵結束,由于添加了誘導劑,重組菌中外源基因過量表達,生長速率加快、菌體生物量明顯高于出發菌株,強化了菌株葡萄糖代謝能力。與重組菌C.glutamicumZL-8/pECXK-99E-ppgk-iolT1相比,重組菌C.glutamicumZL-8/pDXW-8-ptsG生長速率及最終菌體生物量稍高,但不明顯。有研究表明[22],不依賴于PTSGlc系統葡萄糖轉運途徑轉運葡萄糖約占葡萄糖轉運總數的15%。因此僅從菌體生長方面可知,過表達基因ptsG與同時過表達基因iolT1和ppgk并無明顯區別。
2.4不同葡萄糖轉運途徑相關基因過表達對菌體葡萄糖消耗速率及L-賴氨酸合成的影響
搖瓶發酵出發菌株C.glutamicumZL-8及重組菌C.glutamicumZL-8/pECXK-99E-ppgk-iolT1、C.glutamicumZL-8/pDXW-8-ptsG,發酵期間定期取樣測定葡萄糖含量和L-賴氨酸產量并繪制發酵曲線(圖5)。
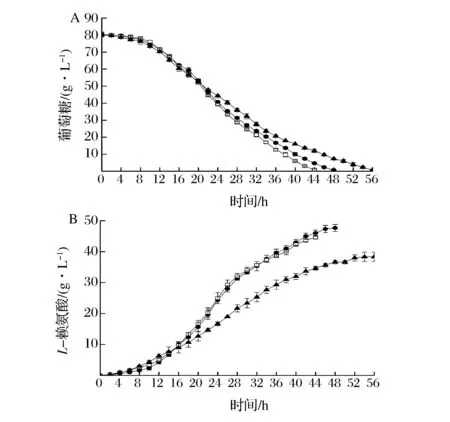
▲-C. glutamicum ZL-8;●-C. glutamicum ZL-8/pECXK-99E-ppgk-iolT1;□-C. glutamicum ZL-8/pDXW-8-ptsG圖5 出發菌株和重組菌株在搖瓶培養條件下葡萄糖消耗速率和L-賴氨酸產量Fig.5 The consumption rate and L-lysine yield of oringinal and recombinant strains in shake flask culture
由圖5可知,發酵結束后出發菌株C.glutamicumZL-8發酵液中L-賴氨酸為38.3 g/L,重組菌C.glutamicumZL-8/pDXW-8-ptsG、C.glutamicumZL-8/pECXK-99E-ppgk-iolT1L-賴氨酸產量分別為44.6、47.7 g/L,與C.glutamicumZL-8相比,L-賴氨酸產量分別提高了16.4%、24.7%,同時發酵周期也分別縮短了12、8 h,說明重組菌葡萄糖代謝能力顯著增強。重組菌C.glutamicumZL-8/pDXW-8-ptsG和C.glutamicumZL-8/pECXK-99E-ppgk-iolT1產酸速率基本一致,耗糖速率稍快于后者,而糖酸轉化率稍低。由于PTSGlc系統轉運葡萄糖效率高于不依賴于PTSGlc系統葡萄糖轉運途徑,消耗了大量胞內PEP,生成較多的丙酮酸及其衍生物質如乳酸、丙氨酸、纈氨酸等,使糖酸轉化率降低。而不依賴于PTSGlc系統葡萄糖轉運途徑中葡萄糖激酶以ATP或PolyP為磷酸供體,從而積累較多的胞內PEP,更多的直接經磷酸烯醇式丙酮酸羧化酶催化生成賴氨酸前體物質草酰乙酸,避免生成大量丙酮酸而降低糖酸轉化率。
2.5不同菌株發酵液中副產物有機酸和氨基酸含量分析
LINDNER等[8]研究表明,過量表達基因iolT1和ppgk可降低副產物丙酮酸及其衍物質如乳酸、丙氨酸和纈氨酸等的積累。為進一步研究過量表達不同葡萄糖轉運途經相關基因對L-賴氨酸發酵副產物如有機酸和其他氨基酸的影響,發酵賴氨酸結束后測定有機酸和氨基酸濃度。測定結果見表4。
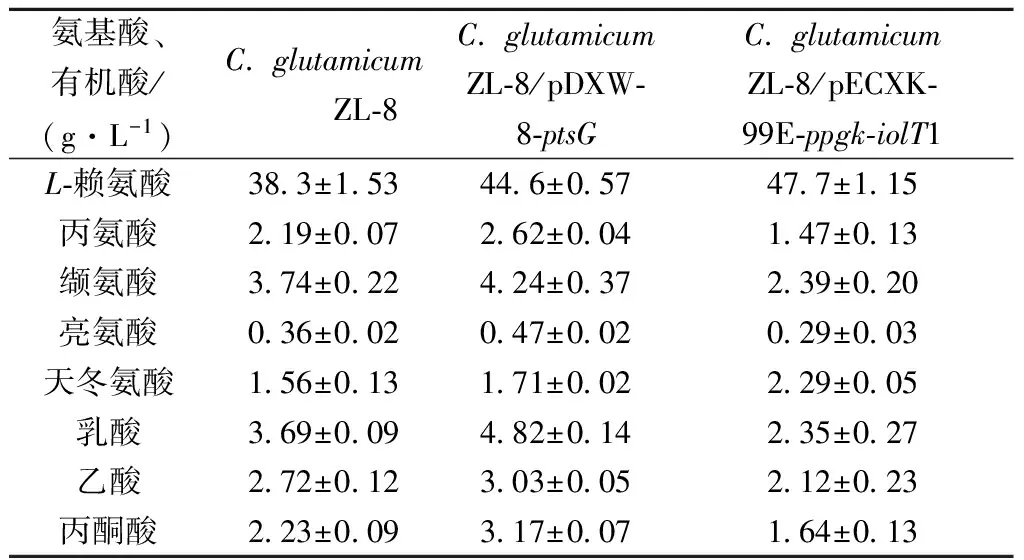
表4 C. glutamicum ZL-8與C. glutamicum ZL-8/pDXW-8-ptsG、C. glutamicum ZL-8/pECXK-99E-ppgk-iolT1發酵液中氨基酸和有機酸含量比較
發酵液中氨基酸測定結果表明,重組菌C.glutamicumZL-8/pECXK-99E-ppgk-iolT1和C.glutamicumZL-8/pDXW-8-ptsG發酵液中L-賴氨酸含量分別為47.7、44.6 g/L,較出發菌株的38.3 g/L分別提高了24.7%、16.4%。其他氨基酸如丙氨酸、纈氨酸和天冬氨酸含量變化較為明顯(表4),重組菌C.glutamicumZL-8/pDXW-8-ptsG發酵液中丙氨酸和纈氨酸較出發菌株C.glutamicumZL-8分別提高了19.6%、13.4%,天冬氨酸含量變化不明顯;而重組菌C.glutamicumZL-8/pECXK-99E-ppgk-iolT1發酵液中丙氨酸和纈氨酸含量分別降低了22.9%、36.1%,天冬氨酸含量升高了46.7%。由于過表達基因ptsG,提高了葡萄糖轉運速率,同時也生成了較多的丙酮酸及其衍生物質丙氨酸、纈氨酸等;而基因iolT1、ppgk的過量表達不以PEP為磷酸供體,降低了丙酮酸及其衍生物質的生成,而天冬氨酸積累量的提高,是由于天冬氨酸至L-賴氨酸合成途徑中關鍵酶(天冬氨酸激酶)活性較低。
發酵液中有機酸測定結果表明,同時過量表達基因iolT1和ppgk降低了以PEP為磷酸供體葡萄糖的消耗,使更多的PEP直接經磷酸烯醇式丙酮酸羧化酶催化生成草酰乙酸,降低了副產物如丙酮酸、乳酸、乙酸等的生成,重組菌C.glutamicumZL-8/pECXK-99E-ppgk-iolT1發酵液中乳酸、乙酸、丙酮酸含量分別為2.35、2.12、1.64 g/L,比出發菌株的3.69、2.72、2.23 g/L分別降低了36.4%、22.1%、26.5%;而過表達基因ptsG消耗較多的PEP,因此產生了較多的丙酮酸及丙酮酸衍生物質(有機酸)。重組菌C.glutamicumZL-8/pDXW-8-ptsG發酵液中的上述3種有機酸較出發菌株分別提高了30.6%、11.4%、42.1%。大量研究表明[8,11-12]強化不依賴于PTSGlc系統葡萄糖轉運途,可使碳代謝更加平衡、副產物減少、主產物率提高等優點。
3 結論
本研究對葡萄糖代謝緩慢的賴氨酸產生菌C.glutamicumZL-8進行基因工程改造,克隆來源于C.glutamicumATCC 13032 EIIGlc基因(ptsG)、肌醇透性酶基因(iolT1)和葡萄糖激酶基因(ppgk),構建重組質粒pDXW-8-ptsG、pECXK-99E-ppgk-iolT1,將重組質粒電轉化至C.glutamicumZL-8,構建重組菌C.glutamicumZL-8/pECXK-99E-ppgk-iolT1、C.glutamicumZL-8/pDXW-8-ptsG,對重組菌株及出發菌株進行搖瓶發酵實驗,與C.glutamicumZL-8相比,重組菌C.glutamicumZL-8/pECXK-99E-ppgk-iolT1葡萄糖激酶酶活力提高了768%,而C.glutamicumZL-8/pDXW-8-ptsGPTSGlc系統酶活力也提高了62.7%,兩重組菌菌體生物量明顯提高、發酵周期分別縮短了8、12 h,說明重組菌葡萄糖代謝能力顯著增強,L-賴氨酸產量也分別提高了24.7%、16.4%;同時測定發酵液副產物如有機酸和其他氨基酸,重組菌C.glutamicumZL-8/pECXK-99E-ppgk-iolT1發酵液中副產物如乳酸、乙酸和纈氨酸等均有不同程度的降低,而重組菌C.glutamicumZL-8/pDXW-8-ptsG發酵液中副產物均有一定程度升高。由于過量表達基因ptsG高效轉運葡萄糖,一定程度上破壞碳代謝平衡,使得副產物增多、糖酸轉化率降低;而同時過量表達基因ppgk和iolT1,葡萄糖消耗速率稍低于過表達基因ptsG,同時降低了以PEP為磷酸供體磷酸化葡萄糖的消耗,使更多的PEP經磷酸烯醇式丙酮酸羧化酶催化生成草酰乙酸,避免生成大量丙酮酸造成碳代謝不平衡,也減少了不利于菌體生長物質如乙酸、乳酸等大量積累。
張傳志[11]為了減少質粒使用,將整合基因ppgk-iolT1整合到基因組ptsI位點上;蔡恒等[12]發現調節因子IolR抑制葡萄糖激酶基因的表達,通過敲除基因iolR增強葡萄糖激酶基因的表達。為進一步強化菌株葡萄糖代謝能力、提高糖酸轉化率、降低副產物,有必要缺陷PTSGlc系統、將ppgk和iolT1整合至基因組上,同時敲除抑制葡萄糖激酶表達基因iolR。
[1] 周勇, 滿云, 張偉國.L-賴氨酸高產菌發酵的研究[J]. 食品與生物技術學報, 2011, 30(6): 924-927.
[2] 劉曉飛, 高學軍, 劉營, 等. 微生物產賴氨酸的研究進展[J]. 東北農業大學學報, 2010, 41(1): 157-160.
[3] MORI M, SHIIO I. Phosphoenolpyruvate: sugar phosphotransferase systems and sugar metabolism inBrevibacteriumflavum[J]. Agricultural and Biological Chemistry, 1987, 51(10): 2 671-2 678.
[4] POSTMA P W, LENGELER J W, JACOBSON G R, et al. Phosphoenolpyruvate: carbohydrate-phosphotransferase systems of bacteria, [J]. Microbiological Reviews, 1993, 57(3): 543-594.
[5] YOON K N, Nucleotide sequence and characterization ofptsGgene encoding glucose-specific enzyme II of phosphotransferase system fromBrevibacteriumflavum[J]. Agricultural and Biological Chemistry,2005, 48(4): 218-221.
[6] IKEDA M, MIZUNO Y, AWANE S I, et al. Identification and application of a different glucose uptake system that functions as an alternative to the phosphotransferase system inCorynebacteriumglutamicum[J]. Applied Microbiology and Biotechnology, 2011, 90(4): 1 443-1 451.
[7] IKEDA M, NOGUCHI N, OHSHITA M, et al. A third glucose uptake bypass inCorynebacteriumglutamicumATCC 31833[J]. Applied Microbiology and Biotechnology, 2015, 99: 2 741-2 750.
[8] LINDNERA S N, SEIBOLD G M, KRAMER R, et al. Impact of a new glucose utilization pathway in amino acid-producingCorynebacteriumglutamicum[J]. Bioengineered Bugs, 2011, 2(5): 291-295.
[9] DE ANDA R, LARA A R, HEMANDEZ V, et al. Replacement of the glucose phosphotransferase transport system by galactose permease reduces acetate accumulation and improves process performance ofEscherichiacolifor recombinant protein production without impairment of growth rate[J]. Metabolic Engineering, 2006, 8(3): 281-290.
[10] WANG Qing-zhao, WU Chan-yuan, CHEN Tao, et al. Expression of galactose permease and pyruvate carboxylase inEscherichiacoliptsGmutant increases the growth rate and succinate yield under anaerobic conditions[J]. Biotechnology Letters, 2006, 28(2): 89-93.
[11] 張傳志. 谷氨酸棒桿菌L-苯丙氨酸合成途徑系統改造及發酵優化[D]. 無錫: 江南大學, 2014.
[12] ZHOU Zhi-hui, WANG Chen, XU Hong-tao, et al. Increasing succinic acid production using the PTS independent glucose transport system in aCorynebacteriumglutamicumPTS defective mutant[J]. J Ind Microbiol Biotechnol, 2015, 42: 1 073-1 082.
[13] LINDNERA S N, SEIBOLD G M, HENRICH A, et al. Phosphotransferase system-independent glucose utilization inCorynebacteriumglutamicumby inositol permeases and glucokinases[J]. Applied and Environmental Microbiology, 2011, 77(11): 3 571-3 581.
[14] VAN D R, LANGE C, MOLENAAR D. A heat shock following electroporation induces highly efficient transformation ofCorynebacteriumglutamicumwith xenogeneic plasmid DNA [J]. Applied Microbiology and Biotechnology, 1999, 52(4): 541-545.
[15] CORINNA S, DAVIN U, STEPHANE D, et al. Characterization of aCorynebacteriumglutamicumlactate utilization operon induced during temperature-triggered glutamate production[J]. Applied and Environmental Microbiology, 2005, 71(10): 5 920-5 928.
[16] LINENERA SN, KNEBEL S, PALLERLA SR, et al. Cg2091 encodes a polyphosphate/ATP-dependent glucokinase ofCorynebacteriumglutamicum[J]. Applied Microbiology and Biotechnology, 2010, 87(2): 703-713.
[17] MURIRL CB, ARMEL G, NICHOLAS DL. Growth rate-dependent modulation of carbon flux through central metabolism and the kinetic consequences for glucose-limited chemostat cultures ofCorynebacteriumglutamicum[J]. Applied and Environmental Microbiology, 1996, 62(2): 429-436.
[18] MICHIKO M, ISAMU S. Pyruvate formation and sugar metabolism in an amino acid-producing bacterium,Brevibacteriumflavum[J]. Agricultural and Biological Chemistry, 1987, 51(1): 129-138.
[19] 陳銀芳.L-賴氨酸產生菌選育及其發酵條件的調控[D]. 無錫: 江南大學, 2009.
[20] 侯小虎.L-纈氨酸代謝工程育種的研究[D]. 無錫: 江南大學, 2012.
[21] 陳燏, 朱善良. PET質粒表達對宿主菌的影響研究[J]. 江蘇教育學院學報, 2011, 27(1): 1671-1679.
[22] KOTRBA P, INUI M, YUKAWA A. Bacterial phosphotransferase system (PTS) in carbohydrate and control of carbon metabolism[J]. Journal of Bioscience and Bioengineering, 2001, 92(2): 502-517.
OverexpressionofgenesrelatedtoglucosetransportsysteminCorynebacteriumglutamicumZL-8andtheireffectsonglucosemetabolismandL-lysinesynthesis
LIU Dong-dong, ZHANG Wei-guo*, XU Jian-zhong*, TIAN Cheng-fu
(The Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China)
Corynebacteriumglutamicum(C.glutamicum) ZL-8 is anL-lysine producing strain of mutation breeding with low rate of glucose uptake and phosphorylation. Phosphoenolpyruvate-dependent glucosephospho-transferase system (PTSGlc) and PTSGlc-independent play an important role in the process of glucose uptake and phosphorylation. In this paper, the roles of EIIGlc, IolT1, glucokinase in glucose metabolic rate,L-lysine yield and by-products accumulation were investigated by overexpressing EIIGlc(ptsG), IolT1 (iolT1), glucokinase (ppgk)coding genes inL-lysine producing strainCorynebacteriumglutamicumZL-8. Compared with the original strain, theL-lysine yield and glucose metabolic rate of the recombinant strainC.glutamicumZL-8/pDXW-8-ptsG(increased by 27.3% and 16.4%, respectively) andC.glutamicumZL-8/pECXK-99E-ppgk-iolT1(increased by 16.7% and 24.7%, respectively) were increased by overexpressing the genes in glucose transport system. In addition, the activity of PTSGlcsystem inC.glutamicumZL-8/pDXW-8-ptsGwas increased by 62.7%, whereas the activity of glucokinase inC.glutamicumZL-8/pECXK-99E-ppgk-iolT1 was increased by 768%. Meanwhile, results indicated that the accumulation of organic acids (pyruvic acid, lactic acid and acetic acid) and amino acids (valine, alanine, aspartic acid) changed more obviously during overexpression of the different genes involved in glucose transport system.
Corynebacteriumglutamicum; glucose transport system;glucose metabolic rate;L-lysine
10.13995/j.cnki.11-1802/ts.013796
碩士研究生(張偉國教授,徐建中講師為通訊作者,E-mail:zhangwg168@126.com;xujz126@126.com)。
江蘇省自然科學基金青年基金(BK20150149)
2017-01-10,改回日期:2017-03-28

