使用稀禾定馴化提高裂殖壺菌的生長和DHA積累
王康,劉良森,陳磊,張衛文
(天津大學 化工學院,天津,300350)
使用稀禾定馴化提高裂殖壺菌的生長和DHA積累
王康,劉良森,陳磊*,張衛文
(天津大學 化工學院,天津,300350)
采用基于實驗室的微生物適應性馴化方法,對Schizochytriumsp. S31進行脂肪酸合成途徑抑制劑稀禾定連續傳代馴化,逐步提高稀禾定的馴化濃度。經過近200天連續馴化65代,Schizochytriumsp. S31對稀禾定的耐受濃度從200 μmol/L提高到了500 μmol/L。通過250 mL搖瓶發酵96 h后發現,馴化株的生物量明顯高于野生株的生物量,其中馴化株ALE500的生物量最高,比相同時間點野生株的生物量高20.2%,二十二碳六烯酸(Docosahexaenoic acid, DHA)產量也提高了30.4%。此外,馴化株的脂肪酸不飽和度也有所提高,其中馴化株ALE500的不飽和度達到了1.11。采用5 L發酵罐驗證馴化效果,結果顯示馴化株ALE500的生物量和DHA產量分別提高了19.74%和29.38%。綜上所述,使用脂肪酸合成途徑抑制劑稀禾定對裂殖壺菌進行定向馴化的方法可以提高裂殖壺菌的發酵生物量和DHA產量。
裂殖壺菌;稀禾定;馴化;生物量;DHA
二十二碳六烯酸(Docosahexaenoic acid, DHA)是一種ω-3多不飽和脂肪酸(ω-3 PUFAs),具有預防和治療心血管疾病、健腦益智和提高記憶力、改善視網膜功能和提高視力、抗癌、抗過敏等重要生理功能[1-3]。比較傳統魚油來源的DHA,一些海洋微生物油脂中的DHA含量更高[4],且海洋微生物具有種質資源豐富、培養簡單可控、脂肪酸組成簡單、不含魚腥味等優點而成為可以替代魚油的重要DHA來源。其中,裂殖壺菌因生長速度快、油脂含量高、DHA含量高且無毒副作用、易于培養、易于純化等優點而成為一種有潛力的生產DHA的種質資源。
為了提高裂殖壺菌的發酵生物量,克服裂殖壺菌在長期的保存及使用過程中由于退化導致的發酵生物量低的缺點,以往研究主要集中在培養基配方、培養條件、發酵工藝以及遺傳改造等方面[5-7],但是DHA 產量和質量仍有較大的提升空間[8]。由于微生物有快速適應不同環境的能力,基于實驗室的微生物適應性馴化(Adaptive Laboratory Evolution, ALE)已經越來越被推崇為一種篩選并富集有利突變進而可以獲得高活性或高抗性菌株的重要方法[9]。
乙酰輔酶A羧化酶(Acetyl-CoA carboxylase, ACCase)可以催化乙酰輔酶A生成丙二酸單酰輔酶A,此反應是脂肪酸合成的限速步驟[10]。而稀禾定(sethoxydim, 2-[1-(乙氧基亞氨基)丁基]-5-[2-(乙硫基)丙基]-3-羥基-2-環己烯-1-酮)是該酶的抑制劑(包括但不限于稀禾定)[11]。DONG[11]使用泛素啟動子在玉米細胞中過量表達狐尾粟胞內的ACCase基因,使得稀禾定對玉米的損傷指數降低到33%,玉米油脂含量從24%提高到65%;SARA[12]在經過7 000多次實驗后證實,稀禾定可以殺死產油效率低的藻類植物,同時也能促進產油效率高的藻類植物快速生長。這表明稀禾定在海洋微藻產油方面具有篩選與促進的雙重作用。作為原始的真核植物細胞,裂殖壺菌與植物有著密切的進化關系[13]。在裂殖壺菌的培養基中添加稀禾定同樣會抑制細胞生長,于是推測稀禾定也是通過抑制裂殖壺菌的脂肪酸合成而導致其衰弱甚至死亡的。本研究中,我們以Schizochytriumsp. S31為研究對象,采用適應性馴化的方法對其進行稀禾定馴化,提高其對稀禾定的耐受性,從而提高裂殖壺菌的發酵生物量和DHA產量。
1 材料與方法
1.1菌種
裂殖壺菌(Schizochytriumsp. S31),購自廣東微生物菌種保藏中心。
1.2主要試劑
十九烷酸甲酯(Methyl nonadecanoate,內標)、二十二碳六烯酸甲酯(Docosahexaenoic acid methylester, DHA-ME,外標)、2-[1-(乙氧基亞氨基)丁基]-5-[2-(乙硫基)丙基]-3-羥基-2-環己烯-1-酮(稀禾定,Sethoxydim,純度≥98%):色譜純,美國Sigma-Aldrich公司;苯酚、亞硝基鐵氰化鈉:分析純試劑,天津江天化工公司;葡萄糖測定試劑盒:中生北控公司。
1.3主要儀器
7890A/5975CAgilent氣相色譜與質譜聯用儀,Agilent公司;5430R Eppendorf臺式高速冷凍離心機,Eppendorf公司;LGJ-10冷凍干燥機,松源華興公司;ELX-808 96孔板掃描儀,基因公司;UV-1750紫外可見分光光度計,日本島津公司;LWG-L96真空干燥離心機,湘儀離心機儀器公司;Forma 702 超低溫冰箱,Thermo公司。
1.4培養基
種子培養基(g/L):葡萄糖5.0,酵母粉1.0,蛋白胨1.0,海鹽20.0,pH 6.5;
發酵培養基(g/L):葡萄糖40.0,酵母粉10.0,蛋白胨5.0,海鹽20.0,pH 6.5。
以上培養基均在1×105Pa壓力下滅菌30 min。
1.5方法
1.5.1 培養方法
種子發酵培養:一級液體種子發酵培養:50 mL種子培養基裝于250 mL三角瓶中,從斜面保藏菌種挑取單菌落接種于液體培養基,25 ℃、180 r/min培養2 d。二級液體種子發酵培養:100 mL種子培養基裝于500 mL三角瓶中,從一級種子液中按照接種量5%(v/v)取液體菌種,接種于滅菌的二級發酵培養基中,25 ℃、180 r/min培養2 d得二級種子液,進入5 L發酵罐。
搖瓶發酵培養:從一級液體種子中取種子液,接種于裝有50 mL發酵培養基的250 mL三角瓶中,使起始OD660為0.4,25 ℃、180 r/min培養4 d。所有發酵培養基均未添加稀禾定,且每組做3個平行樣,定點取樣用于后續分析測定。
5 L反應器補料分批發酵:初始葡萄糖濃度為40 g/L,裝液量為2 L,接種量10%(v/v),培養溫度25 ℃,通氣為1.0 L/(L·min),通過控制轉速使溶氧控制在30%以上。通過添加NaOH,維持pH在6.5 ± 0.1,消泡劑選用50 g/L生工Foam-free powder。發酵過程中每隔一定的時間取樣測定葡萄糖濃度、氨態氮濃度、生物量、油脂含量以及DHA含量。通過添加60%的葡萄糖控制罐內葡萄糖質量濃度在10 g/L以上。在發酵24 h后,為了防止補料發酵過程中的氮源限制向發酵液中流加酵母粉10 g。
1.5.2 馴化方法
取少量Schizochytriumsp. S31菌液涂布于含有10、50、100、200、300 μmol/L不同濃度稀禾定的固體種子培養基上,正常條件下進行培養,同時以未添加稀禾定的固體平板作為對照。根據平板上的菌落長出情況,確定稀禾定的抑制濃度為200 μmol/L。馴化過程中控制接種到培養基后的菌液濃度OD660為0.4,添加一定濃度的稀禾定,培養至OD660為10左右后傳代,仍然控制起始接種OD660為0.4。在傳代的過程中,待馴化株的長勢由緩慢變正常后以50 μmol/L的增幅逐漸增大稀禾定的濃度,每一個特定稀禾定濃度持續幾代至十幾代不等。
1.5.3 耐受性測定
在四分格培養皿中依次倒入5 mL分別含有0、200、350、500 μmol/L稀禾定的固定種子培養基。待其凝固后,分別取野生株和馴化株ALE500在每格的固體培養基上進行劃線。將其置于25 ℃培養箱中培養,48 h后取出進行分析比較。
1.5.4 分析方法
生物量的測定:取3 mL發酵液置于已稱重的離心管中,7 500 r/min離心5 min,棄上清后,用pH 6.5的PBS溶液洗滌2次,置于-80 ℃冰箱中凍結細胞,后用冷凍干燥機凍干至恒重(約24 h)后稱重。
殘糖的測定:收集上步離心后的上清液,雙蒸水稀釋30倍,按照葡萄糖測定試劑盒(葡萄糖氧化酶法)使用說明書進行測定[14]。
氨態氮的測定:靛酚藍-分光光度法[15]。
總油脂的測定:有機溶劑萃取方法[16]。
脂肪酸含量的測定[17]:稱取凍干后的菌體100 mg,加入2 mL氯仿和2 mL酯化液(含有3%(v/v)濃硫酸和2.5 g/L十九烷酸甲酯(作為內標)的甲醇溶液),在100 ℃下酯化2 h,取出后冷卻至室溫,加入1 mL雙蒸水。充分振蕩后靜置至溶液分層,取下層溶液在氣相色譜與質譜聯用儀Agilent 7890A/5975C中檢測。氣相色譜條件:色譜柱:HP-5MS,載體為氮氣,分流比為30∶1。升溫程序為:起始溫度80 ℃并停留2 min,以10 ℃/min的速度升至300 ℃并停留20 min。質譜掃描范圍為:35~650 amu。質譜結果通過NIST2002數據庫檢索比對,各組分含量由歸一化法定量。DHA的定性分析:在上述氣相色譜條件下,用已知的DHA甲酯標準品色譜峰的保留時間與樣品甲酯化后脂肪酸甲酯各組分色譜峰的保留時間對照進行分析。
1.5.5 統計分析
使用SPSS軟件對實驗數據進行t檢驗分析差異性。以野生型數值作為對照,P<0.005,表明與野生型的差異極顯著;P<0.01,表明差異非常顯著;P<0.05,表明差異顯著。
2 結果和分析
2.1裂殖壺菌的稀禾定馴化曲線及耐受性測定
鑒于稀禾定作為乙酰輔酶A羧化酶的抑制劑,在本研究中,以Schizochytriumsp. S31為研究對象,選定稀禾定作為馴化劑,采用適應性馴化的方法對其進行稀禾定馴化,如圖1所示。

圖1 稀禾定馴化裂殖壺菌曲線圖Fig.1 Laboratory evolution of sethoxydim tolerance in Schizochytrium sp. S31
經過約200天65代的連續馴化,裂殖壺菌對稀禾定的耐受濃度逐漸提高到了500 μmol/L,是起始馴化濃度的2.5倍。但是隨著稀禾定濃度的增大,馴化株達到平臺期的時間逐漸延長,且在當前濃度下的傳代次數隨之增多。在提高稀禾定馴化濃度之前對可在當前濃度下穩定遺傳的馴化株進行保種。分別取野生株(Wild type)、耐200 μmol/L稀禾定的馴化株(ALE200)、耐300 μmol/L稀禾定的馴化株(ALE300)、耐400 μmol/L稀禾定的馴化株(ALE400)和耐500 μmol/L稀禾定的馴化株(ALE500)用作后續分析實驗。為了驗證馴化株對稀禾定的耐受性,設計了平板表型驗證實驗。如圖2(a)、(b)所示,野生株只在不含稀禾定和含200 μmol/L稀禾定的平板上生長,且在含200 μmol/L稀禾定的平板上的菌落數明顯少于不含稀禾定的對照組。而馴化株ALE500卻可以在含以上所有濃度稀禾定的平板上生長,但是由于高濃度稀禾定的脅迫,稀禾定濃度越高,菌落數越少。由此結果得出,通過稀禾定馴化確實提高了裂殖壺菌對稀禾定的耐受性。
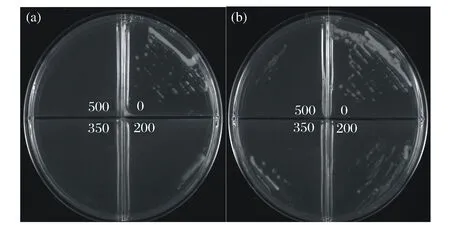
0:c(稀禾定)= 0 μmol/L;200:c(稀禾定)= 200 μmol/L;350:c(稀禾定)= 350 μmol/L;500:c(稀禾定)= 500 μmol/L圖2 裂殖壺菌野生株(a)和馴化株ALE500(b)的平板表型驗證Fig.2 Phenotype validation of wild type (a) and evolved strain ALE500 (b) on plate
2.2不同裂殖壺菌馴化菌株的搖瓶發酵性能差異比較
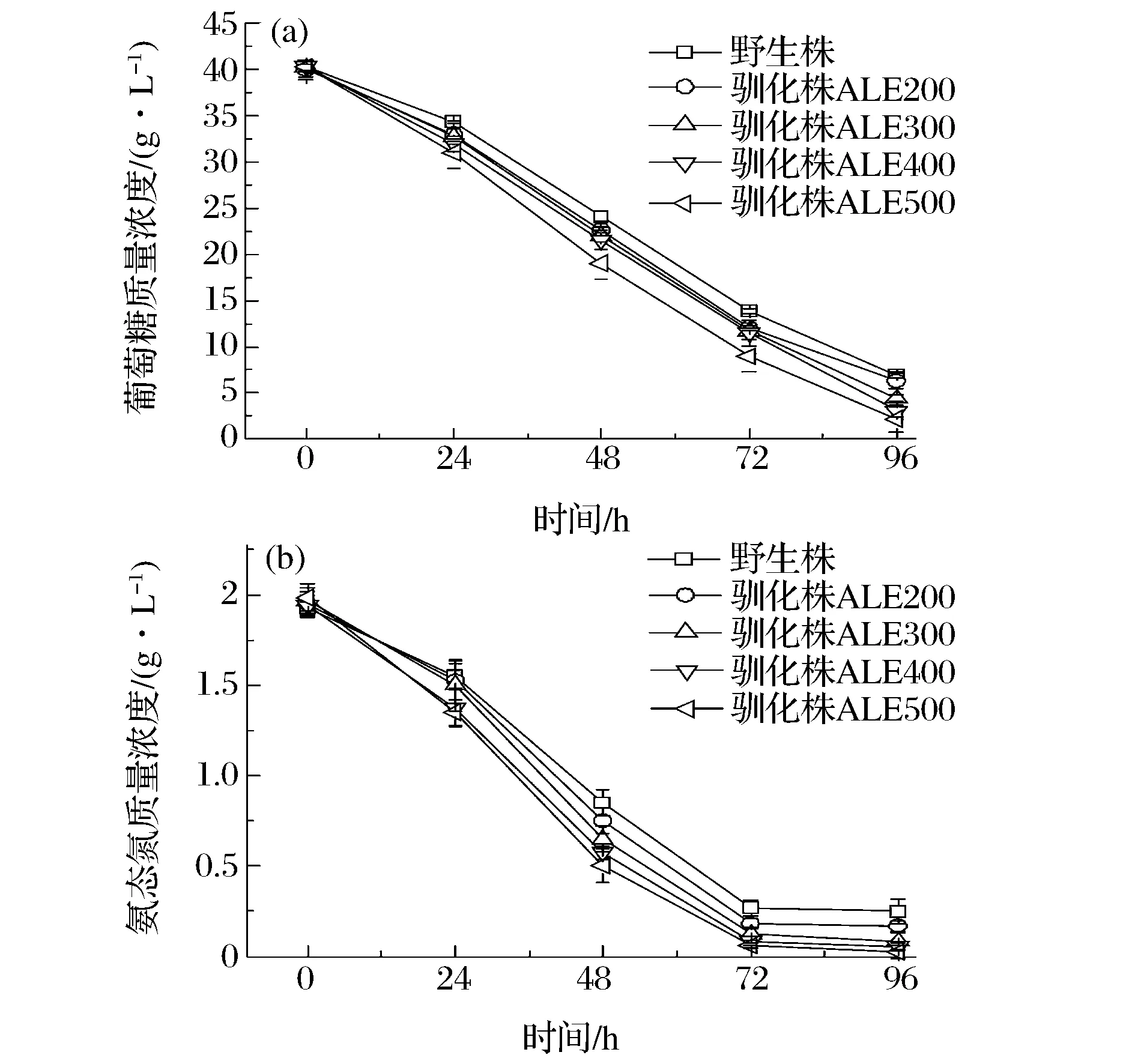
將上述5株不同的裂殖壺菌菌株接入相同的發酵培養基中,按照1.5.1的培養條件進行培養,探討其搖瓶發酵性能的差異。不同菌株的生長曲線如圖3所示,前24 h是菌體生長的適應期,菌株之間差別不明顯。24 h之后,菌體生長便進入指數生長期,菌株之間的差別逐漸拉大。馴化菌株的生長速率明顯高于野生株,且隨著馴化菌株耐受濃度的增大,生長速率也逐漸增大。和野生株相比,馴化菌株的耗糖和耗氮速率明顯加快,且總耗糖量和總耗氮量也明顯增多(圖3)。
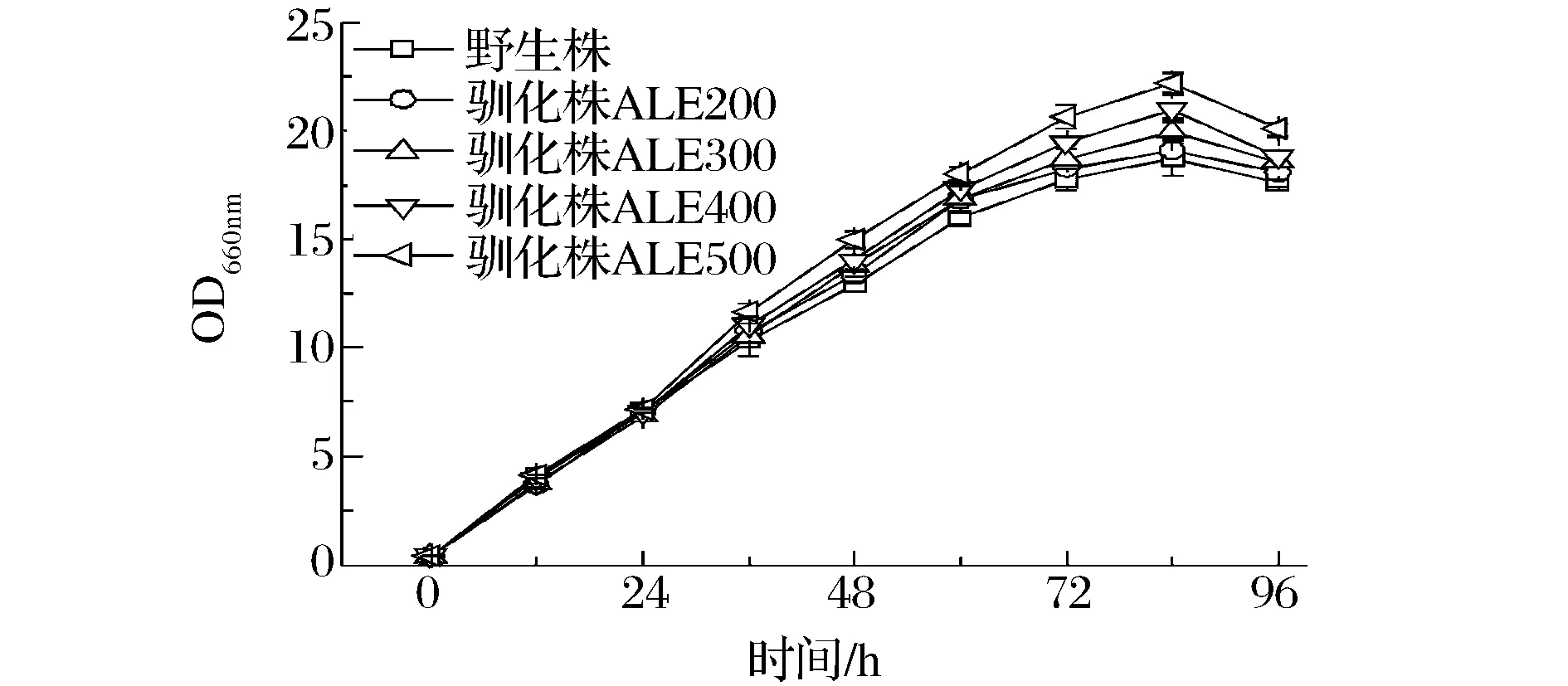
圖3 裂殖壺菌野生株和馴化株生長曲線Fig.3 The growth curves of wild type and four evolved strains
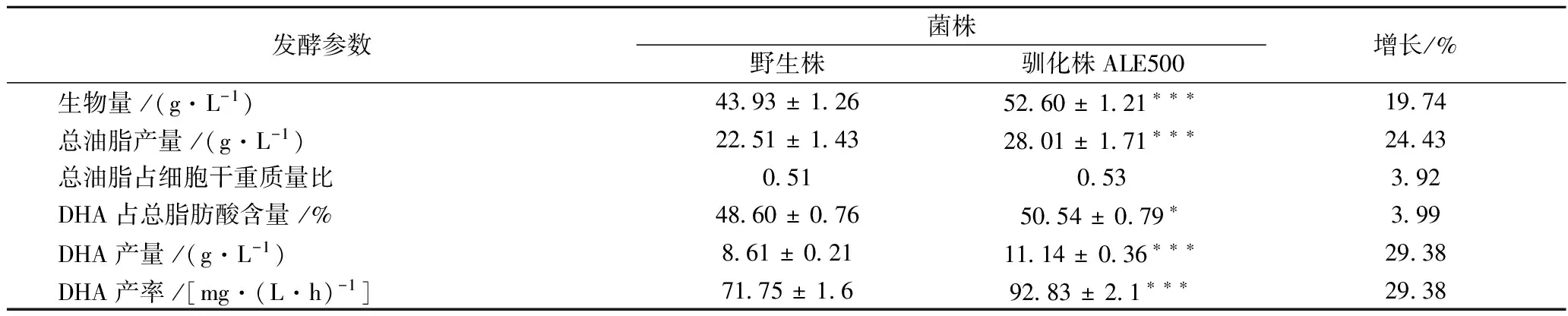
其中,野生株96 h的總耗糖量為33.41 g/L,而馴化株ALE500的總耗糖量卻達到了38.02 g/L。如表1所示,馴化株的最大比生長速率呈依次增大的趨勢,其中馴化株ALE500的最大比生長速率0.356比野生株的最大比生長速率0.294高21.1%。由于在相同的發酵周期,馴化株的生物量比野生株的高,因此馴化株的干重產率也高于野生株。搖瓶發酵野生株和不同馴化株72 h后,馴化株ALE500的干重產率達到了0.20 g/(L·h),而野生株僅為0.17 g/(L·h),ALE500馴化株的干重產率是是野生株的1.18倍(表1)。以上實驗結果均表明,通過稀禾定馴化裂殖壺菌可以有效提高裂殖壺菌的發酵生物量,進而可以獲得高DHA產率的馴化菌株。
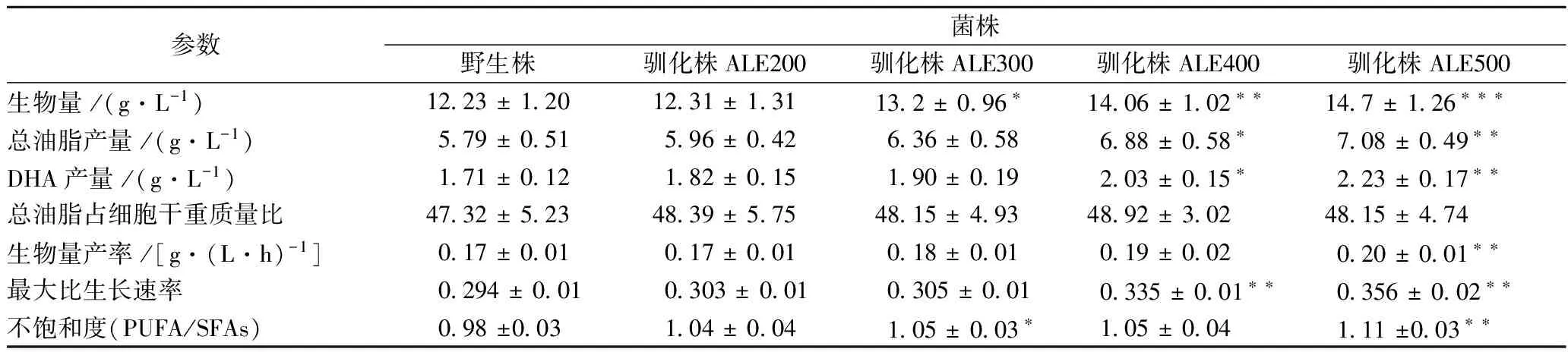
表1 裂殖壺菌野生株和馴化株搖瓶發酵特性
注:***:P<0.005;**:P<0.01;*:P<0.05.
2.3不同裂殖壺菌馴化菌株的脂肪酸分布
C14∶0,C15∶0,C16∶0,C17∶0及C18∶0是裂殖壺菌胞內主要的飽和脂肪酸,二十碳五烯酸(Eicosapentaenoic Acid, EPA)和DHA則是主要的不飽和脂肪酸。針對不同裂殖壺菌馴化株及野生株的脂肪酸成分分析表明,在幾株馴化株與野生株中,DHA占總脂肪酸的含量沒有顯著變化(表2)。然而由表1所示,馴化株ALE500的DHA產量達到了2.23 g/L,與野生株的1.71 g/L相比,其差異顯著性水平P<0.005,這表明高濃度的稀禾定馴化可以顯著提高裂殖壺菌的DHA產量。同時,馴化株ALE500的PUFA/SFAs值達到了1.11,是野生株的1.13倍,其差異顯著性水平0.005 表2 裂殖壺菌野生株和馴化株脂肪酸成分對比 2.4野生株與馴化株的補料分批發酵比較 為了驗證裂殖壺菌馴化株的高生長能力,將野生株和馴化株ALE500分別應用到5 L發酵罐中進行擴大培養,結果如圖4(a)所示。 圖4 裂殖壺菌野生株和馴化株耗糖(a)和耗氮(b)速率Fig. 4 The glucose (a) and ammonium nitrogen (b) consumption of wild type and four evolved strains 雖然野生株和馴化株ALE500的生物量在細胞指數生長期都快速增長,但是馴化株的生物量增長速率要明顯高于野生株。其中在發酵84 h時,馴化株ALE500的生物量比同一時間點野生株的生物量高21.6%。84 h之后,生物量繼續增長,隨后便進入細胞生長平臺期(>96 h),馴化株ALE500的細胞干重達到了52.6 g/L。比野生株高19.74%(表3)。雖然在整個發酵過程中,野生株和馴化株ALE500的油脂含量差別不大,但是馴化株ALE500的油脂產量卻明顯高于野生株(圖4(a))。發酵60 h后,隨著生物量的增長,馴化株ALE500呈現出了較野生株更強的油脂積累能力。馴化株ALE500的油脂產量最大達到了28.01 g/L,比野生株提高了24.43%(表3)。馴化株ALE500的DHA占總脂肪酸含量持續增長,最終達到了53%,比野生株提高了3.92%。和野生株相比,馴化株ALE500實現了更高的DHA產量,最高在發酵120 h時達到了11.14 g/L,比野生株高29.38%。以上結果均表明,經過稀禾定馴化得到的馴化株,其發酵生物量和DHA產量均有所提高。 圖5 裂殖壺菌野生株和馴化株ALE500補料分批發酵過程中生物量和總油脂(a)、DHA占總脂肪酸含量和DHA產量(b)的變化比較曲線Fig. 5 Comparisons between wild type and evolved strain ALE500 for biomass and total lipids(a), DHA percentage in total fatty acids and DHA yield(b) in fed-batch fermentation 表3 裂殖壺菌野生株和馴化株ALE500的補料分批發酵參數比較 注:***:P<0.005;:P<0.01;*:P<0.05. 菌種的生物量低、易退化和不穩定已成為DHA發酵產率低的主要因素。為了克服以上缺點,一方面,傳統的菌種改造技術將繼續為生物發酵提供簡單易行的工業菌株改造手段。比如:YAN[19]等把大腸桿菌中的乙酰輔酶A合成酶(acetyl-CoA synthetase, ACS)基因整合到裂殖壺菌Schizochytriumsp. TIO1101的基因組上,通過過量表達外源ACS基因,可以提高裂殖壺菌的生長速率和耗糖速率,最終實現生物量和脂肪酸含量分別提高了29.9%和11.3%;另一方面,基于實驗室的微生物馴化方法得到對某一脅迫有高耐受性的菌株,結合基因組重測序、轉錄組學、蛋白組學或代謝組學的研究,在整體水平上得到與耐受性相關的基因、mRNA、蛋白、代謝物等其他的遺傳或代謝基礎,從而為后續基因工程改造高產菌株提供科學依據和靶點[20],然而這在裂殖壺菌馴化研究中還沒有相關報道。 稀禾定作為一種環己二酮類除草劑,是乙酰輔酶A羧化酶的抑制劑。如果將其添加到微藻培養基中,ACCase活性較弱的細胞衰弱甚至死亡,而ACCase活性較強的細胞可以生長。以此為出發點,嘗試在裂殖壺菌培養基中添加稀禾定,采用基于實驗室的微生物適應性馴化的方法對Schizochytriumsp. S31進行稀禾定馴化,逐步提高其對稀禾定的耐受性,從而可以獲得ACCase活性較強的馴化株。為了驗證馴化株對稀禾定的耐受性,設計了平板表型驗證,結果表明Schizochytriumsp. S31對稀禾定的耐受性確實有了大幅度的提高。通過補料分批發酵比較裂殖壺菌野生株與馴化株ALE500的生長及發酵特性,裂殖壺菌馴化株ALE500的生物量比野生株提高了19.74%,油脂產量提高了24.43%,DHA產量提高了29.38%。另外,本研究把裂殖壺菌對稀禾定的耐受濃度只提高到了500 μmol/L,將來仍然可以繼續對其進行馴化,以得到生物量更高的裂殖壺菌。 [1] MORRISM C, EVANS D A, BIENIAS J L, et al. Consumption of fish and n-3 fatty acids and risk of incident Alzheimer disease[J]. Archives of Neurology, 2003, 60(7): 940-946 [2] SIMOPOULOS A P. Omega-3 fatty acids in inflammation and autoimmune diseases[J]. Journal of the American College of Nutrition, 2002, 21(6): 495-505. [3] MEIRLES L G, MALCATA F X. Lipid class composition of the microalgaPavlovalutheri: eicosapentaenoic and docosahexaenoic acids[J]. Journal of Agricutral and Food chemistry, 2003, 51(8): 2 237-2 241. [4] BARCLAY W R, MEAGER K M, ABRIL J R. Heterotrophic production of long chain omega-3 fatty acids utilizing algae and algae-like microorganisms[J]. Journal of Applied Phycology, 1994, 6(10): 123-129. [5] LIAN Min, HUANG He, REN Lu-jing, et al. Increase of docosahexaenoic acid production bySchizochytriumsp. through mutagenesis and enzyme Assay[J]. Applied Biochemistry and Biotechnology, 2010, 162(4): 935-941. [6] LI M H, ROBINSON E H, TUCKER C S, et al. Effects of dried algaeSchizochytriumsp., a rich source of docosahexaenoic acid, on growth, fatty acid composition, and sensory quality of channel catfish Ictalurus punctatus[J]. Aquaculture, 2009, 292(3-4): 232-236. [7] YAN Jin-fei, CHENG Ru-bin, LIN Xiang-zhi, et al. Overexpression of acetyl-CoA synthetase increased the biomass and fatty acid proportion in microalgaSchizochytrium[J]. Applied Microbiology and Biotechnology, 2013, 97(5): 1 933-1 939. [8] 魏萍, 馬小琛, 任路靜. 裂殖壺菌發酵生產DHA研究進展[J]. 食品工業科技, 2010, 31(10): 398-401. [9] LU Lei-fang, WEI Liu-jing, ZHU Kun, et al. Combining metabolic engineering and adaptive evolution to enhance the production of dihydroxyacetone from glycerol byGluconobacteroxydansin a low-cost way[J]. Bioresource Technology, 2012, 117: 317-324. [10] VAGELOS P R, ALBERTS A W, MARTIN D B.Studies on the mechanism of activation of acetyl coenzyme A carboxylase by citrate[J]. Journal of Biological Chemistry, 1963, 238(2): 533-540. [11] DONG Zhi-gang, ZHAO Hu-ji, He Jun-guang, et al.Overexpression of a foxtail millet acetyl-CoA carboxylase gene in maize increases sethoxydim resistance and oil content[J]. African Journal of Biotechnology, 2011, 10(20): 3 986-3 995. [12] Science news. Sara Volz loves algae - and vice versa [EB/OL]. [2015-09-03].http://scienceplx.com/sara-volz-loves-algae-and-vice-versa/. [13] SALAMA E S, KABRA A N, JI M K, et al. Enhancement of microalgae growth and fatty acid content under the influence of phytohormones[J]. Bioresource Technology, 2014, 172: 97-103. [14] DE S M E, DE R, T C, et al. Optimisation of docosahexaenoic acid production in batch cultivations byCrypthecodiniumcohnii[J]. Journal of Biotechnology, 1999, 70(1-3): 185-192. [15] 梁劍光, 朱玲, 徐正軍. 靛酚藍-分光光度法測定發酵液中氨態氮含量研究[J]. 食品與發酵工業, 2006, 32(9): 134-137. [16] LI Jing-han, NIU Xiang-feng, PEI Guang-sheng, et al. Identification and metabolomic analysis of chemical modulators for lipid accumulation inCrypthecodiniumcohnii[J]. Bioresource Technology, 2015, 191: 362-368. [17] XIONG Wei, LIU Li-xa, WU Chao, et al.13C-tracer and gas chromatography-masss spectrometry analysis reveal metabolic flux distribution in the oleaginous microalga Chlorella protothecoides[J]. Plant Physiology, 154(2): 1001-1011. [18] Oh-I S, SHIMIZU H, SATO T,et al. Molecular mechanisms associated with leptin resistance: n-3 polyunsaturated fatty acids induce alterations in the tight junction of the brain[J]. Cell Metabolism, 2005, 1(5): 331-341. [19] YAN Jin-fei, CHENG Ru-bin, LIN Xiang-zhi,et al. Overexpression of accetyl-CoA synthetase increased the biomass and fatty acid proportion in microalga Schizochytrium[J]. Applied Microbiology and Biotechnology, 2013, 97(5): 1933-1939. [20] DRAGOSITS M, MATTANOVICH D. Adaptive laboratory evolution-principles and applications for biotechnology[J]. Microbial Cell Factories. 2013, 12(64): 1-17 ImprovinggrowthandDHAproductionofSchizochytriumsp.bysethoxydim-basedadaptiveevolution WANG Kang, LIU Liang-sen, CHEN Lei*, ZHANG Wei-wen (School of Chemical Engineering and Technology, Tianjin University, Tianjin 300350, China) Laboratory-based adaptive evolution was applied to increase the tolerance to ACCase inhibitor sethoxydiminSchizochytriumsp. S31. Through an experimental evolution process of continuous 65 passages for 200 days, the sethoxydim tolerance concentration inSchizochytriumsp. was increased from 200 μmol/L to 500 μmol/L. After 96 h fermentation in shake flasks, a comparative analysis of wild type and evolved strains showed that the biomass of the final evolved strain ALE500 reached 14.7 g/L at 72 h, which was 20.2% higher than that of wild type. In addition, docosahexaenoic acid (DHA) yield was increased by 30.4% in the evolved strain compared with the wild type. Moreover, the unsaturation degree of total fatty acids was also significantly increased in the evolved strain ALE500 and reached 1.11. To further verify the domestication effect of evolved strain, fed-batch strategy was applied and 19.74% increase of biomass and 29.38% increase of DHA yield were observed. This study demonstrated that the application of the sethoxydim-tolerance increased the biomass accumulation and DHA production inSchizochytriumsp. S31. Schizochytriumsp.; Sethoxydim;adaptive evolution; growth; docosahexaenoic acid (DHA) 10.13995/j.cnki.11-1802/ts.014107 碩士研究生(陳磊副教授為通訊作者,E-mail:lchen@tju.edu.cn)。 國家自然科學基金(21621004);國家“973”計劃(2014CB745101);高等學校博士學科點專項科研基金(20120032110020、20130032120022);天津市應用基礎與前沿技術研究計劃(15JCZDJC32500) 2017-02-21,改回日期:2017-03-22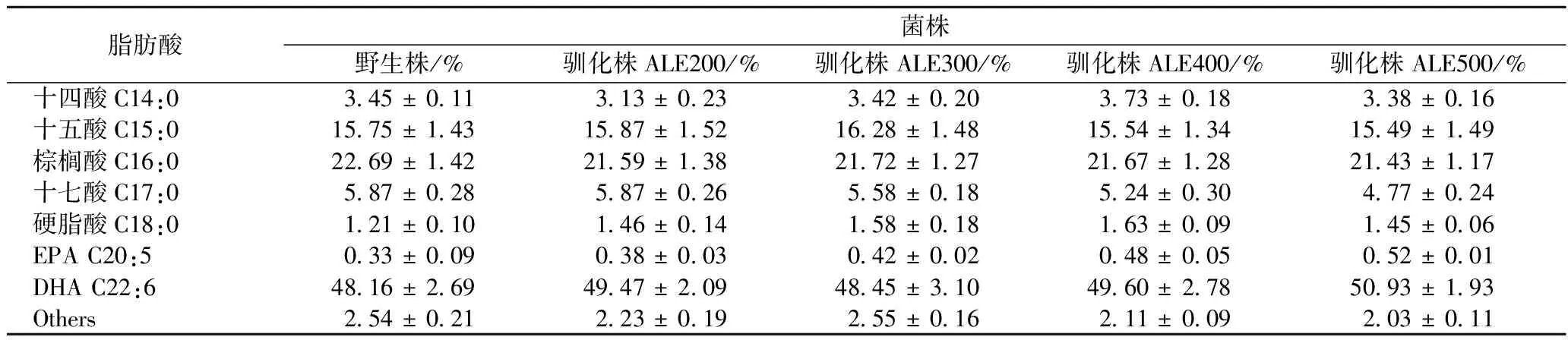

3 討論

