激素超排對小鼠卵母細胞染色體空間形態的影響
吳 迪, 李晨迪, 王 婷, 王一鳴, 田 寧
(沈陽師范大學 物理科學與技術學院, 沈陽 110034)
激素超排對小鼠卵母細胞染色體空間形態的影響
吳 迪, 李晨迪, 王 婷, 王一鳴, 田 寧
(沈陽師范大學 物理科學與技術學院, 沈陽 110034)
激素超數排卵作為一種非自然排卵方式,在臨床輔助生殖及基礎科學研究中應用廣泛。但此種排卵方式對卵母細胞成熟質量的影響仍不明確。鑒于此,以熒光標記、雙光子成像及圖像三維重構為技術基礎,量化研究激素超排獲取的卵母細胞中染色體的空間構象情況。結果表明,激素超排造成染色體空間排布異常,但不影響染色體的體積、表面積等幾何構型。此結果可能提示激素超排干擾了染色體的運動與遷移功能,希望能為深入認識激素超排技術提供有用的參考。
激素超排; 熒光標記; 雙光子熒光成像; 染色體構象
0 引 言
激素超排是指在雌性哺乳動物發情的恰當時期,通過注射外源促性腺激素的方法,使卵巢比自然發情時有更多的卵泡發育并排卵的現象[1]。在實際生產中,超數排卵有提高母畜繁殖力、保存瀕危動物物種的功效[2-3]。在臨床輔助生殖醫學領域,以激素超排方法促進女性超數排卵,以便實現卵子冷凍保存及試管嬰兒等臨床訴求。在基礎科學研究中,由于動物自然排卵量少且排卵時間不固定,在制作轉基因動物[4]、嵌合體動物[5]、體外受精[6]等生物工程研究中,常需要利用激素超排獲取大量的卵母細胞。激素超排屬于不正常排卵方式,但是在以成熟卵母細胞為研究對象的應用及科研活動中,常需要利用此技術獲得超常數量的研究樣品。那么,超數排卵是否影響哺乳動物卵母細胞質量是實際生產、輔助生殖及科學研究的基礎。針對此問題,國內外已取得一些研究進展:張興會等人以絨山羊為模型,對幼畜超排后得到的卵母細胞進行裸卵鏡檢,通過統計異常卵數量及卵母細胞極體率,得出卵母細胞終會成熟但比正常卵母細胞質量差的結論[7]。M.F.Martinez等人對超數排卵的綿羊卵母細胞進行研究,使用普通光學顯微鏡觀察卵細胞形態,發現超排導致卵母細胞形態畸變率增加[8]。鄺素華等人通過核型分析技術對比了激素超排與體外成熟卵母細胞的染色體情況,并認為單倍體率、非整倍體率及染色體畸變率無顯著差異[9]。應該指出,一方面,利用普通光學顯微鏡可二維觀測卵胞質的折光性、卵細胞幾何尺寸、卵周間隙大小等形態指標,并得到豐富的實驗結果。但此成像手段不具備縱向層析能力,且分辨率及辨識度有限,無法觀測卵胞質內細胞器或遺傳物質的情況。另一方面,核型分析技術需要裂解卵母細胞形態,使染色體二維平鋪于載玻片上,可見該技術無法原位地獲得染色體的三維構象。且鄺素華的研究缺少對比激素超排與自然排卵的卵母細胞之間的差異,無法準確獲知激素超排技術對卵母細胞質量的影響。本文以小鼠為動物模型,綜合熒光標記、雙光子成像以及圖像三維重構技術,原位且量化地分析了激素超排對小鼠成熟的卵母細胞染色體空間構象的影響。希望本文的研究結果能為深入認識激素超排技術提供有用的數據。
1 實驗方法
1.1 樣品制備
1) 激素超排組:7~8周齡ICR雌性小鼠,腹腔注射孕馬血清促性腺激素5 IU/只,48 h后腹腔注射人絨毛膜促性腺激素5 IU/只。15 h后脫頸椎致死。隨后無菌摘取輸卵管,并于輸卵管膨大處采集體內成熟卵母細胞。
2) 自然排卵組:本實驗在上午8~10點期間采集正常小鼠輸卵管,從40只小鼠樣本中采集到5個膨大的輸卵管,并成功采集到約100個自然排卵的成熟卵母細胞。
1.2 熒光成像
1) 熒光標記:將成熟卵母細胞置于4%的多聚甲醛中固定30 h,經0.3% 磷酸鹽緩沖液清洗3遍。再經5 μg/ml Hoechst 33342熒光染色20 h。清洗3遍后用于觀測。
2) 成像系統:本文使用雙光子熒光顯微成像系統采集染色體的三維圖像。該系統由Bio-rad MRC 1024掃描成像單元與Nikon TE 300倒置顯微鏡組合而成。實驗中物鏡使用100×oil 鏡(平場復消色差物鏡, NA=1.4, Nikon);激光波長設為780 nm,焦平面處激光的平均功率約30 mW;縱向步長設置為0.5 μm。
1.3 數據分析
1) 染色體體積V=(標記染色體的熒光團擁有的像素個數)×(三維像素尺寸)。其中,三維像素的尺寸為0.072×0.072×0.5 μm3。
2) 染色體表面積S=(標記染色體的熒光團最外層擁有的像素個數)×(三維像素尺寸)。
3) 染色體異常排布比率=(異常排布的染色體數目÷染色體總數)×100%。
4) 本文使用SPSS 16.0檢驗兩組數據間差異。自然排卵組與激素超排組間染色體體積、表面積的區別通過單因素方差分析做比較。染色體異常排布比率的區別通過卡方檢驗實現。p<0.05表示結果有顯著性差異。
2 實驗結果
本文共觀察到3種染色體形態(圖1):1) 正常排布的染色體分布均勻,排列整齊;2) 錯位排布的染色體中有個別染色體脫離其他染色體,游離于赤道面外;3) 不整齊排布的染色體在赤道面上下參差排列。其中染色體錯位排布及不整齊排布為異常排布方式。
自然排卵組染色體異常排布的比率約5.4%,明顯小于激素超排組的情況(12.8%,p<0.05,見圖2a)。進一步發現,自然排卵組染色體體積為259.5 μm3,表面積為362.2 μm2,激素超排組相應數據分別為261.1 μm3,367.6 μm2,這2組數據間無顯著差異(圖2b)。
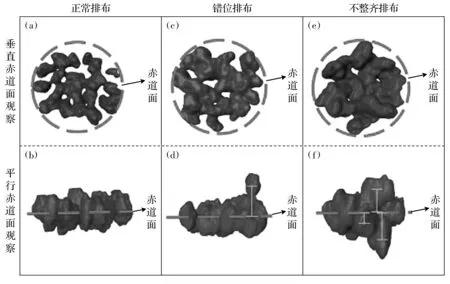
圖1 染色體正常排布、錯位排布及不整齊排布

圖2 染色體異常排布比率(a)及幾何構型比較(b)
3 討 論
染色體作為遺傳物質的重要載體,常利用分子生物學手段(如PCR技術[10])進行研究。但分子生物學手段通常建立在裂解細胞,破壞染色體結構的基礎上,因此利用該方法無法獲知染色體在細胞內的空間定位及三維構型信息,應指出染色體的空間構象(即空間定位或排布及幾何構型)可反映染色體的多種功能。本文基于雙光子成像技術和圖像重構技術,三維立體地研究染色體空間定位情況。研究發現激素超排組中染色體異常空間排布的比率明顯高于自然排卵組(p<0.05)。這表明激素超排可能影響染色體的空間定位,即干擾染色體的正常運動與遷移。吳銀鈴在研究超排激素對囊胚的影響時,也發現了激素超排造成的染色體排列紊亂的現象[11]。
本文進一步對比了自然排卵組和激素超排組卵母細胞中染色體的體積和表面積。結果表明,激素超排組染色體的體積和表面積與自然排卵組無顯著差異(p>0.05)。染色體體積可表征染色體在卵胞質內的空間占位情況,也可表征染色體蜷縮的緊密程度,而表面積可表征染色體與卵胞質的空間接觸。激素超排組和自然排卵組染色體體積及表面積無明顯差異,可能說明激素超排未影響到染色體的空間構型。
本文結果可能提示激素超排不干擾染色體的空間構型,但影響染色體的空間定位。染色體空間定位與紡錘體功能及調控染色體排列、運動的基因緊密相關[12-14]。染色體空間構型與染色體的表觀修飾(如甲基化、乙酰化等)及促細胞成熟、促分裂相關的蛋白激酶緊密相關[15-16]。激素超排引起的染色體空間構象的改變可能提示超排激素可干擾紡錘體功能,影響染色體運動的調控基因,但不影響染色體凝縮及表觀修飾等基因和蛋白的表達與活性。然而具體的分子機制有待于進一步實驗探究。此外,染色體空間排布異常比率增高可能與卵母細胞未完全成熟有關。自然排卵周期長,排出的卵母細胞已完全成熟,其染色體空間排布異常比率較低。而超數排卵是激素誘導的卵母細胞提前排出,致使卵母細胞可能未完全成熟,從而導致染色體錯位排布及不整齊排布的情況增多。
本文基于雙光子熒光顯微成像技術及三維重構技術,原位地重建了小鼠卵母細胞染色體的三維形態。經量化分析發現激素超排影響成熟的卵母細胞染色體空間構象,超排激素干擾染色體空間排布,但不影響染色體的空間構型。希望本文研究結果能為深刻認識激素超排技術提供有用的參考數據。
致 謝 感謝清華大學馬萬云課題組對本文數據采集工作的支持與幫助。
[ 1 ]路佩瑤,張春香,岳文斌. 超數排卵在哺乳動物中的應用[J]. 山西農業科學, 2009,37(5):84-87.
[ 2 ]INYAWILERT W,LIAO Y J,TANG P C. Superovulation at a specific stage of the estrous cycle determines the reproductive performance in mice[J]. Reproductive Biology, 2016,16(4):279-286.
[ 3 ]CHENOWETH P J. Influence of the male on embryo quality[J]. Theriogenology, 2007,68:308-315.
[ 4 ]MYELNIKOV D. Transforming mice:technique and communication in the making of transgenic animals[D]. Cambridge:University of Cambridge, 2015.
[ 5 ]FORBES B. Computational and Visualization Techniques for Structural Bioinformatics Using Chimera[M]. Boca Raton:CRC Press, 2014:24-26.
[ 6 ]YANG Rui,LI Hongzhen,LI Rong,et al. A comparison among different methods of letrozole combined with gonadotropin in an antagonist protocol and high-dose gonadotropin ovarian stimulation antagonist protocol in poor ovarian responders undergoing in vitro fertilization[J]. Archives of Gynecology and Obstetrics, 2016,294(5):1091-1908.
[ 7 ]張興會,張世偉,宋先忱,等. 幼齡母羊超數排卵及卵母細胞成熟效果分析[J]. 中國畜牧獸醫, 2011,389(11):136-139.
[ 8 ]MARTINEZMF,MCLEOD B,TATTERSFIELDG,et al. Successful induction of oestrus, ovulation and pregnancy in adult ewes and ewe lambs out of the breeding season using a GnRH+ progesterone oestrussynchronisation protocol[J]. Animal Reproduction Science, 2015,155:28-35.
[ 9 ]鄺素華,龔春柳,吳銳輝,等.小鼠體外成熟與激素超排卵母細胞核型分析[J]. 癌變·畸變·突變, 2003,15(3):133-137.
[10]張恒慶,朱立南,杜洋,等. 藜ISSR-PCR反應體系的優化[J]. 沈陽師范大學學報(自然科學版), 2011,29(2):255-257.
[11]吳銀鈴. 小鼠超數排卵后胚胎質量評價[D]. 保定:河北大學, 2016.
[12]EAGENK P,HARTLT A,KORNBERGRD. Stable Chromosome Condensation Revealed by Chromosome Conformation Capture[J]. Cell, 2016,62(2):141-151.
[13]李奇慧,朱明學,張黎明,等. 硫芥誘導小鼠染色體畸變和微核形成作用的研究[J]. 第三軍醫大學學報, 2004,26(19):1701-1703.
[14]CHARD L R,NORTON M E. Genetic Counseling for Patients Considering Screening and Diagnosis for Chromosomal Abnormalities[J]. Clinics in Laboratory Medicine, 2016,36(2):227-236.
[15]MARGOT J B,EHRENHOFER-MURRAY A E,LEONHARDT H. Interactions within the mammalian DNA methyltransferase family[J]. BMC Molecular Biology, 2003,4:7-15.
[16]TATON C,CARBONE M C,GALLO R,et al. Age-associated changes in mouse oocytes during postovulatory in vitro culture: possible role for meiotic kinases and survival factor BCL2[J]. Biology of Reproduction, 2009,74(2):395-402.
Effects of hormone induction ovulation on mouseoocyte chromosomes
WUDi,LIChendi,WANGTing,WANGYiming,TIANNing
(College of Physics Science and Technology, Shenyang Normal University, Shenyang 110034, China)
Hormone induction ovulation (HIO), asa non-natural ovulation, is widely used in the clinical assisted reproduction and basis scientific research. However, the negative effects of HIO on the oocyte maturation quality are still uncertain. In view of this, this paper used fluorescence labelling, two-photon imaging and three-dimensional reconstruction to study the HIO-induced changes on the chromosomal architecture in the matured mouse oocytes. Our results showed that HIO caused an increase in the abnormal chromosomal arrangement, but had little effects on the chromosomal volume and surface area. This might suggest that HIO disturbed the function of chromosome movement or migration. It is hoped that this study can offer useful reference for further understanding HIO.
Hormone induction ovulation; fluorescence labelling; two-photon imaging; chromosomal architecture
2017-01-02。
遼寧省科技廳自然科學基金資助項目(2015020715)。
吳 迪(1979-),男,遼寧沈陽人,沈陽師范大學副教授,博士。
1673-5862(2017)03-0277-04
Q631; Q632
A
10.3969/ j.issn.1673-5862.2017.03.003