晚期非小細胞肺癌靶向治療進展與展望:聚焦小分子酪氨酸激酶抑制劑
張國偉 王慧娟 綜述 馬智勇 審校
肺癌是全球癌癥相關死亡的首要原因[1],而非小細胞肺癌(non-small cell lung cancer, NSCLC)約占肺癌的85%[2]。晚期NSCLC的傳統治療模式是含鉑雙聯化療,中位總生存期(overall survival, OS)約8個月,2年生存率12%[3]。近年來晚期NSCLC的治療快速發展,而關鍵性的進步來自于表皮生長因子受體酪氨酸激酶抑制劑(epidermal growth factor receptor tyrosine kinase inhibitors, EGFR-TKIs)[4]和間變性淋巴瘤激酶酪氨酸激酶抑制劑(anaplastic lymphoma kinase tyrosine kinase inhibitor, ALK-TKI)[5]。小分子酪氨酸激酶抑制劑代表著一種將NSCLC根據驅動基因區分為不同的分子亞型并給予相應藥物的治療模式,是晚期NSCLC靶向治療的典型代表,也可稱其為狹義的靶向治療(廣義的靶向治療還包括抗血管生成治療、免疫檢查點抑制劑等)。隨著EGFR-TKIs和ALK-TKI臨床中的應用日趨成熟,小分子TKI類藥物的發展開始有了新的主題和側重,即解決EGFR-TKIs和ALK-TKI耐藥后的治療困境,并拓展更多的治療靶點(本文提及的靶點及對應靶向藥物的療效總結見表1)。本文擬就此進行分析和闡述。
1 第三代EGFR-TKIs
盡管EGFR敏感突變型NSCLC患者第一代EGFRTKIs療效卓越,但通常在9個月-14個月就會出現疾病進展[4,6,7]。一代EGFR-TKIs耐藥機制多種多樣,包括EGFR的二次突變、旁路途徑的激活、以及病理亞型的轉換等,其中尤以EGFR 20外顯子T790M突變最為常見,可見于50%以上的獲得性耐藥患者[8]。既往耐藥后除了傳統化療之外缺乏有效的治療手段,雖然有增加藥物劑量、換用另一種TKI等探索,但結果差強人意。第二代EGFR-TKIs為不可逆的泛HER抑制劑(阿法替尼、Dacomitinib等),除EGFR外尚可拮抗其他HER家族受體,并在基礎研究中顯示出一定的抗T790M活性,曾被寄望治療一代TKIs獲得性耐藥患者,但臨床試驗給出了陰性的結果[9]。2009年問世的一種化合物WZ4002,在基礎研究中拮抗T790M的活性30倍-100倍于一代TKIs,而對野生型EGFR的活性則約為一代TKIs的1/100[10]。此后這一類藥物被稱為第三代EGFR-TKIs,共同特征是對傳統敏感突變以及T790M突變高度敏感,而幾乎不抑制野生型EGFR。WZ4002未進行后續的臨床研發。目前最主要的第三代EGFR-TKIs包括Osimertinib(AZD9291)、Rociletinib(CO-1686)、Olmutinib(HM61713)等。
1.1 Osimertinib(AZD9291) Osimertinib是第一個獲批的三代EGFR-TKIs[11],也是目前為止第一個獲得了III期臨床試驗數據的三代EGFR-TKIs。其獲批數據主要來自于I期/II期臨床研究AURA及II期臨床研究AURA2。
AURA研究I期階段共入組253例一代TKIs獲得性耐藥患者。所有可評價療效患者的客觀緩解率(objective response rate, ORR)為51%,疾病控制率(disease control rate,DCR)為84%,擴展隊列的無進展生存期(progression free survival, PFS)為8.2個月。其中127例T790M突變患者中,ORR為61%,DCR為95%,中位PFS為9.6個月[12]。AURA研究II期階段選擇80 mg的治療劑量,所入組人群為T790M突變的TKI獲得性耐藥者,2015年世界肺癌大會(World Conference on Lung Cancer, WCLC)報告其初步結果:入組患者201例,中位治療暴露時間4.9個月,168例患者仍在治療中,獨立評價委員會評價ORR為58%,DCR為92%,研究者評估ORR為68%,中位PFS尚未達到[13]。AURA2是一項單臂的II期臨床研究,也入組T790M突變的耐藥患者,入組患者210例,中位治療暴露時間4個月,截至報告183例患者仍在治療中,獨立評價委員會評價ORR為64%,DCR為90%,研究者評價ORR為64%,中位PFS尚未達到[14]。
AURA 3是一項在一線EGFR-TKIs進展后且T790M突變陽性的患者中對比Osimertinib和培美曲塞含鉑化療療效的III期臨床試驗。結果顯示與化療相比,Osimertinib顯著延長PFS(10.1個月 vs 4.4個月;HR=0.3;95%CI:0.23-0.41;P<0.001),ORR也顯著優于化療:71% vs 31%(OR=5.39,95%CI: 3.47-8.48, P<0.001)。該研究確立了Osimertinib在一線TKIs進展后T790M突變陽性患者中的首選地位[15]。
1.2 Rociletinib(CO1686) Rociletinib是另一種廣受關注的第三代EGFR-TKIs。目前主要的臨床數據來自于I期/II期臨床研究TIGER-X,該研究分為2個階段,I期的劑量爬坡階段和II期的劑量擴展階段。研究最初入組的57例患者應用游離型Rociletinib,之后入組的患者應用氫溴酸結合型1686(藥代動力學更優)。在II期擴展階段中,納入T790M陽性的患者接受500 mg每日2次、625 mg每日2次、或750 mg每日2次的治療劑量。截至2015年文獻發表,共入組130例患者,客觀緩解見于游離型900 mg每日2次劑量組及氫溴酸鹽所有劑量組,在這些患者中,T790M陽性者ORR為59%,DCR為93%;T790M陰性者ORR為29%,DCR為59%。T790M陽性和陰性患者的中位PFS分別為13.1個月和5.6個月。在研究中Rociletinib顯示出兩種特征性的不良反應:高血糖癥,發生率高達47%,2級以上發生率為22%;QT波延長,發生率為12%,3級以上為5%;但未有治療相關性死亡[16]。
基于TIGER-X研究的結果,同Osimertinib一樣,2015年Rociletinib進入了食品藥品監督管理局(Food and Drug Administration, FDA)的快速審批通道。但由于FDA認為TIGER-X研究中患者的療效評價未按照實體瘤療效評價標準(Response Evaluation Criteria in Solid Tumors,RECIST)評價標準進行嚴格的確認,并且對于高血糖和QT波延長的不良反應存在疑慮,最終于2016年4月拒絕提前批準Rociletinib。隨后2016年美國臨床腫瘤學會(American Society of Clinical Oncology, ASCO)年會中報道了TIGER-X研究的數據更新,并對療效進行了確認,確認后T790M陽性患者中500 mg每日2次劑量組的ORR僅21.8%,625 mg每日2次劑量組的ORR僅31.4%[17]。
1.3 Olmutinib(HM61713) Olmutinib(HM61713)是一種韓國研發的第三代EGFR-TKIs。2015年美國臨床腫瘤學會(American Society of Clinical Oncology, ASCO)年會報告了其I期/II期臨床試驗兩個擴展隊列的初步結果:300 mg隊列(n=83)和800 mg隊列(n=62,II期階段),800 mg隊列中所有患者均存在T790M突變,為II期臨床研究推薦劑量。結果顯示兩隊列的ORR分別為29.1%和54.8%[18]。2016年ASCO年會報告了II期階段(800 mg)的數據更新:共入組76例T790M陽性患者,至數據截止,中位治療持續時間為7個月,34%的患者仍在接受治療。ORR為56%(經過確認的ORR為44%),DCR為90%,中位PFS 7.0個月[19]。2016年5月Olmutinib在韓國被批準用于治療T790M陽性的進展期NSCLC,成為全球第二個獲批的第三代EGFR-TKIs[20]。
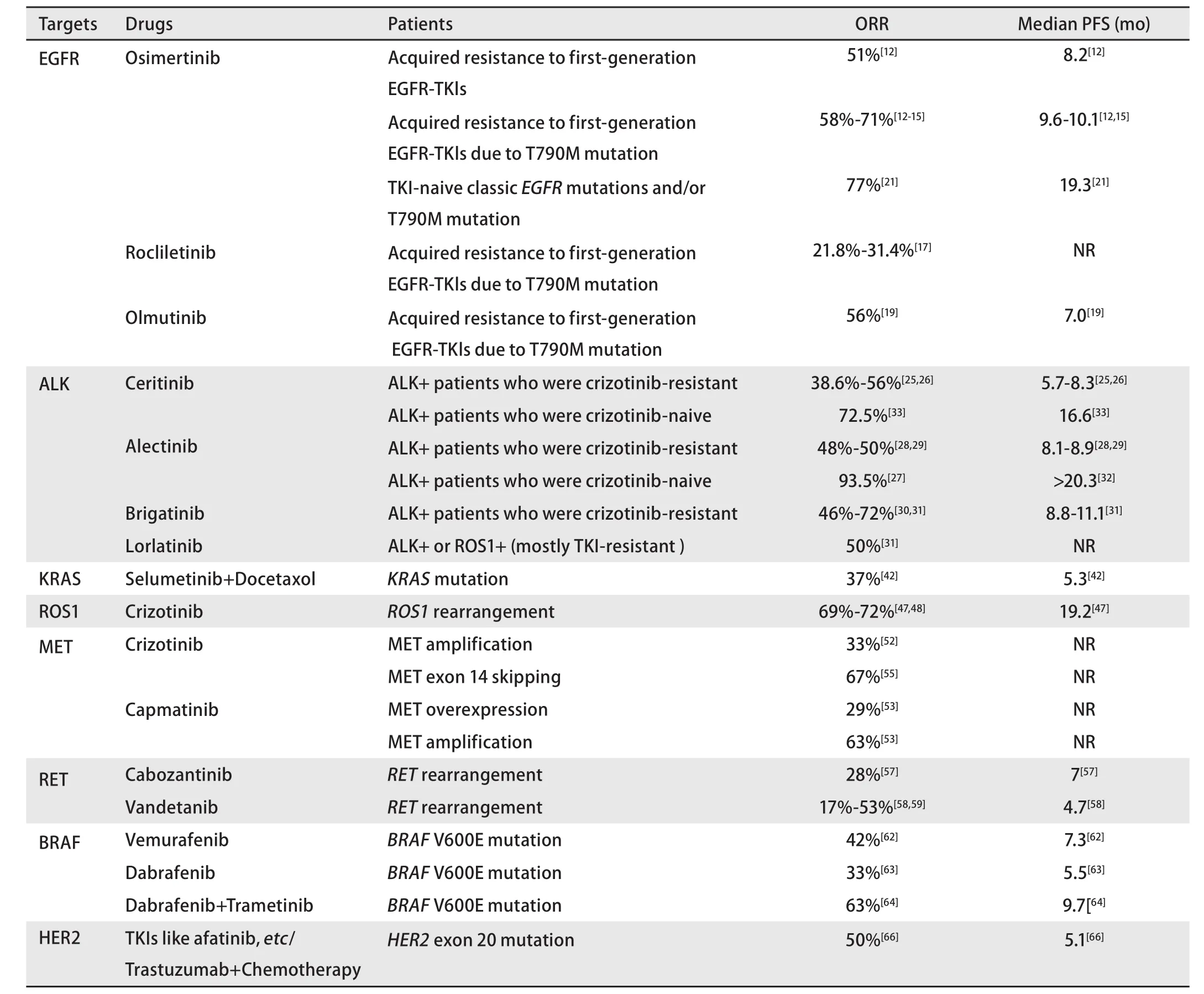
表 1 本文中提及的靶點及對應的靶向藥物Tab 1 Targets and corresponding drugs mentioned in this article
其他的第三代EGFR-TKIs還包括EGF816、ASP8273以及我國原研的Avitinib等,多已初步展現了良好的臨床療效。總之,第三代EGFR-TKIs對于一代TKIs獲得性耐藥患者的作用已毋庸置疑,尤其在T790M突變患者中,有幾乎等同于一線TKIs在敏感人群中的療效。不同藥物之間,從目前數據看來Osimertinib療效最優,但仍需有進一步證據支持。而第三代EGFR-TKIs也已經有了初步的一線治療數據:2016年歐洲肺癌大會(European Lung Cancer Conference, ELCC)報告AURA I期擴大研究中Osimertinib一線治療隊列的結果:入組60例患者(80 mg, n=30; 160 mg,n=30),40% EGFR 19外顯子突變,42% EGFR L858R突變,5例存在EGFR T790M突變。ORR為77%(其中80 mg組67%,160 mg組87%),DCR為98%,中位PFS更是達到驚人的19.3個月[21]。因此將來第三代TKIs究竟是作為一代、二代TKIs耐藥后的解救治療,還是直接走向一線取代傳統TKIs,尚未可知。
2 新一代ALK-TKIs
與EGFR-TKIs相似,大部分ALK陽性的NSCLC患者在接受克唑替尼治療1年內就會出現進展[5,22]。克唑替尼獲得性耐藥的機制大體上可以被區分為兩類[22]。第一類可稱之為ALK靶點依賴性耐藥:因為這些機制的出現增強、恢復了ALK通路的激活,它主要包括ALK激酶域的繼發性突變和ALK融合基因的擴增,兩者可單獨或同時出現,尤以繼發性突變最為常見,見于約30%的耐藥患者;另一類為非ALK靶點依賴性耐藥,即旁路激活:如EGFR、KRAS獲得性突變,c-KIT基因擴增等。所謂新一代ALK-TKIs,對EML4-ALK的抑制能力強于克唑替尼,且對導致克唑替尼耐藥的繼發性突變多有不同程度的抑制能力(不同藥物對不同突變型的抑制譜不同)。因此,新一代ALK-TKIs可以對抗第一類機制導致的耐藥,有望成為克唑替尼耐藥后的主要治療手段。
2.1 已經獲批的新一代ALK-TKIs 目前全球獲批的新一代ALK-TKIs包括Ceritinib和Alectinib。
基于2014年I期臨床試驗ASCEND-1報告的初步臨床結果,Ceritinib獲得FDA批準用于克唑替尼耐藥的晚期ALK陽性NSCLC患者[23]。當時在克唑替尼耐藥及未經ALK-TKIs治療的ALK陽性患者中,ORR分別為55%和66%,整體PFS為8.2個月,耐藥患者為6.9個月[24]。在2016年更新后的研究結果中,共83例未經ALK-TKI治療及163例曾經ALK-TKI治療的ALK陽性患者,ORR分別為72%和56%,中位PFS分別為17.0個月和8.3個月[25]。而在另一項評估Ceritinib治療克唑替尼耐藥后患者療效的II期臨床試驗ASCEND-2[26]中,入組140例患者,ORR為38.6%,中位PFS 5.7個月。
基于一項I期/II期臨床試驗AF-001JP中對未經ALK抑制劑治療的ALK陽性患者93.5%的ORR,2014年Alectinib首先在日本獲得批準[27]。而2015年Alectinib被FDA批準用于克唑替尼耐藥的ALK陽性晚期NSCLC患者是基于兩項II期臨床試驗[23]:NP28671和NP28673。前者入組87例克唑替尼耐藥患者,ORR為48%,中位PFS 8.1個月[28];后者入組138例克唑替尼耐藥患者,ORR為50%,DCR為69%,中位PFS 8.9個月[29]。
2.2 尚未獲批的ALK-TKIs Brigatinib(AP26113)同時是ALK、ROS1和EGFR抑制劑。一項I期/II期臨床試驗2016年報告的結果中,Brigatinib治療克唑替尼耐藥和未經克唑替尼治療的患者ORR分別為72%(51/71)和100%(8/8),整體人群的中位PFS達到13.2個月[30]。同年報告的II期臨床研究ALTA入組克唑替尼耐藥患者222例,A組接受Brigatinib每日90 mg,B組接受每日90 mg共7 d后增量到每日180 mg,ORR分別為46%和54%,中位PFS分別為8.8個月和11.1個月[31]。Lorlatinib(PF-06463922)也是一種多靶點藥物,它是ALK和ROS1抑制劑。目前正在進行I期/II期臨床試驗,2016年ASCO報告其I期研究階段的最新結果:入組41例ALK陽性患者及12例ROS1陽性患者(均大部分經過TKIs治療),ORR為50%[31]。其他在早期臨床研究中的新一代ALK-TKIs還包括X-396、ASP3026、TSR-011、Entrectinib、CEP-28122等。
綜上,新一代ALK-TKIs在克唑替尼獲得性耐藥的患者中已展現了不俗的療效。同時已經可以初步看出,這些藥物在未經克唑替尼治療的ALK陽性患者中療效更好。2016年ASCO報告了Alectinib一項III期臨床試驗初步結果:Alectinib對比克唑替尼用于未經ALK-TKIs治療過的ALK陽性患者,截至報告,Alectinib組中位PFS尚未達到(95%CI:20.3-無法評估),而克唑替尼組中位PFS 10.2個月[32]。2016年WCLC報告了Ceritinib對比克唑替尼一線治療ALK陽性患者的III期臨床試驗ASCEND-4,該研究達到了其首要終點:Ceritinib組PFS較克唑替尼組顯著延長(16.6個月 vs 8.1個月;HR=0.55,95%CI:0.42-0.73;P<0.000,01),ORR也明顯提高(72.5% vs 26.7%)[33]。因此,新一代ALK-TKIs的角色同樣并非限制在克唑替尼獲得性耐藥的解救治療。同時研究證實,各種ALK-TKI對于不同的繼發性突變敏感性不同(表2),甚至有Lorlatinib耐藥后回頭應用克唑替尼重新有效的報道[34]。因此,未來理想的方式應該是動態監測耐藥患者突變狀態的變化,并選擇相應的ALK-TKI。
3 新治療靶點的拓展
在中國,EGFR突變及EML4-ALK融合基因分別約占NSCLC患者的約41%[35]和8.65%[36]。這意味著除此之外,還有約一半的患者無法從靶向治療中獲益。因此,除了EGFR及ALK靶點的縱深研究,尋找新的治療靶點也是當務之急。
3.1 KRAS KRAS基因突變是高加索裔NSCLC患者最常見的驅動基因突變,發生率約30%[37-39],亞裔人群中約占5.8%[40]。KRAS突變在肺癌中的發現已有30年之久[41],但以其作為治療靶點的臨床研究卻屢屢失敗。唯獨近年來針對KRAS下游通路的MEK抑制劑在KRAS突變患者中展現出一定的臨床前景。2012年MEK抑制劑司美替尼報告了一項II期臨床研究結果[42],共入組87例KRAS突變的IIIb期/IV期NSCLC患者,隨機接受多西他賽聯合司美替尼或多西他賽聯合安慰劑,結果顯示司美替尼組較安慰劑組ORR和PFS均有顯著優勢,ORR分別為37%和0(P<0.000,1),中位PFS分別為5.3個月和2.1個月(HR=0.58, 90%CI: 0.42-0.79;P=0.014),OS也有延長趨勢,中位OS分別為9.4個月和5.2個月(HR=0.80; 90%CI: 0.56-1.14; P=0.21)。然而遺憾的是近期阿斯利康公司宣布司美替尼用于KRAS突變型NSCLC的III期臨床試驗[43]以失敗告終,希望將來最終試驗結果的發表能闡明失敗的原因,給以后KRAS突變型肺癌的研究以啟示。
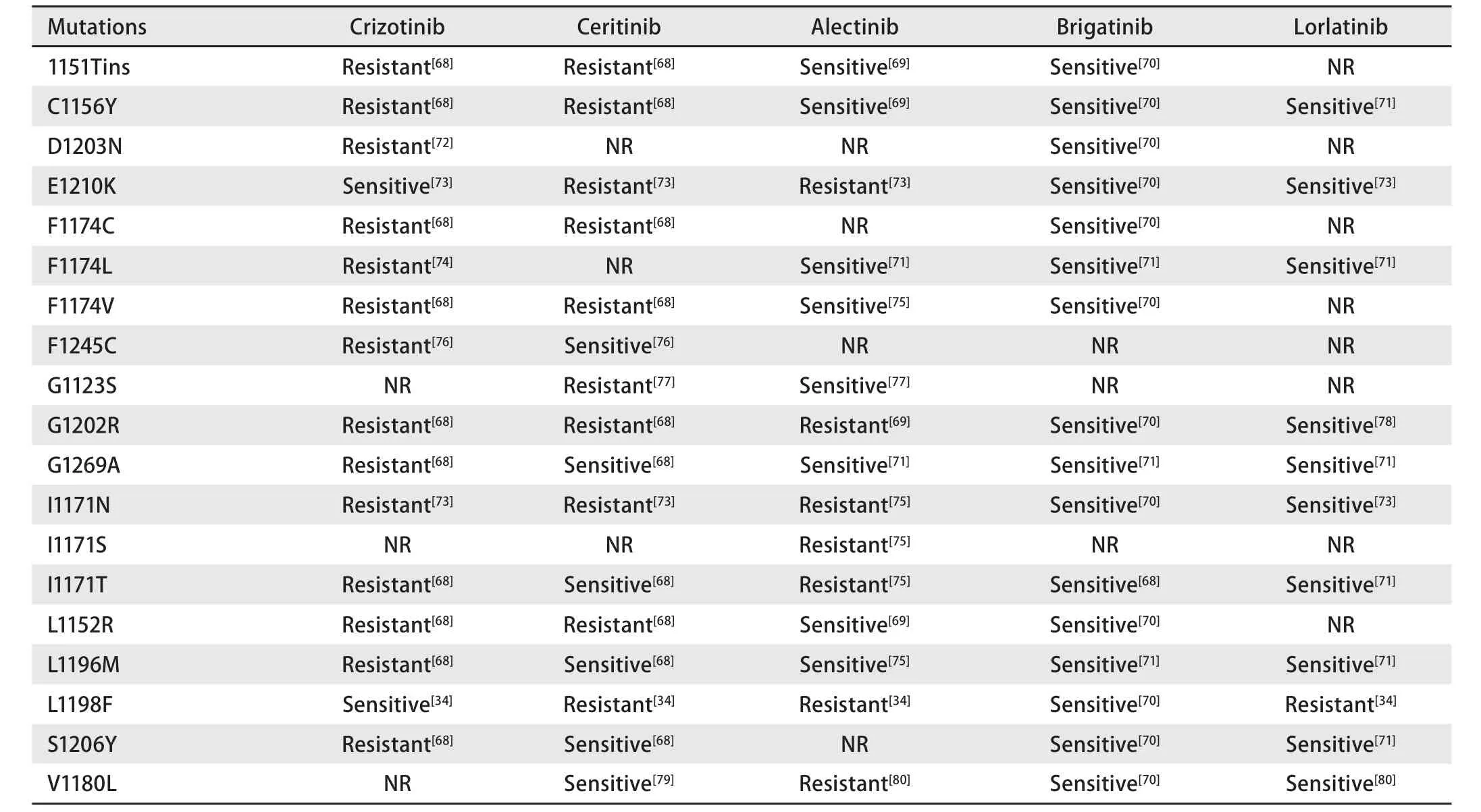
表 2 各種ALK-TKIs對ALK激酶域不同繼發性突變位點的敏感性差異Tab 2 Sensitivities of different ALK-TKIs to different secondary ALK kinase domain mutations
3.2 ROS1 ROS1基因編碼一種胰島素受體家族的酪氨酸激酶受體,ROS1基因重排可導致其所編碼受體的酪氨酸激酶活性異常,導致下游多條致癌信號通路的激活。ROS1基因重排在我國患者中的陽性率與高加索裔無差異,約為1%-2%[44-46]。克唑替尼同時是ALK、ROS1和MET抑制劑,其I期臨床試驗PROFILE 1001中包含一個ROS1的擴展隊列,共入組50例ROS1基因重排的NSCLC患者,ORR為72%,中位治療持續時間17.6個月,中位PFS為19.2個月[47]。從而克唑替尼被FDA批準用于ROS1基因重排的NSCLC患者。2016年ASCO報告了一項克唑替尼治療ROS1基因重排的東亞患者的II期臨床試驗,共入組129例ROS1陽性、ALK陰性、全身治療≤3線的進展期NSCLC患者,克唑替尼客觀緩解率達到69%,且與治療線數無關,DCR為84%,中位治療持續時間7.8個月,中位PFS尚未達到[48]。
3.3 MET MET基因是肝細胞生長因子受體蛋白(hepatocyte growth factor receptor, HGFR)的編碼基因[49]。MET信號通路的異常激活可由多種形式導致,如基因突變、基因擴增、蛋白的過表達等[50,51]。它的異常激活,可以作為原發驅動基因,也是EGFR-TKIs獲得性耐藥的重要機制之一[49]。克唑替尼I期臨床試驗PROFILE 1001的MET擴增隊列中,克唑替尼單藥顯示出一定的臨床療效,但ORR僅33%[52]。2016年ASCO報告Capmatinib(INC280)的I期臨床數據,在免疫組化3+的患者中ORR為29%,基因拷貝數≥5的患者中ORR為63%[53]。最值得期待的療效預測因子可能是MET基因14外顯子跳躍突變:2015年,Paik等[54]報告小分子MET抑制劑(克唑替尼、卡博替尼)在MET 14外顯子跳躍突變的NSCLC患者中可能療效卓越。2016年ASCO會議中,PROFILE 1001研究報告了MET 14外顯子跳躍突變隊列應用克唑替尼治療的初步結果,截至報告為止,15例可評價療效的患者中10例患者達到PR[55]。從以上結果看來,MET基因的擴增、過表達及突變似乎均可作為MET抑制劑的療效預測因子,其中以14外顯子突變的療效預測意義最為顯著。基因擴增、過表達及突變作為療效預測因子是否具有內在邏輯的相關性值得進一步探索。
3.4 RET RET基因重排是一種已知在甲狀腺癌中可作為治療靶點的驅動基因,它在NSCLC的發生率約1.5%[56]。目前NSCLC中RET基因的相關臨床研究多是在評價已在甲狀腺癌中獲批的RET抑制劑治療RET重排NSCLC的療效。如2015年ASCO報道卡博替尼在一項單臂的II期臨床研究中治療20例RET重排NSCLC的結果,在18例可評價療效的患者中,ORR為28%,中位PFS 7個月(95%CI:3個月-未達到),中位OS未達到[57]。2016年ASCO報告凡德他尼治療RET重排NSCLC的兩項II期單臂臨床試驗:一項來自日本,入組19例患者,可評價療效者17例,ORR為53%,中位PFS 4.7個月[58];另一項來自韓國,共入組18例患者,ORR 17%[59]。
3.5 BRAF BRAF也是一種在其他瘤種中可作為治療靶點的驅動基因:BRAF V600E突變見于約40%-60%的惡性黑色素瘤患者[60],這些患者接受BRAF抑制劑達拉菲尼、Vemurafenib治療療效突出。在肺腺癌中BRAF突變的發生率約1%-5%,其中大部分為V600E突變[61]。在一項Vemurafenib的II期籃子試驗中入組了19例BRAF V600E陽性的NSCLC患者,ORR為42%,中位PFS 7.3個月[62];達拉菲尼治療BRAF V600E陽性NSCLC的II期臨床試驗入組84例患者,ORR 33%,中位PFS 5.5個月[63]。另一項II期臨床研究重復了惡性黑色素瘤的成功模式,將達拉菲尼與MEK抑制劑曲美替尼聯合用于治療BRAF V600E陽性NSCLC,57例患者,ORR為63%,中位PFS 9.7個月[64]。
2.6 HER2 HER2與EGFR同屬于ERBB受體家族。在乳腺癌中,HER2擴增發生率約20%,且可以作為抗HER2單抗或TKIs的療效預測因子[65]。在NSCLC中,雖然HER2擴增有約2%-4%的發生率,但以其作為靶點進行的臨床研究均告失敗。而在肺腺癌中,有約1%-2%的患者存在HER2 20外顯子突變[66]。目前尚缺乏前瞻性臨床研究數據。但2012年有報告使用阿法替尼治療了3例HER2 20外顯子突變型NSCLC,3例患者均達到部分緩解(partial response,PR)[67]。另一項歐洲的回顧性隊列研究顯示,這部分患者接受HER2抑制劑(阿帕替尼等TKI單藥或曲妥珠單抗聯合化療)的治療可達到50%的ORR和83%的疾病控制率,中位PFS為5.1個月[66]。
4 小結
綜上所述,目前根據驅動基因的不同,我們至少可以將NSCLC分為具有治療指導意義的7種分子亞型:EGFR突變型、EML4-ALK基因融合型、ROS-1基因融合型、CMET高表達/擴增/突變型、RET基因融合型、BRAF突變型、HER-2突變型。第三代EGFR-TKIs和新一代ALK-TKIs的出現解決了一代藥物的耐藥問題,使EGFR和ALK陽性患者的生存進一步延長,而針對其他的少見靶點,也或多或少有臨床證據支持相應的藥物應用。同時近年來基因檢測技術的快速發展使得我們能更合理地利用這些藥物進行治療決策:如NGS能利用較少的標本一次進行多種基因的檢測、液體活檢技術使我們可以動態檢測耐藥患者的基因狀態改變。因此,晚期非小細胞肺癌靶向治療的臨床應用將由此帶來深度和廣度上的進一步革新。然而,新的問題總是接踵而來:我們能否打破藥物敏感、耐藥、新藥研發、再耐藥的無盡循環?部分少見靶點的療效差強人意(RET、BRAF、HER-2),如何解決?能否進一步擴展靶向治療的版圖(KRAS等)?期待未來的研究可以使這些問題得以解決。

