替換阿立哌唑對兒童、青少年精神分裂癥伴代謝綜合征的影響
陳美英,陳尚坤,袁也豐,張華坤
(1.江西省精神病院精神科,南昌 330029; 2.南昌大學第一附屬醫(yī)院心身醫(yī)學科,南昌 330006)
替換阿立哌唑對兒童、青少年精神分裂癥伴代謝綜合征的影響
陳美英1,陳尚坤1,袁也豐2,張華坤1
(1.江西省精神病院精神科,南昌 330029; 2.南昌大學第一附屬醫(yī)院心身醫(yī)學科,南昌 330006)
目的 探討兒童、青少年精神分裂癥伴代謝綜合征(MS)者換用阿立哌唑治療后的代謝改變和療效。方法選取使用奧氮平治療出現(xiàn)MS的兒童、青少年精神分裂癥患者66例,將其隨機分為阿立哌唑組和奧氮平組,阿立哌唑組逐步替換奧氮平為阿立哌唑單一治療,奧氮平組繼續(xù)原奧氮平治療。2組分別在入組前和入組后的第8、12、24、52周末,進行代謝指標、療效和安全性的監(jiān)測。結果 阿立哌唑組體質量、體質指數(shù)(BMI)、空腹血糖(FBS)、總膽固醇(CHOL)、血壓在入組第8周開始顯著降低(P<0.05),而奧氮平組持續(xù)惡化。52周后阿立哌唑組未見有滿足MS診斷的患者。PANSS總分2組與入組前比較均顯著下降,差異有統(tǒng)計學意義(P<0.01);組間比較差異無統(tǒng)計學意義(P>0.05)。結論 對于因使用奧氮平治療致兒童、青少年精神分裂癥伴MS患者,換用阿立哌唑治療能顯著改善代謝指標,且安全有效。
兒童精神分裂癥; 代謝綜合征; 阿立哌唑; 奧氮平; 療效; 安全性
最新的國外研究[1-3]顯示,兒童、青少年精神分裂癥患者相比成年人而言,在接受抗精神病藥物治療時,更易于罹患諸如錐體外系癥狀、催乳素水平升高、體質量增加及代謝副作用等不良事件,而代謝副反應兒童、青少年更常見。有研究[4]表明使用奧氮平體質量可增加 10%~14%。對伴隨代謝異常的兒童、青少年精神分裂癥患者而言,有指南[5]推薦可以換用對代謝影響較小的藥物治療,但臨床相關的研究較少,尤其是對兒童、青少年的研究更少。為此,本研究對服用奧氮平的兒童、青少年精神分裂癥患者伴發(fā)代謝綜合征(MS)者換用阿立哌唑治療,并探討該換藥方案的安全性、有效性。
1 對象和方法
1.1 研究對象
選取2012年6月至2016年1月在江西省精神病院門診或住院治療的符合入組標準患者66例。將入組病例隨機分為2組,奧氮平組33例繼續(xù)奧氮平治療,阿立哌唑組33例換用阿立哌唑單一治療,在2周內逐步停用奧氮平。隨訪52周。
入組標準:1)符合《精神障礙診斷和統(tǒng)計手冊》第四版修訂版(DSM-IV-TR)[6]和《國際疾病和相關健康問題分類第十版》(ICD-10)[7]的精神分裂癥診斷標準,年齡6~18歲;2)入組前6周服用奧氮平單一藥物治療,符合2004年中華醫(yī)學會糖尿病學分會MS診斷標準[8];3)患者、家屬或監(jiān)護人簽訂知情同意書。
排除標準:1)目前伴器質性精神障礙或雙相障礙患者;2)在過去12個月內符合任何物質濫用障礙的診斷標準者;3)本次發(fā)作期間接受過合并抗精神病藥和阿立哌唑治療≥3周的患者,以及本次發(fā)作期間接受過電抽搐療法治療的患者;4)抗精神病藥物治療前有MS病史,或有高血壓、糖尿病家族史;5)有減輕體質量計劃者(包括特殊飲食或特殊的體育運動等);6)近期有妊娠或哺乳計劃者。
MS的診斷標準:具備以下4項組成成分中的3項或全部者:1)超重和(或)肥胖:體質指數(shù)(BMI)≥25 kg·m-2;2)空腹血糖(FBG)≥6.1 mmol·L-1(110 mg·dL-1)及(或)糖負荷后2 h血糖≥7.8 mmol·L-1(140 mg·dL-1),及(或)已確診為糖尿病并治療者;3)高血壓:收縮壓/舒張壓≥130/85 mmHg,及(或)已確認為高血壓并治療者;4)血脂紊亂:空腹血三酰甘油TG≥1.7 mmol·L-1(150 mg·dL-1),及(或)血高密度脂蛋白(HDL)<1.04 mmol·L-1(40 mg·dL-1)。
在入組前開始,2組均按標準統(tǒng)一患者的飲食、運動、睡眠,直到研究結束。
1.2 給藥方法
阿立哌唑(成都康弘藥業(yè)集團股份有限公司,批號:20120305;20130101;20140603;20160305)的起始劑量為5 mg·d-1,依據(jù)病情需要增加劑量,在2周內逐漸停用原有的奧氮平,以阿立哌唑單一治療,療程共52周。對于急性激越或嚴重失眠者可使用苯二氮卓類藥,評估前12 h禁止使用;出現(xiàn)錐體外系副反應者可以使用鹽酸苯海索,出現(xiàn)竇性心動過速可以使用普萘洛爾。
1.3 評定方法
分別在入組前和入組后第8、12、24、52周末監(jiān)測代謝指標和安全性有效性,包括:體質量、BMI、FBS、TG、總膽固醇(CHOL)、低密度脂蛋白(LDL)、HDL、血壓、血常規(guī)、心電圖、陽性和陰性癥狀量表(PANSS)、副反應量表(TESS);全程觀察不良事件。于研究前對參與研究的醫(yī)生進行測評量表的培訓和一致性檢驗(Kappa 值≥0 .82)。
1.4 統(tǒng)計學方法
2 結果
2.1 一般資料
最終入組患者66例,2組各33例,共58例完成了為期52周的研究。阿立哌唑組30例完成研究,其中男性16例,女性14例,年齡12~18歲,平均年齡(16±1.25)歲,治療劑量為10~30 mg·d-1,平均17.14 mg·d-1;失訪1例,病情不穩(wěn)定換藥1例,治療4周出現(xiàn)傷人行為脫落1例。奧氮平組28例完成研究,其中男性15例,女性13例,年齡12~18歲,平均年齡(16±1.25)歲,劑量為10~25 mg·d-1,平均15.65 mg·d-1。5例未完成實驗,其中2例失訪,病情不穩(wěn)定換藥者1例出現(xiàn)在第8周,2例因不良反應脫落(體質量增加和CHOL升高)。2組在入組前年齡、性別、受教育程度、病程和病情、代謝參數(shù)方面差異均無統(tǒng)計學意義(P>0.05)。
2.2 體質量及BMI比較
與入組前比較,奧氮平組體質量、BMI入組第8周開始顯著增加(P<0.05),而阿立哌唑組,從入組第8周起下降顯著(P<0.05);2組間入組第8—52周體質量及BMI比較差異均有統(tǒng)計學意義(P<0.05)。見表1。
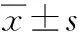

組別n時間體質量m/kgBMI/(kg·m-2)奧氮平組 28入組前60.74±11.3324.74±0.58入組后第8周64.50±10.93*△26.09±1.23*△第12周65.75±10.27*△26.35±1.21*△第24周72.13±5.23*△26.55±2.07*△第52周72.25±2.24*△27.16±2.08*△阿立哌唑組30入組前60.72±9.7324.65±1.67入組后第8周58.05±8.34*23.82±3.73*第12周57.25±8.73*22.53±2.42*第24周57.06±7.26*21.64±2.37*第52周56.63±8.23*21.02±1.21*
*P<0.05與同組入組前比較;△P<0.05與阿立哌唑組比較。
2.3 代謝參數(shù)比較
阿立哌唑組的代謝指標中FBS、CHOL、TG及血壓在入組前后的差值自第8至52周呈負向增大,差異具有統(tǒng)計學意義(P<0.05),第52周無滿足MS診斷的患者;奧氮平組相反,F(xiàn)BS、TG、CHOL及血壓在第8至52周持續(xù)升高,差異具有統(tǒng)計學意義(P<0.05);2組入組后第8—52周FBS、TG、CHOL及血壓比較差異均有統(tǒng)計學(P<0.05)。其余代謝指標組間及組內變化差異無顯著無統(tǒng)計學意義(P>0.05)。見表2。
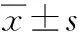

組別n隨訪時間FBSc/(mmol·L-1)TGc/(mmol·L-1)HDLc/(mmol·L-1)LDLc/(mmol·L-1)奧氮平組28入組前4.57±0.631.10±0.431.17±0.212.23±0.42入組后8周差值0.19±0.88*△0.46±0.18*△-0.05±0.37-0.01±0.3512周差值0.20±0.35*△0.66±0.27*△-0.06±0.17-0.01±0.5624周差值0.22±0.58*△0.74±0.23*△-0.06±0.58-0.01±0.7852周差值0.25±0.83*△0.87±0.29*△-0.07±0.19-0.01±0.82阿立哌唑組30入組前4.55±0.351.22±0.131.21±0.272.08±0.83入組后8周差值-0.28±0.89*-0.26±0.32*-0.01±0.14-0.25±0.1612周差值-0.29±0.92*-0.28±0.53*-0.01±0.19-0.27±0.2224周差值-0.31±0.25*-0.30±0.25*-0.01±0.20-0.29±0.1952周差值-0.33±0.46*-0.31±0.43*-0.01±0.27-0.31±0.11組別n隨訪時間總膽固醇c/(mmol·L-1)收縮壓p/mmHg舒張壓p/(mmHg)PANSS總分/分奧氮平組28入組前3.53±0.57121.16±5.2774.56±5.43105.20±10.568入組后8周差值0.25±0.34*△10.34±8.21*△5.15±7.34*△-24.97±5.63*△12周差值0.31±0.39*△10.14±7.12*△5.50±6.67*△-37.63±6.42*△24周差值0.32±0.73*△10.23±8.02*△5.57±8.54*△-46.43±3.16*△52周差值0.34±0.43*△10.54±8.56*△5.79±7.69*△-47.24±4.53*△阿立哌唑組30入組前3.48±0.56123.21±9.3270.12±5.25110.20±6.138入組后8周差值-0.26±0.94*8.37±9.4*6.03±8.67*-23.97±5.63*12周差值-0.27±0.99*8.14±10.81*5.89±8.96*-35.63±7.15*24周差值-0.28±0.13*7.68±11.42*5.44±7.69*-46.62±5.51*52周差值-0.28±0.34*7.14±11.30*5.12±10.15*-48.83±5.92*
*P<0.05與同組入組前比較;△P<0.05與阿立哌唑組比較。1 mmHg=0.133 kPa。
2.4 有效性與安全性比較
2組PANSS總分與入組前比較均顯著下降,差值負向增大(P<0.01),入組前后精神癥狀有明顯的改善;2組PANSS評分組間比較差異無統(tǒng)計學意義(P>0.05),見表2。TESS量表監(jiān)測奧氮平組不良事件多數(shù)為嗜睡、疲乏感、靜坐不能、便秘等,均比較輕,對癥處理后能好轉。阿立哌唑組多數(shù)為靜坐不能、嗜睡、疲乏感,多數(shù)能耐受,或在對癥處理后好轉,無嚴重不良反應發(fā)生。
3 討論
早年的研究表明精神分裂癥導致的心血管代謝風險,與藥物治療、疾病的狀態(tài)或特征相關,比如患者貧窮、就醫(yī)機會減少、生活方式(吸煙、運動、飲食等)及患者的身體代謝異常等[9]。筆者的研究嚴格限制了患者的生活方式,排除了入組前患有代謝疾病病史的患者,并且入組采用隨機的方法,一般人口統(tǒng)計學資料無差異。現(xiàn)有的文獻[10]支持抗精神病藥物體質量增加主要發(fā)生在用藥的前6周,增加的程度具有統(tǒng)計學意義。這與筆者的研究發(fā)現(xiàn)相符(治療前8周BMI迅速改變)。因此,筆者認為奧氮平治療6周的患者伴發(fā)MS入組可以基本排除課題設計的混雜因素。
需要說明的是,兒童正處于生長發(fā)育階段,體質量可能變化較大,因此BMI作為對兒童體質量增加的判斷意義重大。體質量增加和肥胖會導致患者對治療的不依從。本研究奧氮平組2例因不能耐受體質量增加和肥胖的不良反應而脫落。因此SGA導致的BMI增加及MS需要臨床謹慎對待。研究表明兒童、青少年精神病患者的2型糖尿病的發(fā)生率與精神疾病的不同診斷無明顯關系,而與抗精神病治療、女性患者、精神病診斷時年齡較大呈正相關[11]。因此對于兒童、青少年精神病患者來說,嚴格的抗精神病治療適應證、藥物品種的選擇、早期治療和常規(guī)代謝疾病監(jiān)測十分重要。
奧氮平治療在8周內引起體質量及BMI迅速增加,此過程也出現(xiàn)在奧氮平引起的體質量增加的動物模型中[12],并且在兒少期(10~15歲)體質量超標患者中近80%在25歲的成年期有肥胖[13],這說明治療8周開始的體質量快速增長即可判斷出長久治療后體質量的增加和肥胖,其個體身體代謝存在異常,在這個階段的代謝監(jiān)測應該更加頻繁。正如指南與近期的文獻[14-15]所示,建議在入組前和第8周、第12周定期監(jiān)測體質量指數(shù)、血糖和血脂以預防MS的發(fā)生。而且在有糖尿病、高脂血脂與肥胖、體質量增加家族史的患者中尤其重要。
奧氮平組第8周開始直至52周體質量、BMI、FBS、TG、CHOL、血壓均持續(xù)增加,MS將加重。而阿立哌唑組第8周開始上述指標均改善,52周MS能得到有效緩解。2組治療對兒童、青少年精神分裂癥均有部分療效,且療效相當。不良反應較為常見,無嚴重不良反應。因此換用阿立哌唑治療是較為理想的選擇,可以有效運用于臨床。通常,體質量增加>7%被考慮與藥物有關[16]。2004年ADA/APA的專家共識推薦:如果使用SGA后體質量增加超過5%,可以考慮換成其他代謝較低風險的抗精神病藥物[5]。因此,臨床醫(yī)生對于在治療8周至12周出現(xiàn)體質量超過5%的兒童、青少年精神分裂癥患者,可以換用對代謝影響較小的阿立哌唑治療。
[1] Maayan L,Correll C U.Weight gain and metabolic risks associated with antipsychotic medications in children and adolescents[J].J Child Adolesc Psychopharmacol,2011,21:517-535.
[2] Arango C,Giráldez M,Merchán Naranjo J,et al.Second-generation antipsychotic use in children and adolescents:a six-month prospective cohort study in drugna?ve patients[J].J Am Acad Child Adolesc Psychiatry,2014,53:1179-1190.
[3] Correll C U,Manu P,Olshanskiy V,et al.Cardiometabolic risk of second-generation antipsychotic medications during first-time use in children and adolescents[J].JAMA,2009,302:1765-1773.
[4] Jerrell J M,Tripathi A,Rizvi A A,et al.The risk of developing type 2 diabetes mellitusas associated with psychotropic drug use in children and adolescents: A retrospective cohort analysis[J].Primcare Companion CNS Disord,2012,14(1):1-23.
[5] American Diabetes Association/American Psychiatric Association.Consensus development conference on antipsychotic drugs and obesity and diabetes[J].Diabetes Care,2004,27:596-601.
[6] American Psychiatric Association.Diagnostic and Statistical Manual of Mental Disorders[M].4th ed.Washington:Washington DC,2000:78-85.
[7] 世界衛(wèi)生組織.ICD-10精神與行為障礙分類[M].范肖東,汪向東,于欣,等譯.北京:人民衛(wèi)生出版社,1993:90-106.
[8] 中華醫(yī)學會糖尿病學分會代謝綜合征研究協(xié)作組.中華醫(yī)學會糖尿病學分會關于代謝綜合癥的建議[J].中華糖尿病雜志,2004,12(3):156-161.
[9] Petter R,John E,Birkenaes A B,et al.Increased mortality in schizophrenia due to cardiovascular disease-a non-systematic review of epidemiology,possible causes,and interventions[J].Front Psychiatry,2014,5:137-140.
[10] Megan S,Evan W,Loucas C E,et al.Efficacy and safety of pharmacological and psychological interventions for the treatment of psychosis and schizophrenia in children,adolescents and young adults:a systematic review and meta-analysis[J].PLOS ONE,2015,10(2):1-7.
[11] Nielsen R E,Laursen M F,Vernal D,et al.Risk of diabetes in children and adolescents exposed to antipsychotics:A nationwide 12-year Case-Control study[J].J Am Acad Child Adolesc Psychiatry,2014,53(9):971-979.
[12] Minet Ringuet J,Even P C,Lacroix M,et al.A model for antipsychotic-induced obesity in the malerat[J].Psychopharmacology (Berl),2006,187(4):447-454.
[13] Reaven G M.Role of insulin resistance in human disease[J].Diabetes,1988,37:1595-1607.
[14] Galling B,Correll C U.Do antipsychotics increase diabetes risk in children and adolescents?[J].Expert Opin Drug Saf,2015,14:219-241.
[15] Pramyothin P,Khaodhiar L.Type 2 diabetes in children and adolescents on atypical antipsychotics[J].Curr Diab Rep,2015,15:623-628.
[16] Pringsheim T,Lam D,Ching H,et al.Metabolic and neurological complications of second generation antipsychotic use in children:a systematic review and meta-analysis of randomized controlled trials[J].Drug Safe,2011,34:651-668.
(責任編輯:劉大仁)
Effect of Switch to Aripiprazole on Metabolic Syndrome in Children with Schizophrenia
CHEN Mei-ying1,CHEN Shang-kun1,YUAN Ye-feng2,ZHANG Hua-kun1
(1.DepartmentofPsychiatry,JiangxiMentalHospital,Nanchang330029,China; 2.DepartmentofPsychosomaticMedicine,theFirstAffiliatedHospitalofNanchangUniversity,Nanchang330006,China)
Objective To discuss the efficacy of switch to aripiprazole and metabolic changes in children with schizophrenia and metabolic syndrome (MS).Methods Sixty-six schizophrenia children with MS were randomly assigned either to stay on olanzapine (olanzapine group) or switch to aripiprazole (aripiprazole group).Metabolic parameters,curative efficacy and safety were monitored before switch to aripiprazole and at the end of the 8th,12th,24th and 52th weeks.Results In aripiprazole group,the body mass,body mass index,fasting blood glucose,total cholesterol and blood pressure began to decrease from the 8th week after switch to aripiprazole (P<0.05).However,the condition continued to deteriorate in olanzapine group.After treatment with aripiprazole for 52 weeks,no children were diagnosed as having MS.The PANSS total score decreased in both groups after switch to aripiprazole (P<0.01),but the difference was not significant between the two groups (P>0.05).Conclusion The switch to aripiprazole from olanzapine can effectively and safely improve metabolic parameters in children with schizophrenia and MS.
childhood schizophrenia; metabolic syndrome; aripiprizole; olanzpine; efficacy; safety
2017-03-15
江西省衛(wèi)生廳科技計劃項目(20133194)
陳美英(1982—),女,學士,主治醫(yī)師,主要從事臨床精神病學的研究。
R749.3
A
1009-8194(2017)07-0059-04
10.13764/j.cnki.lcsy.2017.07.023

