大鼠早期局灶性腦缺血再灌注損傷中USP10的表達水平變化及其與自噬的關系
方聰聰 毛善平 曾智 董慧敏 劉寶輝 王舜 譚華威
大鼠早期局灶性腦缺血再灌注損傷中USP10的表達水平變化及其與自噬的關系
方聰聰 毛善平 曾智 董慧敏 劉寶輝 王舜 譚華威
目的 探討早期局灶性腦缺血再灌注損傷大鼠模型中再灌注不同時間點USP10的表達水平變化及其與自噬的關系。方法 將36只成年雄性SD大鼠隨機分成4組:假手術組、腦缺血2 h再灌注6 h模型組、腦缺血2 h再灌注12 h模型組、腦缺血2 h再灌注24 h模型組;采用線栓法致大腦中動脈栓塞(middle cerebral artery occlusion, MCAO)制備大鼠局灶性腦缺血再灌注模型,給予神經行為學評分,用TTC染色法測定腦梗死體積,透射電鏡觀察梗死周邊區皮層神經元自噬,Western blot 法檢測梗死周邊區皮層USP10和自噬相關蛋白LC3B的表達水平,免疫熒光雙標法檢測梗死周邊區皮層神經元中USP10及LC3B的表達水平變化。結果 免疫熒光雙標顯示模型組自噬蛋白陽性細胞數與存活神經元數均于再灌注12 h最多(P<0.05),二者某種程度上趨勢一致;Western blot免疫熒光雙標均顯示與假手術組相比,USP10及LC3B蛋白在模型組中表達上調(P<0.01),且于再灌注12 h組達到高峰(P<0.05);透射電鏡顯示再灌注不同時間點自噬強度的變化與免疫熒光自噬蛋白表達水平的趨勢基本一致。結論 早期腦I/R損傷中自噬的激活某種程度上可減輕神經元的損傷,而USP10可能通過某種機制調控腦I/R中自噬的發生發展。
腦缺血再灌注損傷 自噬 USP10 LC3
缺血性腦卒中是中國乃至全世界致殘率和致死率都較高的疾病之一,其發病是由于腦血管突然閉塞(腦缺血)引起一系列病理變化,從而導致腦神經功能缺損。早期溶栓被證明是減輕神經元損傷、促進神經功能恢復最有效的方法。隨著介入技術的發展,動脈內溶栓被廣泛用于臨床并取得了良好的效果,但研究顯示缺血區恢復再灌注后腦組織損傷反而加重,出現更嚴重的功能障礙,且稱之為腦缺血再灌注損傷(cerebral ischemia reperfusion injury, CIRI)[1]。減輕該損傷對早期有效治療缺血性腦血管病和改善患者預后十分重要。
最近有研究發現再灌注期間尤其是再灌注早期機體會啟動自噬(autophagy)[2-4],通過清除損傷或多余的細胞器來修復缺氧導致的神經元損傷以及再灌注引起的繼發性損傷。它被認為是新近發現的一種機體內源性神經保護現象[5]。但自噬是一把雙刃劍[6],一方面自噬的啟動可能有助于維持神經元穩態,減少繼發損傷,清除已經被損傷的細胞器而保護神經元;另一方面自噬的過度激活同樣可以導致自噬性細胞死亡,顯然這對于腦I/R中的神經元恢復非常不利。無論是缺血預處理[7]還是缺血后處理[8]誘導的神經保護作用均與自噬有著密切的關系,但是在腦缺血中自噬的水平如何決定細胞的生存與死亡尚不明確。因此,在腦I/R中研究不同時間點自噬強度的變化顯得十分有必要。
USP10是哺乳動物泛素特異性蛋白酶(DUBs)的一員,能利用活性硫醇位點將泛素與靶蛋白拆開[9],使靶蛋白泛素化障礙,阻斷泛素蛋白酶體途徑。有報道去泛素化酶家族DUBs中USP15[10],USP30[11]和USP35直接去泛素化Parkin的底物,下調線粒體自噬。
早期的研究報道在大鼠等多種腦缺血動物模型中都能夠誘發自噬,包括全腦缺血或局灶性腦缺血以及腦缺血缺氧模型等[12-14]。也有研究證明自噬的激活與I/R損傷的減輕有關[15-16],但其在腦I/R中作用機制尚不明確。本研究擬利用SD大鼠MCAO模型,探討在腦I/R中不同時間點自噬強度的變化、USP10的表達水平變化及二者之間的關系,為闡明自噬參與腦I/R損傷的機制及臨床研發治療腦I/R損傷的神經保護性候選藥物提供有力的實驗依據。
1 材料與方法
1.1 實驗動物
健康成年雄性SD大鼠36只,體重250~300 g,來源于武漢大學人民醫院動物實驗中心,實驗動物許可證號:SYXK(鄂) 2015-0027。
1.2 主要材料與試劑
大鼠MCAO模型尼龍線栓購于北京西濃科技有限公司;兔源性USP10、LC3B及GAPDH抗體均來自英國Abcam公司;IgG二抗(羊抗兔)來自英國Abcam公司;預染蛋白Marker購于Thermo公司;熒光二抗購于美國LICOR公司;BCA蛋白水平檢測試劑盒,RIPA裂解液(強)試劑購于碧云天生;醋酸纖維素膜購于Biosharp。
1.3 方法
1.3.1 實驗動物分組
將同一批健康成年SD雄性大鼠隨機分為假手術組和模型組。假手術組:僅行手術及分離血管,不放線栓。模型組:將Zea longa線栓法[17]改良而建立模型。
1.3.2 大鼠大腦中動脈栓塞模型(MCAO)制備
5%異氟烷深度麻醉大鼠,取頸部正中切口,分離左側頸外、頸內及頸總動脈,結扎并離斷頸外動脈,用動脈夾夾閉頸內動脈及頸總動脈并預留一縫合線備用;在頸外動脈近頸總動脈分叉處離斷頸外動脈及其周圍的分支,將頸外動脈近頸動脈分叉處剪一小口,向頸內動脈緩慢插入尼龍線栓,去除頸內及頸總動脈的動脈夾,將線栓全部插入時感到有阻力,即已達到大腦中動脈的分叉處;栓塞成功后用預留的縫合線打活結扎緊線栓,縫合手術切口;阻斷2 h的血流后再次麻醉大鼠,拔除線栓并結扎頸內動脈,再次縫合手術切口。
1.3.3 神經行為學評分
取材前參照Longa評分標準[18]進行神經行為學評分。模型成功的標志是大鼠麻醉蘇醒后出現缺血對側以前肢為重的偏癱。模型納入標準為神經行為學評分在1分以上,且大鼠斷頭取腦后在顯微鏡下查看大腦中動脈起始部略為擴張并無血管內血栓形成或出血。神經行為學參照評分,即0分:無癥狀;1分:提尾時損傷對側前肢不能伸直;2分:行走時向損傷對側旋轉;3分:行走時向損傷對側傾倒;4分:無自發活動或死亡。
1.3.4 2% 2,3,5-氯化三苯基四氮唑(TTC)測量腦梗死體積
異氟烷深度麻醉并處死大鼠,斷頭取腦,放入鼠腦專用切片模具中,沿冠狀位將大腦切成2 mm的切片,將切片于TTC中浸泡30 min,恰當染色后浸于4%多聚甲醛中固定過夜,將切片按層面排列整齊并掃描[18],使用NIH Image J軟件測定大腦皮層面積及梗塞面積,通過矯正腦水腫而計算出腦組織損傷程度,即測量病灶對側整個大腦半球面積與梗死同側正常半球組織,梗死面積由梗塞對側面積減去梗死同側正常組織面積而來,再乘以切片厚度(2 mm)即為梗死體積。整個半球的梗死程度由5片大腦切片梗死體積相加而來,最后以梗死體積占對側大腦皮層體積的百分比表示。
1.3.5 透射電鏡
用2%的戊巴比妥按6 mL/Kg麻醉大鼠后用含0.5%戊二醛的4%多聚甲醛經心臟灌注固定,然后快速取腦,在冰上暴露并切取大鼠傷側皮層約1 mm×mm×mm大小,迅速入預冷的4%戊二醛,4 ℃保存;檢測前取出標本經1%餓酸固定2 h;梯度酒精、丙酮逐級脫水:50%酒精10 min→70%酒精10 min→80%丙酮10 min,2次→90%丙酮10 min,2次→無水丙酮10 min,2次→環氧樹脂包埋,60 ℃溫箱中聚合48 h; 切片機做超薄切片,厚度為100 nm醋酸鈾,檸檬酸鉛染色;透射電鏡觀察神經元、線粒體、溶酶體及自噬體的超微結構并拍照[18]。
1.3.6 Western blot 法檢測USP10和LC3蛋白的表達水平
用生理鹽水進行心臟灌注后取腦,提取腦組織蛋白,BCA法測蛋白,將組織蛋白樣品與上樣緩沖液(5×)按照4∶1的體積比混勻,100 ℃,5~10 min變性組織蛋白后取50 g蛋白上樣,10%SDS—PAGE電泳,先70 V,40 min,然后110 V,1 h;將凝膠上的蛋白轉移至硝酸纖維素膜上,用PBS洗3遍,每遍5 min;室溫下5%脫脂奶粉封閉1 h;將一抗置膜于稀釋的一抗中(USP10,兔源性,1∶1000;GAPDH,兔源性,1∶1 000;LC3,兔源性,1∶1 000;),4 ℃孵育過夜,后用PBST 洗膜3次,每次5 min;然后室溫下孵育二抗(羊抗兔1∶2000)2 h,先用PBST洗膜2遍,后用PBS洗膜1遍,每遍5 min,最后用Odyssey Infrared Imaging掃膜。
1.3.7 免疫熒光雙標法檢測USP10和LC3蛋白的表達水平
先用生理鹽水再用4%的多聚甲醛快速灌注心臟后取腦,再將完整腦組織置于4%的多聚甲醛中,于4 ℃冰箱固定12 h以上;然后制成石蠟切片置于65 ℃烘箱中烘片2 h,脫蠟至水,用PBS洗3次,每次5 min;切片置于EDTA緩沖液中微波修復,中火至沸后斷電,間隔10 min低火至沸;自然冷卻后PBS洗3次,每次5 min;切片置于3%過氧化氫溶液中室溫下避光孵育10 min;PBS洗3次,每次5 min,甩干后5% BSA封閉20 min;去除BSA液,每張切片加入約50 μL稀釋的一抗覆蓋組織,4 ℃過夜;PBS洗3次,每次5 min;去除PBS液,每張切片加50 μL~100 μL相應種屬的二抗,37 ℃孵育50 min;PBS洗3次,每次5 min;去除PBS液,每張切片加50~100 μL DAPI染液,室溫避光孵育5 min;染色后將切片放入PBS中洗3次,每次5 min;滴加適量的抗熒光淬滅劑于組織上,蓋玻片封片,熒光顯微鏡觀察拍照。
1.3.8 統計學處理
2 結 果
2.1 神經功能缺損評分的評估
假手術組大鼠無神經功能缺損,而MCAO6h組(2.33±0.81)、MCAO12h組(1.83±0.75)及MCAO24h組(2.00±0.89)分大鼠于麻醉清醒后即出現不同程度的神經功能缺損癥狀,如對側前肢屈曲,右側轉圈等,但任意兩組比較均無明顯差異(P>0.05)。
2.2 TTC染色
如圖1所示,各組均可見皮層及皮層下有明顯的白色梗死灶。
2.3 透射電鏡下觀察自噬體的超微結構
如圖2所示,各組神經元均出現異染色質核膜下邊集;線粒體腫脹、嵴斷裂,甚至溶解消失;初、次級溶酶體、自噬溶酶體及自噬小體形成。
2.4 Western blot法檢測相關蛋白在各組中的表達水平見圖3~4。
2.5 免疫熒光雙標法檢測梗死周邊區皮層神經元中USP10和LC3蛋白的表達水平見圖5~8。

圖1 再灌注不同時間點腦梗死灶大小
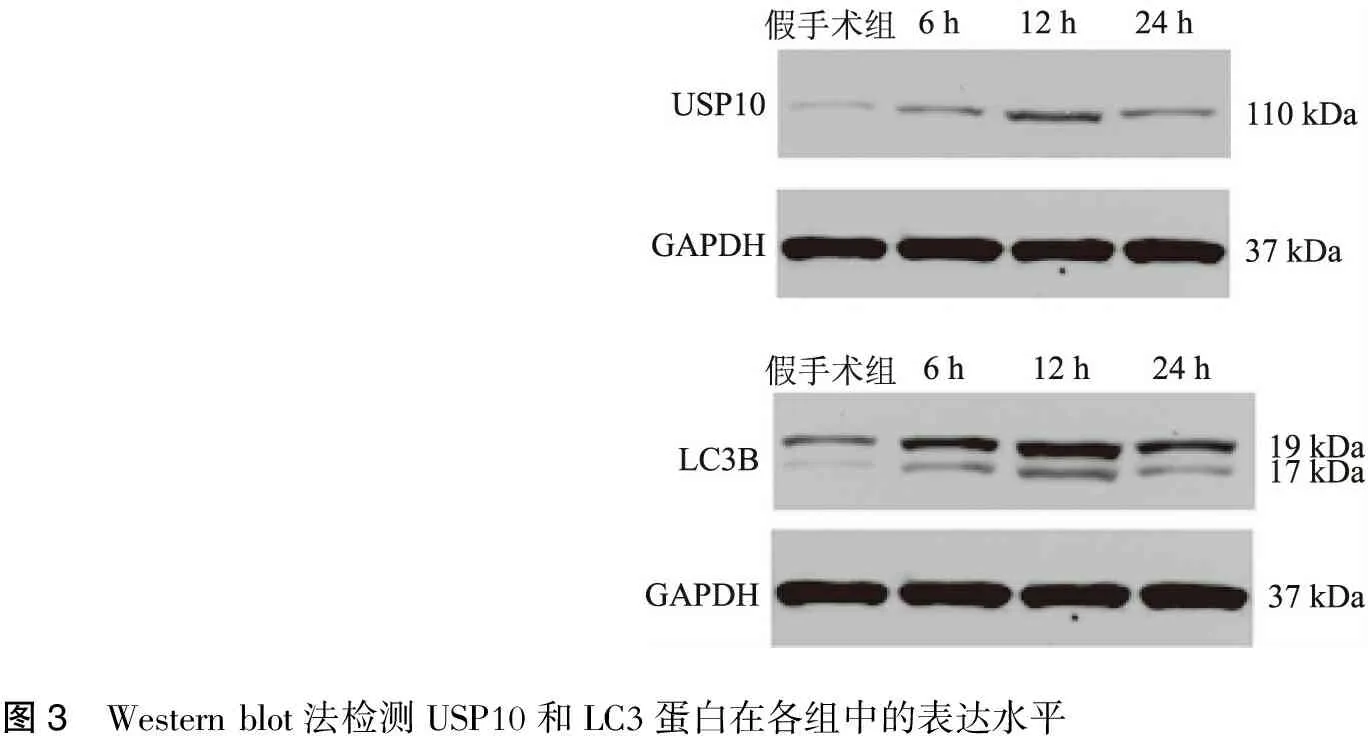
圖3 Westernblot法檢測USP10和LC3蛋白在各組中的表達水平

圖2 透射電鏡下(×8000倍)腦缺血再灌注不同時間點溶酶體及自噬體的檢測 注:→初級溶酶體,→次級溶酶體,→自噬小體,→自噬溶酶體,M為線粒體

圖4 Westernblot法檢測各組USP10及LC3B蛋白的表達水平 MCAO組USP10和LC3蛋白的表達明顯增加(與假手術組比較,?P<0.01);其中MCAO12h組各蛋白表達量最高(與MCAO12h比較,△P<0.05),而MCAO6h組與MCAO24h組各蛋白的表達水平卻無明顯差異(P>0.05)
3 討 論
近20年來腦卒中始終占我國主要疾病病死率前3位,其中缺血性腦卒中占所有腦卒中的87%[20]。腦卒中發生時十分兇險,即使度過急性期,多數患者也會遺留許多后遺癥。因此,如何研發有效的藥物減輕CIRI、改善患者生存質量一直是該領域急需攻克的難題。

圖5 免疫雙標法檢測缺血再灌注不同時間點神經元中USP10的表達水平變化
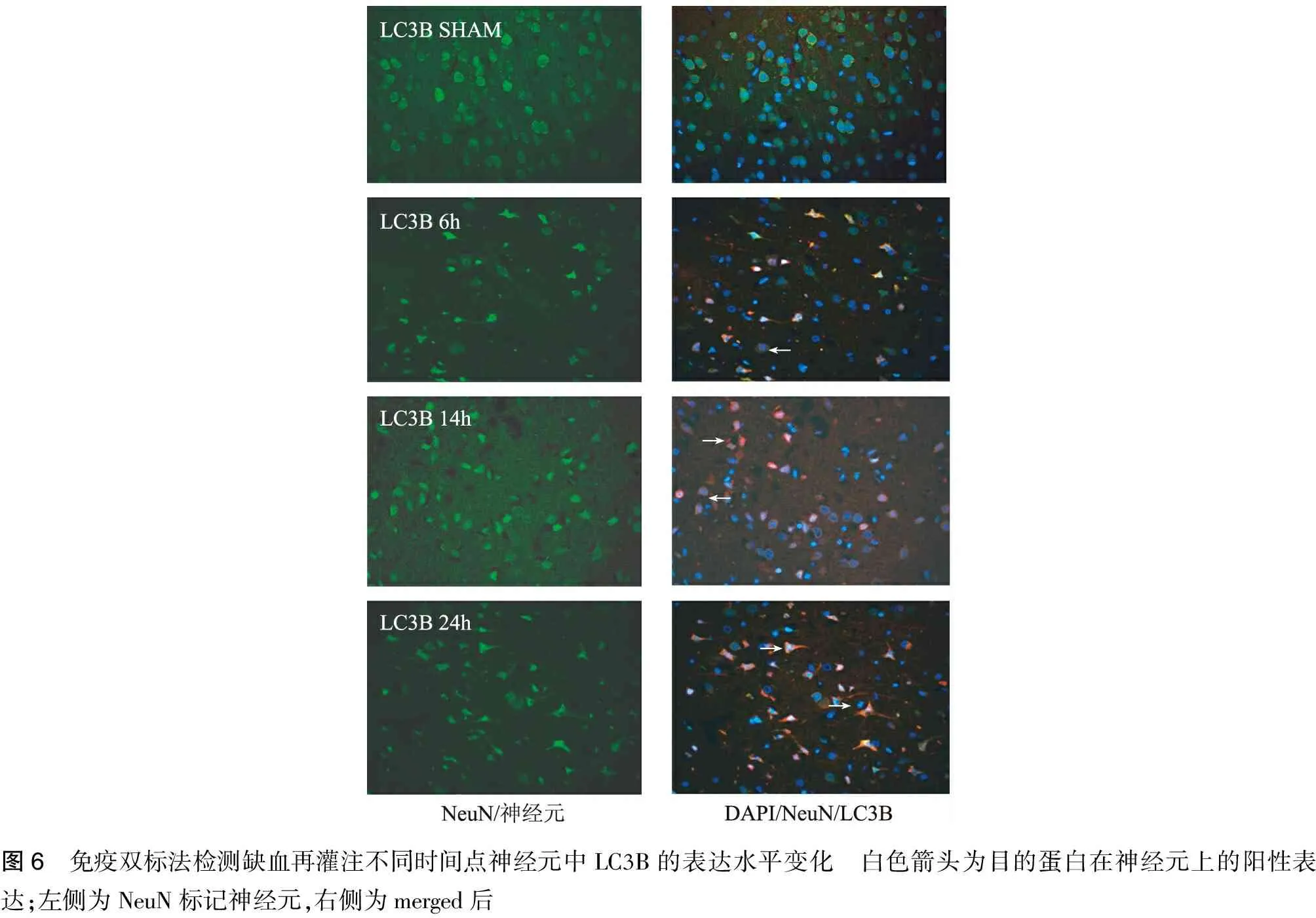
圖6 免疫雙標法檢測缺血再灌注不同時間點神經元中LC3B的表達水平變化 白色箭頭為目的蛋白在神經元上的陽性表達;左側為NeuN標記神經元,右側為merged后
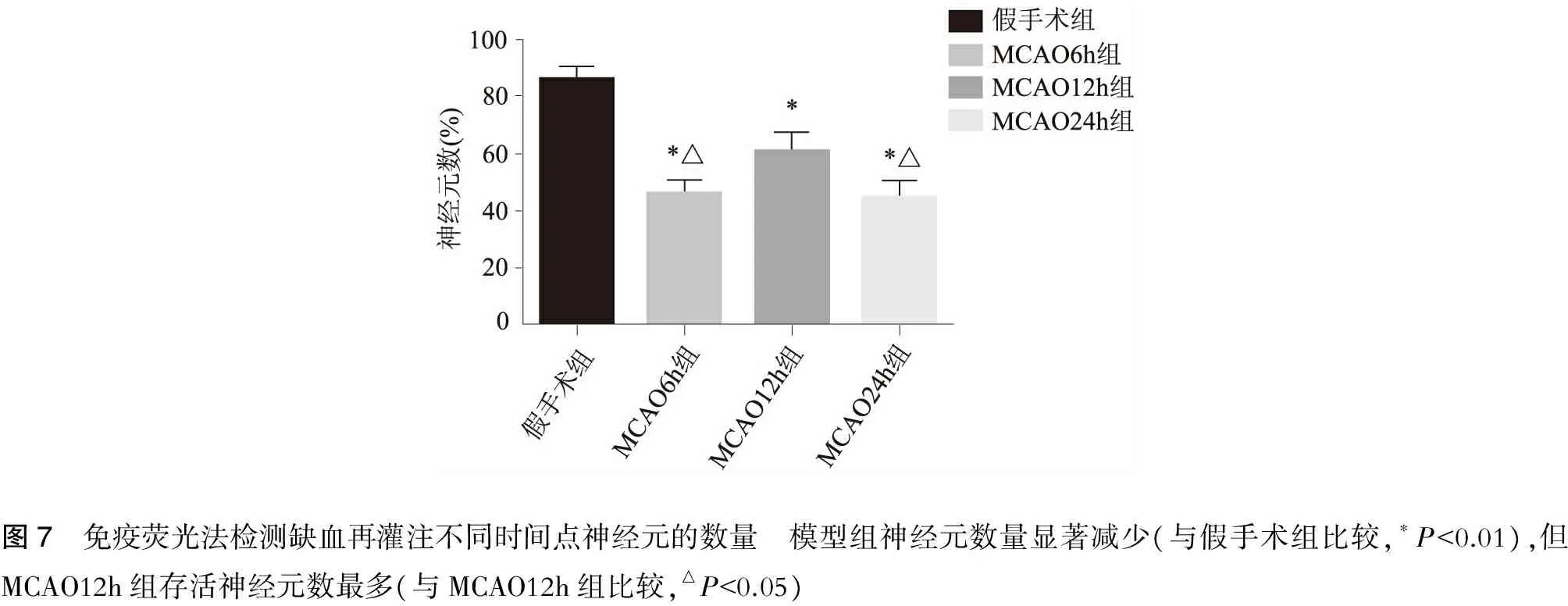
圖7 免疫熒光法檢測缺血再灌注不同時間點神經元的數量 模型組神經元數量顯著減少(與假手術組比較,?P<0.01),但MCAO12h組存活神經元數最多(與MCAO12h組比較,△P<0.05)
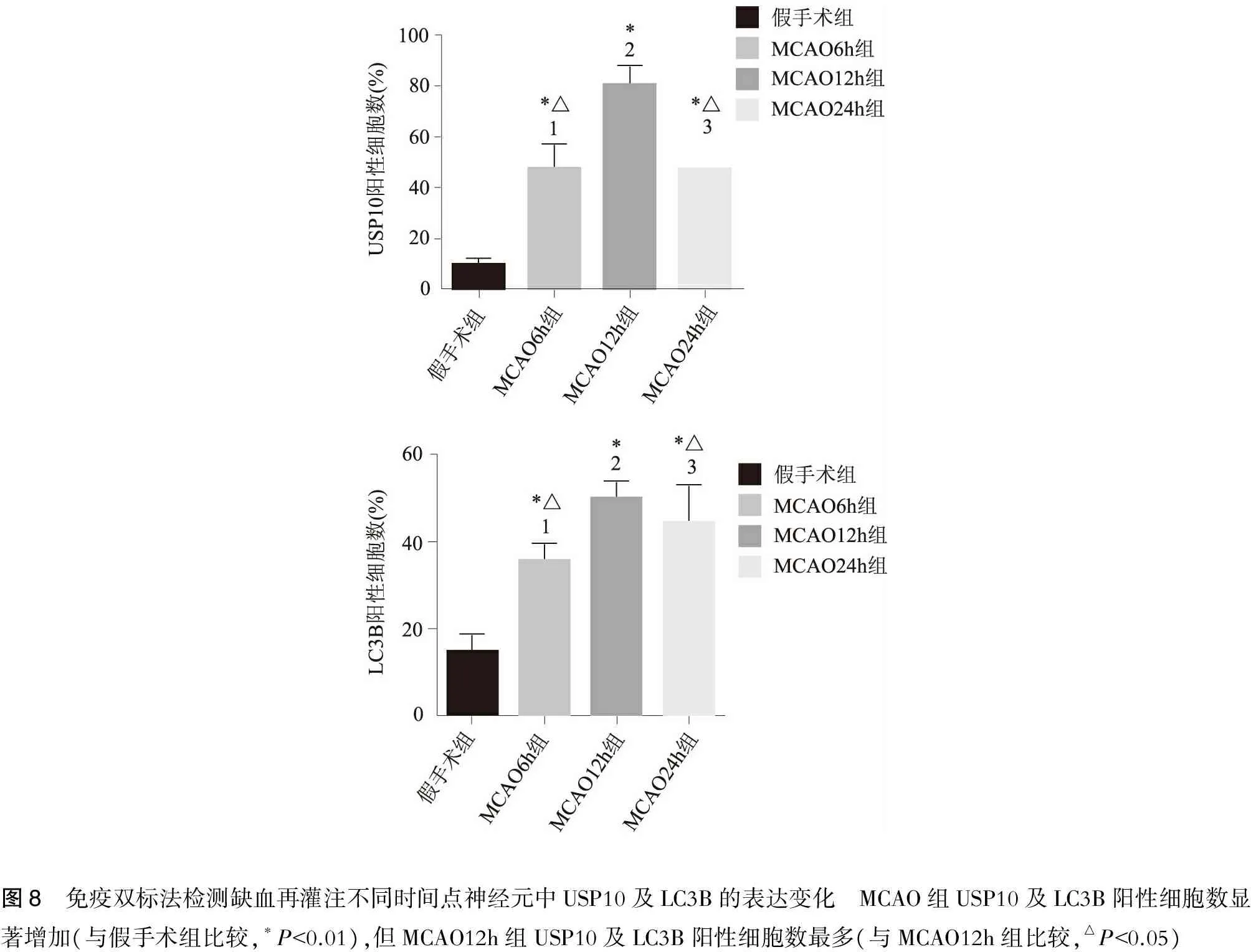
圖8 免疫雙標法檢測缺血再灌注不同時間點神經元中USP10及LC3B的表達變化 MCAO組USP10及LC3B陽性細胞數顯著增加(與假手術組比較,?P<0.01),但MCAO12h組USP10及LC3B陽性細胞數最多(與MCAO12h組比較,△P<0.05)
CIRI機制十分復雜,包括活性氧自由基(Reactive oxide species,ROS)、細胞內鈣超載、NO失調控、興奮性氨基酸毒性等事件。其中,ROS是CIRI的關鍵事件,線粒體是ROS損傷的靶器官,也是體內ROS的主要來源之一。線粒體功能紊亂與ROS過量生成/NO失調控相互作用,進一步可誘導炎癥發生,從而加重神經元損傷。研究表明自噬在腦I/R中可被激活進而清除損傷的線粒體,間接清除積累的ROS,可能是治療缺血性腦卒中的一大潛在途徑[21]。
USP10是哺乳動物的泛素特異性蛋白酶(DUBs)的一員,顯然可以阻斷泛素蛋白酶體途徑[9]。諸多研究證實缺血再灌注損傷時,泛素化蛋白質聚集,蛋白酶體活性降低[22]。同時,有研究顯示去泛素化酶家族中的USP15、USP30和USP35可以下調線粒體自噬。一直以來自噬和泛素蛋白酶體都被看做是兩種相互獨立的蛋白降解系統,但越來越多的研究發現這兩個系統內部有相互關聯之處[23]。本研究發現USP10與自噬蛋白的表達趨勢一致,并不難猜測USP10可能通過泛素蛋白酶體途徑在CIRI中參與自噬的調節。
LC3是自噬相關的一個重要蛋白,常被作為自噬起始的標記物,也被作為檢測細胞自噬程度的分子標記。LC3在細胞內主要存在兩種亞型:LC3-A型和LC3-B型,LC3B在自噬的過程中始終定位于自噬體膜上[24], LC3B含量的多少在某種程度上反映了細胞的自噬活性。本研究在假手術組內即有LC3B的低水平表達,而MCAO組LC3B蛋白表達水平自再灌注6 h起出現升高趨勢,在12 h達到高峰,隨后緩慢下降,差異均有統計學意義。這表明MCAO組大鼠在接受缺血缺氧刺激后機體處于應激狀態并激發神經元發生自噬,且在再灌注的6 h~24 h時間段中自噬呈持續性發生。
目前國內針對自噬在腦缺血再灌注中的作用機制研究正在不斷深入,但是現有的研究仍然局限于自噬到底有無保護作用以及自噬的上游調控機制等方面。本研究結果顯示,腦I/R12 h存活神經元的數量最多,在一定程度上與自噬強度有關,但24 h存活神經元數卻并未與自噬強度變化高度一致,本研究推測①CIRI機制十分復雜,自噬的神經保護作用不足以拯救所有方式的神經元死亡;②自噬是一把雙刃劍,自噬的激活不足有可能并不能發揮神經保護作用,相反可能會導致更多神經元損傷。同時,本研究發現在腦I/R不同時間點神經元中USP10的表達水平變化均與自噬蛋白LC3B的變化高度一致。因此,本研究結果表明在早期腦I/R中自噬的激活對缺血神經元有保護作用,且與自噬強度呈現一定程度的關系;本研究推斷USP10很可能參與了腦I/R中自噬的過程,并高度懷疑泛素蛋白酶體系統與自噬溶酶體途徑可能在腦I/R中存在交叉調控作用。
總之,自噬在早期腦I/R中被激活并在一定程度上發揮了神經保護作用,而這種保護作用可能與自噬強度有關系;同時本研究推測USP10可能參與了早期腦I/R中的自噬過程,但具體機制還有待進一步研究。本研究注重探討自噬與腦缺血/再灌注損傷的相互作用關系,將可能成為下一步的研究重點,并為腦缺血性疾病的治療提供新的思路和策略。
[1] Xu ZX,Liu BS.Time window characteristics of cultured rat hippocampal neurons subjected to ischemia and reperfusion[J].Chin J Traumatol,2005,8(3):179-182.
[2] Rami AA,Steiger S.Focal cerebral ischemia induces upregulation of Beclin 1 and autophagy-like cell death[J].Neurobiol Dis,2008,29(1):132-141.
[3] Adhami FG,Morozov YM.Cerebral ischemia-hypoxia induces intravascular coagulation and autophagy[J].Am J Pathol,2006,169(2):566-583.
[4] Wen YR,Zhang LS.Neuronal injury in rat model of permanent focal cerebral ischemia is associated with activation of autophagic and lysosomal pathways[J].Autophagy,2008,4(6):762-769.
[5] Geisler SM,Skujat D.PINK1/parkin-mediated mitophagy is dependent on VDAC1 and p62/SQSTM1[J].Nat Cell Biol,2010,12(2):119-131.
[6] Qin ZY,Kegel KB.Autophagy regulates the processing of amino terminal huntingtin fragments[J].Hum Mol Genet,2003,12(24):3231-3244.
[7] Yan WH,Bai X.Autophagy activation is involved in neuroprotection induced by hyperbaric Oxygen preconditioning against focal cerebral ischemia in rats[J].Brain Res,2011,1402(2):109-121.
[8] Gao LT,Guo J.Inhibition of autophagy contributes to ischemic postconditioning-induced neuroprotection against focal cerebral ischemia in rats[J].PLoS One,2012,7(9):5-12.
[9] Kim JC,Chung SS.Deubiquitinating enzymes as cellular regulators[J].J Biochem,2003,134(1):9-18.
[10]Cornelissen TF.The deubiquitinase USP15 antagonizes Parkin-mediated mitochondrial ubiquitination and mitophagy[J].Hum Mol Genet,2014,10(5):60-68.
[11]Liang JA,Lane JD.USP30 deubiquitylates mitochondrial Parkin substrates and restricts apoptotic cell death[J].EMBO Rep,2015,12(6):20-24.
[12]Wang JQ,Chu KT.Severe global cerebral ischemia-induced programmed necrosis of hippocampal CA1 neurons in rat is prevented by 3 Methyladenine:a widely used inhibitor of autophagy[J].J Neuropathol Exp Neurol,2011,70(4):314-322.
[13]Puyal JA,Mottier V.Postischemic treatment of neonatal cerebral ischemia should target autophagy[J].Ann Neurol,2009,66(3):378-389.
[14]Koike MM,Tadakoshi M.Inhibition of autophagy prevents hippocarroal pyramidal neuron death after hypoxic-ischemic iniury[J].Am J Pathol,2008,172(2):454-469.
[15]Gottlieb RD.MENTZER R M Jr.cardioprotection requires taking out the trash[J].Basic Res Cardiol,2009,104(2):169-180.
[16]Park HK,Jung KH.Autophagy is involved in the ischemic preconditioning[J].Neurosci Lett,2009,451(1):16-19.
[17]Longa ER,Carlson S.Requirement middle cerebral artery occlusion without craniecomy in rats[J].Stroke,1989,20(1):84-91.
[18]Ashford TK.Cytoplasmic components in hepatic cell lysosomes[J].Cell Biol,1962,12(1):198-202.
[19]Xiong XL,Wei L.IL-4 is required for sex differences in vulnerability to focal ischemia in mice[J].Stroke,2015,46(8):2271-2276.
[20]Liu L W D WK,Stroke Care in China:Huge Burden.Significant workload,and a National priority[J].Stroke,2011,42(5):3651-3654.
[21]Hua CW,Jin H,Sun X,et al.Molecular chaperones and hypoxic-ischemic encephalopathy[J].Neural Regeneration Research,2017,12(2):153-160.
[22]Ge PY,Liu C.Protein aggregation and proteasome dysfunction after brain ischemia[J].Stroke,2007,38(12):3230-3236.
[23]Myeku NE.Dynamics of the degradation of ubiquitinated proteins by proteasomes and autophagy association With sequestosome 1/p62[J].J Biol Chem,2011,286(25):22426-22440.
[24]張創杰,周琳.胰腺癌中自噬相關蛋白Beclinl,LC3和P62的表達及臨床意義[M].鄭州:鄭州大學第一附屬醫院,2015.
(2016-08-12收稿)
The study on the relation between the expression of USP10 and autophagy following early focal cerebral ischemical reperfusion injury in rats
FangCongcong,MaoShanping,ZengZhi,etal.
DepartmentofNeurology,RenminHosiptalofWuhanUniversity,Wuhan430060
Objective To explore the relation between USP10 expression and autophagy in rats model of early focal cerebral ischemia-reperfusion(I/R) injury.Methods Totally 36 male, healthy Sprague-Dawley rats were used and randomlyassigned to four groups: Sham-operated group(Sham) and cerebral ischemia-reperfusion group (MCAO6 h,12 h and 24 h group).The focal cerebral chemia-reperfusiong ( I/R) rat models were established by the middle cerebral artery occlusion (MCAO) using intraluminal suture method. The behavior scales function rats was used as a general assessment of neural of brain injury; 2,3,5-triphenyltetrazolium chloride (TTC) straining was used to observe infarct volume; specific structure of autophagosome and specific protein of autophagy microtubule-associated protein 1 light chain 3 B(LC3B)were detected by transmission electron microscope,WB and immunofluorescence respectively.Results Compared to the Sham group, autophagy existed in different time periods after I/R shown both in transmission electron microscope, WB and immunofluorescence, which was in line with the expression of USP10. The number of positive cells and survival neurons was significantly increased at I/R 12H compared with sham group(P<0.05) in immunofluorescence.Conclusion The intensity of autophagy was positive correlation of the number of survival neurons in rats model of early focal cerebral ischemia-reperfusion(I/R) injury. The expression of USP10 was in accord with LC3B,which indicates USP10 might regulate the development of autophagy and would lay important foundation for the study on the interaction of autophagy-lysosomes system and ubiquitin-proteasomes system in cerebral I/R injury.
Cerebral ischemia/reperfusion Autophagy USP10 LC3B
武漢市科技攻關計劃項目(項目編號為2013060602010270)
430060 武漢大學人民醫院神經內科[方聰聰 毛善平(通訊作者) 王舜 董慧敏],病理科(曾智),神經外科(劉寶輝),精神科(譚華威)
R743.33
A
1007-0478(2017)04-0290-07
10.3969/j.issn.1007-0478.2017.04.004

