耐堿性蛋白A色譜配基的構建及性能評價
管志龍,白姝,孫彥,史清洪
?
耐堿性蛋白A色譜配基的構建及性能評價
管志龍,白姝,孫彥,史清洪
(系統生物工程教育部重點實驗室,天津大學化工學院,天津 300072)
提出了優化分子內作用力提高蛋白A(SpA)的結構域Z分子穩定性的方法,構建了突變結構域Z?和Z?。圓二色光譜分析結果表明,突變結構域具有與結構域Z一致的特征峰,但突變結構域Z?中α-螺旋含量明顯高于突變結構域Z?。在pH 6.0下,突變結構域Z?的熱轉變溫度(m)較結構域Z提高了3.9℃,而突變結構域Z?的T值僅提高了1.6℃。這表明,突變結構域Z?中第12位引入疏水性更大的Ile殘基提高了結構域分子的穩定性。色譜介質耐堿性實驗結果表明,突變結構域Z?具有更好的耐堿性,其耐堿性在突變結構域Z?四串聯體融合蛋白中得到了進一步提升。研究工作為SpA色譜配基的分子改造提供了新思路。
抗體;吸附;熱力學;蛋白A色譜;示差掃描量熱;圓二色光譜;耐堿性
引 言
蛋白A(protein A,SpA)是一種來自金黃色葡萄球菌表面的膜蛋白,包含5個可與抗體特異性結合且高度同源串聯結構域(依次為E、D、A、B和C)。SpA色譜是當前抗體藥物制備的核心技術,一直被業界視為單克隆抗體提取單元操作的“金標準”[1-3]。這一技術成功的基礎在于持續提升的SpA色譜介質性能[4-5]。自首個商品化SpA色譜介質1978年問世后的若干年中[6],SpA色譜介質的化學穩定性曾一度飽受詬病。這種狀況直到Nilsson等[7]構建了突變結構域B(G29A)后才得以緩解。這種突變結構域被命名為結構域Z,其通過消除Asn-Gly結構的去酰胺化效應使SpA的化學穩定性得以明顯改善。此后,一大批以MabSelect SuRe和ProSep vA Ultra等為代表基于結構域Z的新型SpA色譜介質不斷地涌現[8-10]。
當前除MabSelect SuRe以外的絕大多數商品化SpA色譜介質仍無法耐受苛刻的標準原位清洗(CIP)溶液(0.5 mol·L-1NaOH溶液)。因此,需要采用折中(0.05~0.1 mol·L-1NaOH溶液)或替代(6 mol·L-1鹽酸胍溶液,pH約4.0)方法實現CIP操作[10]。針對上述問題,Linhult等[11]通過基因突變逐一替代結構域Z中Asn殘基的方法研究了其對結構域堿液耐受性的影響。結果顯示,N23T突變顯著提高了結構域的堿液耐受性。以突變結構域Z(F30A,N23T)為配基的SpA色譜介質在標準CIP溶液中連續浸泡7.5 h后仍保持了70%以上的抗體結合能力;而同樣處理后的結構域Z(F30A)的抗體結合能力僅剩25%。N23T突變對結構域Z化學穩定性的影響也得到了Xia等[12]的驗證。Asn殘基對化學穩定性影響也見于蛋白G(Streptococcal protein G,SpG)結構域C2的報道中[13]。研究發現,N7A和N36A雙突變的結構域C2在堿液中最為穩定。另外,Minakuchi等[14]發現,結構域C的G29W和G29Y兩種突變體具有比G29A突變體更好的化學穩定性。Palmer等[15]通過自由能隨pH變化的比較發現,Lys、Arg和Tyr側鏈基團的去質子化導致了SpG在堿性溶液中穩定性降低。這種SpG蛋白中表面電荷影響穩定性的討論為改善SpA配基的穩定性提供了另一思路。
在前人工作基礎上[16],本文提出了通過優化分子內作用力提高結構域Z分子整體穩定性的方法,其是通過對結構域Z非關鍵氨基酸殘基中去酰胺化效應的消除(N11T和N23T)和疏水性相互作用的強化(A12I和Q32T)兩種途徑實現的。基于上述思路,本文構建了兩種突變結構域,分別命名為Z?和Z?(如圖1所示)。借助于圓二色(CD)光譜、示差掃描量熱(DSC)分析和抗體吸附實驗,系統地比較了結構域Z、Z?和Z?的分子結構、穩定性及抗體結合能力;進而構建了結構域Z和Z?四串聯體融合蛋白Z4和Z?4,實現了SpA色譜配基堿液耐受性的進一步提升。本研究工作為SpA色譜配基的分子改造提供了新思路。
1 實驗材料和方法
1.1 實驗材料
結構域Z及突變結構域Z?和Z?由北京華大蛋白質研發中心有限公司合成。含有融合蛋白Z4和Z?4的表達質粒pET-30a(+)-Z4和pET-30a(+)- Z?4由生工生物工程(上海)有限公司構建并轉入感受態細胞BL21(DE3)大腸桿菌中表達。Q Sepharose FF和Sepharose FF凝膠購自通用電氣醫療系統(中國)有限公司。實驗用的抗體、1,4-丁二醇二縮水甘油醚(BDDE)和縮水甘油醚三甲基氯化銨(GTMAC)為Sigma-Aldrich公司產品,購自天津博瑞星科技有限公司。蛋白質分子標準品Blue Plus Protein Maker (14×103~100×103)購于北京全式金生物技術有限公司。胰蛋白胨、酵母提取物為英國Oxoid公司產品,其和其他化學試劑均購自當地,化學試劑除特殊說明外均為分析純試劑。
1.2 圓二色光譜分析
結構域Z、Z?和Z?的CD光譜分析采用JASCO J-180圓二色光譜儀在0.15 mg·ml-1濃度和1 mm光程條件下完成。樣品緩沖液為含100 mmol·L-1NaCl的20 mmol·L-1PBS溶液(pH 6.0)。CD光譜采用連續掃描模式,掃描速度為50 nm·min-1,掃描波長范圍為250~190 nm,每個樣品重復掃描3次。分析中以樣品緩沖液為參照扣除背景干擾。
1.3 示差掃描量熱分析
結構域Z、Z?和Z?的DSC分析采用MicroCal VP-DSC示差掃描量熱儀(GE Healthcare, PA, USA)在1.0 mg·ml-1濃度下完成。樣品分別溶解于含100 mmol·L-1NaCl的20 mmol·L-1PBS溶液(pH 6.0)和0.1 mol·L-1NaOH溶液中。DSC的溫度掃描范圍為25~110℃,升溫速率為1℃·min-1。實驗數據采用MicroCal Origin軟件的MN2State模型進行擬合,得到熱變性溫度m。
1.4 蛋白表達與純化
含表達質粒pET-30a(+)-Z4和pET-30a(+)-Z?4的BL21(DE3)大腸桿菌在37℃下于LB培養基平板培養后,挑選單菌落置于10 ml含30 μg·ml-1卡那霉素的LB液體培養基中培養過夜作為種子液。種子液按照1:100(體積比)接種于200 ml LB液體培養基(卡那霉素的終濃度為30 μg·ml-1)。上述菌液在37℃培養后加入終濃度為0.5 mmol·L-1IPTG;含pET-30a(+)-Z4的BL21(DE3)大腸桿菌在37℃下誘導6 h后收集菌體;pET-30a(+)-Z?4的BL21(DE3)大腸桿菌在20℃下誘導過夜后收集菌體。收集的菌體復懸于20 mmol·L-1Tris-HCl緩沖液(pH 7.5)后,于冰浴中超聲破碎。細胞破碎液于12000 r·min-1下離心收集上清液。
上清液經0.45 μm針頭濾器過濾后采用Q Sepharose FF離子交換色譜柱純化得到目標蛋白,其步驟如下:填充于XK 16/26色譜柱中的Q Sepharose FF經20 mmol·L-1Tris-HCl緩沖液(pH 7.5)平衡至少5CV后,連續輸入上清液直至穿透。目標蛋白收集以含1 mol·L-1NaCl的20 mmol·L-1Tris-HCl緩沖液(pH 7.5)為洗脫液,通過1%洗脫液/min的線性梯度洗脫分步回收。目標蛋白經透析和凍干后保存于-20℃備用。
1.5 SpA色譜介質合成
通過結構域Z、Z?和Z?以及融合蛋白Z4和Z?4分別偶聯于Sepharose FF合成5種SpA色譜介質,步驟簡述如下:將經去離子水反復清洗并抽干的凝膠Sepharose FF(10 g)加入到裝有75%(質量)GTMAC(5 ml)和0.645 mol·L-1NaOH(5 ml)混合溶液的錐形瓶中,懸浮液在170 r·min-1和25℃下反應過夜。收集的凝膠經去離子水反復沖洗后,稱取2 g抽干后凝膠重懸于 4.6 mol·L-1NaOH溶液(1.2 ml)中并加入4 ml BDDE。上述懸浮液于170 r·min-1和25℃下反應2 h以引入環氧基團活化Sepharose FF。活化凝膠經去離子水反復沖洗并抽干后用于SpA色譜介質合成。
活化Sepharose FF在10 mmol·L-1NaHCO3溶液中平衡過夜后,轉移至含有配基的10 mmol·L-1NaHCO3溶液中。上述懸浮液于170 r·min-1和37℃下反應2 h。反應產物經去離子水反復清洗后轉移至巰基乙醇(1 ml)和含0.5 mol·L-1NaCl的0.2 mol·L-1NaHCO3(9 ml)的混合溶液中于37℃下反應2 h封閉凝膠表面殘留的環氧基團。SpA色譜配基的修飾密度通過Water C18反相色譜柱測定反應前后溶液中配基濃度變化后計算得到。本文中合成的5種SpA色譜介質依據配基的種類分別命名為Z SepFF、Z? SepFF、Z? SepFF、Z4SepFF和Z?4SepFF。
1.6 SpA色譜介質耐堿性實驗
SpA色譜介質的耐堿性實驗分別在濃度為0.1和0.5 mol·L-1的NaOH溶液中進行。簡要步驟如下:SpA色譜介質在NaOH溶液中浸泡2、6和12 h;繼而經去離子水沖洗后,SpA色譜介質于含100 mmol·L-1NaCl的20 mmol·L-1PBS緩沖液(pH 7.5)中平衡過夜;稱取10 mg 平衡后的介質依次轉入裝有10 ml濃度為0.2~3.0 mg·ml-1抗體溶液的錐形瓶中。上述懸浮液在25℃和120 r·min-1條件下反應過夜達到吸附平衡。最后,在4000 r·min-1下離心收集上清液,在280 nm下測定上清液中抗體濃度,根據質量守恒計算出抗體吸附量。根據式(1)的Langmuir吸附等溫線可計算出抗體飽和吸附容量m(mg·g-1)和解離常數d(mg·ml-1)

2 結果與討論
2.1 結構域Z、Z?和Z?的圓二色光譜
本文利用CD光譜分析了結構域Z、Z?和Z?在含100 mmol·L-1NaCl的20 mmol·L-1PBS溶液(pH 6.0)和0.1 mol·L-1NaOH溶液中的二級結構及其變化規律。3種結構域的CD光譜結果如圖2所示。
圖2(a)中結構域Z的CD光譜顯示,其在190~200 nm間有一正特征峰,而在208和222 nm附近各有一負特征峰。這與典型的α-螺旋結構CD特征峰相吻合[17-18]。此外,Jendeberg等[19]在200~250 nm的CD光譜掃描結果也顯示,結構域Z在208和222 nm附近各有一個負特征峰。迄今結構域Z及其與抗體復合物分子結構的研究均表明,結構域Z分子由空間上3條反向平行α-螺旋構成[19-21]。由圖2(a)結果可知,本文中結構域Z不僅與文獻報道的結構域Z一級序列相同而且均有典型的α-螺旋結構,由此證明兩種分子具有相同的空間結構。
(a) 100 mmol·L-1NaCl in 20 mmol·L-1PBS buffer (pH 6.0); (b) 0.1 mol·L-1NaOH solution
突變結構域Z?和Z?在pH 6.0下的CD光譜結果亦繪于圖2(a)中。從中可知,突變結構域Z?和Z?具有與結構域Z一致的特征峰,即分別為190~200 nm間的正特征峰和208與222 nm附近兩個負特征峰。由此可知,結構域Z中氨基酸突變(如圖1所示)并未引起突變結構域分子二級結構的改變,突變結構域Z?和Z?保持了與結構域Z相同的二級結構。而在0.1 mol·L-1NaOH溶液中,結構域Z、Z?和Z?中僅有222 nm附近的負特征峰仍然可見[圖2(b)]。圖2(a)結果進一步顯示,在222 nm下突變結構域Z?比突變結構域Z?和結構域Z具有更強的負特征峰,表明突變結構域Z?的α-螺旋含量更高。對比圖1中結構域序列發現,其變化趨勢與結構域中第12位上Trp(-0.9)、Ala(1.8)和Ile(4.5)殘基的Kyte-Doolittle疏水性指數增加相一致[22-23]。這說明在結構域Z的12位引入疏水性更大的氨基酸殘基有利于提高α-螺旋含量。
2.2 結構域Z、Z?和Z?的示差掃描量熱分析
為了進一步考察其對結構域分子穩定性的影響,本文采用DSC測量結構域Z、Z?和Z?的熱轉變溫度m。不同條件下,結構域Z、Z?和Z?的偏摩爾熱容(ΔC)隨溫度變化結果如圖3所示。從中可以看出,在含100 mmol·L-1NaCl的20 mmol·L-1PBS溶液(pH 6.0)中結構域Z的m為75.3℃。這個結果與Dincbas-Renqvist等[24]通過CD光譜[]222變化測定的結構域Z在pH 5.7下熱轉變溫度(m=78.5℃)非常接近。相同條件下,突變結構域Z?的m為76.9℃,其較結構域Z提高了1.6℃;突變結構域Z?的m為79.2℃,其相較于結構域Z和Z?分別提高了3.9℃和2.3℃。同樣的趨勢也出現在0.1 mol·L-1NaOH溶液中。如圖3(b)所示,0.1 mol·L-1NaOH溶液中結構域Z、Z?和Z?的m分別降至61.6、64.8和62.8℃。對比突變結構域Z?和Z?的氨基酸序列(如圖1所示)可以發現,兩者之間唯一差別在于突變結構域Z?第12位上的Trp替換為突變結構域Z?中疏水性更大的Ile。由此,突變結構域Z?分子內的疏水性相互作用得到了強化,從而顯著提高突變結構域的分子穩定性。而當Kyte-Doolittle疏水性指數較小的Trp存在時,突變結構域Z?的m值較突變結構域Z?下降。突變結構域Z?不僅在3種結構域中具有最高的m值而且其在0.1 mol·L-1NaOH溶液中的m值接近Minakuchi等[14]報道的中性條件下結構域B的熱轉變溫度(m= 67.5℃)。這說明突變結構域Z?具有更好的分子穩定性。
(a) 100 mmol·L-1NaCl in 20 mmol·L-1PBS buffer (pH 6.0); (b) 0.1 mol·L-1NaOH solution
2.3 融合蛋白Z4與Z?4表達與純化
采用Q Sepharose FF離子交換色譜柱對BL21(DE3)大腸桿菌表達的融合蛋白Z4和Z?4進行純化。離子交換色譜平衡后,連續輸入細胞破碎后的上清液直至穿透;上樣后清洗除去未吸附的蛋白樣品,然后引入洗脫液通過線性梯度洗脫吸附組分并收集電導率為6~10 mS·cm-1的洗脫峰。實驗結果如圖4所示。圖4(a)為融合蛋白Z4的色譜圖及電泳照片。從中可以看出,陰離子交換色譜Q-Sepharose FF收集的洗脫蛋白質分子量介于26×103~27×103,其與融合蛋白Z4的理論分子量相當。該目標蛋白的純度達到95%以上。相同的結果也出現在圖4(b)中。經離子交換色譜Q Sepharose FF純化收集的融合蛋白Z?4同樣具有95%以上的純度。兩種融合蛋白直接用于SpA親和色譜介質的合成。
2.4 SpA色譜介質的耐堿性分析
本文中突變結構域Z?和Z?與結構域Z分別偶聯于瓊脂糖凝膠Sepharose FF表面合成Z SepFF、Z? SepFF和Z? SepFF 3種SpA色譜介質。3種色譜介質的SpA配基密度依次為9.7、9.7和9.5 mg·g-1介質。上述3種介質分別浸于0.1 mol·L-1NaOH溶液2、6和12 h后,測定其抗體吸附能力。抗體在Z SepFF和Z? SepFF介質上的靜態吸附結果如圖5所示。抗體吸附的Langmuir參數列于表1中。結果顯示,Z SepFF和Z? SepFF介質在含100 mmol·L-1NaCl的20 mmol·L-1PBS緩沖液(pH 7.5)中的抗體飽和吸附容量相當,分別為22.1和21.4 mg·ml-1。但是,抗體在Z? SepFF介質上的吸附量非常低(本文未列出)。對比圖1中突變結構域Z?和Z?的序列可知,兩者間唯一差別在于突變結構域Z?中Ile替換為突變結構域Z?中Trp。這種差別也導致突變結構域Z?中α-螺旋含量及m值的降低。本文將專注于Z SepFF和Z? SepFF介質的耐堿性分析。浸泡于0.1 mol·L-1NaOH溶液12 h后,Z SepFF和Z? SepFF介質的m值也僅略微降低不到10%(如表1所示)。
本文進一步合成了Z4SepFF和Z?4SepFF介質。Z4SepFF和Z?4SepFF介質的SpA配基密度分別為9.5和9.3 mg·g-1介質。在此基礎上,進一步比較了上述4種SpA色譜介質對標準CIP溶液(0.5 mol·L-1NaOH溶液)的耐受性。實驗結果如圖6所示。從中可以看出,Z SepFF介質的抗體吸附容量隨著浸泡時間的延長下降得最為顯著,在標準CIP溶液中浸泡12 h后僅保留了50%的抗體吸附能力。這種抗體吸附容量的下降程度與Linhult等[11]報道相近,其發現結構域Z在0.5 mol·L-1NaOH溶液浸泡12 h后的抗體吸附量相當于浸泡1 h后的65%。圖6結果進一步顯示,Z? SepFF對標準CIP溶液的耐受性更好,其在標準CIP溶液中浸泡12 h后仍保留了初始抗體吸附容量的62%。本文中融合蛋白Z4和Z?4的引入不僅提高了SpA色譜介質的抗體吸附容量而且進一步提高了其對堿液的耐受性。在含100 mmol·L-1NaCl的20 mmol·L-1PBS緩沖液(pH 7.5)中,抗體在Z4SepFF和Z?4SepFF介質上的m分別達到55.4和57.9 mg·ml-1。這不僅比von Roman等[25]報道的以結構域B四串聯體融合蛋白為配基SpA色譜介質的m高出25%,也接近商品化MabSelect Xtra和MabSelect SuRe介質的m值[26]。
(a) chromatography of SpA-Z4and native PAGE image; (b) chromatography of SpA-Z?4and native PAGE image; F and P stands for feedstock and product, respectively
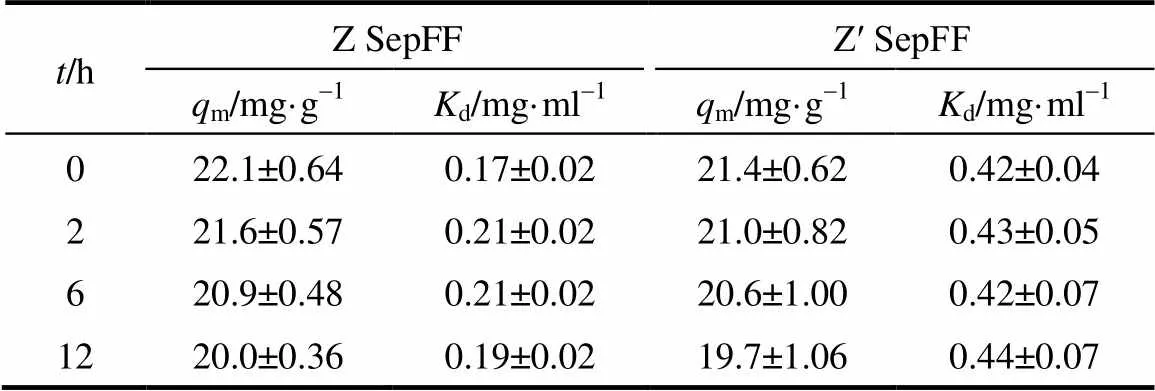
表1 不同堿液浸泡時間t后Z SepFF和Z? SepFF介質的Langmuir參數
在標準CIP溶液中浸泡12后,Z4SepFF和Z?4SepFF的m分別降至60%和68%。這表明SpA色譜介質的堿液耐受性得到進一步改善。耐堿性實驗結果不僅證明了突變結構域Z?具有更好的堿液耐受性,而且這種堿液耐受性在突變結構域Z?四串聯體融合蛋白為配基的SpA色譜介質中得到了提高。
3 結 論
本文通過對結構域Z非關鍵氨基酸殘基中去酰胺化效應的消除(N11T和N23T)和疏水性相互作用的增強(Q31T和A12I)提高SpA蛋白結構域Z分子整體穩定性。突變結構域Z?和Z?的CD光譜結果顯示,兩者的特征峰與結構域Z相一致。這表明突變結構域中氨基酸的替換并未引起結構域分子二級結構的改變。突變結構域Z?在222 nm下具有最強的負特征峰,暗示著其α-螺旋含量要明顯高于其他分子。在pH 6.0下,突變結構域Z?的m較突變結構域Z?提高了2.3℃,達到了79.2℃。這一結果表明,突變結構域Z?中第12位替換為疏水性更大的Ile顯著提高了結構域分子的穩定性。SpA色譜介質耐堿性實驗結果表明,突變結構域Z?具有更好的堿液耐受性,這種堿液耐受性在以其四串聯體融合蛋白為配基的SpA色譜介質中得到了進一步提高。
References
[1] HOBER S, NORD K, LINHULT M. Protein A chromatography for antibody purification[J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2007, 848(1): 40-47.
[2] LOW D, O'LEARY R, PUJAR N S. Future of antibody purification[J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2007, 848(1): 48-63.
[3] GHOSE S, ALLEN M, HUBBARD B,. Antibody variable region interactions with protein A: implications for the development of generic purification processes[J]. Biotechnology and Bioengineering, 2005, 92(6): 665-673.
[4] BOLTON G R, MEHTA K K. The role of more than 40 years of improvement in protein A chromatography in the growth of the therapeutic antibody industry[J]. Biotechnology Progress, 2016, 32(5): 1193-1202.
[5] TAJIMA N, TAKAI M, ISHIHARA K. Significance of antibody orientation unraveled: well-oriented antibodies recorded high binding affinity[J]. Analytical Chemistry, 2011, 83(6): 1969-1976.
[6] EY P L, PROWSE S J, JENKIN C R. Isolation of pure IgG1, IgG2a and IgG2b immunoglobulins from mouse serum using protein A-sepharose[J]. Immunochemistry, 1978, 15(7): 429-436.
[7] NILSSON B, MOKS T, JANSSON B,. A synthetic IgG-binding domain based on staphylococcal protein A[J]. Protein Engineering, 1987, 1(2): 107-113.
[8] HAHN R, SCHLEGEL R, JUNGBAUER A. Comparison of protein A affinity sorbents[J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2003, 790(1/2): 35-51.
[9] GHOSE S, HUBBARD B, CRAMER S M. Binding capacity differences for antibodies and Fc-fusion proteins on protein A chromatographic materials[J]. Biotechnology and Bioengineering, 2007, 96(4): 768-779.
[10] HAHN R, SHIMAHARA K, STEINDL F,. Comparison of protein A affinity sorbents(Ⅲ): Life time study[J]. Journal of Chromatography A, 2006, 1102(1/2): 224-231.
[11] LINHULT M, GULICH S, GRASLUND T,. Improving the tolerance of a protein A analogue to repeated alkaline exposures using a bypass mutagenesis approach[J]. Proteins-Structure Function and Bioinformatics, 2004, 55(2): 407-416.
[12] XIA H F, LIANG Z D, WANG S L,. Molecular modification of protein A to improve the elution pH and alkali resistance in affinity chromatography[J]. Applied Biochemistry and Biotechnology, 2014, 172(8): 4002-4012.
[13] GULICH S, LINHULT M, STAHL S,. Engineering streptococcal protein G for increased alkaline stability[J]. Protein Engineering, 2002, 15(10): 835-842.
[14] MINAKUCHI K, MURATA D, OKUBO Y,. Remarkable alkaline stability of an engineered protein A as immunoglobulin affinity ligand: C domain having only one amino acid substitution[J]. Protein Science, 2013, 22(9): 1230-1238.
[15] PALMER B, ANGUS K, TAYLOR L,. Design of stability at extreme alkaline pH in streptococcal protein G[J]. Journal of Biotechnology, 2008, 134(3/4): 222-230.
[16] HUANG B, LIU F F, DONG X Y,. Molecular mechanism of the effects of salt and pH on the affinity between protein A and human immunoglobulin G1 revealed by molecular simulations[J]. Journal of Physical Chemistry B, 2012, 116(1): 424-433.
[17] JOHNSON W C JR. Protein secondary structure and circular dichroism: a practical guide[J]. Proteins, 1990, 7(3): 205-214.
[18] KELLY S M, PRICE N C. The use of circular dichroism in the investigation of protein structure and function[J]. Current Protein & Peptide Science, 2000, 1(4): 349-384.
[19] JENDEBERG L, TASHIRO M, TEJERO R,. The mechanism of binding staphylococcal protein A to immunoglobin G does not involve helix unwinding[J]. Biochemistry, 1996, 35(1): 22-31.
[20] ZHENG D Y, ARAMINI J M, MONTELIONE G T. Validation of helical tilt angles in the solution NMR structure of the Z domain ofprotein A by combined analysis of residual dipolar coupling and NOE data[J]. Protein Science, 2004, 13(2): 549-554.
[21] TASHIRO M, TEJERO R, ZIMMERMAN D E,. High-resolution solution NMR structure of the Z domain of staphylococcal protein A[J]. Journal of Molecular Biology, 1997, 272(4): 573-590.
[22] KYTE J, DOOLITTLE R F. A simple method for displaying the hydrophatic character of a protein[J]. Journal of Molecular Biology, 1982, 157(1): 105-132
[23] 閻隆飛, 孫之榮. 蛋白質分子結構[M]. 北京: 清華大學出版社, 1999: 1-21.
YAN L F, SUN Z R. Molecular Structure of Protein[M]. Beijing: Tsinghua University Press, 1999: 1-26.
[24] DINCBAS-RENQVIST V, LENDEL C, DOGAN J,. Thermodynamics of folding, stabilization, and binding in an engineered protein-protein complex[J]. Journal of the American Chemical Society, 2004, 126(36): 11220-11230.
[25] VON ROMAN M F, BERENSMEIER S. Improving the binding capacities of protein A chromatographic materials by means of ligand polymerization[J]. Journal of Chromatography A, 2014, 1347: 80-86.
[26] HAHN R, BAUERHANSL P, SHIMAHARA K,. Comparison of protein A affinity sorbents(Ⅱ): Mass transfer properties[J]. Journal of Chromatography A, 2005, 1093(1/2): 98-110.
Construction and characteristics of alkali-tolerance mutants of Z domain for protein A chromatography
GUAN Zhilong, BAI Shu, SUN Yan, SHI Qinghong
(Key Laboratory of Systems Bioengineering of Ministry of Education, School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China)
A novel strategy to optimize intramolecular interaction of Z domain was proposed to improve alkali-tolerance of the domain ofprotein A (SpA) and two mutants of Z domain, named as Z? domain and Z? domain, were prepared to evaluate their alkali tolerance as the ligand for protein A chromatography. The result of circular dichroism showed that both the mutants had the identical characteristic peaks to Z domain whilst Z? domain had higher α-helix content than Z? domain. At pH 6.0, heat transition temperature of Z? domain increased by 3.9℃ compared with domain Z whilst heat transition temperature of Z? domain increased merely by 1.6℃. It indicated that the introduction of more hydrophobic Ile at position 12 in Z? domain improved the stability of the Z? domain. Using Z, Z? and their tetrameric domains as the ligand for protein A adsorbents, adsorption performance of SpA adsorbents was evaluated after their exposure in alkaline solutions. The results demonstrated that domain Z? had a higher alkali tolerance among three domains and the tolerance was further improved by applying a tetrameric Z? domain. The research provided a new clue for the development of alkali-tolerance protein A ligand.
antibody; adsorption; thermodynamics; protein A chromatography; differential scanning calorimetry; circular dichroism; alkali tolerance
10.11949/j.issn.0438-1157.20170366
TQ 028.8
A
0438—1157(2017)09—3459—07
2017-04-10收到初稿,2017-05-10收到修改稿。
史清洪。
管志龍(1989—),男,碩士研究生。
國家自然科學基金項目(21276189, 21476166);天津市應用基礎研究計劃項目(15JCYBJC48500);生化工程國家重點實驗室開放基金(2014KF-03)。
Receiving date: 2017-04-10.
Prof. SHI Qinghong, qhshi@tju.edu.cn
supported by the National Natural Science Foundation of China (21276189, 21476166), the Tianjin Natural Science Foundation (15JCYBJC48500) and the Open Funding Project of the State Key Laboratory of Biochemical Engineering (2014KF-03).

