制備高純超細氧化鋁粉體新方法
聶玉娟,王二東,王許云
?
制備高純超細氧化鋁粉體新方法
聶玉娟1,王二東2,王許云1
(1青島科技大學化工學院,山東青島 266042;2中國科學院大連化學物理研究所,遼寧大連116023)
以99.99% 高純鋁板為陽極原料,采用電化學方法制備氧化鋁前體氫氧化鋁,討論分析了氫氧化鋁的焙燒溫度、保溫時間對制備高純超細氧化鋁的影響,考察了不同電流密度放電對氧化鋁形貌和粒度的影響。結果表明:在70 mA·cm-2的較高電流密度下鋁/空氣電池放電過程可得到平均粒度為268 nm的氫氧化鋁;制備的氫氧化鋁經洗滌,在1400℃焙燒,保溫3 h,可得到平均粒度為200 nm,形貌為近似球狀的99.99% 的超細氧化鋁粉體;而低電流密度所得氧化鋁顆粒團聚嚴重。主要原因是高電流密度使放電過程中產生的氫氧化鋁晶體的介穩區寬度變窄所致。
電化學;氫氧化鋁;高純超細氧化鋁;鋁/空氣電池;粉體
引 言
高純超細氧化鋁在硬度、強度、亮度、隔電性、耐磨損性、耐高溫和耐腐蝕性等方面展現出的卓越性能,被廣泛應用于化工、電子、冶金、航天以及醫學等領域[1-3]。目前,高純超細氧化鋁的應用大致可分為3個層次:低端市場、中端市場和高端市場。低端市場氧化鋁主要應用在集成電路、熒光粉、消費電子等領域,而中高端市場主要包括藍寶石襯底、電池隔膜等高新技術領域,其對氧化鋁的純度、粒徑、形貌、產品穩定性等要求較高。根據國內外相關文獻資料和已公開的專利報道,目前國內生產高純氧化鋁與國際水平還有一定差距,一些高端產品需要進口[4-7]。
氧化鋁的制備方法眾多,主要包括化學法、水解法、溶膠-凝膠法、沉淀法、分解法等十余種方法[8-18],由此衍生出來的改良拜耳法、醇鹽水解法、水熱法能較好地生產出高純度的氧化鋁[19-24]。其中,醇鹽水解法和水熱法被認為是目前生產高純氧化鋁的最佳方法。但因其工藝復雜,成本高或者生產過程存在安全隱患而難以實現商業化。因而,如何簡化高純超細氧化鋁的生產工藝,降低生產成本,并實現成熟工業化一直是研究人員廣泛關注的問題。
近年來,不少研究人員將注意力轉向使用電化學方法來生成不同金屬氧化物納米顆粒,主要采用金屬陽極溶解的方式。目前,通過該方法已成功制備出納米級氧化鋅、氧化鎂以及金屬鈷復合物[25-27]。后來,Starowicz等[28]通過電解液中金屬鋁陽極溶解的方式制備出了鋁基氧化物納米顆粒。但該團隊僅對整個電化學過程產生的鋁基氧化物納米顆粒進行了研究,并未進一步探索生成的納米顆粒是否具備轉化為納米級高純氧化鋁的可能性。
本文提出利用不同電流密度下鋁/空氣電池放電來生產高純超細氧化鋁的方法。使用高純鋁做陽極,在制備出氫氧化鋁前體后,通過焙燒獲得了高純超細氧化鋁,并對產物進行了一系列的表征分析。本方法將有望制備出適合市場應用的高純超細氧化鋁,降低電池使用成本。
1 實驗材料和方法
1.1 材料
氫氧化鈉,由上海阿拉丁生化科技股份有限公司提供,電子級,純度為99.99%,實驗所用電解液均為氫氧化鈉溶于超純水制成,濃度為4 mol·L-1。99.99%高純鋁板,由北京環球金鼎科技有限公司提供,切割成30 mm×30 mm×3 mm的尺寸用作電池陽極。表1為所用高純鋁的化學組成。焙燒所用料舟為純度99.9%氧化鋁料舟。實驗室用水為超純水(UP)。

表1 高純鋁化學組成
1.2 分析測試儀器
X射線粉末衍射儀,X'pert Pro型,荷蘭PANalytical B.V.; SEM, JSM-7800F型,日本電子株式會社;Zetasizer 激光粒度分析儀,Zetasizer Nano型,英國Malvern公司;電感耦合等離子體發射光譜儀ICP-OES,PerkinElmer ICP-OES 7300DV型,PerkinElmer。
1.3 氫氧化鋁前體的制備與后處理
氫氧化鋁前體由鋁/空氣電池放電過程產生。鋁/ 空氣電池由1片鋁陽極和兩側各1片陰極平行放置構成。使用藍電電池測試系統(武漢市藍電電子有限公司提供)將鋁/空氣電池分別在20、50和70 mA·cm-2的放電電流密度下進行放電,截止電壓均為0.6 V。將放電結束后電解液中的沉淀產物依次進行如下處理:使用循環水式多用真空泵對含沉淀電解液進行多次洗滌,抽濾得餅狀產物;在真空干燥箱中80℃條件下干燥24 h;將干燥后粉餅進行研磨,備用。
2 實驗結果與討論
2.1 前體氫氧化鋁分析
圖1給出的是前體氫氧化鋁的XRD譜圖和多次測量的粒度分析圖。從XRD結果可知:前體氫氧化鋁晶型主要為Gibbsite型,對應的PDF卡片號為33-0018,另外還存在極少部分的Bayerite型。粒度分析結果則顯示,氫氧化鋁顆粒尺寸在200~600nm之間,且顆粒尺寸分布均勻性較差,平均粒度為268 nm。
2.2 焙燒條件選擇
2.2.1 焙燒溫度對氧化鋁的影響 70 mA·cm-2放電,不同焙燒溫度下(保溫時間均為2 h)所得晶體的XRD譜圖結果見圖2。由圖可知,不同焙燒溫度下均得到了氧化鋁,但氧化鋁的晶型不盡相同。1000℃條件下得到的是δ-Al2O3,θ-Al2O3和χ-Al2O3,其對應的PDF卡片號分別為46-1131,23-1009和13-0373,但以δ-Al2O3晶型為主,占晶格比例的92.8%。此溫度下XRD譜線寬化明顯,推測生成的產物顆粒細小;1200℃下得到的是θ-Al2O3,κ-Al2O3和a-Al2O3,對應PDF卡片號分別為23-1009, 04-0878和10-0173,以θ-Al2O3晶型為主(三強峰對應的2分別為31.597°,32.848°和67.481°)。而1400℃下只存在a-Al2O3(PDF卡片號為10-0173),該種晶型的氧化鋁為高端市場所需的氧化鋁,且近幾年其在二次電池領域的應用已經引起了廣泛關注與研究[29-30]。結果表明,隨焙燒溫度升高,氧化鋁晶型趨向于單一化。峰強度和尖銳程度隨溫度升高增加明顯,推知高溫下晶體結晶度明顯改善,晶體由顆粒細小的多晶向形貌規則的單晶轉化。即隨焙燒溫度升高,晶型主要發生了從δ-Al2O3到θ-Al2O3再到a-Al2O3的相轉化。
由數據分析知1400℃時產物已完全轉化為a-Al2O3,因此確定1400℃為本實驗條件下適宜的焙燒溫度。
2.2.2 保溫時間對氧化鋁的影響 已知1400℃時產物已完全轉化為a-Al2O3,此時結晶度良好。為更好地探討保溫時間對氧化鋁表觀形貌的影響,根據XRD結果選擇產物焙燒溫度為1200℃,電流密度仍選擇70 mA·cm-2。該條件下在不同保溫時間所得到的氧化鋁SEM圖和平均粒度分布圖如圖3所示。從圖中可以看出,相比氫氧化鋁,氧化鋁的顆粒尺寸增加明顯,這主要是高溫和長保溫時間導致的顆粒團聚所引起的。由圖3(a)~(c) 可知,隨著保溫時間延長,氧化鋁結晶度逐漸升高,結晶形貌由細小顆粒逐漸向板狀、塊狀轉變,最終有轉變為蠕蟲狀的趨勢。在由板狀或塊狀向蠕蟲狀形貌轉變過程中,晶體尺寸逐漸減小。該形貌與XRD結果表現出良好的一致性。由圖3(d) 可知,隨保溫時間延長,顆粒平均粒度分布逐漸增加,尺寸分布均勻性明顯變差,該結果看似與SEM結果不符,但實際上由于保溫3 h時顆粒蠕蟲狀尺寸雖然減小,由于團聚作用并未實現相互分離,所以表觀尺寸仍然是增大的。
2.3 電流密度對氧化鋁的影響
為進一步確定電流密度對最終產物氧化鋁表觀形貌的影響,在控制焙燒溫度為1400℃、保溫時間為3 h的條件下,考察了放電電流密度分別為20,50和70 mA·cm-2下,鋁/空氣電池放電產物通過焙燒所得最終產物氧化鋁的表觀形貌和平均粒度分布,如圖4所示。從圖4(a)~(c) 可以看出,低電流密度條件下焙燒產生的氧化鋁顆粒間團聚現象顯著,顆粒尺寸較大,均勻性差,為明顯的蠕蟲狀;隨電流密度升高,所得焙燒產物逐漸向近球狀顆粒轉變,近球狀顆粒尺寸逐漸減小且相對均勻。尤其是在70 mA·cm-2條件下,平均粒度可減小到200 nm,但顆粒內部的蠕蟲狀趨勢仍存在。該結果和圖4(e)平均粒度結果表現出很好的一致性。由此可知:相同焙燒條件下,較高電流密度一定程度上有利于細化氧化鋁顆粒。
將放電電流密度為70 mA·cm-2焙燒所得氧化鋁[圖4(c)]和商品氧化鋁[圖4(d)]比較,本實驗所得氧化鋁形貌和商品氧化鋁具有很好的可比性。但氧化鋁顆粒均勻性和商品氧化鋁(99.9%,30 nm)相比還存在一定差距,需進一步改善和提升。
2.4 電流密度對產物影響的機理分析
金屬鋁溶于強堿(以NaOH為例)生成氧化鋁的化學反應方程式如下
2Al + 6H2O + 2NaOH2NaAl(OH)4+ 3H2(1)
NaAl(OH)4MIAl(OH)3+ NaOH (2)
式(1)的驅動力為化學驅動,即主要為化學勢差以及濃度差。然而,通過鋁/空氣電池放電生成氫氧化鋁,在電池放電過程中雖然總反應也為式(1),但主要的驅動力為電化學驅動。在恒電流放電條件下,可以恒定的速率源源不斷地產生Al(Ⅲ),從而避免了傳統方法中陳化時間對氫氧化鋁沉淀產生的影響,大大減少了生成氫氧化鋁的時間,簡化了生產工藝和成本。結晶過程如式(2)所示,其中MI為介穩態中間體。電池放電過程金屬陽極的電化學反應方程式如式(3)
AlAl3++3e-(3)
Al3+產生的速率可依據式(4)計算(排除析氫腐蝕的影響)
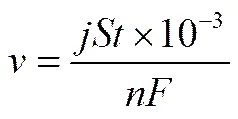
鋁/空氣電池放電過程中不同電流密度下生成的氫氧化鋁形貌如圖5所示。從圖中可以看出:小電流密度下生成的氫氧化鋁顆粒粒度相對較大,且均勻性較差;大電流密度下生成的顆粒則較小,尺寸較均勻,但團聚現象顯著。從圖1已知,氫氧化鋁主要為Gibbsite型。Gibbsite型的生長基元的形成能低,在Al-H2O反應中成核速率快,而其溶解度在較低溫度下相對Bayerite型更低,所以可認為其在溶液中更容易生成[31]。無論是在高電流密度還是低電流密度條件下,推測化學反應均會導致溶液系統迅速達到局部過飽和狀態,促使介穩區寬度(MSZW)[32-33]減小,使Bayerite晶體成核受到抑制,促進Gibbsite晶體在介穩態環境中迅速生長,從而使最終沉淀主要為Gibbsite型。由式(4)可知,電化學條件下Al(Ⅲ)的產生不受其在溶液中溶解度的限制,根據MSZW理論可知,晶體成核和生長機理在MSZW中是決定性因素。較高電流密度條件下Al(Ⅲ)產生迅速,晶體生成過程為成核控制,隨著晶核不斷形成,晶體生長會受到抑制,使最終晶體尺寸較小。而低電流密度下晶體生成過程主要為擴散控制,晶體有足夠的空間穩定生長,所以其顆粒尺寸較大,且分散性更好。可認為高電流密度下介穩區寬度相比低電流密度下更窄,是Gibbsite型氫氧化鋁迅速產生,且顆粒細小的重要原因。
圖5 不同電流密度下產生的氫氧化鋁的SEM圖
Fig.5 SEM images of aluminum hydroxide under different current densities
2.5 氧化鋁粉末純度分析
對70 mA·cm-2的放電電流密度下通過焙燒得到的氧化鋁進行了純度分析,結果如表2所示。其中S3對應的為樣品經過比S1、S2更多次洗滌和使用非玻璃儀器后所測的純度。由表可知,最終氧化鋁的純度超過了99.9%,主要雜質元素是Na和Si。Na+主要來源于電解液中的NaOH,是氧化鋁洗滌不充分所致;而含Si雜質可能來源于周圍環境中的灰塵以及實驗過程所使用的玻璃儀器。通過進一步改善實驗環境,Si和Na的來源可得到有效控制,氧化鋁的純度可達到99.99%以上。
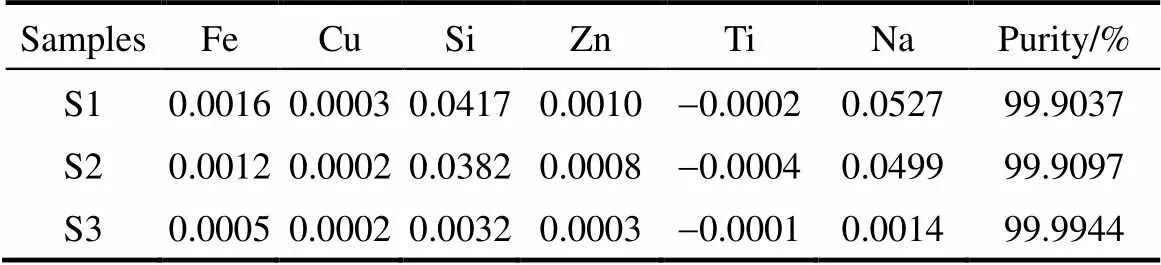
表2 氧化鋁純度分析
3 結 論
(1)采用電化學途徑生產高純超細氧化鋁粉末。通過鋁/空氣電池放電過程制備氧化鋁前體氫氧化鋁,并通過改變放電過程中電流密度大小來調控Al(Ⅲ)產生的速率,從而影響電解液中氫氧化鋁晶核的形成和晶體的生長。通過調控焙燒溫度和保溫時間來控制產生的氧化鋁顆粒的粒度和表觀形貌。結果表明:當放電電流密度為70 mA·cm-2,1400℃焙燒,保溫3 h可制備出平均粒度為200 nm,純度高達99.99% 的類球狀超細氧化鋁粉末。
(2)所制備的氫氧化鋁的顆粒尺寸與放電電流密度具有較大的相關性。低電流密度下顆粒尺寸較大,形貌良好。高電流密度下顆粒細小且無固定形貌。通過引入晶體介穩區寬度理論,分析認為隨電流密度增加,晶體生長介穩區寬度逐漸變窄,使顆粒尺寸細化,最終得到粒徑較小的氧化鋁。
符 號 說 明

F——Faraday常數,C·mol-1 j——放電電流密度,mA·cm-2 n——鋁陽極失電子數 S——鋁陽極有效放電面積,cm2 t——放電時間,s v——Al3+生成速率,mol·s-1
References
[1] 韓東戰, 尹中林, 王建立. 高純氧化鋁制備技術及應用研究進展[J]. 無機鹽工業, 2012, 44(9): 8-11.HAN D Z, YIN Z L, WANG J L.Research progress in preparation and application of high purity alumina[J]. Inorganic Chemicals Industry, 2012, 44(9): 8-11.
[2] GOLESTANI-FARD F, MAZAHERI M, AMINZARE M,. Microstructural evolution of a commercial ultrafine alumina powder densified by different methods[J]. Journal of the European Ceramic Society, 2011, 31(14): 2593-2599.
[3] DU M X, CHEN K L, XIONG Y G. Advances in high-purity alumina and resource distribution[J]. Advanced Materials Research, 2014, 926/930: 36-39.
[4] FU X F, XU B J, HUANG C J. Preparation of high purity alumina technology overview[J]. Advanced Materials Research, 2013, 734/737: 2496-2500.
[5] MAHRABI K, KHODABAKHSHI F, ZAREH E,. Effect of alumina nanoparticles on the microstructure and mechanical durability of meltspun lead-free solders based on tin alloys[J]. Journal of Alloys and Compounds, 2016, 688: 143-155.
[6] QIAN M, SUN Y, XU X,. 2D-alumina platelets enhance mechanical and abrasion properties of PA612interfacial hydrogen-bond interactions[J]. Chemical Engineering Journal, 2017, 308: 760-771.
[7] HOSSAIN A M S, BALBIN A, ERAMI R S,. Synthesis and study of the catalytic applications in C—C coupling reactions of hybrid nanosystems based on alumina and palladium nanoparticles[J]. Inorganica Chimica Acta, 2017, 455(2): 645-652.
[8] 李繼光, 孫旭東, 王亞蓉, 等. α-Al2O3納米粉的燒結初期機理研究[J]. 硅酸鹽學報, 1998, 26(4): 471-475. LI J G, SUN X D, WANG Y R,.Sintering mechanism of α-Al2O3nano-crystalline powder in initial stage[J].Journal of the Chinese Ceramic Society, 1998, 26(4): 471-475.
[9] 吳義權, 張玉峰, 黃校先, 等. 低溫制備α-Al2O3粉體[J]. 無機材料學報, 2001, 16(2): 349-352. WU Y Q, ZHANG Y F, HUANG X X,. Preparation of nano-sized alumina powders at low temperatures[J]. Journal of Inorganic Materials, 2001, 16(2): 349-352.
[10] 鄒力. 無機鹽前驅體復合陶瓷膜制備及表征[D]. 西安: 西安工程大學, 2013. ZOU L. Preparation and characterization of composite ceramic membranes with inorganic precursors abstract[D]. Xi’an: Xi’an Polytechnic University, 2013.
[11] 龔茂初, 林之恩, 袁書華, 等. 成膠條件對耐高溫高表面積氧化鋁熱穩定性的影響[J]. 催化學報, 2001, 22(6): 520-522. GONG M C, LIN Z E, YUAN S H,. Effects of colloid forming conditions on thermal stability of high-temperature-resistant alumina with high surface area[J]. Chinese Journal of Catalysis, 2001, 22(6): 520-522.
[12] 王雅娟, 李春喜, 王子鎬, 等. 超聲波-化學沉淀法制備納米氧化鋁粒子[J]. 北京化工大學學報(自然科學版), 2002, 29(4): 8-13. WANG Y J, LI C X, WANG Z H,.Preparation of alumina nanometer particles by an ultrasonic precipitation method[J]. Journal of Beijing University of Chemical Technology (Natural Science Edition), 2002, 29(4): 8-13.
[13] 張豪, 林闖, 張愛生, 等. 有機鋁水解制備亞微米高純氧化鋁[J]. 科學中國人, 2013, (6): 75-77. ZHANG H, LIN C, ZHANG A S,.Infenor micron high-purity alumina prepared by hydrolysis of organic aluminium[J].Scientific Chinese, 2013, (6): 75-77.
[14] KASHCHEEV I D, ZEMLYANOI K G, DORONIN A V,. New possibilities for an acid method of preparing aluminum oxide 1[J]. Refractories and Industrial Ceramics, 2014, 55(2): 87-92.
[15] ZHANG X. Preparation of alumina powders through pyrocatechol, resorcinol mediated sol-gel method[J]. Materials Science Forum, 2016, 850: 742-747.
[16] KONG J, CHAO B, WANG T,. Preparation of ultrafine spherical AlOOH and Al2O3powders by aqueous precipitation method with mixed surfactants[J]. Powder Technology, 2012, 229(6): 7-16.
[17] WANG L Y, ZHANG N. Synthesizing process of prepared ultrafine alumina powder by ammonia precipitation method[J]. Advanced Materials Research, 2014, 1079/1080: 62-65.
[18] ZHAO Y T, TAO R, ZHOU D F,. Regulatory process for preparing an all-micron ultra-high purity alumina powder method: 103787395A[P].2015-09-02.
[19] FANELLI A J, BURLEW J V. Preparation of fine alumina powder in alcohol[J]. Journal of the American Ceramic Society, 2010, 69(8): C-174-C-175.
[20] OGIHARA T, OGATA N, FUJITA K,. Continuous synthesis of monodispersed alumina particles by the hydrolysis of metal alkoxide using taylor vortex[J]. Powder & Particle, 2010, 20: 231-237.
[21] 于嚴淏. 異丙醇鋁水解制備高純氧化鋁及水合氧化鋁[D].大連: 大連理工大學, 2014. YU Y H. Synthesis of high-purity alumina and aluminium hydroxide from aluminium isopropoxide[D]. Dalian: Dalian University of Technology, 2014.
[22] ROUSSEAUX J M, PIGNOL G, MAGNAN Y. Bayer process for production of alumina trihydrate, the said improvement relating to separation of aluminate liquor and insoluble residues: US7807119[P]. 2010-05-10.
[23] TAKATORI K, KADOURA H, MATSUO H,. Microstructural evolution of high purity alumina ceramics prepared by a templated grain growth method[J]. Journal of the Ceramic Society of Japan, 2016, 124(4): 432-441.
[24] VLASKIN M S, GRIGORENKO A V, ZHUK A Z,. Synthesis of high-purity α-Al2O3from boehmite obtained by hydrothermal oxidation of aluminum[J]. High Temperature, 2016, 54(3): 322- 329.
[25] STYPULA B, BANAS J, STAROWICZ M,. Production of nanoparticles of copper compounds by anodic dissolution of copper in organic solvents[J]. Journal of Applied Electrochemistry, 2006, 36(12): 1407-1414.
[26] STAROWICZ M, STAROWICZ P, ZUKROWSKI J,. Electrochemical synthesis of magnetic iron oxide nanoparticles with controlled size[J]. Journal of Nanoparticle Research, 2011, 13(12): 7167-7176.
[27] STYPULA B, STAROWICZ M, HAJOS M,. Electrochemical synthesis of ZnO nanoparticles during anodic dissolution of zinc in alcohols solvents[J]. Archives of Metallurgy and Materials, 2011, 56(2): 286-292.
[28] STAROWICZ M, STAROWICZ P, STYPULA B. Alumina-based nanoparticles obtained by anodic dissolution of Al in electrolytes with alcohol solvents[J]. Journal of Solid State Electrochemistry, 2014, 18(11): 3065-3071.
[29] FAN X, LIU G, LIU J. Preparation of high-purity ultra-fine alumina used for lithium battery ceramic diaphragm coating, involves preparing slurry using alpha-alumina powder spray drying, and jet milling: 105347778-A[P]. 2016-02-24.
[30] CHUNG H S, JUN T Y. Manufacture of high-purity alumina used for.. secondary battery, involves dissolving aluminum hydroxide in supersaturated sodium hydroxide, preparing mother liquor, filtering, precipitating, separating, heating, and calcining: KR2016076832-A[P]. 2016-07-01.
[31] DEMICHELIS R, CIVALLERI B, NOEL Y,. Structure and stability of aluminium trihydroxides bayerite and gibbsite: a quantum mechanical, study with the Crystal 06 code[J]. Chemical Physics Letters, 2008, 465(4/5/6): 220-225.
[32] WANG H, WANG Z, LIU L,. Alumina hydrate polymorphism control in Al-water reaction crystallization by seeding to change MSZW[J].Crystal Growth & Design, 2016, 16(2): 1056-1062.
[33] WANG H, WANG Z, GUO J,. Boehmite preparationalditols-interacting transformation of metastable intermediates in Al-H2O reaction crystallization[J]. Crystal Growth & Design, 2017, 17(1): 183-190.
New approach to prepare high purity and superfine alumina powder
NIE Yujuan1, WANG Erdong2, WANG Xuyun1
(1College of Chemical Engineering, Qingdao University of Science and Technology, Qingdao 266042, Shandong, China;2Division of Fuel Cell & Battery, Dalian National Laboratory for Clean Energy, Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023, Liaoning, China)
99.99% high-purity aluminum is introduced as anode material to obtain aluminum hydroxide, the precursor of alumina, by an electrochemical method. The influence of calcination temperature and holding time on preparing high purity and superfine alumina is discussed. And effects on morphology and size of alumina at different current densities are studied. Experimental results show that the average size of 268 nm aluminum hydroxide can be obtained at 70 mA·cm-2, a relative high current density in aluminum/air batteries. After washing aluminum hydroxide and roasting at 1400℃, holding3 h, the average size of 200 nm and near-spherical alumina powder is received. However, alumina particles agglomerate seriously at low current densities, which is mainly caused by narrowing of metastable zone width at high current densities.
electrochemical method; aluminum hydroxide; high purity and superfine alumina; aluminum/air batteries; powder
10.11949/j.issn.0438-1157.20170176
TQ 133.1
A
0438—1157(2017)09—3616—07
2017-02-22收到初稿,2017-05-15收到修改稿。
王許云,王二東。
聶玉娟(1990—),女,碩士研究生。
中國科學院科技服務網絡計劃項目;中國科學院青年創新促進會優秀會員項目。
2017-02-22.
Prof. WANG Xuyun, wangxy@qust.edu.cn; Prof. WANG Erdong, edwang@dicp.ac.cn
supported by the Science and Technology Service Network Initiative of Chinese Academy of Sciences and the Outstanding Member Project of Youth Innovation Promotion Association, Chinese Academy of Sciences.

