基于定量磁化率成像人腦深層灰質核團概率性圖譜的構建
薄斌仕,翟國強,張苗,王乙,2,李建奇*
基于定量磁化率成像人腦深層灰質核團概率性圖譜的構建
薄斌仕1,翟國強1,張苗1,王乙1,2,李建奇1*
作者單位:1. 華東師范大學物理系,上海市磁共振重點實驗室,上海 200062 2. 康奈爾大學,威爾醫學院放射系,紐約 10022,美國
目的 基于定量磁化率成像(quantitative susceptibility mapping,QSM)技術制作可用于自動分割大腦深層灰質核團的概率圖譜。材料與方法 15名健康受試者參與研究,所有受試者掃描均在3.0 T磁共振成像設備系統上完成。在隨機選取的10名受試者得到的標準空間QSM圖上,手動勾畫出六個雙側腦深部灰質核團,之后采用相應的圖譜評價方法選擇最優概率閾值的圖譜作為最終的概率圖譜。在其余5名受試者得到的標準空間QSM圖上,分別使用三種圖譜(概率圖譜、AAL圖譜和Johns Hopkins圖譜)自動分割和由2名研究者手動勾畫出六個雙側腦深部灰質核團感興趣區,并分別計算自動分割與手動勾畫得到的區域的相似度Dice系數和磁化率值,以評價概率圖譜的準確性。結果 在基底節區域,概率圖譜分割結果的Dice系數明顯高于AAL圖譜,但和Johns Hopkins圖譜區別不大;在顱底和小腦區域,概率圖譜分割結果的Dice系數明顯高于Johns Hopkins圖譜。與其他兩種圖譜相比,概率圖譜自動分割深部核團后測量得到的磁化率值,更接近于手動勾畫核團測量得到的磁化率值,其差別更小。結論 基于多名受試者QSM圖像構建的腦深部灰質核團概率圖譜,對大腦灰質核團分割效果更加可靠,可有效提高圖像分析工作的效率。
磁共振成像;定量磁化率成像;基于圖譜分割;腦深部核團
三維立體腦圖譜可為大腦成像數據分析提供有用的解剖參考,通過受試者與腦模板之間的自動配準,腦圖譜可有效將受試者大腦分割成相應的感興趣區。人腦的結構和功能復雜多樣,每部分都有其特異性。空間標準化能夠減小個體間大腦解剖結構的差異,因此它是人腦圖譜研究中一個重要的步驟。目前,磁共振研究廣泛采用的大腦圖譜源于T1WI,如Talairach和Tournoux圖譜[1]、基于Colin 27模板的自動解剖標記(anmtomical automatic labeling,AAL)圖譜[2]等。
隨著高場磁共振成像技術的發展,定量磁化率成像(quantitative susceptibility mapping,QSM)提供了一種新穎的對比機制,它利用一般磁共振成像技術舍棄的相位信息得到局部磁場變化特性,再通過復雜的場到源反演計算,可直接得到定量磁化率分布圖[3-10]。大腦磁化率圖像的對比機制主要來源于含鐵的深部灰質核團和含髓磷脂的白質,對于深部核團來說其對比度非常好[4,6,10-11]。
采用QSM技術可得到精確腦鐵含量圖,而腦鐵沉積異常是神經退行性病變的潛在生物標記物,因此QSM已應用于帕金森病[11-12]、阿爾茨海默病[13-14]、Huntington病[15]等疾病的研究。在這些研究中,深部灰質核團區域的定義主要基于人工手動勾畫感興趣區(region of interest,ROI)[12-14],然后再進行相關統計分析,這需要耗費大量的時間。
最近來自Johns Hopkins大學的研究團隊制作了一個基于定量磁化率圖的大腦圖譜[16],但是其圖譜是基于單個受試者的大腦,不能充分反映大量正常大腦的解剖結構的多樣性。大量文獻表明,不同的正常人大腦結構存在很大差異[17-19],因此基于單個受試者的腦模板不能代表解剖結構變化較大的那些腦區域。
在本研究中,筆者采用一組受試者的高分辨率QSM圖像創建了一個新的概率性大腦深層灰質核團分割圖譜,該圖譜可以作為一個有用的模板自動進行大腦深層核團的識別以及進行大數據的組分析測量。
1 材料與方法
1.1 磁共振數據采集
15名健康受試者參與本項研究,7名女性,8名男性,平均年齡(24.3±1.0)歲。隨機選取其中10名(男女各5名)受試者作為圖譜制作對象,其余5名受試者作為后期檢驗圖譜有效性的對象。實驗前要求受試者認真閱讀并簽署磁共振檢查知情同意書。
所有受試者掃描均在3.0 T磁共振成像設備系統(西門子Magnftom Trio Tim 3.0 T)上完成,采用12通道頭線圈作為信號接收線圈。QSM掃描序列為三維多回波梯度回波(gradient echo,GRE)序列,具體掃描參數如下:TR 60 ms,第一回波時間(TE1) 6.8 ms,回波間隔(ΔTE) 6.8ms,回波數8,反轉角(FA) 15°,FOV 240 mm×180 mm,體素大小為0.625 mm× 0.625 mm× 2.000 mm,層數96。為減少采樣時間,在相位編碼方向(受試者左右方向)采用并行采樣技術,加速因子為2。T1WI高分辨結構像采用三維磁化準備快速梯度回波(magnetization-prepared rapid gradient echo,MPRAGE)序列,具體參數如下:正中矢狀面掃描,TR 2530 ms,反轉時間(TI) 1100 ms, FA為7°, TE 2.34 ms,FOV 256 mm×256 mm,體素大小為1 mm×1 mm ×1 mm,層數192。對所有受試者還進行了常規T1WI、T2WI及FLAIR等序列的掃描,以篩查患有腦血管疾病的受試者。在掃描過程中于受試者頭部兩側和下方均放置海綿墊,以減小受試者頭部運動而且保證受試者間定位的一致性。
1.2 QSM重建和圖譜制作
由GRE序列采集到的復數數據經過相位擬合、相位解纏繞、去背景場、基于形態學的偶極子反演算法(morphology enabled dipole inversion,MEDI)等步驟重建出顱腦橫斷面磁化率圖[7-8,20]。
在圖譜制作之前先對每個受試者的圖像進行了預處理[16,21],然后再進行圖譜制作:(1)使用磁共振掃描儀自帶的三維后處理軟件將受試者矢狀面高分辨T1結構像重建為橫斷面圖像,其分辨率為1 mm×1 mm×1 mm,然后使用FSL5.0.9工具包中的BET軟件(brain extraction Tool)去除顱骨和其他非腦組織,提取腦組織部分。(2)對受試者三維GRE序列得到的模圖,也使用FSL 5.0.9工具包中的BET軟件,去除顱骨和其他非腦組織,進行提取腦組織部分。(3)使用FSL 5.0.9工具包中的FLIRT線性配準算法中的剛體變換算法將去除顱骨之后受試者的橫斷面圖配準到去除顱骨之后的受試者模圖GreMag空間中,得到受試者模圖空間中的T1圖(Mag T1圖)。(4)使用FSL 5.0.9工具包中的FLIRT線性配準算法中的12參數仿射變換方法將受試者的Mag T1圖配準到ICBM T1圖的標準空間(MNI)中,得到MNI空間中受試者的T1圖(MNIT1圖)與受試者模圖空間到MNI空間的轉換矩陣(M)。(5)將轉換矩陣M運用到受試者的GreMag圖和QSM圖上,將其變換到標準空間中,得到標準空間的受試者模圖和QSM圖(MNI Mag圖和MNIQSM圖)。(6)在上述經過預處理得到的單個受試者的標準空間MNI QSM圖上,由1名研究者利用ITK-SNAP 3.2軟件手動勾畫出6個雙側腦深部灰質核團ROI (尾狀核:CN,殼核:PU,蒼白球:GP,黑質:SN,紅核:RN,齒狀核:DN),從而得到每個受試者在MNI坐標系的深部灰質分割圖(deep gray matter parcellation map,DGMPM)。(7)基于10名受試者的DGMPM圖,使用自編程序將每一類ROI按照像素出現的概率得到概率圖譜。然后根據不同概率閾值得到不同概率閾值圖譜,如10%概率閾值圖譜為所有出現概率超過10%的像素集合,20%概率閾值圖譜為所有出現概率超過20%的像素集合,依此類推。之后采用下述相應的圖譜評價方法生成最優閾值的概率圖譜。
1.3 圖譜評價方法
由2名研究者利用ITK-SNAP 3.2軟件在用于評價的5名受試者的標準空間QSM圖上手動勾畫出深部核團ROI,以此作為評價圖譜分割精確度的金標準。
對于每一個ROI的分割結果準確性的量化評價采用圖1所示原理進行[22]。假設研究者手工分割得到目標核團的像素為T,本文概率圖譜、AAL圖譜[2]、Johns Hopkins (JH)圖譜[16]得到的目標核團的像素為R, 研究者手工分割和圖譜自動分割得到的目標圖像的重疊區域的像素數目為真陽性(true positive,TP),而手工分割結果與圖譜自動分割結果之外包含區域像素數目為真陰性(true negative,TN),圖譜自動分割結果中不包含手工分割結果區域的像素數目為假陽性(FALSEpositive,FP),手工分割結果中不包含圖譜自動分割結果區域的像素數目為假陰性(false negative,FN)。采用Kappa系數、Dice系數[16,22-23]和覆蓋率(overlap ratio,OR)[19,23]來對分割結果可靠性進行分析:
其中,相似度Dice系數是指正確分割結果的像素數目占整個分割區域(包含手工分割和圖譜自動分割的所有區域)的比率,其對兩個區域大小和位置的差異很敏感,取值范圍為[0,1],1表示完全一致。在本研究中由于TN像素數目相對于目標核團像素數目為無窮大,從而使Kappa系數與Dice系數相等,而且已經有文獻指出Dice系數是Kappa系數的一種特例[22,24]。覆蓋率OR是指手工分割結果與圖譜分割結果共同包含區域與兩種分割方法結果包含的全部區域的比率,其取值范圍為[0,1],若圖譜分割結果和手工分割結果完全重合,則OR=1,若完全不重合,則OR=0。
1.4 最優圖譜選擇
對于用于評測的5名受試者磁化率圖,分別使用筆者制作的10種不同概率閾值的概率圖譜配準和手工勾畫的方法得到兩組ROI,然后對這兩組ROI區域進行Dice系數和覆蓋率統計,并對兩者結果進行權衡,選擇最佳概率閾值的概率圖譜作為最終的概率圖譜。此外,筆者對AAL圖譜和JH圖譜所研究的基底節區ROI分別進行擴大1個、2個像素或腐蝕1個、2個、3個、4個像素的操作,使其產生7種不同圖譜;顱底和小腦區域的ROI由于核團體積較小,只腐蝕到2個像素,使其產生5種不同圖譜。然后對AAL圖譜和JH圖譜的每一個深部灰質核團的分割效果進行統計分析,從中選出最佳圖譜并且與本文最佳中國人概率圖譜進行比較。為了保證比較的公平性,對三種圖譜所有核團均比較相同層位和數量的區域。
為了保證最優圖譜選擇的可靠性,筆者使用多次平均的方法:首先,求出每名受試者由每名研究者手動勾畫的ROI與圖譜自動分割的ROI之間的Dice系數和覆蓋率,將2名研究者得到的數值求平均值,得到各受試者每一個區域2名研究者評測的平均值;其次,對所有受試者的平均Dice系數和平均覆蓋率再求平均,從而得到每一個研究核團的最終Dice系數值和覆蓋率值。三種圖譜的每一類情況均使用多次平均的方法得到每一個研究核團的最終Dice系數和覆蓋率,然后分析他們的分布趨勢,最后得出最優圖譜。
1.5 磁化率值測量
使用圖譜自動分割深部核團并測量磁化率值,其步驟如下:首先,使用FSL 5.0.9工具包中FLIRT線性配準算法中的反轉矩陣方法,將圖譜制作過程中生成的受試者空間至MNI空間的轉換矩陣(M)求逆矩陣;然后,利用上述逆矩陣,將每個圖譜變換到對應受試者空間中,進而測量每個ROI的磁化率值。對于2名研究者手工勾畫的ROI,也使用M的逆矩陣,將其變換到受試者空間并測量ROI內的磁化率值。由于QSM得到的磁化率值是相對值而非絕對值,考慮到枕葉白質的磁化率分布比較均勻,磁化率值較為穩定[25],因此,本研究中將左側枕葉白質磁化率值作為參考值,所分析的磁化率值均為以枕葉白質磁化率為參考的相對值。
1.6 統計分析
為了評價2名研究者勾畫的ROI的一致性,對2名研究者手工勾畫的各灰質核團ROI計算相似度Dice系數和覆蓋率。另外,對每個核團2名研究者手工勾畫的ROI內測量的平均磁化率值進行一致性檢驗(intraclass correlation coefficient,ICC),ICC>0.75為一致性較好。
為了驗證圖譜自動獲取ROI方法的可靠性,筆者還分析了三種最佳圖譜分割結果與手工勾畫得到的灰質核團的相似度Dice系數之間的統計差異。本組因例數較少,統計差異分析采用非參數統計的Wilcoxon法,分析軟件使用SPSS 17.0 Windows版本,P<0.05為差異具有統計學意義。
2 結果
2名研究者手工勾畫的ROI的相似度Dice系數和平均覆蓋率見圖2,每一個核團ROI的平均Dice系數均在0.814以上,所有ROI的平均Dice系數為0.848±0.027,表明2名研究者手工勾畫的ROI之間是高度一致的;另外,每一個核團ROI的平均覆蓋率也均在0.763以上,所有ROI的平均覆蓋率為0.839± 0.042,可見我們的統計結果是很可靠的。
圖3和圖4顯示了每一個核團由三種圖譜自動分割與2名研究者手動分割的相似度平均Dice系數和平均覆蓋率的分布趨勢。對于基底節區域,本研究構建的概率圖譜取概率閾值為50%時總體上Dice系數達到一個極大值(圖3A;所有ROI的平均Dice系數:0.793±0.061),且此時的覆蓋率總體也處于一個比較高的可接受范圍(圖3B;所有ROI的平均覆蓋率:0.775±0.066),權衡兩者情況,因此取概率閾值為50%的圖譜為最優概率圖譜。AAL圖譜和JH圖譜最優ROI均取原始大小時相似度Dice系數達到極大值(圖3C、E),但此時的覆蓋率偏低(圖3D、F),AAL圖譜的所有ROI平均Dice系數為0.672±0.118,平均覆蓋率為0.611±0.120;JH圖譜的所有ROI平均Dice系數為0.771±0.074,平均覆蓋率為0.745±0.090。對于顱底和小腦的區域,概率圖譜取概率閾值為50%時總體上相似度Dice系數達到極大值(圖4A),但是Dice系數和覆蓋率比基底節稍低(所有ROI的平均Dice系數:0.718±0.087,平均覆蓋率:0.715±0.106)。 AAL圖譜中沒有這些區域的ROI,因此沒有參與比較。JH圖譜最優ROI取增加一個像素時相似度Dice系數達到極大值,此時所有ROI平均Dice系數為0.510±0.150,平均覆蓋率為0.580±0.154。
表1為三種最優圖譜每一類ROI的平均Dice系數。從表中數據可知,在基底節區域,概率圖譜分割結果的Dice系數明顯高于AAL圖譜,但和JH圖譜區別不大;在顱底和小腦區域,概率圖譜分割結果的Dice系數明顯高于JH圖譜。另外,對三種圖譜最優結果的每一個深層灰質核團ROI的兩次平均Dice系數進行統計差異性檢驗,發現概率圖譜與AAL圖譜的Dice系數只有左側尾狀核差異有統計學意義,其余核團差異沒有統計學意義;與JH圖譜的Dice系數在基底節的核團中差異沒有統計學意義,但是在顱底和小腦中的核團均有明顯的統計差異。由此可見,本文制作的圖譜總體上比另外兩個圖譜對中國人大腦深層灰質核團的分割效果更精確。
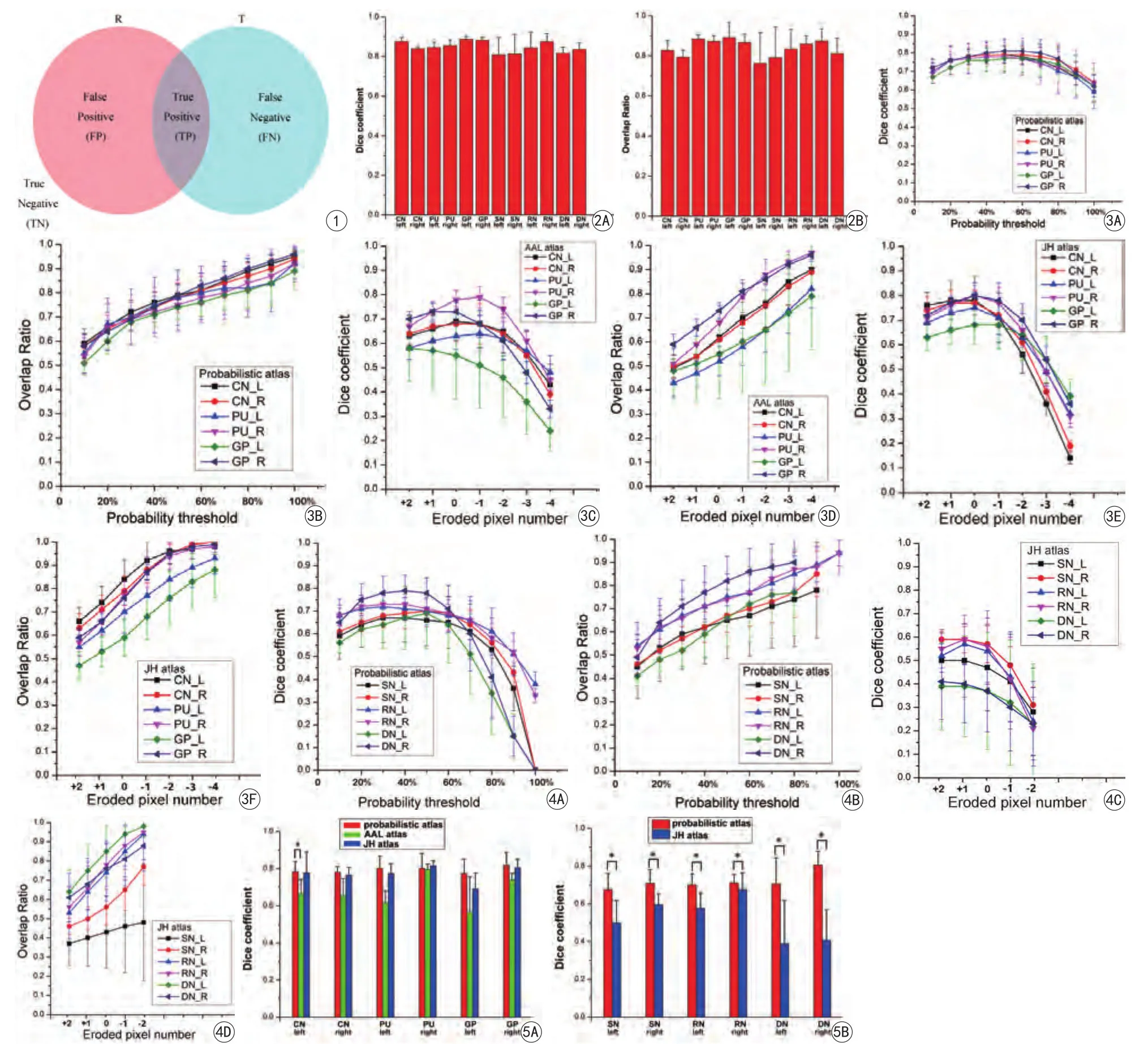
圖1 評價原理示意圖 圖2 為2名研究者手工勾畫的各個核團平均Dice系數和平均覆蓋率的分布圖。CN:尾狀核;PU:殼核;GP:蒼白球;SN:黑質;RN:紅核;DN:齒狀核 圖3 三種圖譜自動分割得到基底節區域中各個核團Dice系數和覆蓋率的分布趨勢。L:左;R:右 圖4 三種圖譜自動分割得到顱底和小腦區域中各個核團Dice系數和覆蓋率的分布趨勢。 L:左;R:右 圖5 三種最優圖譜分割的深層灰質核團平均Dice系數對比。*表示P<0.05,具有統計學意義Fig. 1 Diagrammatic sketch of the evaluation principle. Fig. 2 Bar chart showing the average Dice coefficient and average overlap ratio between ROIs drawn by the two researchers. CN: caudate nucleus. PU: putamen. GP: globus pallidus. SN: substantia nigra. RN: red nucleus. DN: dentate nucleus.Fig. 3 Distribution trends of Dice coef ficients and overlap ratio of each nucleus automatically segmented with three kinds of atlas. L: left. R: right.Fig. 4 Distribution trends of Dice coefficients and overlap ratio of each nucleus automatically segmented with two kinds of atlas. L: left. R: right.Fig. 5 Bar chart showing the average Dice coef ficient in the deep gray matter nuclei based on the three kinds of optimal atlas. Symbols of “*” indicate signi ficant difference (P<0.05).
對于2名研究者手工勾畫ROI區域的磁化率測量值,每一個核團的ICC值均在0.953以上,所有ROI的平均ICC值為0.981±0.013,表明2名研究者手工勾畫ROI區域測量的磁化率值之間是高度一致的。每一個受試者手工勾畫的研究區域最終磁化率值定義為,在2名研究者測量得到的平均磁化率的基礎上再對左右兩側的測量值再求平均。表2顯示了三種圖譜每個核團最優結果得到的平均磁化率值和手工勾畫得到的平均磁化率值,以及三種圖譜自動分割和手工勾畫得到的每個核團測量的磁化率值之間的相對差。從表2中可見,概率圖譜測量得到的平均磁化率值比其他兩種圖譜更為接近手工勾畫得到的磁化率值。概率圖譜測量得到的磁化率值與手工勾畫ROI得到的磁化率值之間的相對差均在10%以內,較另外兩種圖譜測得的磁化率值的相對差小。由以上結果也可看出本文的概率圖譜比另外兩種圖譜對各個核團的磁化率值測量更為準確。
表1 三種最優圖譜各個核團平均Dice系數Tab. 1 The average Dice coef ficients of each nucleus in three kinds of optimal atlas

表1 三種最優圖譜各個核團平均Dice系數Tab. 1 The average Dice coef ficients of each nucleus in three kinds of optimal atlas
注:P1表示本研究概率圖譜和AAL圖譜之間Dice系數的統計差異。P2表示本研究概率圖譜和JH圖譜之間Dice系數的統計差異。CN:尾狀核;PU:殼核;GP:蒼白球;SN:黑質;RN:紅核;DN:齒狀核。L:左;R:右
?

表2 三種最優圖譜和手工勾畫分割的各個核團平均磁化率值統計表Tab. 2 Average susceptibility values of each nucleus segmented with three kinds of optimal atlas and manual drawing
3 討論
定量磁化率圖可清晰顯示大腦深部灰質核團,筆者提出了一種基于多名受試者定量磁化率圖的概率性大腦深層灰質核團圖譜。此圖譜對大腦深層灰質核團的自動分割結果優于AAL圖譜和JH圖譜的分割結果,而且對分割區域的磁化率值測量結果也顯示本文的概率圖譜比另外兩種圖譜更為接近手工勾畫的測量結果。
目前廣泛采用的大腦圖譜大多不是基于定量磁化率圖而研究的,而基于QSM制作的JH圖譜是基于單個受試者制作的,其具有很大的個體特異性,并不能代表多數正常人區域解剖結構的變化,因此,這可能會導致自動配準得到的深部核團位置的不準確[19]。另外,也有文獻報道歐洲人和亞洲人大腦存在明顯結構差異[17-18],所以使用目前的圖譜對中國人大腦進行臨床分析也會導致區域分割的不準確。本研究結果顯示,筆者制作的中國人概率圖譜與JH圖譜在顱底和小腦區域的核團差異有明顯統計學意義,而且圖譜分割和測量的精確度比JH圖譜明顯較高(表1,2;圖5)。
筆者制作的中國人概率圖譜與AAL圖譜和JH圖譜相比,對測量顱底和小腦深層灰質核團具有明顯優勢,但是在基底節部位與JH圖譜相比差異不大。有文獻中指出,Dice系數大于0.7即為自動分割與標準分割結果非常接近[24];也有一些研究者認為,對于較小的結構Dice系數大于0.6,對于較大的結構Dice系數達到0.8即認為非常相似[26]。筆者最終制作的概率圖譜基底節較大的核團平均Dice系數為0.793±0.061,顱底和小腦中較小的核團的平均Dice系數為0.718±0.087。因此,筆者的圖譜分割結果是較為精確的,可用于自動測量磁化率圖中大腦相關區域的磁化率值,并進行有關的統計分析,從而提高工作效率。
在圖譜制作過程中,顱底和小腦的區域(如紅核、黑質等核團),對應圖譜Dice系數和覆蓋率比基底節中核團的測量值稍低,可能的原因是:(1)這些核團本身比較小,容易出現偏差;(2)顱底空腔處組織-空氣界面的磁化率差異較大,而GRE序列對這種差異非常敏感[27],導致該處組織磁化率圖信噪比差和組織圖像變形。
筆者提出的制作深層灰質核團的概率圖譜方法也存在幾點不足:(1)圖譜制作過程中使用了10個健康青年受試者,人數相對較少,今后還需要進一步擴大樣本量制作一個更具普遍性的概率性圖譜;(2)圖譜制作過程中使用的磁化率圖在顱底和小腦區域的圖像質量不如基底節部位的圖像質量,一定程度上會影響圖譜制作的精度,因此今后需進一步提高顱底部位的QSM圖像質量,從而使顱底和小腦部分的圖譜分割效果更佳。
綜上所述,本研究利用定量磁化率圖,制作了基于多名受試者的腦深部灰質核團概率圖譜,其對大腦灰質核團分割效果更加可靠,有效提高了圖像分析工作的效率,可以作為臨床研究過程中的一個有效工具。
[References]
[1] Talairach J, Tournoux P. Co-planar stereotactic atlas of the human brain: 3-Dimensional proportional system: an approach to cerebral imaging. New York: Georg Thieme Medical Publishers, 1988: 1-122.
[2] Tzourio-Mazoyer N, Landeau B, Papathanassiou D, et al. Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain.Neuroimage, 2002, 15(1): 273-289.
[3] de Rochefort L, Liu T, Kressler B, et al. Quantitative susceptibility map reconstruction from MR phase data using bayesian regularization: validation and application to brain imaging. Magn Reson Med, 2010, 63(1): 194-206.
[4] Haacke EM, Liu S, Buch S, et al. Quantitative susceptibility mapping: current status and future directions. Magn Reson Imaging,2015, 33(1): 1-25.
[5] Li W, Wu B, Liu C. Quantitative susceptibility mapping of human brain reflects spatial variation in tissue composition. Neuroimage,2011, 55(4): 1645-1656.
[6] Liu C, Li W, Tong K A, et al. Susceptibility-weighted imaging and quantitative susceptibility mapping in the brain. J Magn Reson Imaging, 2015, 42(1): 23-41.
[7] Liu J, Liu T, de Rochefort L, et al. Morphology enabled dipole inversion for quantitative susceptibility mapping using structural consistency between the magnitude image and the susceptibility map.Neuroimage, 2012, 59(3): 2560-2568.
[8] Liu T, Khalidov I, de Rochefort L, et al. A novel background field removal method for MRI using projection onto dipole fields (PDF).NMR Biomed, 2011, 24(9): 1129-1136.
[9] Shmueli K, de Zwart JA, van Gelderen P, et al. Magnetic susceptibility mapping of brain tissue in vivo using MRI phase data.Magn Reson Med, 2009, 62(6): 1510-1522.
[10] Wang Y, Liu T. Quantitative susceptibility mapping (QSM):Decoding MRI data for a tissue magnetic biomarker. Magn Reson Med, 2015, 73(1): 82-101.
[11] Du G, Liu T, Lewis MM, et al. Quantitative susceptibility mapping of the midbrain in Parkinson's disease. Mov Disord, 2016, 31(3):317-324.
[12] Murakami Y, Kakeda S, Watanabe K, et al. Usefulness of quantitative susceptibility mapping for the diagnosis of Parkinson disease. AJNR Am J Neuroradiol, 2015, 36(6): 1102-1108.
[13] Hwang EJ, Kim HG, Kim D, et al. Texture analyses of quantitative susceptibility maps to differentiate Alzheimer's disease from cognitive normal and mild cognitive impairment. Med Physics, 2016,43(8): 4718-4728.
[14] Moon Y, Han SH, Moon WJ. Patterns of brain iron accumulation in vascular dementia and Alzheimer's dementia using quantitative susceptibility mapping imaging. J Alzheimers Dis, 2016, 51(3):737-745.
[15] Ng AC, Poudel G, Stout JC, et al. Iron accumulation in the basal ganglia in Huntington's disease: cross-sectional data from the IMAGE-HD study. J Neurol Neurosurg Psychiatry, 2016, 87(5):545-549.
[16] Lim IA, Faria AV, Li X, et al. Human brain atlas for automated region of interest selection in quantitative susceptibility mapping:application to determine iron content in deep gray matter structures.Neuroimage, 2013, 82(22): 449-469.
[17] Zeng D, Zhang TJ, Jiang LJ, et al. Chinese brain template built on 3D high resolution MR imaging at 3.0 T. J Biomed Engineering,2010, 27(3): 561-564.曾東, 張體江, 蔣莉君, 等. 基于3.0 T磁共振高分辨三維像的中國人腦常模. 生物醫學工程學雜志, 2010, 27(3): 561-564.
[18] Tang Y, Hojatkashani C, Dinov ID, et al. The construction of a Chinese MRI brain atlas: a morphometric comparison study between Chinese and Caucasian cohorts. Neuroimage, 2010, 51(1): 33-41.
[19] Wu M, Rosano C, Lopez-Garcia P, et al. Optimum template selection for atlas-based segmentation. Neuroimage, 2007, 34(4): 1612-1618.
[20] Liu T, Wisnieff C, Lou M, et al. Nonlinear formulation of the magnetic field to source relationship for robust quantitative susceptibility mapping. Magn Reson Med, 2013, 69(2): 467-476.
[21] Shattuck DW, Mirza M, Adisetiyo V, et al. Construction of a 3D probabilistic atlas of human cortical structures. Neuroimage, 2008,39(3): 1064-1080.
[22] Shattuck DW, Prasad G, Mirza M, et al. Online resource for validation of brain segmentation methods. Neuroimage, 2009, 45(2):431-439.
[23] Avants BB, Yushkevich P, Pluta J, et al. The optimal template effect in hippocampus studies of diseased populations. Neuroimage, 2010,49(3): 2457-2466.
[24] Zijdenbos AP, Dawant BM, Margolin RA, et al. Morphometric analysis of white matter lesions in MR images: method and validation. IEEE Trans Med Imaging, 1994, 13(4): 716-724.
[25] Barbosa JH, Santos AC, Tumas V, et al. Quantifying brain iron deposition in patients with Parkinson's disease using quantitative susceptibility mapping, R2 and R2*. Magn Reson Imaging, 2015,33(5): 559-565.
[26] Avants BB, Epstein CL, Grossman M, et al. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Med Image Anal, 2008, 12(1): 26-41.
[27] Dong F, Pei MC, Wang QF, et al. Respiration-induced artifacts and navigator echo correction in gradient echo imaging on human brain.Chin J Magn Reson, 2014, 31(3):321-330.董芳, 裴孟超, 王前鋒, 等. 顱腦梯度回波成像: 呼吸偽影和導航回波矯正. 波譜學雜志, 2014, 31(3): 321-330.
Construction of the probability map of the human deep brain nuclei by quantitative susceptibility mapping
BO Bin-shi1, ZHAI Guo-qiang1, ZHANG Miao1,Wang Yi1,2, LI Jian-qi1*
1Shanghai Key Laboratory of Magnetic Resonance & Department of Physics, East China Normal University, Shanghai 200062, China
2Department of Radiology, Weill Medical College of Cornell University, New York 10022, U S A
*Li JQ, E-mail: jqli@phy.ecnu.edu.cn
Objective: Based on quantitative susceptibility mapping (QSM) technique,an auto-segment probabilistic atlas for the gray matter nuclei in deep brain was established in the present study. Materials and Methods: The QSM data from 15 healthy subjects were acquired on a clinical 3.0 T MRI scanner with a 12 channel matrix head coil. Ten subjects were randomly selected to create a gray matter nuclei atlas of the deep brain, and the remained five subjects were used to evaluate the effectiveness of the atlas. Specifically, the regions of interest (ROI) in six bilateral structures drawn manually by two raters were used as the gold standard, meanwhile,these corresponding ROIs were automatically segmented by three kinds of atlas.To assess the accuracy of proposed segment approach, the probabilistic atlas was compared with both AAL and Johns Hopkins atlas by calculating the Dice coef ficient and the susceptibility values in the auto-segment and manual-segment ROIs,respectively. Results: The Dice coef ficient in our probability atlas was signi ficantly higher than the AAL in the basal ganglia region and the Johns Hopkins atlas in the skull base and cerebellum, respectively. Moreover, the susceptibility values in our probability atlas were more closer to that of manual segment region compared with the other two atlases. Conclusions: The probability atlas based on the QSM images is more reliable than both AAL and Johns Hopkins atlas in the segment of gray matter nuclei of deep brain. This atlas may be effective to improve the ef ficiency of image analysis in the clinical research.
Magnetic resonance imaging; Quantitative susceptibility mapping; Atlas-based segmentation; Deep brain nuclei
Received 19 Dec 2016, Accepted 6 Apr 2017
ACKNOWLEDGMENTSThis study was supported by grant from the National Natural Sciences Foundation (No. 81271533).
國家自然科學基金(編號:81271533)
李建奇,E-mail:jqli@phy.ecnu.edu.cn
2016-12-19
接受日期:2017-04-06
R445.2;R741
A
10.12015/issn.1674-8034.2017.05.010
薄斌仕, 翟國強, 張苗, 等. 基于定量磁化率成像人腦深層灰質核團概率性圖譜的構建. 磁共振成像, 2017, 8(5):367-373.

