例題解析如何掌握影響電極電勢的因素
董寶霞
(揚州大學 化學化工學院,江蘇 揚州225002)
●數理教研
例題解析如何掌握影響電極電勢的因素
董寶霞
(揚州大學 化學化工學院,江蘇 揚州225002)
本文從濃度(分壓)、pH值、生成難溶電解質、弱電解質及配合物五個角度,針對影響電極電勢的因素及四大平衡之間的關系由淺入深,逐一舉例解析,挖掘影響電極電勢的實質,以期讓讀者深刻理解四大平衡之間的聯系、掌握及的運算.
電極電勢;無機化學;氧化還原反應;化學平衡
電極電勢(E)是無機化學中一個非常重要的概念,具有廣泛的應用,某一電對的E值大小反映出電對中氧化型、還原型物質在水溶液中氧化、還原能力的強弱.因此,利用某條件下有關電對的E值大小,可以計算組成原電池的電動勢和相應的氧化還原反應的摩爾吉布斯函數變,比較氧化劑和還原劑的相對強弱,判斷某一指定的氧化還原反應進行的方向和反應進行的程度等.影響電極電勢的因素眾多,在第四章氧化還原反應與應用電化學中接觸到濃度(分壓)、酸度、生成難溶電解質及生成弱電解質對電極電勢的影響[1],即沉淀平衡、酸堿平衡與氧化還原平衡之間的聯系,而在第八章配合物的結構和性質部分又引申出配位平衡與氧化還原平衡之間的聯系.由于這部分內容復雜、抽象[2],我們在無機化學課程授課過程中發現很多學生在學習過程中感覺很難接受,大一學生尤其對難溶鹽電極、配合物電極電極電勢的計算不能理解,涉及此類問題時難以深入.因此,本文針對影響電極電勢的因素及四大平衡之間的關系由淺入深,逐一舉例解析,以期將此問題分析透徹.

此式稱為電池反應的能斯特方程式(Nernst equation),其中
任何一個原電池總可以分解為兩個半電池,每個半電池各由一對氧化還原電對組成一個電極.組成原電池的正、負電極的電極電勢差值就是原電池的電動勢(EMF),即為標準狀態下的某一電對的電極電勢值,這里標準態的定義需要明確(標準態是指組成電對的物質皆為純物質,相關物質的濃度為1mol·L-1,若涉及氣體,氣體的分壓為100kPa).若為任一指定狀態,則EMF=E(正)–E(負).
對于電極反應,氧化型+ze–?還原型,當R=8.314J·K-1·mol-1,F=96485J·V-1,T=298.15K時,公式可以簡化成,這一表達式明確表明任意狀態與標準狀態下電極電勢之間的關系.因此,判斷影響電極電勢的因素的前提是正確寫出氧化還原電對的電極反應.
1 濃度(分壓)對電極電勢的影響

解析電極反應式的書寫至關重要,由以上幾個例子可以看出,濃度(分壓)對電極電勢的影響體現在對數項中.針對例3,當c(Co3+):c(Co2+)分別為1:1,10:1和1:10時(表1),計算得到E(Co3+/Co2+)的值分別為1.92,2.04和1.86V;可見,若[氧化型]/[還原型]比值越大,該電對的電極電勢值越大,表示氧化型物質的氧化能力越強;若[氧化型]/[還原型]比值越小,該電對的電極電勢值越小,表示還原型物質的還原能力越強.

表1 不同c(Co3+):c(Co2+)濃度比例下的E(Co3+/Co2+)值
2 酸度(pH值)對電極電勢的影響
對于有H+或OH-參與的電極反應,溶液的酸度往往對電對的電極電勢有較大的影響,例如:
例4已知
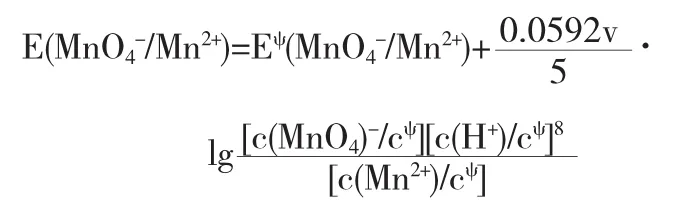

可見,c(H+)越大,E值越大,即含氧酸鹽在酸性介質中其氧化性增強.c(H+)每增大10倍,E(MnO4-/Mn2+)值增加0.09V.
例5已知

同理,若c(Cr2O72-)=c(Cr3+)=1.0mol·L-1,c(H+)每增大10倍,E(Cr2O72-/Cr3+)的值增大0.14V.
3 生成難溶電解質對電極電勢的影響,即沉淀平衡與氧化還原平衡之間的聯系
例6已知在含有Ag+/Ag電對體系中,加入NaCl溶液,使溶液中c(Cl-)=1.0mol·L-1,計算E(Ag+/Ag)=?
解析此過程中由于Cl-的加入,導致沉淀反應Ag+(aq)+Cl-(aq)?AgCl(s)↓的發生,從而改變了Ag+的濃度,因此E(Ag+/Ag)的計算需要考慮變化之后的Ag+的濃度,該濃度可通過新建立起來的沉淀平衡來確定.
在新的Ag+的濃度條件下建立起來的電極電勢,
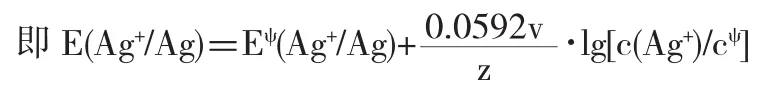
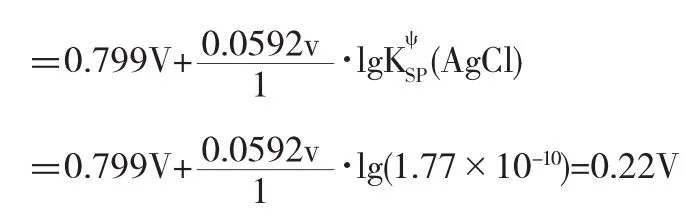
顯然,沉淀的生成使c(Ag+)減小,該電對E(Ag+/Ag)的電極電勢也顯著減小,Ag+氧化能力顯著降低.在新的平衡條件下,若c(Cl-)=1.0mol·L-1,則建立起來的電對相當于Eψ(Ag-Cl/Ag),即E(Ag+/Ag)=Eψ(AgCl/Ag),對應于電極反應:AgCl(s)+e-?Ag(s)+Cl-(aq).
引申:若向其中加入其它沉淀劑離子如Br-,I-,同理計算,結果如下:

表2 不同沉淀劑離子作用下的的E(Ag+/Ag)值
可見,同種離子的不同難溶鹽電對Eψ(AgX/Ag),隨著難溶鹽電解質的減小而減小.
例7已知Eψ(PbSO4/Pb)=-0.356V,Eψ(Pb2+/Pb)=-0.125V,計算
解析此題是例6的一個變型.
對于電極反應Pb2+(aq)+2e-?Pb(s),Eψ(Pb2+/Pb)=-0.125V,
電對Eψ(PbSO4/Pb)對應的電極反應:PbSO4(s)+2e-?Pb(s)+SO42-(aq),
在任意指定狀態下:E(PbSO4/Pb)=Eψ(PbSO4/Pb)+
如果將此兩個電對組成原電池,在達到平衡狀態時,E(Pb2+/Pb)=E(PbSO4/Pb)

同理:對于氧化型和還原型物質都形成難溶電解質的體系,如Eψ{Fe(OH)3/Fe(OH)2}與Eψ(Fe3+/Fe2+)的關系,我們可以推導得出[3]:
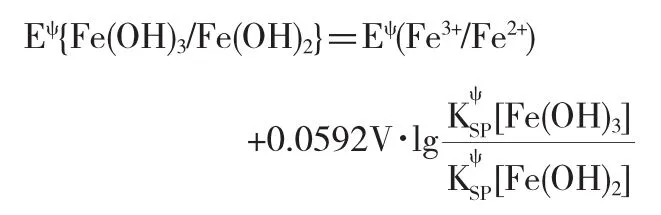
4 生成弱電解質對電極電勢的影響,即電離平衡與氧化還原平衡之間的聯系
例8在含有H+/H2電對的體系中,加入NaOAc溶液,使溶液中c(HOAc)=c(OAc-)=1.0mol·L-1,p(H2)=1.0×105Pa,計算:E(H+/H2)=?
解析弱電解質的生成對電極電勢的影響也是通過改變離子濃度實現的.在此過程中,由于HOAc是一種弱電解質,其在溶液中存在如下電離平衡:
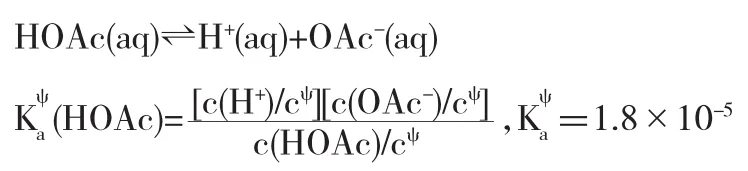
OAc-的加入會與溶液中的H+結合形成HOAc分子,消耗了溶液中的H+,使得E(H+/H2)偏離
對于電極反應:2H+(aq)+2e-?H2(g)(已知
在任意指定狀態下:
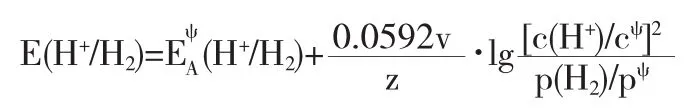
因此,c(H+)的計算是解題關鍵.當體系達到動態平衡后,若c(HOAc)=c(OAc-)=1.0mol·L-1,則c(H+)可通過電離平衡關系式求得,即:

由于弱酸(HOAc)的生成,使c(H+)減小,E(H+/H2)值減小,H+的氧化能力降低,此時的電極反應相當于:2HOAc(aq)+2e-?H2(g)+2OAc-(aq)
即E(H+/H2)=Eψ(HOAc/H2)=-0.28V
例10已知
解析此題是例9的一個變型電對中包含一種弱電解質,它代表當溶液中c(HCN)=c(CN-)=1.0mol·L-1,并且p(H2)=pψ時的電極電勢:
電極反應:2HCN(aq)+2e-?H2(g)+2CN-(aq)
相當于向含有H+/H2電對體系中加入CN-使其形成HCN從而改變c(H+),HCN(aq)?H+(aq)+CN-(aq),當達到平衡后,即

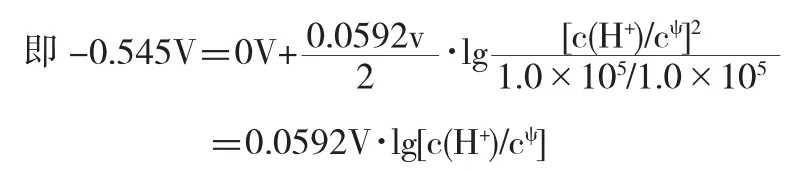
綜上,對于包含弱電解質的電對體系,必須抓住電極電勢產生的本質,即找到電極反應是由誰得失電子決定的,無論是HCN還是HOAc,Eψ(HCN/H2)或Eψ(HOAc/H2)的大小本質上是由一定濃度的H+得電子決定的,即因此,只有抓住本質,建立起正確的聯系,才能求解.
5 生成配合物對電極電勢的影響,即配位平衡與氧化還原平衡之間的聯系
例11已知半電池中,加入氨水,當c(NH3)=1.0mol·L-1,c{Cu(NH3)4]2+}=1.0mol·L-1時,E(Cu2+/Cu)=?并求Eψ{Cu(NH3)4]2+/Cu}=?
解析向Cu2+/Cu半電池中加入氨水,由于存在配位平衡:Cu2+(aq)+4NH3(aq)?[Cu(NH3)4]2+(aq),形成了[Cu(NH3)4]2+配離子,改變了溶液中的c(Cu2+),從而實現了對電極電勢的影響.
對于電極反應:[Cu(NH3)4]2+(aq)+2e-?Cu(s)+4NH3(aq)
Eψ{[Cu(NH3)4]2+/Cu}代表當溶液中c{Cu(NH3)4]2+}=1.0mol·L-1,c(NH3)=1.0mol·L-1時,電對[Cu(NH3)4]2+/Cu的標準電極電勢,由前述的例證不難得到Eψ{[Cu(NH3)4]2+/Cu}相當于新的平衡條件下的E(Cu2+/Cu),

求解的關鍵是在新的平衡狀態下,c(Cu2+)由誰決定?
由于c(NH3)=1.0mol·L-1,c{Cu(NH3)4]2+}=1.0mol·L-1,

即Eψ{[Cu(NH3)4]2+/Cu}=-0.026V<Eψ(Cu2+/Cu)
上述計算說明,配離子[Cu(NH3)4]2+的形成,即氧化型物種形成配離子,使得Cu的還原能力增強,E減小.
引申:若還原型物種形成配離子,如[CuI2]-,相應的電對Eψ{Cu2+/[CuI2]-}與Eψ(Cu2+/Cu+)相比,何者大?已知
同理計算:Cu+(aq)+2I-(aq)?[CuI2]-(aq)
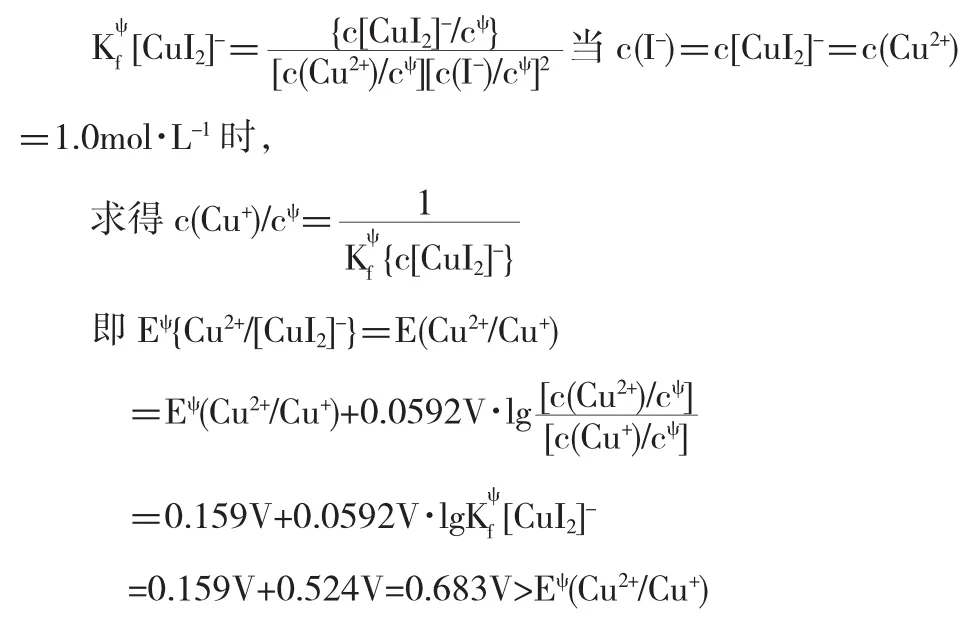
上述計算說明,配離子[CuI2]-的形成,即還原型物種形成配離子,使得Cu2+的氧化能力增強,E增大.
引申:若氧化型和還原型都形成配合物,如何比較呢?見例12.
例12已知
解析此題求解的關鍵是將兩個電對Eψ(Co3+/Co2+)和Eψ([Co(NH3)6]3+/[Co(NH3)6]2+)的聯系建立起來,比如設計一原電池:

現在的關鍵是求解電池反應:Co3++[Co(NH3)6]2+?Co2++[Co(NH3)6]3+的Kψ
由配位平衡:
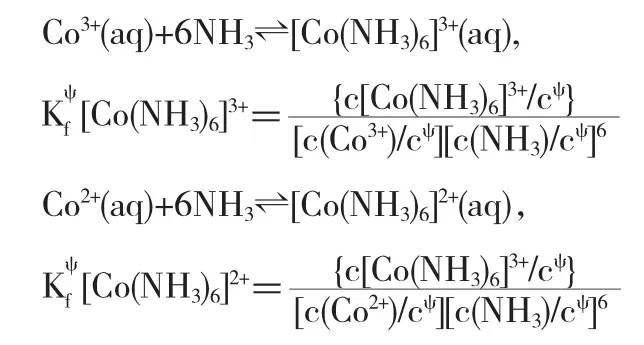

即[Co(NH3)6]2+的還原性比Co2+強;而Co3+的氧化性比[Co(NH3)6]3+強.
即對于電池反應:Co3++[Co(NH3)6]2+?Co2++[Co(NH3)6]3+

綜上所述,判斷影響電極電勢的因素中最關鍵的問題是把握住電極電勢產生的本質[4],正確書寫出電極反應的能斯特方程表達式,而最核心的問題則是對數項中相應濃度的計算.沉淀、弱電解質和配合物的生成均可以通過改變離子濃度來實現對電極電勢的影響,結合相應的化學平衡常數及的表達式,則可以建立起與相應離子濃度的聯系,從而得以求解.
〔1〕天津大學無機化學教研室.無機化學[M].北京:高等教育出版社,2010.97-105.
〔2〕北京師范大學,華中師范大學,南京師范大學.無機化學[M].北京:高等教育出版社,2002.349-367.
〔3〕大連理工大學無機化學教研室.無機化學[M].北京:高等教育出版社,2006.
〔4〕劉雷芳,王新芳.濃度對電極電勢的影響[J].德州學院學報,2015(31):15–17.
O646.23
A
1673-260X(2017)09-0001-04
2017-07-14

