產NDM-1型碳青霉烯酶肺炎克雷伯菌兒童血流感染的臨床特征及細菌耐藥性分析
張 燁, 董 方, 宋文琪, 郭凌云, 王 艷,劉 鋼
產NDM-1型碳青霉烯酶肺炎克雷伯菌兒童血流感染的臨床特征及細菌耐藥性分析
張 燁, 董 方*, 宋文琪*, 郭凌云, 王 艷*,劉 鋼
目的研究產NDM-1型碳青霉烯酶肺炎克雷伯菌兒童血流感染的臨床特征及細菌耐藥性。方法收集首都醫科大學附屬北京兒童醫院2011年1月-2014年8月住院患兒血培養分離的非重復耐碳青霉烯類肺炎克雷伯菌(CRKp);用微量肉湯稀釋法測定15種抗菌藥物的MIC值;采用PCR法確定產NDM-1菌株;回顧分析病歷資料了解感染產NDM-1菌株患兒的臨床特征,并與感染非產NDM-1菌株患兒進行比較。結果52株CRKp中共檢出28株產NDM-1菌株。產NDM-1菌株組均為多重耐藥菌,對青霉素、頭孢菌素和哌拉西林-他唑巴坦的耐藥率達100%(28/28),對氨曲南、甲氧芐啶-磺胺甲唑及慶大霉素的耐藥率均>75%,對亞胺培南和美羅培南的耐藥率分別為100%(28/28)、92.9%(26/28)。產NDM-1菌株中碳青霉烯類高MIC值的菌株比例高于非產NDM-1菌株。產NDM-1菌株組的患兒中, 82.1%( 23/28)來自血液病房,常見基礎疾病為血液系統惡性腫瘤(78.6%,22/28),20例(76.4%)患兒存在中性粒細胞缺乏伴發熱;產與非產NDM-1肺炎克雷伯菌血流感染患兒相比,反復住院(P=0.202)、近期使用抗菌藥物(P=0.615)、常見基礎疾病(P=0.856)以及深靜脈置管(P=0.099)方面差異無統計學意義。明確肺炎克雷伯菌感染后,37例患兒接受了碳青霉烯類藥物聯合敏感藥物治療。產NDM-1菌株組病死率與非產NDM-1菌株組相比無明顯差異(2/28 對 3/24;P=0.625)。結論該院已出現產NDM-1肺炎克雷伯菌株,呈逐年增長趨勢,此類細菌呈多重耐藥,碳青霉烯類高MIC值的菌株所占比例高,臨床特征上與非產NDM-1菌無明顯區別。
新德里金屬β內酰胺酶-1; 肺炎克雷伯菌; 血流感染; 兒童; 碳青霉烯類抗生素
Abstract: ObjectiveTo investigate the clinical characteristics and antibiotic resistance of the bloodstream infections due to NDM-1 producingKlebsiella pneumoniaein children.MethodsThe nonduplicate carbapenem-resistantKlebsiella pneumoniae(CRKp) strains isolated from blood samples were collected in Beijing Children’s Hospital from January 2011 to August 2014.Antimicrobial susceptibility was tested with broth microdilution method. PCR ampli fi cation and DNA sequencing were conducted targetingblaNDM-1genes. Medical records were reviewed and analyzed.ResultsOf the 52 CRKp strains,blaNDM-1gene was detected in 28 strains. All NDM-1-producing strains were multidrug-resistant. All the 28 isolates were resistant to penicillin, cephalosporins,piperacillin-tazobactam, and imipenem. More than 75.0% of these NDM-1-producing strains were resistant to aztreonam,trimethoprim-sulfamethoxazole, gentamicin, and meropenem (92.9%, 26/28). NDM-1-producing isolates had higher carbapenem MICs than non-NDM-1-producing isolates. Most (82.1%,23/28) of the NDM-1-producing isolates were isolated from hematology-oncology ward. The most common underlying disease was hematologic malignancy (78.6%, 22/28). Febrile neutropenia was found in 20 (71.4%) patients. No difference was found between NDM-1-producing and non-NDM-1-producing CRKp infection in terms of repeated hospitalization (P=0.202), prior antibiotic use (P=0.615), underlying diseases(P=0.856), and deep venous catheter (P=0.099). After the susceptibility results were available, 37 patients received carbapenembased combination regimen. The mortality did not show difference between NDM-1 producing CRKp infections and non-NDM-1-producing CRKp infections, 7.1% (2/28) vs. 12.5% (3/24),P=0.625.ConclusionsThe NDM-1 carbapenemase producingKlebsiella pneumoniaeis emerging in this hospital. NDM-1-producing strains are resistant to multiple antimicrobial agents, associated with higher carbapenem MIC value. However, no difference was found in the clinical features between the bloodstream infections due to NDM-1-producing strain and those due to non- NDM-1-producing strains.
Key words:NDM-1;Klebsiella pneumoniae; bloodstream infection; children; carbapenem antibiotics
2009年,Yong 等[1]在1例新德里旅游的印度裔瑞典患者尿液中分離出1株產新德里金屬β內酰胺酶-1(NDM-1)肺炎克雷伯菌 ,此后產NDM-1的細菌在世界各地陸續被檢出。2011年,我國香港首次發現1株產NDM-1酶大腸埃希菌[2],隨后,國內多地在不同菌種中檢出NDM-1[3]。NDM-1酶屬于B類金屬酶,能夠水解除氨曲南外的所有β內酰胺類抗菌藥物,包括碳青霉烯類藥物[4]。近年來,攜帶blaNDM-1基因的肺炎克雷伯菌日益增多,引起的血流感染已成為醫院感染的重要問題,對患者的生命構成嚴重威脅[5-6]。在國內,已有報道產NDM-1肺炎克雷伯菌在兒科病房暴發流行[7-8]。本研究對碳青霉烯類耐藥肺炎克雷伯菌(carbapenem-resistantKlebsiella pneumoniae,CRKp)進行blaNDM-1基因檢測,分析這些菌株的耐藥特性、患兒的臨床特征以及產與非產NDM-1肺炎克雷伯菌之間有無不同。
1 材料與方法
1.1 材料來源
共收集北京兒童醫院2011年1月-2014年8月血培養陽性患兒分離的52株非重復CRKp。CRKp的定義為對碳青霉烯類抗菌藥物亞胺培南或美羅培南至少一種不敏感(MIC≥2 mg/L)的肺炎克雷伯菌。收集患兒病歷資料,包括一般情況、治療及臨床結局。
1.2 藥敏試驗
按照CLSI 2014年推薦的微量肉湯稀釋法測定抗菌藥物的MIC值[9]。統一進行15種抗菌藥物MIC的測定,包括慶大霉素、阿米卡星、左氧氟沙星、環丙沙星、氨曲南、氨芐西林、頭孢唑林、頭孢他啶、頭孢噻肟、頭孢吡肟、亞胺培南、美羅培南、阿莫西林-克拉維酸、哌拉西林-他唑巴坦和甲氧芐啶-磺胺甲唑。質控菌株為大腸埃希菌ATCC25922,肺炎克雷伯菌ATCC BAA-1705。使用WHONET5.6軟件對MIC結果進行耐藥性分析。
1.3 碳青霉烯酶基因型PCR檢測
檢測blaNDM-1基因的引物參照文獻[10]。各引物由天一輝遠生物科技有限公司合成。PCR反應產物委托該公司純化、測序,測得的碳青霉烯酶基因序列,在GenBank中Blast (http://www.ncbi.nlm.nih.gov/blast)進行同源分析。
1.4 統計學分析
計數資料使用數字和百分比描述,組間比較使用χ2檢驗或Fisher精確檢驗,計量資料使用中位數和四分位數描述,組間比較使用Mann-WhitneyU檢驗;使用SPSS 17軟件進行統計分析。
2 結果
2.1 blaNDM-1基因檢測結果
共分離52株CRKp。blaNDM-1基因檢測結果28株陽性(PCR產物電泳圖見圖1)。其中23株來自血液病房,4株來自新生兒病房(包括3例NICU),1株來自心外科病房。產與非產NDM-1菌株在各年份的分布見圖2。
圖1 PCR擴增NDM-1基因產物電泳圖Figure 1 Representative electrophoretogram of PCR products targetingblaNDM-1gene
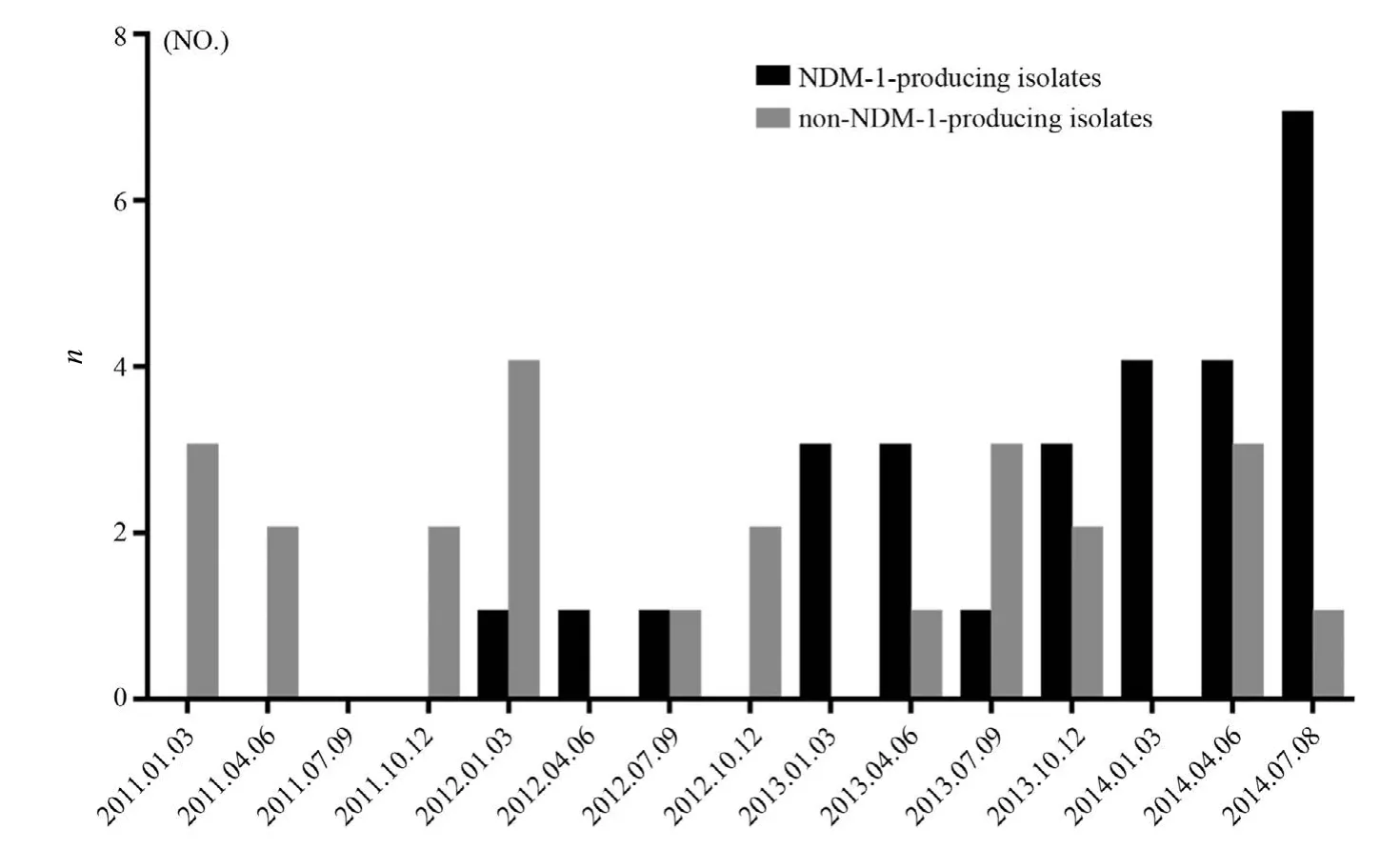
圖2 2011-2014年耐碳青霉烯類肺炎克雷伯菌季度分布圖Figure 2 The quarterly distribution of carbapenem-resistantKlebsiella pneumoniaeisolates during the period from 2011 to 2014
2.2 菌株耐藥情況
52株細菌均為多重耐藥菌,對氨芐西林、頭孢噻肟、頭孢他啶、頭孢唑林、阿莫西林-克拉維酸耐藥率達100%(52/52),對亞胺培南和美羅培南的耐藥率分別為90.4%(47/52)、82.7%(43/52),僅對阿米卡星(3/52)、左氧氟沙星(4/52)、環丙沙星(5/52)耐藥率低。碳青霉烯類藥物對52株細菌的MIC值不盡相同,產NDM-1菌株碳青霉烯類藥物的MIC值較高,MIC≥8 mg/ L,亞胺培南占89.3%(25/28)、美羅培南75.0%(21/28),而非產NDM-1菌株高MIC值的菌株所占比例相對偏低,均為62.5%(產與非產NDM-1菌株對亞胺培南耐藥率差異P=0.022,對美羅培南P=0.33);產與非產NDM-1菌株的耐藥情況見圖3,與非產NDM-1菌株組相比,產NDM-1菌株組對環丙沙星的敏感率高(P=0.039),對哌拉西林-他唑巴坦及亞胺培南的耐藥率高(P<0.001及P=0.016)。
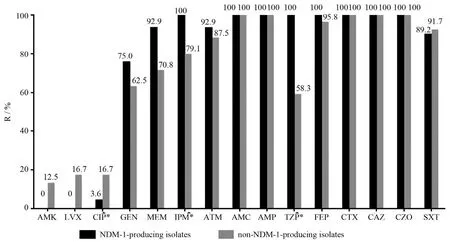
圖3 耐碳青霉烯類肺炎克雷伯菌對15種抗菌藥物的耐藥率Figure 3 Resistance rate of 52 carbapenem-resistantKlebsiella pneumoniaestrains to 15 antimicrobial agents
2.3 患兒一般情況
28例產NDM-1肺炎克雷伯菌血流感染的患兒中,男20例,女8例,年齡中位數為5.0歲(四分位數間距:1.0~9.3歲)。23例(82.1%)來自血液病房,4例來自新生兒病房(包括3例NICU),1例來自心外科病房,中位住院天數為19 d(1~55 d)。22例(78.6%)患兒有近3個月反復住院史。18例患兒在近3個月有抗生素使用史,使用的抗菌藥物種類從2種到8種不等。20例患兒為醫院獲得性感染[11],8例患兒為醫療相關性感染,無社區獲得性感染。基礎疾病包括:22例血液系統惡性腫瘤,1例神經母細胞瘤,1例早產,1例先天性心臟病。89.3%(25/28)的患兒進行了深靜脈置管(包括外周導入中心靜脈置管、臍靜脈置管)。92.9%(26/28)的患兒感染首發癥狀為發熱,其中76.9%(20/26)的患兒在化療期間出現中性粒細胞缺乏伴發熱[12];另外2例患兒(2/28)1例首發癥狀為呼吸暫停,1例為感染性休克表現。3例患者出現嚴重膿毒血癥,其中1例心外科的患兒在先天性心臟病手術后合并感染性休克而死亡。4例出現多重耐藥菌感染的患兒(包括銅綠假單胞菌、陰溝腸桿菌、唾液鏈球菌、屎腸球菌、奇異變形桿菌)中,1例放棄治療,1例死亡。28例產NDM-1肺炎克雷伯菌血流感染患兒與24例非產NDM-1肺炎克雷伯菌血流感染患兒臨床特征比較見表1,兩組在年齡、性別、基礎疾病、感染前3個月反復住院、感染前3個月抗菌藥物使用史、科室分布以及臨床表現上差異無統計學意義,僅在住院天數上差異有統計學意義(P=0.007)。
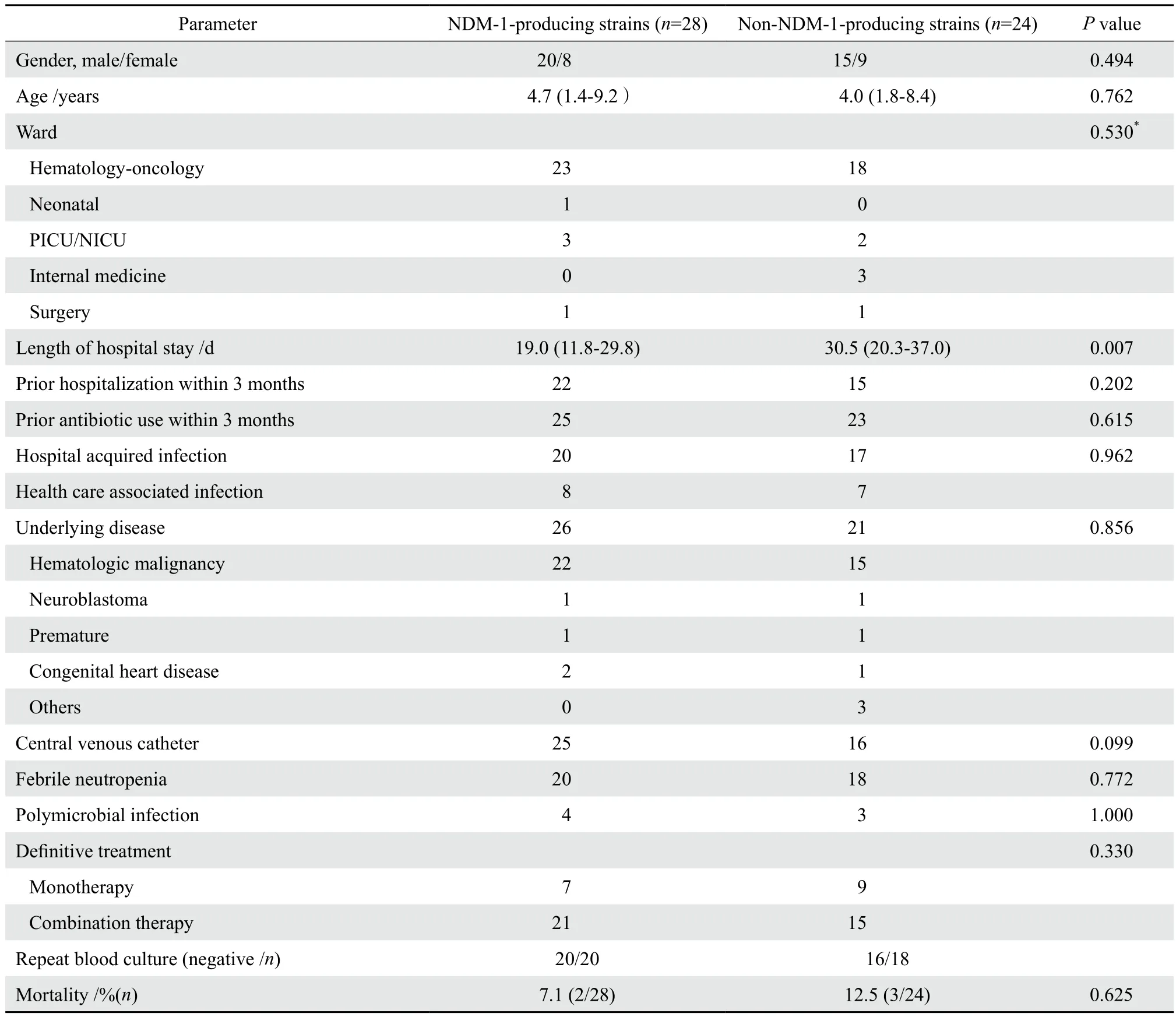
表1 碳青霉烯類耐藥肺炎克雷伯菌血流感染患兒的臨床特征Table 1 Clinical characteristics of patients with bloodstream infection due to carbapenem-resistantKlebsiella pneumoniae
2.4 抗菌藥物治療及臨床結局
在明確肺炎克雷伯菌感染前所有患兒均使用了抗菌藥物(表2),其中使用較多的是β內酰胺類-β內酰胺酶抑制劑復合劑和碳青霉烯類(美羅培南、亞胺培南),而氨基糖苷類(阿米卡星)和喹諾酮類(左氧氟沙星)僅占少數。在明確肺炎克雷伯菌感染后,37例患兒使用包含碳青霉烯類藥物的聯合治療,30例患兒使用包含阿米卡星的聯合治療,這些患兒均未出現腎功能不全等藥物不良反應。產NDM-1肺炎克雷伯菌血流感染患兒中,死亡2例(1例血液科患兒和1例心外科患兒),這2例患兒均僅使用了不敏感的單藥[美羅培南(MIC: 4 mg/L)、頭孢哌酮-舒巴坦]治療;非產NDM-1肺炎克雷伯菌血流感染患兒中,死亡3例(2例血液科患兒和1例心外科患兒),3例患兒均僅使用單藥治療(美羅培南),其中2例患兒血培養分離菌株對美羅培南的MIC值均>8 mg/L。產與非產NDM-1組在治療和臨床結局上差異并無統計學意義。見表1。
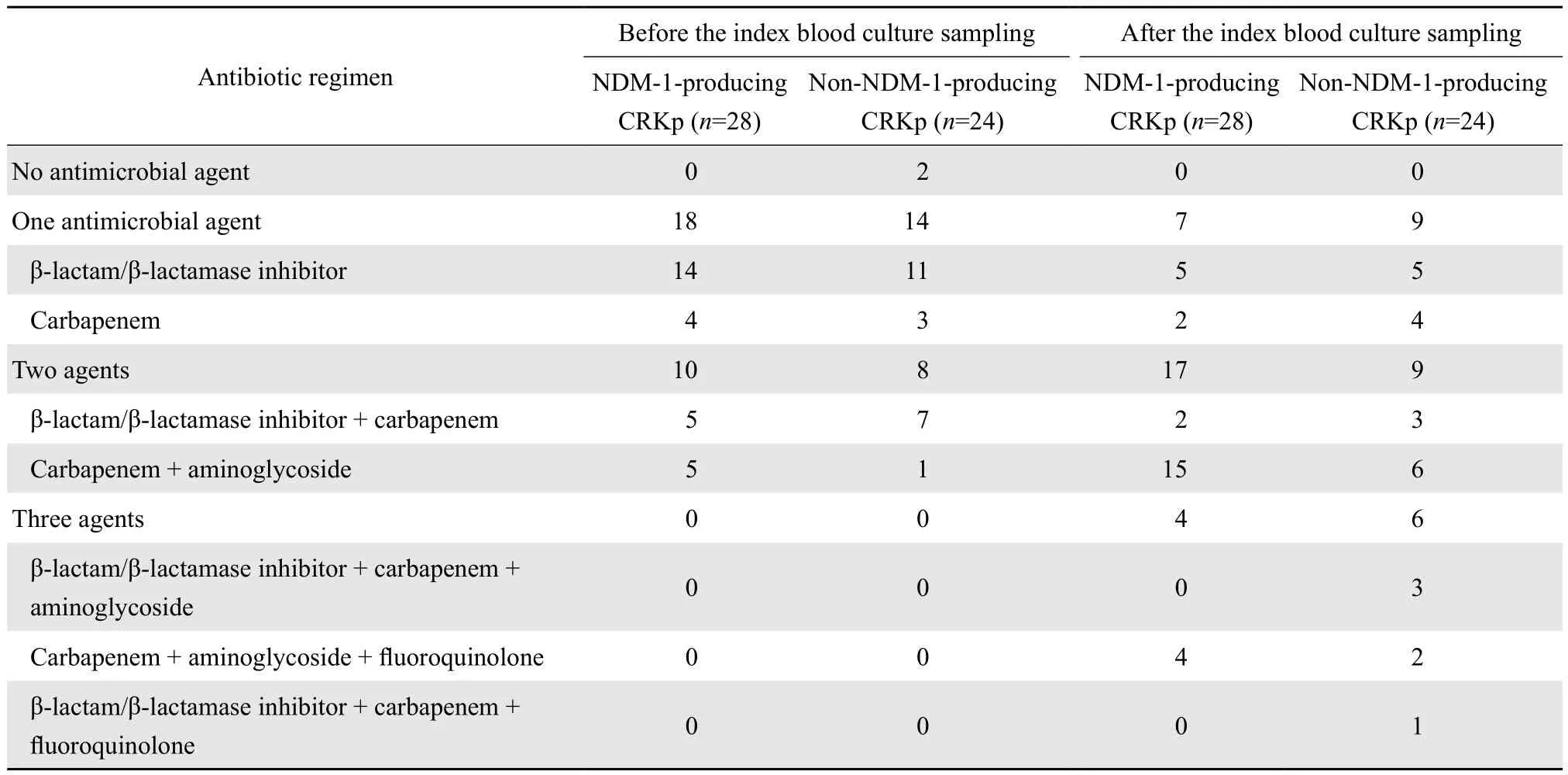
表2 碳青霉烯類耐藥肺炎克雷伯菌血流感染患兒抗菌藥物使用情況Table 2 Antimicrobial treatment administered to patients with bloodstream infection due to carbapenem-resistantKlebsiella pneumoniae
3 討論
肺炎克雷伯菌可引起尿路、血液、肺部等多種感染,產NDM-1肺炎克雷伯菌引起的感染由于細菌的廣泛耐藥性使得臨床治療十分棘手。有學者綜述國內文獻發現兒童是感染產NDM-1細菌的易感人群[3]。目前關于兒童產NDM-1細菌感染的報道多為尿路感染,且多集中在流行病學及分子學特征,而對于攜帶blaNDM-1基因的肺炎克雷伯菌所致兒童血流感染的臨床特征及治療描述較少[7-8]。
本研究從2011年1月至2014年8月住院患者血培養中共分離出52株CRKp菌株,從中檢測出28株產NDM-1肺炎克雷伯菌,在2012年以前,本院血液分離肺炎克雷伯菌主要為產IMP-4的菌株,未發現產NDM-1肺炎克雷伯菌[13],自2012年1月份從血液中分離出第一株開始,產NDM-1肺炎克雷伯菌呈逐年上升趨勢,并逐漸成為主要菌株,非產NDM-1肺炎克雷伯菌則呈全年散發分布,然而同時期中國流行的CRKp的基因型為blaKPC-2[14],這可能與兒童這一特殊人群有關,具體原因需進一步研究。我院產NDM-1肺炎克雷伯菌的耐藥譜整體趨勢與王盛書等[3]總結的相符,但對阿米卡星、左氧氟沙星、環丙沙星的耐藥率要明顯偏低,考慮其原因可能為本研究的對象為兒童,這3種藥在兒童中并不常用,而在成人屬常用藥,因此其耐藥率存在差異。通過對患兒臨床信息總結發現,52例CRKp血流感染患兒中57.7%患有血液系統腫瘤,這些患兒大都有長期反復住院史、近期使用抗菌藥物史及深靜脈置管史,并且在化療期間出現中性粒細胞缺乏伴發熱,然而產NDM-1與非產NDM-1肺炎克雷伯菌血流感染患兒相比,在反復住院、深靜脈置管、近期使用抗菌藥物方面以及所患基礎疾病并無統計學差異,亦有研究發現,無論是產NDM-1細菌還是產IMP-4細菌,深靜脈置管均為其引起血流感染的危險因素[15]。因此對于CRKp來說,無論是何種耐藥機制,長期反復住院、抗菌藥物長期反復使用以及深靜脈置管均為其引起血流感染的危險因素[16-17]。在臨床特征方面,兩組患兒除住院時間有差異外,余未見明顯不同。de Jager 等[15]回顧性分析病例發現產NDM-1革蘭陰性菌感染者住院時間明顯長于非產NDM-1菌感染者,而本研究中產NDM-1肺炎克雷伯菌血流感染患兒的總體住院時間要短于非產NDM-1組,原因需進一步研究。
目前臨床上針對CRKp的治療藥物仍非常有限,大多數數據來自回顧性病例,缺乏強有力的依據,本研究中CRKp菌株均為多重耐藥菌,僅對阿米卡星、左氧氟沙星、環丙沙星敏感,應用這些敏感藥物及包含碳青霉烯類藥物聯合治療的患兒均好轉出院,且未出現腎功能不全及軟骨毒性等藥物不良反應,值得注意的是,死亡的5例患兒均使用單藥治療,但由于嚴重的基礎疾病對預后也有影響[18],所以尚不能判斷本研究中聯合治療或單藥治療對結局的影響有無區別。死亡病例中有3例患兒分離細菌對美羅培南的MIC值≥4 mg/L,有研究報道美羅培南的MIC值與患兒病死率密切相關[19],然而由于本研究樣本量的限制,尚無法判斷美羅培南MIC值與死亡率之間的關系。多項研究證明在治療CRKp血流感染患者時,即使是在碳青霉烯類耐藥的情況下,包含碳青霉烯類藥物的聯合治療要好于單藥及其他藥物的聯合治療[18,20-21];另外,對于CRKp感染來說,若碳青霉烯類藥物的MIC值≤8 mg/L時,可以使用高劑量美羅培南以及延長輸注時間[22-24],而美羅培南的MIC值> 8 mg/L時,使用高劑量及延長輸注時間治療CRKp血流感染效果減弱[25]。本研究中菌株對碳青霉烯類藥物的MIC值較高,60%~90%菌株MIC值≥8 mg/L,故聯合治療可能效果更佳。本研究中CRKp菌株對阿米卡星的敏感度高,進行聯合治療后大多取得良好結局,有文獻報道對于CRKp所致血流感染,單用氨基糖苷類藥物即可有效[23]。另外臨床醫師在治療產NDM-1組和非產NDM-1組患兒時用藥方面并無差異,且二者結局也無差異,因此在治療CRKp血流感染時,無論何種耐藥機制,選擇敏感藥物以及進行聯合治療均為有效治療手段。共識[12]中推薦聯合治療的基礎用藥為替加環素和多黏菌素,但由于在研究階段本院尚未引入替加環素以及微生物室對肺炎克雷伯菌的藥敏試驗中不包括這兩種藥物,故無法對其分析。
本研究中分離的菌株多來自同一病房,但由于未做多位點序列分型和脈沖場凝膠電泳,所以無法觀察分離自同一病房菌株之間的同源性以及菌株的流行情況。然而產NDM-1肺炎克雷伯菌菌株數量的增加提示可能存在克隆菌株在病房內的流行傳播,而且碳青霉烯耐藥基因多位于質粒上,容易導致耐藥質粒在不同種屬細菌間轉移,使敏感株轉為耐藥株,繼而在醫院內播散流行,另外使用既往不常用的藥物將會篩選出耐藥譜更廣的細菌,這將對患兒的治療和預后構成嚴重威脅。因此在檢驗出產NDM-1型碳青霉烯酶細菌的病房,醫務人員應積極做好手衛生措施以及對患兒進行接觸隔離以防止交叉感染,有條件時可以劃分隔離病房來更好地防止產NDM-1碳青霉烯酶細菌在病區內傳播及流行。
綜上所述,本院血培養分離出的產NDM-1肺炎克雷伯菌占CRKp總數的半數以上,呈逐年上升趨勢。產NDM-1菌與非產NDM-1菌均為多重耐藥菌,產NDM-1菌中高MIC值的菌株比例較高。產NDM-1與非產NDM-1肺炎克雷伯菌血流感染患兒在臨床特征上無明顯區別。醫院內攜帶產NDM-1肺炎克雷伯菌數量的增多需引起重視,需積極采取嚴格的監控及有力的感控措施以防出現大范圍的暴發流行。
[1] YONG D, TOLEMAN MA, GISKE CG, et al. Characterization of a new metallo-beta-lactamase gene, bla(NDM-1), and a novel erythromycin esterase gene carried on a unique genetic structure inKlebsiella pneumoniaesequence type 14 from India[J]. Antimicrob Agents Chemother,2009,53(12):5046-5054.
[2] HO PL, LO WU, YEUNG MK, et al. Complete sequencing of pNDM-HK encoding NDM-1 carbapenemase from a multidrugresistantEscherichiacolistrain isolated in Hong Kong[J]. PLoS One,2011,6(3):e17989.
[3] 王盛書,孫金柱,蘇文莉,等. 我國攜帶 NDM-1基因耐藥菌流行現況分析[J]. 軍事醫學,2015,39(11):825-830.
[4] NORDMANN P, POIREL L, WALSH T R, et al. The emerging NDM carbapenemases[J]. Trends Microbiol,2011,19(12):588-595.
[5] BORER A, SAIDEL-ODES L, RIESENBERG K, et al.Attributable mortality rate for carbapenem-resistantKlebsiella pneumoniaebacteremia[J]. Infect Control Hosp Epidemiol,2009,30(10):972-976.
[6] 王蓮慧,魏丹丹,劉洋,等. 血流感染中肺炎克雷伯菌的分布及耐藥性分析[J]. 實驗與檢驗醫學,2016,34(1):27-28.
[7] 張麗萍,劉杰,孟冬婭,等. 我國北方地區部分醫院產新德里金屬β-內酰胺酶腸桿菌分子流行病學研究[J]. 沈陽藥科大學學報,2015,32 (10):808-813.
[8] JIN Y, SHAO C, LI J, et al. Outbreak of Multidrug Resistant NDM-1-ProducingKlebsiella pneumoniaefrom a Neonatal Unit in Shandong Province, China[J]. PLoS One,2015,10(3):e119571.
[9] CLSI. Performance standards for antimicrobial susceptibility testing[S]. Twenty-fourth informational supplement,2014,M100-S24.
[10] 楊銀梅,葉惠芬,張偉紅,等. 臭鼻克雷伯和鮑曼不動桿菌中檢出NDM-1型金屬β內酰胺酶基因[J]. 國際檢驗醫學雜志,2011,32(13):1407-1409.
[11] 中華人民共和國衛生部. 醫院感染診斷標準(試行)[J]. 中華醫學雜志,2001,81(5):314-320.
[12] 中華醫學會血液學分會,中國醫師協會血液科醫師分會. 中國中性粒細胞缺乏伴發熱患者抗菌藥物臨床應用指南(2016年版)[J]. 中華血液學雜志,2016,37(5):353-359.
[13] 董方,宋文琪,徐樨巍,等. 對碳青霉烯類抗生素不敏感腸桿菌科細菌產碳青霉烯酶基因型研究[J]. 中國感染與化療雜志,2013,13(4):270-274.
[14] GUAN X, HE L, HU B, et al. Laboratory diagnosis, clinical management and infection control of the infections caused by extensively drug-resistant Gram-negative bacilli: a Chinese consensus statement[J]. Clin Microbiol Infect,2016,22 (Suppl 1):s15-s25.
[15] DE JAGER P, CHIRWA T, NAIDOO S, et al. Nosocomial outbreak of new delhi metallo-β-lactamase-1-producing gramnegative bacteria in South Africa: a case-control study[J]. PLoS One,2015,10(4):e123337.
[16] PIRES D, ZAGALO A, SANTOS C, et al. Evolving epidemiology of carbapenemase-producingEnterobacteriaceaein Portugal: 2012 retrospective cohort at a tertiary hospital in Lisbon[J]. J Hosp Infect,2016,92(1):82-85.
[17] PA?O PARDO JR, SERRANO VILLAR S, RAMOS RAMOS JC,et al. Infections caused by carbapenemase-producingEnterobacteriaceae: risk factors, clinical features and prognosis[J]. Enferm Infecc Microbiol Clin,2014,32 (Suppl 4):41-48.
[18] DAIKOS GL, TSAOUSI S, TZOUVELEKIS LS, et al.Carbapenemase-producingKlebsiella pneumoniaebloodstream infections: lowering mortality by antibiotic combination schemes and the role of carbapenems[J]. Antimicrob Agents Chemother,2014,58(4):2322-2328.
[19] NABARRO LEB, SHANKAR C, PRAGASAM AK, et al.Clinical and bacterial risk factors for mortality in children with carbapenem-resistantEnterobacteriaceaebloodstream infections in India[J]. Pediatr Infect Dis J, 2017, 36(6):e161-e166.
[20] GARBATI MA, SAKKIJHA H, ABUSHAHEEN A. Infections due to carbapenem resistantEnterobacteriaceaeamong Saudi Arabian Hospitalized patients: a matched case-control study[J].Biomed Res Int,2016:3961684.
[21] TANGDEN T, GISKE CG. Global dissemination of extensively drug-resistant carbapenemase-producingEnterobacteriaceae:clinical perspectives on detection, treatment and infection control[J]. J Intern Med,2015,277(5):501-512.
[22] DAIKOS GL, MARKOGIANNAKIS A. CarbapenemaseproducingKlebsiella pneumoniae: (when) might we still consider treating with carbapenems?[J]. Clin Microbiol Infect,2011,17(8):1135-1141.
[23] TZOUVELEKIS L S, MARKOGIANNAKIS A, PSICHOGIOU M, et al. Carbapenemases inKlebsiella pneumoniaeand otherEnterobacteriaceae: an evolving crisis of global dimensions[J].Clin Microbiol Rev,2012,25(4):682-707.
[24] TUMBARELLO M, TRECARICHI EM, DE ROSA FG, et al.Infections caused by KPC-producingKlebsiella pneumoniae:differences in therapy and mortality in a multicentre study[J]. J Antimicrob Chemother,2015,70(7):2133-2143.
[25] GOMEZ-SIMMONDS A, NELSON B, EIRAS DP, et al.Combination regimens for treatment of carbapenem-resistantKlebsiella pneumoniaebloodstream infections[J]. Antimicrob Agent Chemother,2016,60(6):3601-3607.
Clinical characteristics and antimicrobial resistance of the bloodstream infections due to NDM-1 producing Klebsiella pneumoniae in children
ZHANG Ye, DONG Fang, SONG Wenqi, GUO Lingyun, WANG Yan, LIU Gang. (Department of Infectious Disease, Beijing Children's Hospital, Capital Medical University, Beijing 100045, China)
R378.996
A
1009-7708 ( 2017 ) 05-0516-07
10.16718/j.1009-7708.2017.05.006
2017-01-16
2017-03-16
1. 首都醫科大學附屬北京兒童醫院感染內科,北京 100045;*細菌室。
張燁(1990—),女,碩士研究生,主要從事兒童感染性疾病研究。
劉鋼,E-mail:liugang10@hotmail.com。

