幾種常見網絡存儲備份方式淺析
韓冰心 彭濤
摘 要:網絡數據信息爆炸性的增長,使網絡存儲技術變得越來越重要,已成為Internet及其相關行業進一步發展的關鍵。本論文主要講述了常用離線存儲備份技術的結構選擇、技術演進、常用實施方案及各種方案的優缺點。
關鍵詞:存儲備份;NAS存儲;SAN存儲;LAN-free備份;Server-Less備份
1 引言
信息是一個企業可持續發展的核心動力之一,信息的可靠存儲是一個企業得以正常運作和發展壯大的根本所在。信息化給人們帶來快捷的服務和方便的管理時,也給人們帶來數字信息丟失的風險。數據的丟失會中斷企業的正常運行,同時也會給企業造成巨大的經濟損失。因此,數據的存儲、備份成為保證數據安全的重要措施。
存儲備份(也稱為數據備份)是容災的基礎,一切容災系統的建立都是以數據備份為基礎的。而建立容災系統的最終目的不是備份,而是快速恢復數據。存儲備份系統一般使用磁帶庫設備和存儲備份軟件,它是整個容災體系中重要的后備支撐。當數據受到破壞,存儲備份系統的任務就是把由數據丟失而造成的災難降到最低,并在最短的時間內將系統中丟失和破壞的數據全部恢復,使系統能正常運行。
存儲備份分為兩大類,一種是離線備份(Offline),如LAN-free、Server-free,即把存儲服務器中的數據備份到磁帶庫中。采用這種備份方式,數據恢復的時間要比在線方式長,但它的投資較小,只要有存儲備份設備和存儲備份軟件即可;另一種是在線備份(on-line),如數據復制。數據復制實際上就是一種同步的數據備份,其數據恢復的時間非常短,短則幾秒、幾分鐘不等。數據復制是一個高級的同步過程,可使數據全整的保存,達到一點都不丟失的狀態。在現在的大部份用戶中,絕大部份用戶使用數據離線備份即可。只有其業務需要連續性的關鍵業務用戶,才會使用在線備份。本文主要闡述離線備份技術的實施手段和優缺點。
2 存儲技術的結構選擇
目前,存儲數據的方式常見的有三種:
2.1 DAS
DAS(Direct Attached Storage)即直接連接存儲技術,是指將存儲設備通過SCSI接口或光纖通道直接連接到服務器上的方式。這種連接方式主要應用于單機或兩臺主機的集群環境中,現在在各大銀行的中心業務系統中常能見到這種方式。
2.2 NAS
NAS(Network Attached Storage)即網絡附加存儲方式,將存儲設備通過標準的網絡拓撲結構例如(以太網),連接到一群計算機上,提供數據和文件服務。NAS服務器一般由存儲硬件、操作系統以及其上的文件系統等幾個部分組成。此為以專業的網絡文件存儲及文件備份為中心的方式,是現在以文件存儲為主的一種存儲方式。
2.3 SAN
SAN(Storage Area Network)即存儲局域網,是指存儲設備相互連接且與一臺服務器或一個服務器群相連的網絡,通常有FC-SAN和IP-SAN兩種架構。存儲區域網絡是一種專用的,集中式管理的并且是具有安全性的信息系統構架,存儲區域網絡能夠實現服務器和存儲設備之間的任意互聯。SAN是一個由多廠商存儲設備,存儲管理軟件,應用服務器以及網絡硬件設備構成的高速的存儲網絡,它能夠輔助用戶更有效地利用其業務信息。
3 備份方式的技術演進
3.1 本機備份
在傳統的備份模式下,每臺主機都配備專用的存儲磁盤或磁帶系統,主機中的數據必須備份到位于本地的專用磁帶設備或盤陣中。這樣,即使一臺磁帶機(或磁帶庫)處于空閑狀態,另一臺主機也不能使用他進行備份工作,磁帶資源利用率較低。另外,不同的操作系統平臺使用的備份恢復程式一般也不相同,這使得備份工作和對資源的總體管理變得更加復雜。
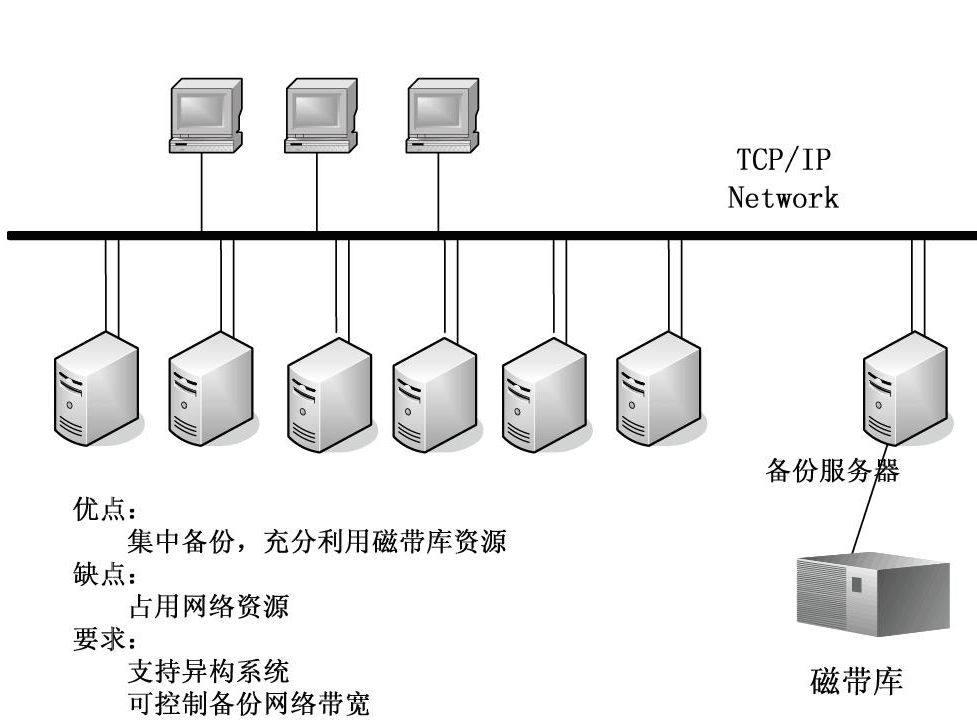
3.2 網絡備份
后來,產生一種克服專用磁帶系統利用率低的改進辦法:即磁帶資源由一個主備份/恢復服務器控制,而備份和恢復進程由一些管理軟件來控制。主備份服務器接收其他服務器通過局域網或廣域網發來的數據,并將其存入公用磁盤或磁帶系統中。
3.3 先進備份方式
隨著信息量呈爆炸性增長,大量的系統數據通過用戶網絡進行備份,使網絡帶寬成為難以逾越的瓶頸。有沒有一種更先進的解決方案,在備份的時候盡可能減小對系統資源的消耗,同時又確保系統的高可用性和靈活性呢?
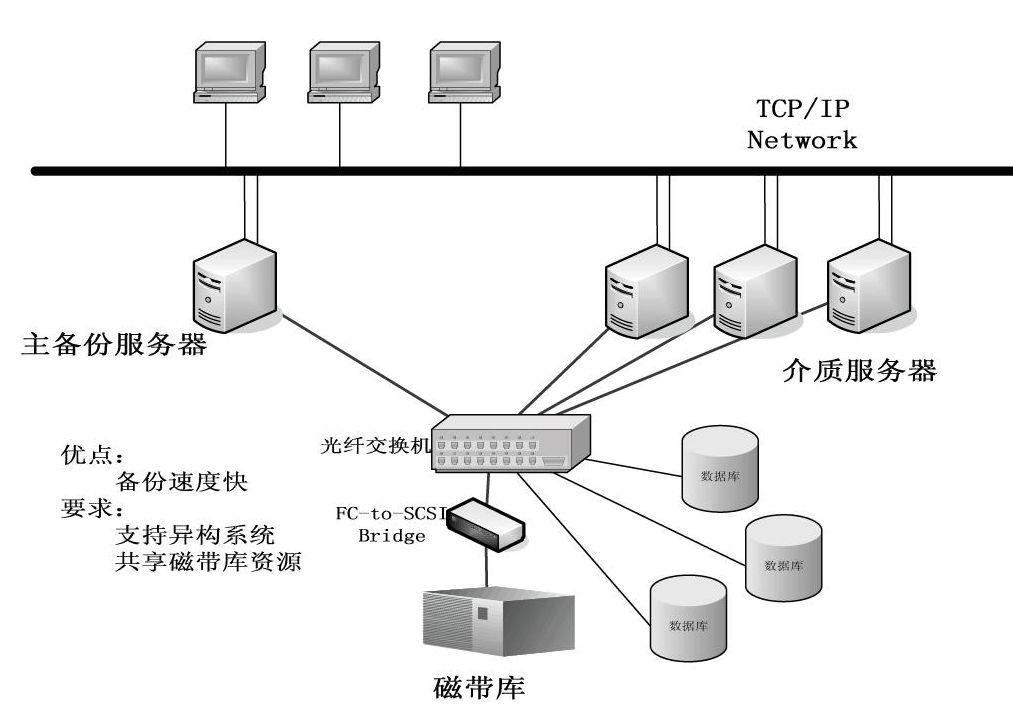
3.3.1 LAN-free備份
辦法之一是采用LAN-free。所謂LAN-free,是指數據不經過局域網直接進行備份,即用戶只需將磁帶機或磁帶庫等備份設備連接到SAN中,各服務器就可把需要備份的數據直接發送到共享的備份設備上,不必再經過局域網鏈路。由于服務器到共享存儲設備的大量數據傳輸是通過SAN網絡進行的,局域網只承擔各服務器之間的通信(而不是數據傳輸)任務。
3.3.1.1 LAN-free備份常用實施方式
通常,用戶都需要為每臺服務器配備光纖通道適配器,適配器負責把這些服務器連接到和一臺或多臺磁帶機(或磁帶庫)相連的SAN上。同時,還需要為服務器配備特定的管理軟件,通過它,系統能夠把塊格式的數據從服務器內存、經SAN傳輸到磁帶機或磁帶庫中。
更有一種常用的LAN-free實施辦法,在這種結構中,主備份服務器上的管理軟件能夠啟動其他服務器的數據備份操作。塊格式的數據從磁盤陣列通過SAN傳輸到臨時存儲數據的備份服務器的內存中,之后再經SAN傳輸到磁帶機或磁帶庫中。
3.3.1.2 LAN-free備份不足
LAN-free技術也存在明顯不足。首先,他仍舊讓服務器參與了將備份數據從一個存儲設備轉移到另一個存儲設備的過程,在一定程度上占用了寶貴的CPU處理時間和服務器內存。更有一個問題是,LAN-free技術的恢復能力差強人意,他很依賴用戶的應用。許多產品并不支持文檔級或目錄級恢復,映像級恢復就變得較為常見。映像級恢復就是把整個映像從磁帶拷回到磁盤上,假如您需要快速恢復某一個文檔,整個操作將變得很麻煩。此外,不同廠商實施的LAN-free機制各不相同,這還會導致備份過程所需的系統之間出現兼容性問題。
3.3.2 Server-Less備份
辦法之二就是采用Server-Less。顧名思義Server-Less就是繞過服務器的備份,具體地說就是在執行備份操作時,備份數據是直接從磁盤上寫入到磁帶中,在整個過程中對LAN網絡和應用服務器毫無影響。這使得網絡的負載和應用服務器真正從備份中解放出來。這種方案的主要長處之一是無需在服務器中緩存數據,顯著減少對主機CPU的占用,提高操作系統工作效率,幫助企業完成更多的工作。
3.3.2.1 Server-Less備份常用實施方式
通常情況下,備份數據通過名為數據移動器的設備從磁盤陣列傳輸到磁帶庫上。該設備可能是光纖通道交換機、存儲路由器、智能磁帶或磁盤設備或是服務器。數據移動器執行的命令其實是把數據從一個存儲設備傳輸到另一個設備。實施這個過程的一種方法是借助于SCSI-3的擴展拷貝命令,他使服務器能夠發送命令給存儲設備,指示后者把數據直接傳輸到另一個設備,不必通過服務器內存。數據移動器收到擴展拷貝命令后,執行相應功能。
另一種方法就是利用網絡數據管理協議(NDMP)。這種協議實際上為服務器、備份和恢復應用及備份設備等部件之間的通信充當一種接口。在實施過程中,NDMP把命令從服務器傳輸到備份應用中,而和NDMP兼容的備份軟件會開始實際的數據傳輸工作,且數據的傳輸并不通過服務器內存。NDMP的目的在于方便異構環境下的備份和恢復過程,并增強不同廠商的備份和恢復管理軟件連同存儲硬件之間的兼容性。
3.3.2.2 Server-Less備份的優勢
由于服務器瓶頸已不存在,備份將更快。
專用的備份服務器被省略。
兼做備份及文件的服務器能將全部的能力用于業務處理。
由于數據被直接送到磁帶設備而不受服務器性能的限制,磁帶機的速度被發揮到最佳。
能在任何時候進行備份并不會對用戶網絡造成影響,真正實現7×24小時全天候備份。
無服務器備份的好處在數據恢復時得到體現。由于網絡“快照”執行起來更方便,所以備份磁帶能包含最新的數據,這樣恢復得也就更快,要做的工作也就更少。
3.3.2.3 Server-Less備份的不足
雖然服務器的負擔大為減輕,但仍需要備份應用軟件(連同其主機服務器)來控制備份過程。元數據必須記錄在備份軟件的數據庫上,這仍需要占用CPU資源。和LAN-free相同,無服務器備份可能會導致同樣類型的兼容性問題。而且,無服務器備份可能難度大、成本高。最后,假如無服務器備份的應用要更廣泛,恢復功能方面更有待更大改進。
4 結束語
數據的重要性越來越得到人們的廣泛認同。未來網絡的核心將是數據,網絡化存儲正是數據存儲的一個發展方向。這里我們簡要的介紹了幾種當前比較流行的網絡存儲技術及備份技術,當前網絡存儲技術還在不斷的快速發展,SAN和NAS的融合、統一虛擬存儲技術是未來發展的兩個趨勢。
[參考文獻]
[1]江小云.淺談存儲技術的發展歷程[J].中國科技信息,2005,(15).
[2]周可,黃永峰,張江陵.網絡存儲技術研究[J].電子計算機與外部設備,2005,24(2).
[3]范濤.網絡存儲技術的研究與應用[J].福建電腦,2008,(6).

