非酒精性脂肪性肝病細胞模型中自噬與脂質代謝的相互調節
閆 蓉, 牛春燕, 于 璐, 田 宇
(1 西安醫學院第一附屬醫院 a.消化內科; b.檢驗科, 西安 710077; 2 河南省人民醫院 內分泌科, 鄭州 450003)
非酒精性脂肪性肝病細胞模型中自噬與脂質代謝的相互調節
閆 蓉1a, 牛春燕1a, 于 璐2, 田 宇1b
(1 西安醫學院第一附屬醫院 a.消化內科; b.檢驗科, 西安 710077; 2 河南省人民醫院 內分泌科, 鄭州 450003)
目的探討非酒精性脂肪性肝病(NAFLD)中自噬與脂質代謝的相互作用。方法體外人肝細胞培養(脂肪變性)制備NAFLD細胞模型,雷帕霉素誘導細胞自噬,3-甲基腺嘌呤抑制細胞自噬,MTT比色法測定細胞活力,ELISA法檢測各組細胞TG、ALT、AST、LDH、GGT、Alb水平,IF法檢測 LC3-Ⅱ的定位與分布,Western Blot 檢測LC3-Ⅱ/LC3-Ⅰ比值。計量資料多組間比較采用方差分析,進一步兩兩比較采用SNK-q檢驗。結果誘導自噬組的吸光度值和細胞活率與脂肪變組比較,明顯下降(HL-7702細胞q值分別為4.160、4.110,SK-HEP-1細胞q值分別為4.407、4.032;P值均<0.05)。脂肪變組TG、ALT、AST、LDH、GGT、Alb水平與對照組相比,明顯升高(HL-7702細胞q值分別為5.316、3.730、4.013、6.967、6.192、5.531,SK-HEP-1細胞q值分別為4.963、3.603、4.774、7.479、6.319、5.193;P值均<0.05)。誘導自噬組TG、ALT、AST、LDH、GGT、Alb水平與脂肪變組相比,明顯降低(HL-7702細胞q值分別為4.978、3.695、3.960、5.130、4.695、3.192,SK-HEP-1細胞q值分別為3.846、5.575、4.184、5.019、4.203、3.049;P值均<0.05)。LC3-Ⅱ在各組肝細胞中的標記值,誘導自噬組最高(HL-7702細胞為90.1%,SK-HEP-1細胞為80.0%),其次是脂肪變組(HL-7702細胞為47.2%,SK-HEP-1細胞為48.4%)及抑制自噬組(HL-7702細胞為30.2%,SK-HEP-1細胞為45.5%)。誘導自噬組LC3-Ⅱ/LC3-Ⅰ比值與脂肪變組相比,明顯升高(HL-7702細胞q值為6.786,SK-HEP-1細胞q值為5.926;P值均<0.05)。結論自噬的上調有利于促進肝臟脂肪的清除,而下調則促進脂質的聚積。
脂肪肝; 自噬; 脂類代謝
近年來,非酒精性脂肪性肝病(NAFLD)患病率逐年增加,已成為全球重要的公共健康問題[1]。NAFLD的發病機制至今尚未完全明確,較為普遍接受的“二次打擊學說”認為,初次打擊為脂質聚積導致肝臟脂肪變及胰島素抵抗,通過外周脂解增加(脂質過多)和高胰島素血癥引起肝細胞脂肪堆積、脂肪變,二次打擊主要指氧化應激和脂質過氧化及細胞因子、線粒體功能異常等,導致肝細胞損傷、炎癥、纖維化[2]。最近的研究[3-4]表明,自噬除了降解肝細胞內過多或損傷的細胞器和蛋白質外,還介導肝細胞內脂肪的代謝和分解,介導脂滴內貯存脂質的降解,提示自噬在NAFLD的發生、發展中具有重要病理生理意義。本實驗通過對體外人肝細胞培養(脂肪變性)制備NAFLD模型,觀察自噬的生物學特性,探討NAFLD中自噬與脂質代謝的相互作用和可能的機制,為將來NAFLD治療領域的分子靶向治療相關研究奠定基礎。
1 材料與方法
1.1 材料 HL-7702細胞和SK-HEP-1細胞株(西安東澳生物科技有限公司),10%脂肪乳注射液(四川科倫藥業股份有限公司),雷帕霉素(Selleck,S1039),3-甲基腺嘌呤(3-MA)(Selleck,S2767),LC3B (D11) XP?Rabbit mAb(CST,3868S),Anti-PKC epsilon 抗體(Abcam,ab124806),油紅O染色液(南京建成科技有限公司,D027),科研人甘油三酯(TG)ELISA 試劑盒(上海酶聯生物科技有限公司,ml026468),科研人ALT檢測試劑盒(上海酶聯生物科技有限公司,ml027133),科研人AST檢測試劑盒(上海酶聯生物科技有限公司,ml024056),科研人乳酸脫氫酶(LDH)檢測試劑盒(上海酶聯生物科技有限公司,ml024518),科研人GGT檢測試劑盒(上海酶聯生物科技有限公司,ml027457),科研人Alb檢測試劑盒(上海酶聯生物科技有限公司,ml025061)。倒置熒光顯微鏡(OLYMPUS),冷凍離心機(Eppendorf),電熱恒溫培養箱(天津泰斯特儀器有限公司),Mini-PROTEAN?Casting stand(Bio-Rad),Power PacTMHC 高電流電泳儀(Bio-Rad),Mini-PROTEAN?電泳槽(Bio-Rad),Mini Trans-Blot?轉印槽(Bio-Rad),iMarkTM酶標儀(Bio-Rad)。
1.2 方法
1.2.1 細胞培養及模型建立 將從液氮中取出的HL-7702細胞和SK-HEP-1細胞在37 ℃水浴鍋中快速融化后接種于10 cm皿中,培養基分別是RPMI1640+10%FBS和MEM+10%FBS。將 10 cm皿中細胞廢液棄除,用PBS清洗1次,滴加8滴胰酶,消化30 s左右,加入完全培養基終止消化,用1 ml的槍吹打細胞,收集細胞液于15 ml離心管中,1000 r/min離心5 min;離心后棄上清,加入新的完全培養基,輕柔吹打細胞,制備單細胞懸液;按1∶2的接種比例將細胞懸液接種于10 cm皿中,在CO2孵箱中培養。HL-7702、SK-HEP-1細胞分別用2%脂肪乳培養 48 h后,用油紅O染色肝細胞出現紅色脂滴,即為建模成功。另將普通培養的2種細胞株設為對照。
1.2.2 肝細胞自噬的調節 人肝HL-7702、SK-HEP-1脂肪變細胞傳代培養至對數生長期后,誘導自噬組加入雷帕霉素(100 nmol/L)培養48 h;抑制自噬組加入3-MA(4.5 mg/L)培養24 h。
1.2.3 細胞活力與功能評價
1.2.3.1 油紅O染色 分別取對數生長期HL-7702、SK-HEP-1細胞,以5×104/孔的密度接種于放玻片的24孔板上,細胞培養至密度達到 60%~70%時,模型組加入 2%脂肪乳(10%脂肪乳注射液稀釋5倍),對照組加入不含脂肪乳的培養基。放入孵箱培養48 h后,取出培養板,PBS洗3次,用4%多聚甲醛固定30 min,PBS洗3次,油紅O染液室溫染色30 min,37 ℃左右蒸餾水洗30 s至背景透明,再用復染劑室溫染色3 min,蒸餾水洗30~60 s,用水性封片劑封片,顯微鏡下觀察細胞內的脂滴。
1.2.3.2 MTT比色法測定細胞活力 將 T25培養瓶中的廢液全部吸棄,消化后重懸細胞;吸取10 μl細胞懸液,用血球計數板按照3×104/ml計數,接種到96孔板中,每孔100 μl,在 CO2孵箱中過夜培養。接種細胞后第2天,更換培養基,模型組加入2%脂肪乳(10%脂肪乳注射液稀釋5倍),對照組加入不含脂肪乳的培養基,置于37 ℃、5% CO2培養箱中48 h。每孔加20 μl MTT溶液(5 mg/ml),繼續培養4 h。去上清液,每孔加入150 μl二甲亞砜,置搖床低速振蕩10 min,全自動酶聯免疫檢測儀490 nm測吸光度值。
1.2.3.3 ELISA檢測 分別取對數生長期HL-7702、SK-HEP-1細胞,以5×105/孔的密度接種于6孔板上,細胞培養至密度達到60%~70%時,模型組加入2%脂肪乳(10%脂肪乳注射液稀釋5倍);對照組加入不含脂肪乳的培養基;放入孵箱培養48 h后,收集各組細胞,用冰的PBS清洗細胞3次,每孔加1 ml PBS后,收集細胞懸液至EP管中,1000 r/min,離心10 min,棄上清液,留細胞沉淀,用PBS調整至1×106個/ml。反復凍融3次裂解細胞,4 ℃、3000 r/min,離心20 min,收集上清后,于-80 ℃保存備用。按ELISA試劑盒操作說明檢測其中TG、ALT、AST、LDH、GGT、Alb水平。
1.2.4 肝細胞自噬相關蛋白在人肝細胞及脂肪變人肝細胞中活性狀態的檢測
1.2.4.1 IF法檢測自噬相關蛋白微管相關蛋白1輕鏈3(microtubule-associated protein 1 light chain 3,LC3)Ⅱ 培養好的細胞經4%多聚甲醛室溫固定30 min。PBS洗3次,每次5 min。0.3% TritonX-100室溫通透15 min。PBS洗3次,每次5 min。一抗孵育:用10%山羊血清將一抗LC3-Ⅱ(1∶100)稀釋,4 ℃孵育過夜。第2天吸去一抗,PBS洗3次,每次5 min。滴加二抗工作液[用 2%山羊血清熒光二抗Alexa Fluor 594 donkey-rabbit (1∶400)](稀釋到工作時的濃度),37 ℃避光孵育30 min。吸去二抗,用PBS洗 3次,每次5 min。滴加VECTASHIELD?+DAPI封片并染細胞核。立即用倒置熒光顯微鏡拍照,藍色代表細胞核,紅色熒光代表LC3-Ⅱ。觀察LC3-Ⅱ的定位和分布。采用雙盲法在光鏡下隨機選擇20個肝細胞/片,記數肝細胞的陽性細胞及細胞總數,LC3-Ⅱ在肝細胞中的標記值為陽性細胞數/細胞總數×100%。
1.2.4.2 Western Blot檢測自噬相關蛋白LC3-Ⅱ/LC3-Ⅰ 收集各組細胞,用冰的PBS清洗細胞3次,每個孔加1 ml PBS后,收集細胞懸液至EP管中,1000 r/min,離心10 min,棄上清液,留細胞沉淀,加入預冷的細胞裂解液裂解細胞,用移液槍反復吹打數次。將裂解好的細胞轉移入預冷的離心管中,冰浴10 min,以使細胞充分裂解。在4 ℃條件下,12 000 r/min離心10 min。將上清轉移至預冷的離心管中。用BCA蛋白定量試劑盒對提取的蛋白進行檢測。檢測后將蛋白樣品分裝成小份,-80 ℃貯存備用。取各組蛋白樣品30 μg,加入相當于蛋白樣品1/4體積的5×蛋白上樣緩沖液,沸水浴中煮5 min,然后進行SDS-PAGE分離蛋白。采用濕轉法,將蛋白質轉移至偏氟乙烯(polyvinylidence difluoride,PVDF)膜上。轉膜結束后,將PVDF膜放在麗春紅染色液中染色2~5 min,觀察蛋白轉移效果。標記出PVDF膜的右上角,將PVDF膜轉移至含有5% BSA的TBST封閉液中,室溫封閉1.5 h。按1∶800稀釋抗體LC3B,按1∶500稀釋抗體β-Actin于封閉液中,將PVDF膜放入皿中,加入一抗的稀釋液,4 ℃過夜。次日,用TBST洗膜10 min×4次。按1∶10 000稀釋辣根過氧化物酶標記的羊抗兔IgG(LC3B)于封閉液中,按1∶10 000稀釋辣根過氧化物酶標記的羊抗鼠IgG(β-Actin)于封閉液中,將PVDF膜放入含稀釋二抗的皿中,脫色搖床孵育1 h。孵育結束后,用TBST洗膜10 min×3次。暗室中,用濾紙輕輕將膜上的液體吸干,在增強化學發光反應混合液中反應2~3 min,壓片顯影。
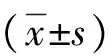
2 結果
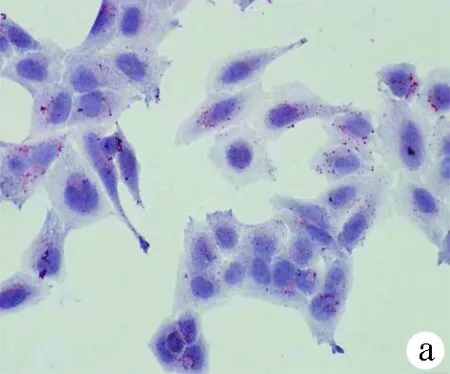
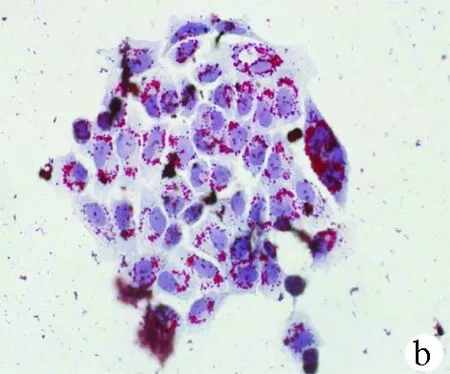
2.1 油紅O染色結果 對照組HL-7702細胞和SK-HEP-1細胞生長為不規則或卵圓形,胞質無明顯紅染或淡染,脂肪變組細胞胞質廣泛染色,為紅色脂滴,大而多(圖1)。
2.2 MTT比色結果 對照組、脂肪變組HL-7702細胞及SK-HEP-1細胞生長良好,吸光度值和細胞活率組間比較,差異均無統計學意義(P值均>0.05)。誘導自噬組HL-7702及SK-HEP-1細胞的吸光度值和細胞活率與脂肪變組比較,明顯下降(P值均<0.05)。抑制自噬組HL-7702及SK-HEP-1細胞的吸光度值和細胞活率與脂肪變組比較,差異均無統計學意義(P值均>0.05)(表1,2)。
對照組
脂肪變組
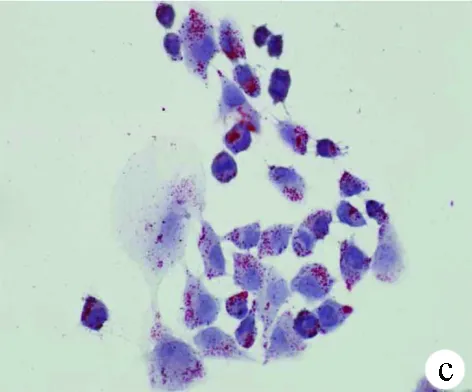
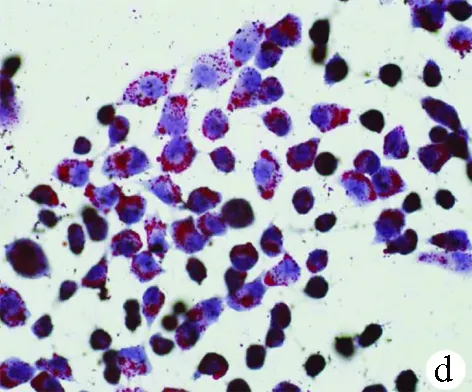
圖1對照組和脂肪變組HL-7702細胞和SK-HEP-1細胞內脂滴油紅O染色結果(×400) a、b:HL-7702;c、d:SK-HEP-1
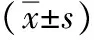
表1 各組HL-7702細胞吸光度值和細胞活率
注:與脂肪變組比較,1)q值分別為4.160、4.110,P<0.05
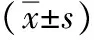
表2 各組SK-HEP-1細胞吸光度值和細胞活率
注:與脂肪變組比較,1)q值分別為4.070、4.032,P<0.05
2.3 ELISA檢測結果 脂肪變組HL-7702及SK-HEP-1細胞TG、ALT、AST、LDH、GGT、Alb水平與對照組相比,明顯升高(P值均<0.05)。誘導自噬組HL-7702及SK-HEP-1細胞TG、ALT、AST、LDH、GGT、Alb水平與脂肪變組相比,明顯降低(P值均<0.05)。抑制自噬組HL-7702及SK-HEP-1細胞TG、ALT、AST、LDH、GGT、Alb水平與脂肪變組比較,差異均無統計學意義(P值均>0.05)(表3,4)。
2.4 IF法檢測LC3-Ⅱ LC3-Ⅱ在各組細胞的定位及分布見圖2。LC3-Ⅱ在各組肝細胞中的標記值,誘導自噬組最高,其次是脂肪變組及抑制自噬組。脂肪變組HL-7702及SK-HEP-1細胞LC3-Ⅱ標記值與對照組相比,明顯升高(P值均<0.05)。誘導自噬組HL-7702及SK-HEP-1細胞LC3-Ⅱ標記值與脂肪變組相比,明顯升高(P值均<0.05)。抑制
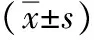
表3 各組HL-7702細胞ELISA檢測結果
注:與對照組比較,1)q值分別為5.316、3.730、4.013、6.967、6.192、5.531,P<0.05;與脂肪變組比較,2)q值分別為4.978、3.695、3.960、5.130、4.695、3.192,P<0.05
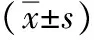
表4 各組SK-HEP-1細胞ELISA檢測結果
注:與對照組比較,1)q值分別為4.963、3.603、4.774、7.479、6.319、5.193,P<0.05;與脂肪變組比較,2)q值分別為3.846、5.575、4.184、5.019、4.203、3.049,P<0.05
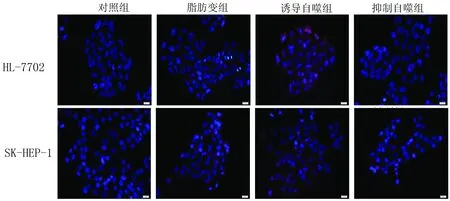
圖2 LC3-Ⅱ在各組細胞的定位及分布
自噬組HL-7702及SK-HEP-1細胞LC3-Ⅱ標記值與脂肪變組相比,差異無統計學意義(P值均>0.05)(表5)。
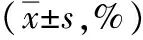
表5 LC3-Ⅱ在各組肝細胞中的標記值
注:與對照組比較,1)q值分別為7.318、7.424,P<0.05;與脂肪變組比較,2)q值分別為8.486、8.609,P<0.05
2.5 Western Blot檢測LC3-Ⅱ/LC3-Ⅰ比值 LC3-Ⅱ/LC3-Ⅰ比值中誘導自噬組最高,其次是脂肪變組、對照組及抑制自噬組。脂肪變組HL-7702及SK-HEP-1細胞LC3-Ⅱ/LC3-Ⅰ比值與對照組相比,差異無統計學意義(P值均>0.05)。誘導自噬組HL-7702細胞及SK-HEP-1細胞LC3-Ⅱ/LC3-Ⅰ比值與脂肪變組相比,明顯升高(P值均<0.05)。抑制自噬組HL-7702細胞及SK-HEP-1細胞LC3-Ⅱ/LC3-Ⅰ比值與脂肪變組相比,無顯著性差異(P值均>0.05)(圖3,表6)。

圖3 Western Blot分析中各組LC3蛋白表達水平
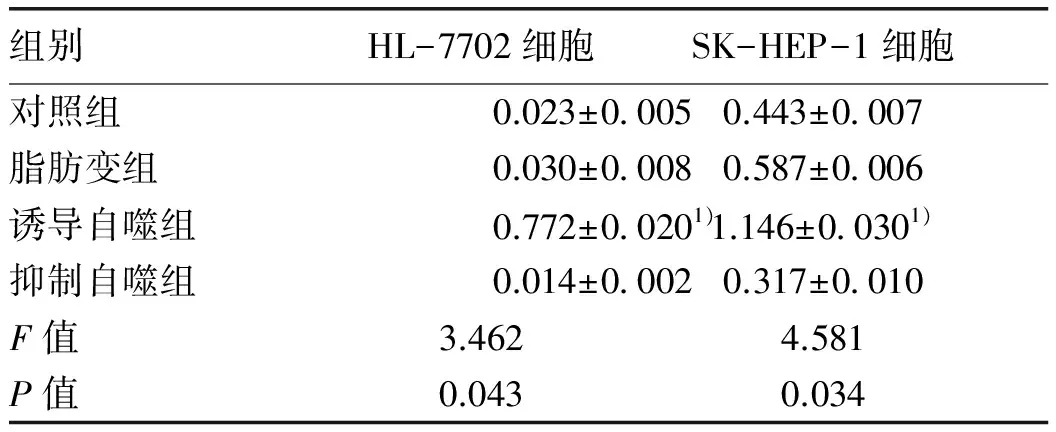
組別HL-7702細胞SK-HEP-1細胞對照組0.023±00050.443±0007脂肪變組0.030±00080.587±0006誘導自噬組0.772±00201)1.146±00301)抑制自噬組0.014±00020.317±0010F值3.4624.581P值0.0430.034
注:與脂肪變組比較,1)q值分別為6.786、5.926,P<0.05
3 討論
自噬是指一些需降解的蛋白質和細胞器等胞漿成分被包裹,并最終運送至溶酶體降解的過程,自噬性降解產生的氨基酸和其他一些小分子物質可被再利用或產生能量。現已明確,自噬的主要功能之一實際上是在細胞受到應激性的死亡威脅時保持細胞的存活,這是真核細胞維持穩態、實現更新的一種重要的進化保守機制[4]。參與自噬的信號調節機制非常復雜,主要有:(1)營養信號調節,最主要的2個通路為,哺乳動物雷帕霉素靶蛋白復合體1通路,Ras/cAMP依賴的蛋白激酶途徑通路;(2)胰島素/生長因子通路;(3)能量響應;(4)應激響應(包括內質網應激、缺氧、氧應激、病原體感染)。參與自噬的基因主要有Atg家族的31種基因、Beclin Ⅰ、LC3 Ⅰ/Ⅱ等。在自噬整個過程中,關鍵分子是位于啟動階段的Ⅲ型磷脂酰肌醇-3-激酶和TOR/mTOR激酶。Ⅲ型磷脂酰肌醇-3-激酶通過磷酸化脂酰肌醇來募集胞漿中含FYVE或PX結構域的蛋白質,用于自噬體膜的形成。3-MA通過抑制該激酶,可有效抑制自噬活性[5]。mTOR通過調控核糖體蛋白質S6的活性而發揮抑制細胞自噬活性的作用[6],mTOR的特異性抑制劑雷帕霉素可抑制mTOR通路,活化細胞自噬。本實驗中,各組細胞經MTT比色法測定細胞活力,3-MA抑制自噬組的吸光度值和細胞活率與脂肪變組比較無顯著性差異(P>0.05)。雷帕霉素誘導自噬組的吸光度值和細胞活率與脂肪變組比較明顯下降(P<0.05),考慮與自噬導致細胞活力下降有關。
除維持生理狀態下機體的穩態功能外,越來越多的研究[7]表明自噬與腫瘤發生、神經退化性疾病、心肌病、克羅恩病、脂肪肝、2型糖尿病以及衰老有關,并且具有抵御細胞內病原、抗原遞呈的功能。本實驗中,誘導自噬組中反映脂質沉積及肝細胞損傷的指標,TG、ALT、AST、LDH、GGT、Alb與脂肪變組相比,明顯降低(P<0.05)。抑制自噬組TG、ALT、AST、LDH、GGT、Alb與脂肪變組相比,無顯著性差異(P>0.05)。考慮與自噬參與脂質代謝有關,自噬的上調有利于促進肝臟脂肪的清除,而下調則促進脂質的聚積[9-10]。另外,自噬還可減輕非酒精性脂肪性肝炎狀態下的內質網應激和肝細胞損傷、改善胰島素抵抗[11-12]。
自噬過程由一系列自噬相關蛋白(Atg蛋白)介導完成,這些蛋白質在自噬體形成的不同階段發揮作用。LC3是自噬體膜上的標記蛋白。細胞內存在2種形式的LC3蛋白:LC3-Ⅰ和LC3-Ⅱ。LC3蛋白在合成后其C端即被Atg4蛋白酶切割變成LC3-Ⅰ,LC3-Ⅰ散在分布于細胞漿內。當自噬體形成后,LC3-Ⅰ和磷脂酰乙醇胺偶聯形成 LC3-Ⅱ并定位于自噬體內膜和外膜。與其他一些定位于自噬性結構膜上的Atg蛋白不同(僅在自噬過程的某一階段發揮作用),LC3-Ⅱ始終穩定地保留在自噬體膜上直到與溶酶體融合,因此被用來作為自噬體的標記,且LC3-Ⅱ的水平在某種程度上反映了自噬體的數量[13]。本實驗中采用IF法檢測LC3-Ⅱ。LC3-Ⅱ在各組肝細胞中的標記值誘導自噬組最高,其次是脂肪變組及抑制自噬組。誘導自噬組LC3-Ⅱ標記值與脂肪變組相比,明顯升高(P<0.05),提示雷帕霉素可以顯著激活細胞自噬,增加自噬體數量。脂肪變組LC3-Ⅱ標記值與對照組相比,明顯升高(P<0.05),提示脂肪變組細胞自噬體數量增加,考慮與脂肪變導致細胞應激有關。
自噬發生后,通過Western Blot可以檢測到2個條帶的蛋白質,盡管 LC3-Ⅱ與磷脂酰乙醇胺結合后實際分子質量大于LC3-Ⅰ,由于其疏水性較強,在聚丙烯酰胺凝膠中的泳動速度要快于 LC3-Ⅰ。由于在自噬時細胞內LC3蛋白總的表達水平其實并無上調,僅僅是一部分LC3-Ⅰ轉變成了LC3-Ⅱ,自噬時應表現為LC3-Ⅰ的減少和LC3-Ⅱ的增加,通過LC3-Ⅱ/LC3-Ⅰ或者LC3-Ⅱ/(LC3-Ⅰ+LC3-Ⅱ)即可反映自噬水平[14]。本實驗中,LC3-Ⅱ/LC3-Ⅰ比值中誘導自噬組最高,其次是脂肪變組及抑制自噬組。誘導自噬組HL-7702細胞及SK-HEP-1細胞LC3-Ⅱ/LC3-Ⅰ比值與脂肪變組相比,明顯升高(P<0.05)。提示與IF法檢測LC3-Ⅱ相比,采用Western Blot法檢測LC3-Ⅱ/LC3-Ⅰ比值更能反映細胞真實的自噬水平。
自噬在NAFLD發生發展中的作用近年來受到越來越多的關注,但NAFLD背景下自噬與脂質代謝之間的作用機制尚未明確。本課題研究的結果初步顯示,自噬的上調有利于促進肝臟脂肪的清除,而下調則促進脂質的聚積;自噬還可減輕非酒精性脂肪性肝炎狀態下的肝細胞損傷。因此,肝細胞自噬活性的調控有望成為治療NAFLD的新靶點。
[1] CHANG BX, ZOU ZS, LI BS, et al. 2015 The Japanese Society of Gastroenterology of Evidence-based clinical practice guidelines for nonalcoholic fatty liver disease/nonalcoholic steatohepatitis
[J]. J Clin Hepatol, 2015, 31(7): 1027-1030. (in Chinese)
常彬霞, 鄒正升, 李寶森, 等. 2015年日本胃腸病學會非酒精性脂肪肝病/非酒精性脂肪肝炎的循證醫學臨床治療指南[J]. 臨床肝膽病雜志, 2015, 31(7): 1027-1030.
[2] MESHKANI R, ADELI K. Hepatic insulin resistance, metabolic syndrome and cardiovascular disease[J]. Clin Biochem, 2009, 42(6): 1331-1346.
[3] GREEN DR, LEVINE B. To be or not to be? How selective autophagy and cell death govern death cell fate[J]. Cell, 2014, 157(1): 65-75.
[4] MARTINEZ-LOPEZ N, SINGH R. Autophagy and lipid droplets in the liver[J]. Annu Rev Nutr, 2015, 35: 215-237.
[5] ESKELINEN EL, SAFTIG P. Autophagy: a lysosomal degradation pathway with a central role in health and disease[J]. Biochim Biophys Acta, 2009, 1793(4): 664-673.
[6] HIROSAKO K, IMASATO H, HIROTA Y, et al. 3-Methyladenine specifically inhibits retrograde transport of cation-independent mannose 6-phosphate/insulin-like growth factor II receptor from the early endosome to the TGN[J]. Biochem Biophys Res Commun, 2004, 316(3): 845-852.
[7] ROSENFELDT MT, RYAN KM.The multiple roles of autophagy in cancer[J]. Carcinoqenesis, 2011, 32(7): 955-963.
[8] MIJALJICA D, PRESCOTT M, DEVENISH RJ. Autophagy in disease[J]. Methods Mol Biol, 2010, 648: 79-92.
[9] CZAJA MJ. Autophagy in health and disease. 2. Regulation of lipid metabolism and storage by autophagy: pathophysiological implications[J]. Am J Physiol Cell Physiol, 2010, 298(5): c973-c978.
[10] MARTINEZ-VICENTE M, TALLOCZY Z, WONG E, et al. Cargo recognition failure is responsible for inefficient autophagy in Huntington′s disease[J]. Nat Neurosci, 2010, 13(5): 567-576.
[11] YOSHIZAKI T, KUSUNOKI C, KONDO M, et al. Autophagy regulates inflammation in adipocytes[J]. Biochem Biophys Res Commun, 2012, 417(1): 352-357.
[12] CHRISTIAN P, SACCO J, ADELI K. Autophagy: emerging roles in lipid homeostasis and metabolic control[J]. Biochim Biophys Acta, 2013, 1831(4): 819-824.
[13] KIMURA S, FUJITA N, NODA T, et al. Monitoring autophagy inmammalian cultured cells through the dynamics of LC3[J]. Methods Enzymol, 2009, 452: 1-12.
[14] KADOWAKI M, KARIM MR. Cytosolic LC3 ratio as a quantitative index of macroautophagy[J]. Methods Enzymol, 2009, 452: 199-213.
Interactionbetweenautophagyandlipidmetabolismincellmodelsofnonalcoholicfattyliverdisease
YANRong,NIUChunyan,YULu,etal.
(DepartmentofGastroenterology,TheFirstAffiliatedHospitalofXi′anMedicalCollege,Xi′an710077,China)
ObjectiveTo investigate the interaction between autophagy and lipid metabolism in nonalcoholic fatty liver disease (NAFLD).MethodsHuman hepatocytes (steatosis) were cultured in vitro to establish a cell model of NAFLD. Rapamycin was used to induce autophagy and 3-methyladenine was used to inhibit autophagy. MTT colorimetry was used to measure cell viability. ELISA was used to measure the levels of triglyceride (TG), alanine aminotransferase (ALT), aspartate aminotransferase (AST), lactate dehydrogenase (LDH), gamma-glutamyl transpeptidase (GGT), and albumin (Alb). IF method was used to determine the location and distribution of LC3-II. Western blot was used to measure LC3-II/LC3-I ratio. An analysis of variance was used for comparison of continuous data between groups, and the SNK-qtest was used for further comparison between two groups.ResultsCompared with the steatosis group, the induced autophagy group had significant reductions in absorbance and cell viability (HL-7702 cells:q=4.160 and 4.110,P<0.05; SK-HEP-1 cells:q=4.407 and 4.032,P<0.05). Compared with the control group, the steatosis group had significant increases in the levels of TG, ALT, AST, LDH, GGT, and Alb (HL-7702 cells:q=5.316, 3.730, 4.013, 6.967, 6.192, and 5.531,P<0.05; SK-HEP-1 cells:q=4.963, 3.603, 4.774, 7.479, 6.319, and 5.193,P<0.05). Compared with the steatosis group, the induced autophagy group had significant reductions in the levels of TG, ALT, AST, LDH, GGT, and Alb (HL-7702 cells:q=4.978, 3.695, 3.960, 5.130, 4.695, and 3.192,P<0.05; SK-HEP-1 cells:q=3.846, 5.575, 4.184, 5.019, 4.203, 3.049,P<0.05). The induced autophagy group had the highest percentage of LC3-II-positive HL-7702 cells (90.1%) and LC3-II-positive SK-HEP-1 cells (80.0%), followed by the steatosis group (47.2% LC3-II-positive HL-7702 cells and 48.4% LC3-II-positive SK-HEP-1 cells) and the autophagy inhibition group (30.2% LC3-II-positive HL-7702 cells and 45.5% LC3-II-positive SK-HEP-1 cells). The induced autophagy group had a significant increase in LC3-II/IC3-I ratio compared with the steatosis group (HL-7702 cells:q=6.786,P<0.05; SK-HEP-1 cells:q=5.926,P<0.05).ConclusionUpregulation of autophagy can promote the elimination of liver fat, while downregulation of autophagy can promote lipid accumulation.
fatty liver; autophagy; lipid metabolism
R575.5
A
1001-5256(2017)10-1981-06
10.3969/j.issn.1001-5256.2017.10.027
2017-06-30;
2017-07-27。
陜西省教育廳科研基金(2013JK0788)
閆蓉(1983-),女,主治醫師,主要從事脂肪肝及胃腸動力性疾病研究。
牛春燕,電子信箱:nchy69@163.com。
引證本文:YAN R, NIU CY, YU L, et al. Interaction between autophagy and lipid metabolism in cell models of nonalcoholic fatty liver disease[J]. J Clin Hepatol, 2017, 33(10): 1981-1986. (in Chinese)
閆蓉, 牛春燕, 于璐, 等. 非酒精性脂肪性肝病細胞模型中自噬與脂質代謝的相互調節[J]. 臨床肝膽病雜志, 2017, 33(10): 1981-1986.
(本文編輯:朱 晶)

