海蛾活性部位抑制人宮頸癌HeLa細胞增殖及誘導凋亡作用研究
李 鋒,裴世鋒,石賢愛
(福州大學1. 藥物生物技術與工程研究所、2. 化學學院、3. 福建省醫療器械與醫藥技術重點實驗室, 福建 福州 350116)
海蛾活性部位抑制人宮頸癌HeLa細胞增殖及誘導凋亡作用研究
李 鋒1,2,裴世鋒2,石賢愛1,3
(福州大學1. 藥物生物技術與工程研究所、2. 化學學院、3. 福建省醫療器械與醫藥技術重點實驗室, 福建 福州 350116)
目的從中藥材海蛾中分離具有抑制人宮頸癌HeLa細胞增殖活性的組分,并探討其誘導凋亡的機制。方法采用生物活性追蹤法對海蛾乙醇浸提物進行硅膠柱層析、葡聚糖凝膠Sephadex LH-20柱層析分離抗腫瘤活性組分;采用MTT法評價其對腫瘤細胞的抑制作用;采用AO/EB、PI及Annexin V-FITC/PI熒光染色流式細胞術分析其誘導凋亡作用;通過分析腫瘤細胞中caspase-3活性及凋亡相關基因的蛋白表達水平,探討其誘導凋亡的可能機制。結果從海蛾中分離得到了具有較高HeLa細胞抑制活性的組分C22,得率為0.73‰,IC50為36.3 mg·L-1;組分C22作用于HeLa細胞后,可致細胞處于亞二倍期的比例增加、磷脂酰絲氨酸外翻等典型細胞凋亡現象,且具有劑量依賴性;組分C22可下調HeLa細胞Bcl-2的表達,降低胞內Bcl-2/Bax比例,增加caspase-3酶活性。結論海蛾活性組分C22能誘導人宮頸癌HeLa細胞凋亡,抑制腫瘤細胞增殖,其誘導凋亡的機制可能是通過線粒體途徑的Bcl-2/caspase通路發揮作用。
海蛾;HeLa細胞;生物活性追蹤法;誘導凋亡;流式細胞術;Bcl-2;caspase-3
海蛾(PegasuslaternariusCuvier),又名海麻雀,隸屬于輻鰭魚綱(Class Actinopterygi),鱸形魚系(Series Percomorpha),海蛾魚目(Pegasiformes),海蛾魚屬(Pegasus LinnePlus)[1],是一種海洋底層性生活的小型魚類,廣布于西太平洋及印度洋熱帶、亞熱帶水域,一般棲息于暖水性淺海的底層。我國廣東、福建一帶海域分布較多,其干燥實體為我國傳統名貴中藥材,性味咸、溫,具散結、消腫、解毒之功效。民間常作為溫補藥材使用。近年來研究發現[2],海蛾魚體含多種生物活性物質,并進行了多方面藥理活性研究。許實波等[3]研究了海蛾提取物的抗血栓活性,結果表明海蛾提取物能夠明顯抑制大鼠實驗性頸動脈血栓的形成,以及誘導劑所致腦血栓的形成,提示海蛾提取物具有明顯的抗血栓活性;唐孝禮等[4]研究發現,海蛾提取物可使氫化可的松或環磷酰胺所致免疫力低下的小鼠脾臟和胸腺重量增加,提示海蛾提取物具有提高免疫力的活性;Li等[5]研究發現,海蛾提取物能夠明顯提高體外培養神經細胞的存活率,對神經細胞突起的生長有明顯的促進作用,并對興奮性氨基酸誘導凋亡、過氧化氫損傷和血清剝奪損傷等3種中樞神經系統細胞損傷具有一定的保護作用,其機制與提高細胞內源性超氧化物歧化酶(superoxide dismutase,SOD)活性,防止脂質過氧化反應有關。雖然我國傳統醫學中有將海蛾用于腫瘤治療的記載[6],但有關海蛾活性組分抗腫瘤及其機制探討方面的研究鮮見報道。本研究以生物活性追蹤法提取分離海蛾中可抑制人宮頸癌HeLa細胞的活性組分,并對其抑制腫瘤細胞增殖及誘導凋亡的作用機制進行了探討。
1 材料與方法
1.1細胞與試劑人宮頸癌HeLa細胞株購于中國科學院上海典藏細胞庫;海蛾藥材干品購于福州同春中藥有限公司,產自廣東汕頭海域,由福州大學藥物生物技術與工程技術研究所鑒定為短尾海蛾魚;DMEM培養基、胎牛血清、胰蛋白酶(美國Hyclone公司); 二甲基亞砜(DMSO)、MTT,購自美國Sigma公司;吖啶橙/溴乙錠(AO/EB)、碘化丙啶(propidium iodide, PI)、Annexin V-FITC/PI染色試劑盒、RIPA細胞組織裂解液(強)、PMSF蛋白酶抑制劑,購自南京凱基生物技術公司;兔抗人Survivin、Bcl-2、Bax多克隆抗體、兔抗人β-actin單克隆抗體,購自武漢Proteintech公司;超敏ECL、caspase-3活性檢測試劑盒、BCA試劑盒,購自北京鼎國生物技術公司;其他化學試劑均為分析純,購于國藥集團化學試劑有限公司。
1.2儀器CO2培養箱(550型,美國Nuaire公司);流式細胞儀(COULTER EPICS XL型,美國Beckman公司);倒置顯微鏡(XDS-1B型,重慶光電公司);熒光顯微鏡(50i型,日本Nikon公司);酶標儀(CENios型,瑞士Tecan公司);全自動凝膠成像分析儀(JS-380C型,上海培清);冷凍離心機(Z323K型,德國Hermle)。
1.3海蛾抗腫瘤活性組分的分離采用生物活性追蹤法對海蛾抗腫瘤組分進行分離。海蛾干品研磨粉碎后,以料液比1 ∶15(W/V)90%乙醇45℃提取3 h,提取3次,合并提取液。提取液45℃減壓濃縮至膏狀,得粗提物,-20℃保存。膏狀粗提物用丙酮溶解后,與少量硅膠混合,揮發丙酮至干,上硅膠柱,分別采用石油醚、乙酸乙酯、甲醇、50%甲醇/水作為洗脫劑進行洗脫,各洗脫2 床層體積(bed volume, Bv),分別收集洗脫液,經減壓濃縮真空干燥后,分別得到A1、A2、A3、A44個組分。對其中腫瘤細胞抑制活性最高的A2繼續進行硅膠柱層析,洗脫劑分別為石油醚、乙酸乙酯和甲醇,各洗脫2 Bv,得到B1、B2、B33個組分。對其中活性最高的B2組分繼續進行Sephadex LH-20柱層析分離,洗脫劑以氯仿/甲醇5 ∶5、4 ∶6、3 ∶7、2 ∶8、1 ∶9的比例階梯洗脫,各洗脫0.5 Bv,紫外檢測器在線檢測,檢測波長為254 nm,根據洗脫譜圖,得到C21、C22、C233個組分。后續對其中活性最高的C22進行各項研究。
1.4MTT法測定受試物對HeLa細胞增殖的抑制作用人宮頸癌HeLa細胞,用DMEM培養基(含15% FBS、100 kU·L-1鏈霉素、100 kU·L-1青霉素),置于5% CO2、37℃培養箱中培養,每48 h換液1次。取對數生長期的細胞,用0.25%胰酶消化,制備細胞懸液,密度調整至1×108·L-1,每孔100 μL,接種于96孔板,繼續培養24 h,隨后轉換成含各受試物的無血清培養基,繼續培養24~48 h。培養板吸去培養基,加入含5 g·L-1MTT的無血清、無酚紅培養基,繼續培養4 h,吸棄MTT溶液,加入DMSO溶解所形成的甲臜晶體,570 nm測定吸光度值。
細胞抑制率/%=(對照組吸光值-處理組吸光值)/對照組吸光值×100%
1.5AO/EB染色觀察細胞凋亡形態將處于對數生長期的生長狀態良好的HeLa細胞接種于12孔板中,5×104個/孔,進行載玻片爬片培養。待細胞完全貼壁生長后,吸棄舊培養基,分別加入終濃度為20、40、60 mg·L-1的組分C22,并設空白對照組。培養48 h后,吸出培養基,PBS漂洗1次。將AO與EB染料等體積混合成工作染液,向蓋玻片上滴加20~100 μL 1 ∶100稀釋的AO/EB染料,避光染色2 min,PBS洗2~3次,每次數秒。510 nm激發波長,熒光顯微鏡下觀察。
1.6PI染色檢測細胞周期分布取對數生長期的HeLa細胞接種于6孔板中,2.0×105個/孔。培養24 h后,培養基換為分別含C22組分10、20、40、60 mg·L-1的無血清培養基,培養48 h后,胰酶消化,2 000 r·min-1×5 min離心收集細胞,PBS洗2次。加1 mL預冷的70%乙醇,于-20 ℃固定12 h,離心收集細胞。按照PI試劑盒說明書操作,對細胞進行PI染色。200目尼龍網過濾,488 nm激發波長,流式細胞儀檢測,每次檢測收集104個細胞。實驗數據由Multicycle for Windows軟件分析。
1.7AnnexinV-FITC/PI雙染分析細胞凋亡于6孔板中,用含C22分別為5、10、20、40、60 mg·L-1的無血清培養基處理細胞48 h。胰酶消化,2 000 r·min-1×5 min離心收集細胞,PBS洗2次。后續按照Annexin V-FITC/PI試劑盒說明書操作,對細胞進行染色。流式細胞儀檢測、分析。激發波長488 nm,發射波長530 nm,FITC標記Annexin V的綠色熒光通過FITC通道(FL1)檢測,PI紅色熒光通過PI通道(FL3)檢測。
1.8細胞caspase-3酶活性分析將處于對數生長期的細胞,按2×105個/孔的密度接種于6孔培養板中,設置空白對照組,培養24 h后,分別加入不同濃度的C22處理細胞48 h,收集蛋白,采用caspase-3酶活性檢測試劑盒檢測,按照試劑盒說明書操作。
1.9Westernblot分析凋亡相關蛋白的表達取對數生長期的HeLa細胞接種于6孔板中,2.0×105個/孔。培養24 h后,培養基換為分別含C22組分20、40、60 mg·L-1的培養基,培養48 h后,用4℃預冷PBS洗滌細胞2次,吸棄洗液,置于冰上。用細胞刮刀刮下細胞,用預冷PBS收集,4 000×g離心2 min收集細胞。按每106個細胞100 μL加入含PMSF的RIPA裂解液,于冰上充分裂解。于4℃ 12 000×g離心5 min,取上清用于后續實驗。蛋白濃度采用BCA試劑盒測定,每份定量為10 μg總蛋白,SDS-PAGE電泳分離蛋白,電轉移至PVDF膜。PVDF膜與一抗于4℃孵育過夜,之后用相應HRP標記的二抗37℃孵育1 h。室溫下用TBST振蕩洗滌3次,每次10 min。將ECL化學發光底物A、B液等體積混合后,與膜蛋白面充分接觸。之后將膜移至保鮮膜上,放入X線片夾中,于暗室中,曝光10~30 min。取出X線片,顯影,定影,沖去殘留定影液,室溫下晾干。X膠片用凝膠成像系統拍照。
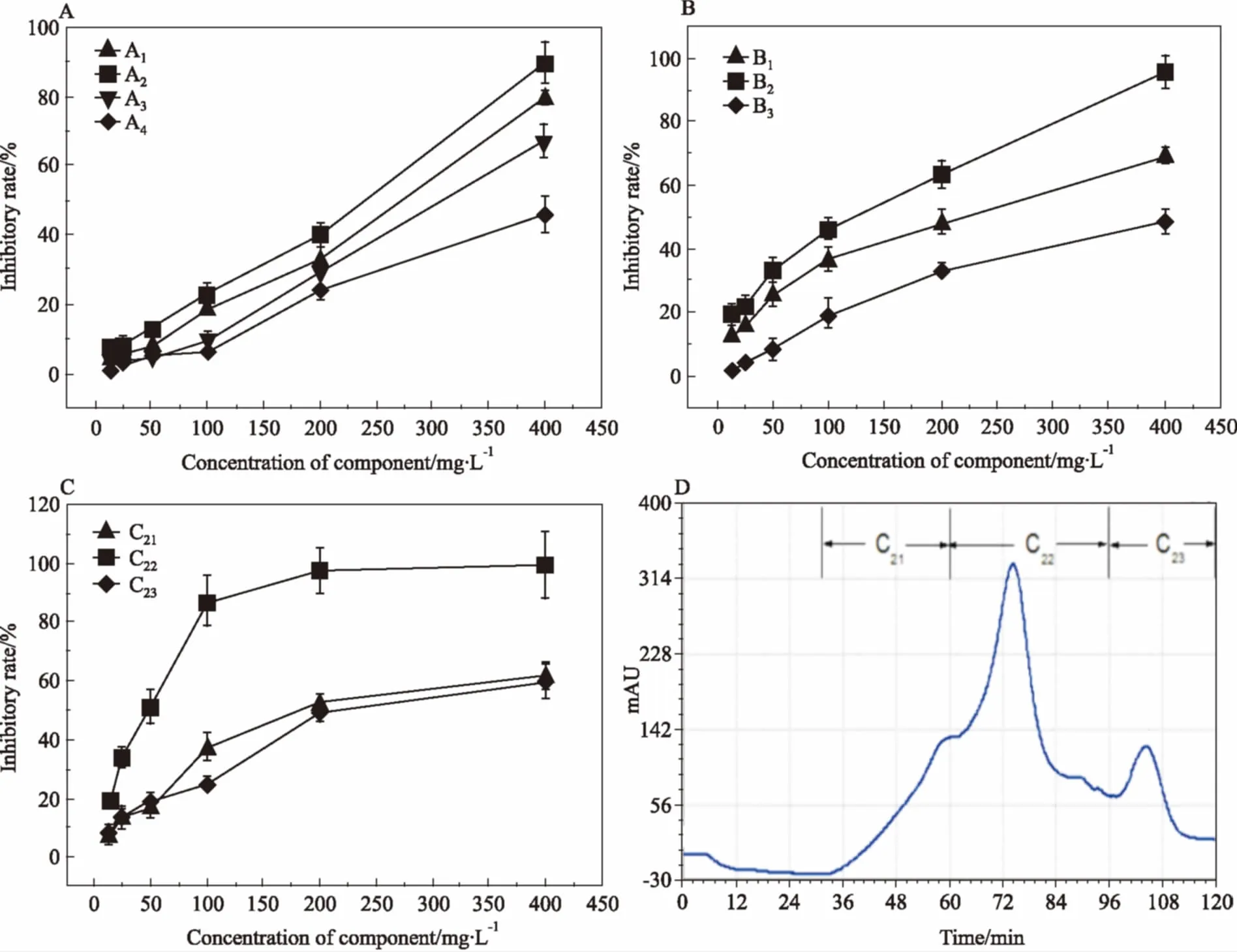
Fig 1 Inhibitory ratios of all fractions on HeLa cells and chromatography of Sephadex LH-20
A:Inhibitory ratios of A series fractions on HeLa cells; B: Inhibitory ratios of B series fractions; C: Inhibitory ratios of C series fractions; D: Sephadex LH-20 chromatograph of C fractions
2 結果
2.1海蛾抑制HeLa細胞增殖活性組分的分離采用生物活性追蹤法分離海蛾的抗腫瘤組分。2.7 kg海蛾藥材經干燥、粉碎后得到2.33 kg粉狀物,采用90%乙醇浸提得到310.2 g粗提物,得率為13.33%。粗提物經第1輪硅膠柱層析后得到A1、A2、A3、A44個組分,各組分得率和對HeLa細胞抑制IC50如Tab 1和Fig 1A所示,其中組分A2抑制活性最強,IC50值為182.4 mg·L-1,對其繼續進行分離。對A2組分進行第2輪硅膠柱層析,得到B1、B2、B33個組分,各組分得率和對HeLa細胞抑制IC50如Tab 1和Fig 1B所示,其中組分B2抑制活性最強,IC50值為83.8 mg·L-1,對其繼續進行分離。對組分B2進行第3輪Sephadex LH-20柱層析,洗脫圖譜如Fig 1D所示,得到C21、C22、C233個組分,其得率和IC50值如Tab 1和Fig 1C所示。其中C22組分抑制活性最強,IC50值達到36.3 mg·L-1。因此,本實驗后續研究以C22為受試物,考察其對HeLa細胞增殖的抑制作用及誘導細胞凋亡的作用機制。
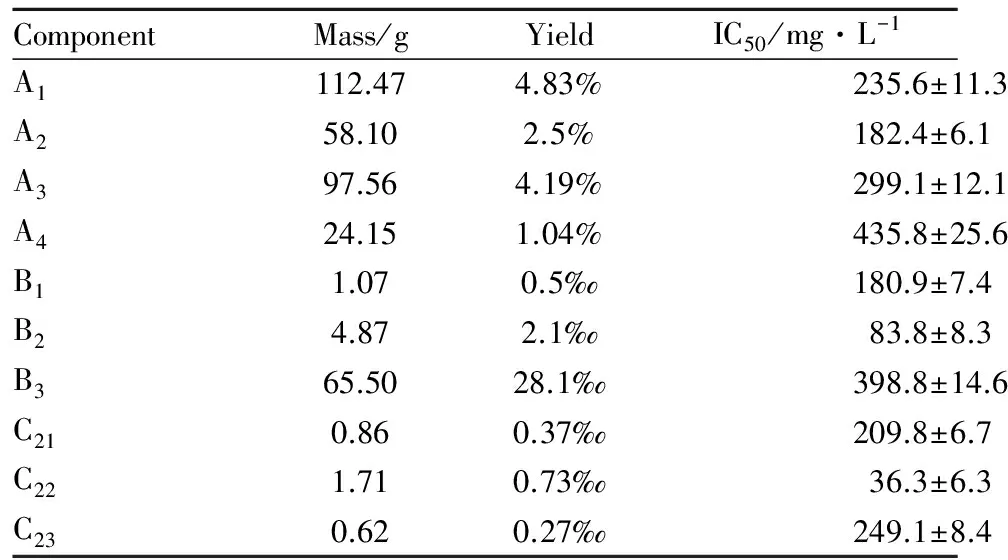
Tab 1 Yield of each component and IC50 against HeLa cells
2.2組分C22對HeLa細胞增殖的抑制作用不同濃度的組分C22處理HeLa細胞48 h后,于倒置顯微鏡下觀察細胞形態,結果如Fig 2所示。對照組細胞形態均一,呈明顯的梭形結構。隨著藥物濃度的增加,細胞形態發生變化,梭形細胞數量逐漸減少,細胞形態逐漸變圓或固縮,細胞碎片增多。當藥物濃度達到40 mg·L-1時,細胞數量明顯減少,固縮細胞增多,視野內可明顯觀察到細胞碎片。至60 mg·L-1時,大部分細胞生長受到抑制。
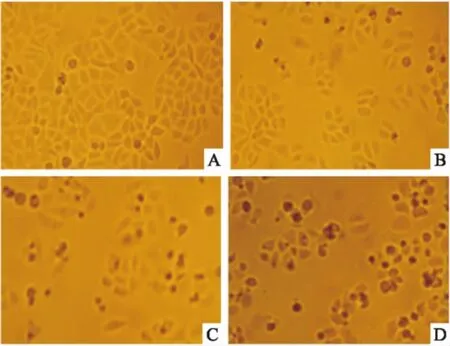
Fig 2 Morphological observation of HeLa cells treated withdifferent concentrations of component C22 for 48 h(×100)
A: Control; B: C2220 mg·L-1; C: C2240 mg·L-1; D: C2260 mg·L-1
2.3組分C22促HeLa細胞凋亡形態分析AO/EB染色法觀察,正常細胞呈明顯梭狀結構,顯綠色熒光,細胞核與細胞質區分明顯,熒光深淺不一。如Fig 3所示,正常對照細胞呈梭形結構,顯綠色熒光,輪廓清晰,大小形態較單一;藥物作用濃度20 mg·L-1條件下,少量細胞所染綠色不均勻、較模糊,細胞出現長條形、新月形等不規則形態,此即為早期凋亡細胞;至60 mg·L-1時,大部分細胞進入凋亡晚期,呈固縮狀或圓珠狀,顯橘紅色熒光,染色質固縮,細胞核碎裂成點狀,大小不一。結果表明,組分C22誘導HeLa細胞凋亡,具有劑量依賴性趨勢。
2.4組分C22處理對HeLa細胞周期分布的影響經PI試劑盒染色處理后,采用流式細胞儀分析不同濃度的C22作用于HeLa細胞48 h后的細胞周期分布情況。如Fig 4所示,隨著組分C22濃度的增加(10~60 mg·L-1),處于亞二倍期(Sub-G0/G1)的細胞所占比例明顯增加(1.4%~19.7%),而處于其他期的細胞數量逐漸減少,表明組分C22對HeLa細胞具有誘導凋亡作用,其誘導凋亡作用與劑量呈正相關。
2.5AnnexinV/PI雙染法分析組分C22對HeLa細胞的誘導凋亡作用Annexin V-FITC/PI試劑盒分析不同濃度的組分C22處理HeLa細胞48 h的凋亡情況。如Fig 5所示,對照組正常細胞占細胞總數的95.5%。20 mg·L-1的組分C22作用于HeLa細胞48 h后,正常細胞占細胞總數的84%,12.9%的細胞處于凋亡前期,顯現出一定的誘導凋亡作用。隨著藥物濃度的增大,正常細胞比例下降,凋亡率逐漸增加,當C22濃度提高至60 mg·L-1時,處理48 h的HeLa細胞的總凋亡率(Q2+Q4)上升到39.4%,正常細胞僅占細胞總數的60.3%,明顯低于低濃度組,表明組分C22誘導HeLa細胞凋亡作用具有劑量依賴性。
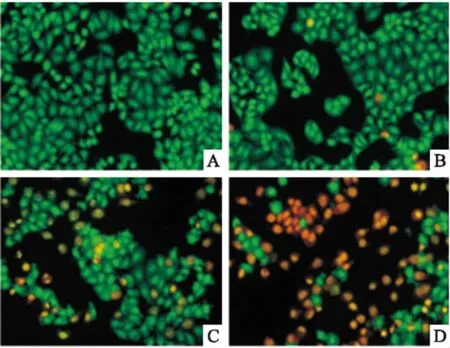
Fig 3 Apoptotic morphology of HeLa cells treatedwith component C22 for 48 h by AO/EB staining
A:Control;B:C2220 mg·L-1;C:C2240 mg·L-1;D:C2260 mg·L-1
2.6組分C22處理對HeLa細胞caspase-3酶活性的影響Caspase-3酶活性的上升是細胞凋亡進程中的重要事件,能反映細胞的凋亡狀態[7],本研究分析了C22對HeLa細胞caspase-3總酶活性的影響。如Fig 6所示,與陰性對照組比較,隨組分濃度的逐漸增大,caspase-3酶活性逐漸升高,C2240、60 mg·L-1時,總酶活性分別是陰性對照組的1.8倍和2.1倍,差異有顯著性。表明組分C22可能是通過caspase-3依賴途徑,誘導HeLa細胞發生凋亡。
2.7組分C22對HeLa細胞Survivin、Bcl-2、Bax表達的影響通過Western blot法分析了C22處理對于細胞凋亡進程中重要蛋白Survivin、Bcl-2、Bax表達的影響。如Fig 7所示,隨著組分C22濃度的升高,Bcl-2蛋白含量明顯降低,而Survivin蛋白含量降低不明顯,Bax蛋白含量無明顯變化,但Bcl-2/Bax比例明顯降低。提示C22作用于HeLa細胞后,能通過抑制Bcl-2基因的表達,促進細胞凋亡。
3 討論
本研究以海蛾藥材為原料,采用生物活性追蹤法,經乙醇浸提、硅膠樹脂柱層析、Sephadex LH-20柱層析等分離手段,得到了一個對HeLa細胞具有較強抑制活性和誘導凋亡作用的組分C22。經AO/EB染色熒光分析細胞形態、PI染色流式細胞術分析細胞周期分布、Annexin V-FITC/PI染色流式細胞術分析細胞凋亡等實驗,確認了C22組分對HeLa細胞的誘導凋亡作用,且具有劑量依賴性。
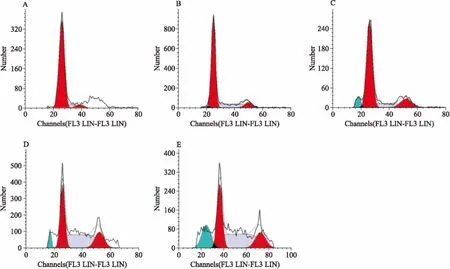
Fig4EffectofcellcycledistributionsofHeLacellstreatedwithdifferentconcentrationsofcomponentC22
A:Control;B:C2210 mg·L-1;C:C2220 mg·L-1;D:C2240 mg·L-1;E:C2260 mg·L-1
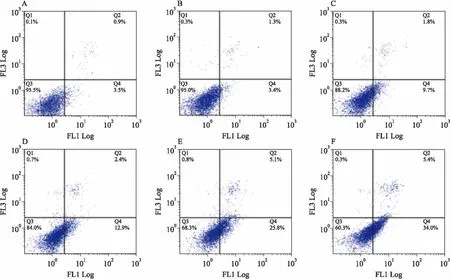
Fig 5 The apoptosis-inducing effect of component C22 tested by AnnexinV/PI staining assay
A:Control;B:C225 mg·L-1;C:C2210 mg·L-1;D:C2220 mg·L-1;E:C2240 mg·L-1; F:C2260 mg·L-1
誘導細胞產生凋亡有多種機制,凋亡信號的傳導途徑有線粒體途徑、死亡受體途徑、內質網途徑等[8-10],其中以線粒體途徑和死亡受體途徑為主,對其研究也最多[7]。Bcl家族蛋白是一類凋亡進程的重要調節因子,可調控釋放細胞色素C,啟動caspase級聯反應,最終導致凋亡的發生。Bcl-2蛋白作為細胞凋亡的抑制基因,在caspase級聯放大與線粒體之間扮演著“橋梁”的作用[7,11]。在多種人源腫瘤細胞株可觀察到Bcl-2過度表達[7,12],而在分化細胞或將凋亡細胞中表達量很低或不表達。Caspase-3是caspase級聯反應中的關鍵執行分子,其功能涉及細胞DNA碎片、染色質凝聚和凋亡小體的形成[13-14]。在細胞發生凋亡階段,caspase-3被激活,裂解相應的胞內底物,最終導致細胞凋亡發生[15]。故caspase-3總酶活力的提高是細胞凋亡中的重要事件,對于鑒定藥物的誘導凋亡作用具有重要的意義。本研究通過分析腫瘤細胞caspase-3酶活性、凋亡相關控制基因的蛋白表達水平,對C22誘導HeLa細胞凋亡機制進行了初步探討。結果表明,C22處理細胞能明顯提高腫瘤細胞的caspase-3酶活性,降低凋亡抑制基因Bcl-2的表達水平及胞內Bcl-2/Bax比例,促進細胞凋亡,與劑量呈正相關。

Fig 6 The relative caspase-3 activityin HeLa cells treated with C22
*P<0.05,**P< 0.01vscontrol
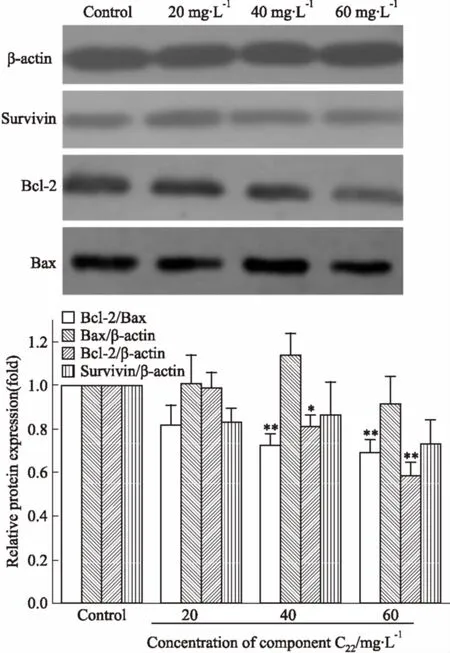
Fig 7 Effects of C22 on expression of Survivin,Bcl-2 and Bax proteins in HeLa cells
*P<0.05,**P<0.01vscontrol
綜上所述,本研究采用生物活性追蹤法,從海蛾中分離得到一個對人宮頸癌HeLa細胞增殖具有較強抑制作用的組分C22,其得率為0.73‰,IC50為45.3 mg·L-1。C22可能通過Bcl-2/caspase途徑誘導HeLa細胞產生凋亡。
(致謝:本實驗在福州大學藥物生物技術與工程研究所實驗室完成,感謝郭養浩教授和在本課題研究中給予幫助的老師和同學。)
[1] 李明德.魚類分類學[M]. 青島: 海洋出版社, 1998: 158-9.
[1] Li M D.Fishtaxonomy[M].Qingdao:China Ocean Press,1998:158-9.
[2] 李瑞聲, 陳卓亮, 龍康侯, 等. 海洋藥物海蛾化學成分的研究[J]. 中山大學學報(自然科學版), 1993,32(3): 132-3.
[2] Li R S, Chen Z L, Long K H, et al. Studies on the chemical constituents of the ChinesePegasuslaternariusCuvier[J].ActaSciNatUnivSunyatsen, 1993,32(3): 132-3.
[3] 許實波, 周 軍, 李瑞聲. 海蛾提取物的抗血栓作用研究[J]. 中山大學學報論叢, 1994, (6):23-7.
[3] Xu S B, Zhou J, Li R S. Study on antithrombotic effect of extract fromPegasuslaternariusCuvier[J].JSunYatsenUniv, 1994,(6):23-7.
[4] 唐孝禮, 顏光美, 許實波. 海蛾提取物對小鼠免疫器官重量和抗應激能力的影響[J]. 中藥材, 1999,6(22): 300-3.
[4] Tang X L, Yan G M, Xu S B. Effects of extracts fromPegasuslaternariuson the weight of immune organs and the antistress in mice[J].ChinTraditHerbDrug, 1999,6(22): 300-3.
[5] Li M, Chen M, Huang H, et al. Neuroprotective effects of active ingredients isolated fromPegasuslaternariuson cultured cerebral neurons[J].CellMolNeurobiol, 2011,31(1): 73-82.
[6] 上海醫藥工業研究院. 中國藥用海洋生物[M]. 上海: 上海人民出版社, 1977: 144-5.
[6] Shanghai Institute of Pharmaceutical Industry.Chinesemedicinalmarineorganisms[M]. Shanghai: Shanghai People Press, 1977: 144-5.
[7] Mohan C.SignalTransduction:AShortOverviewofItsRoleinHealthandDisease[M]. Merck/EMD Biosciences,2010:67-72.
[8] Buja L M, Eigenbrodt M L, Eigenbrodt E H. Apoptosis and necrosis, basic types and mechanisms of cell death[J].ArchPatholLabMed, 1993,117(12):1208-14.
[9] Brojatsch J, Naughton J, Rolls M M, et al. CARl, a TNFR-related protein is a cellular receptor for cytopathic avian leucosis-sarcoma viruses and mediates apoptosis[J].Cell, 1996,87(5): 845-52.
[10] 宋金蓮, 馬中良, 遲曉偉,等. 天然活性分子isatin經p53介導的線粒體途徑誘導乳腺癌細胞MCF-7凋亡[J]. 中國藥理學通報, 2016,32(6):773-8.
[10] Song J L, Ma Z L, Chi X W, et al. The endogenous oxindole isatin induces apoptosis of MCF-7 breast cancer cells through a p53-mediated mitochondrial pathway[J].ChinPharmacolBull, 2016,32(6):773-8.
[11] 孫秀玉, 劉立亞, 吳宥熹,等. Bcl-2家族對線粒體質量控制的調控研究[J]. 中國藥理學通報, 2015,31(12):1633-6.
[11] Sun X Y, Liu L Y, Wu Y X, et al. On mitochondrial quality control regulated by Bcl-2 family[J].ChinPharmacolBull, 2015,31(12):1633-6.
[12] 譙 敏, 向廷秀, 王丕龍, 等. 靶向COX-2的siRNA抑制三種不同分化程度胃癌細胞生長及作用機制[J]. 第四軍醫大學學報, 2006,27(14) : 1318-21.
[12] Qiao M, Xiang T X, Wang P L, et al. Inhibitory effect of siRNA targeting COX-2 on the growth of gastric carcinoma cells of well, moderate or poor differentiation and its mechanism[J].JFourthMilMedUniv, 2006,27(14): 1318-21.
[13] Kerr J F, Wyllie A H, Currie A R. Apoptosis a basic biological phenomenon with wide-ranging implications in tissue kinetics[J].BritJCancer, 1972,26(4): 239-57.
[14] Garrido C, Galluzi L, Brunet M, et al. Mechanism of cytochrome C release from mitochondria[J].CellDeathDiffer, 2006,13(9): 1423-6.
[15] Cain K, Brown D G, Langlais C, et al. Caspase activation involves the formation of the aposome, a large(approximately 700kd) caspase-activating complex[J].JBiolChem, 1999,274(32): 22686-92.
EffectsofactivefractionfromPegasuslaternariusCuvieronproliferationandapoptosisofhumancervicalcancerHeLacells
LI Feng1,2, PEI Shi-feng2, SHI Xian-ai1,3
(1.InstitueofPharmaceuticalBiotechnologyandEngineering, 2.CollegeofChemistry, 3.FujianKeyLabofMedicalInstrument&PharmaceuticalTechnology,FuzhouUniversity,Fuzhou350116,China)
AimTo isolate HeLa cell proliferation-inhibitory active fraction fromPegasuslaternariusCuvier and explore its potential apoptosis-inducing mechanism.MethodsTo obtain the active fraction, the ethanol extract ofPegasuslaternariusCuvier was chromatographed by silica gel and sephadex LH-20 columns; MTT assay was used to evaluate the proliferation-inhibitory ability of active fraction on HeLa cells; AO/EB, PI and Annexin V-FITC/PI fluorescent staining flow cytometry were used to evaluate its apoptosis-inducing ability; the possible mechanism was investigated by analyzing the enzyme activity of caspase-3 and the protein expression of apoptosis-related genes in tumor cells.ResultsA fraction of C22with high HeLa proliferation-inhibitory activity was isolated, with a yield of 0.73 ‰ and an IC50of 36.3 mg·L-1; fraction C22could increase the proportion of cells in sub-G0/G1phase, phosphatidylserine eversion and other typical cell apoptosis in a dose-dependent manner; fraction C22could down-regulate the expression of Bcl-2 and increase the enzyme of caspase-3 in HeLa cells.ConclusionsThe active fraction C22fromPegasuslaternariusCuvier can inhibit the proliferation of HeLa cells by inducing apoptosis. The effect of inducing apoptosis may be conducted through mediating the mitochondrial Bcl-2/caspase pathway.
PegasuslaternariusCuvier; HeLa cells; bioassay-guided method; apoptosis-inducing; flow cytometry; Bcl-2; caspase-3
A
1001-1978(2017)11-1546-07
R 282.77;R 329.24;R 329.25;R 737.330.22
時間:2017-10-10 10:05 網絡出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.028.html
10.3969/j.issn.1001-1978.2017.11.014
2017-06-05,
2017-07-12
福建省自然科學基金資助項目(No 2017J01580)
李 鋒(1976-),男,碩士,助理研究員,研究方向:天然成分生物活性,E-mail:lifeng9676@aliyun.com; 石賢愛(1971-),男,博士,教授,研究方向:藥物生物技術,通訊作者,E-mail:shixa@fzu.edu.cn