新柏氏細胞清洗液在血性胸腹水細胞學診斷中的應用
朱啟淦,孟加榕,禹 樂,戴太監,楊立民,陳藝錦,耿月華
(中國人民解放軍第一七五醫院,廈門大學附屬東南醫院病理科,漳州 363000;*通訊作者,E-mail:mengjiarong@ sina.com)
新柏氏細胞清洗液在血性胸腹水細胞學診斷中的應用
朱啟淦,孟加榕*,禹 樂,戴太監,楊立民,陳藝錦,耿月華
(中國人民解放軍第一七五醫院,廈門大學附屬東南醫院病理科,漳州 363000;*通訊作者,E-mail:mengjiarong@ sina.com)
目的 探討新柏氏細胞清洗液在血性胸腹水脫落細胞學檢測中的應用及意義。 方法 收集我院2016-12~2017-04血性胸腹水130例,用新柏氏細胞清洗液處理后行液基細胞學制片(TCT)、細胞塊切片聯合免疫細胞化學檢測;傳統檢測法未用新柏氏細胞清洗液處理,直接離心涂片及細胞塊切片檢測。 結果 130例血性胸腹水傳統檢測法涂片及細胞塊切片中細胞重疊明顯,常成堆分布,因含大量紅細胞、蛋白黏液,造成背景不清晰;用新柏氏細胞清洗液處理后TCT及細胞塊切片中紅細胞數量與傳統檢測法相比明顯減少,且間皮細胞、腫瘤細胞、淋巴細胞等輪廓清楚,細胞染色清晰。130例血性胸腹水標本傳統細胞涂片腫瘤細胞檢出率為16.15%(21/130),TCT法腫瘤細胞檢出率為29.23%(38/130),兩種方法HE染色結果差異有統計學意義(P<0.05);細胞塊切片結合免疫細胞化學法腫瘤細胞檢出率為36.15%(47/130),與TCT陽性率比較差異無統計學意義(P>0.05)。 結論 血性胸腹水經新柏氏細胞清洗液去紅細胞、黏液及蛋白液等處理,并采用TCT法及細胞塊切片聯合免疫細胞化學法能有效提高腫瘤細胞的檢出率。
血性胸腹水; 液基細胞學; 細胞塊; 免疫細胞化學
脫落細胞學檢查是臨床診斷腫瘤的重要方法之一,但血性胸腹水在細胞學標本制片過程中,由于標本中含有大量紅細胞,使涂片及細胞塊切片被紅細胞覆蓋,給細胞學診斷帶來困難,特別是含血細胞較多而癌細胞又很少時,紅細胞會將很少的癌細胞掩蓋,致使細胞學診斷造成漏診[1,2]。氯化銨、十六烷基三甲基溴化銨[1,2]等可消除紅細胞,但在消除黏液、蛋白液時效果較差。而傳統的血性胸腹水細胞涂片較難為臨床提供腫瘤的準確來源及分型[3],免疫細胞化學染色效果也令人不滿意[4]。為了提高血性胸腹水細胞學陽性檢出率,我科經過反復實驗,采用新柏氏細胞清洗液對血性標本進行處理,可以達到溶血、去黏液及蛋白液等效果,并采用TCT制片及細胞塊切片聯合免疫細胞化學法,紅細胞數量明顯減少,腫瘤細胞顯示更加清晰,消除了背景模糊的現象,從而提高了血性胸腹水標本中腫瘤細胞的檢出率,對細胞學診斷具有較高的使用價值及意義。
1 材料與方法
1.1 材料
收集我院2016-12~2017-04臨床送檢血性胸腹水130例,其中胸水95例,腹水35例。
1.2 儀器與試劑
400C醫用低速離心機(北京白洋醫療器械有限公司),Thinprep 2000(美國新柏氏),RM2245切片機(德國萊卡),Leica ST5020染色機,Leica CV5030封片機, 免疫組化一抗CK7、TTF-1、CK5/6、P63、CD56、Syn、Calretinin、WT-1、NapsinA、CDX-2、CA-125、ER等及二抗試劑盒(羊抗鼠/兔)均購于福州邁新生物技術開發有限公司。
1.3 方法
1.3.1 標本預處理 新鮮血性胸腹水標本靜置30 min,去除上清液,留取近瓶底液體約100 ml,混勻后取標本12 ml于4支15 ml尖端離心管內,2 000 r/min離心[5,6]5 min,去除上清液(若沉淀物少,重復離心),備用。
1.3.2 傳統的血性胸腹水細胞學檢測 取2支預處理離心管,一支沉淀物直接涂片,95%酒精固定,HE染色;一支加4%中性甲醛[7]12 ml混勻固定,靜置30 min,2 000 r/min離心5 min,棄甲醛液,將沉淀物用濾紙包裹后放入包埋盒進行常規脫水、透明、浸蠟、包埋制成細胞塊,HE染色;觀察涂片及細胞塊切片細胞分布及背景清晰度,若發現可疑腫瘤細胞或腫瘤細胞行免疫細胞化學檢測。
1.3.3 新柏氏細胞清洗液處理標本檢測 取2支預處理離心管,加入新柏氏細胞清洗液12 ml,1 500 r/min振蕩10 min,使離心管底部沉淀物分散、溶解直至顏色變淺紅,2 000 r/min離心5 min,去除上清液。一支加新柏氏細胞保存液12 ml,混勻后轉移至新柏氏樣本瓶,靜置15 min,使用新柏氏2000自動行TCT制片,HE染色;一支加4%中性甲醛12 ml混勻固定,靜置30 min,2 000 r/min離心5 min,棄甲醛液,將沉淀物用濾紙包裹后放入包埋盒進行常規脫水、透明、浸蠟、包埋制成細胞塊,HE染色;觀察涂片及細胞塊切片細胞分布及背景清晰度,若發現可疑腫瘤細胞或腫瘤細胞行免疫細胞化學檢測。
1.3.4 免疫細胞化學法 采用免疫細胞化學MaxVisionTM法染色。細胞塊切片,65 ℃烤片40 min,脫蠟至水,PBS清洗3次,高溫高壓抗原修復,3% H2O2封閉10 min,PBS清洗3次,分別滴加一抗4 ℃冰箱過液,PBS清洗3次,每張切片加二抗試劑室溫下孵育15 min,DAB顯色,蘇木素復染,脫水,透明,封片。用已知細胞學陽性標本細胞塊切片做陽性對照及PBS取代一抗做陰性對照。
1.3.5 結果判斷 由診斷醫生對HE及免疫細胞化學結果進行判讀。HE鏡下腫瘤細胞有明顯的異型性,呈腺泡、腺管或團狀排列,有的單個散在,核大深染;免疫細胞化學鱗癌CK5/6、P63、P40陽性,腺癌CK7、TTF-1、NapsinA陽性,小細胞癌CD56、Syn、TTF-1陽性,間皮細胞Calretinin、WT-1、CK5/6陽性。
1.4 統計學方法
采用SPSS17.0軟件進行分析,不同方法腫瘤細胞檢出率用χ2檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 血性胸腹水檢測結果
傳統檢測法:血性胸腹水涂片厚薄不均,細胞重疊明顯,常成堆分布,因含大量紅細胞、蛋白黏液,造成背景不清晰(圖A1);細胞塊切片及免疫細胞化學染色法細胞成堆或散在分布,背景不夠清晰,免疫細胞化學因含大量紅細胞、蛋白黏液,造成背景淺棕色,陽性定位模糊,影響結果判讀(圖B1、C1)。
新柏氏細胞清洗液處理后檢測法:TCT中紅細胞數量明顯減少,腫瘤細胞、間皮細胞、淋巴細胞等輪廓清楚(圖A2),細胞塊切片及免疫細胞化學染色法細胞分布均勻,染色鮮艷,核質對比清晰,免疫細胞化學染色定位清晰準確(圖B2、C2),效果明顯優于傳統檢測法。
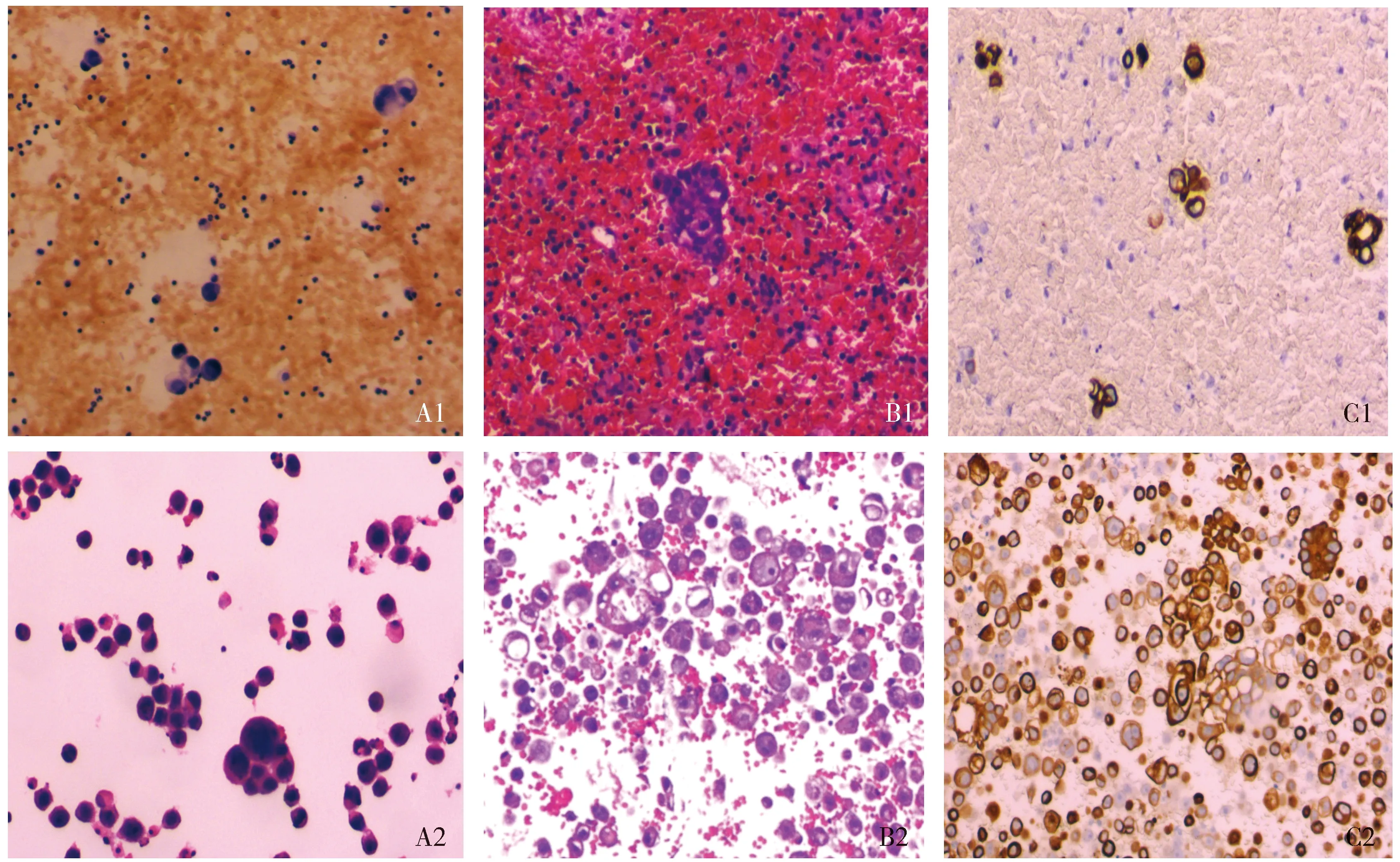
A1.涂片背景紅染,癌細胞結構顯示不清;B1.細胞塊切片背景紅染,癌細胞結構顯示不清;C1.細胞塊切片癌細胞CK7胞質表達,定位較模糊;A2.TCT背景清晰,癌細胞結構顯示清楚;B2.細胞塊切片背景清晰,癌細胞散在、團狀分布;C2.細胞塊切片癌細胞CK7胞質表達,定位準確圖1 傳統檢測法與新柏氏細胞清洗液處理后血性胸腹水檢測結果對比 (×200)
2.2 不同方法腫瘤細胞檢出率比較
130例血性胸腹水標本傳統細胞學涂片腫瘤細胞檢出率為16.15%(21/130),TCT法腫瘤細胞檢出率為29.23%(38/130),兩種方法HE染色結果差異有統計學意義(P<0.05);細胞塊切片結合免疫細胞化學法腫瘤細胞檢出率為36.15%(47/130),與TCT陽性率比較差異無統計學意義(P>0.05,見表1),但TCT對一些可疑細胞、腫瘤細胞的來源及腫瘤分型無法確定,在加做細胞塊聯合免疫細胞化學后,可以判斷類型及來源。
表1血性胸腹水不同方法檢測結果比較

檢測方法n陽性陰性可疑陽性陽性確認率(%)傳統涂片法13021931616.15TCT法1303887529.23*細胞塊免疫組化法1304783036.15
TCT法與傳統細胞學涂片法比較,*P<0.05;細胞塊免疫組化法與TCT法比較,P>0.05
3 討論
胸腹水脫落細胞學常規涂片檢查惡性腫瘤細胞因具有快速、準確、簡便、易行以及患者痛苦少等優點,在臨床上得以廣泛應用。然而脫落細胞學檢查中HE涂片質量是制約其陽性檢出率的關鍵因素之一,加強涂片制片過程的質控,引用新制片技術(如TCT的應用及細胞塊的制備),可顯著提高其陽性檢出率和分型診斷的準確性[8],且在日常細胞學標本制片中,常有血性胸腹水標本,傳統涂片法因存在大量血液和蛋白液[9],造成涂片厚薄不均,細胞重疊,染色效果不佳,常致涂片在染色水洗過程中掉片,使觀察結果受到限制和影響,干擾了脫落細胞學的診斷。由于紅細胞的大量存在,會掩蓋部分腫瘤細胞,極易造成漏診或誤診。我科經過反復試驗,采用新柏氏細胞清洗液對血性胸腹水進行溶血、去黏液及蛋白液等處理,再結合TCT法制片,發現涂片中紅細胞量明顯減少,腫瘤細胞相對集中,分布均勻,形態清晰,明顯提高血性胸腹水中腫瘤細胞的檢出率。
TCT法制片也有缺點,如反應性增生或退變的間皮細胞與某些腫瘤細胞尤其是腺癌細胞在形態上相似, 以及惡性腫瘤細胞的分型僅靠細胞形態學很難做出正確的診斷,且惡性腫瘤在組織形態上時常無法區分其來源和發生部位,因此我科聯合胸腹水沉渣石蠟包埋切片法。該法因多次離心而增加了細胞數量,切片上細胞更加集中,而且細胞結構更加清晰。細胞塊制成后可以連續切片,避免了單一涂片取材的局限性。與常規組織切片相比,無明顯差異,可根據診斷及研究需要開展類似組織學的各種檢查[10],并能長期保存。與涂片及TCT相比,不會出現掉片,使染色定位準確、可靠,背景清晰,易于作出準確診斷,可得到相對一致的細胞學切片[11],彌補TCT制片的不足。
血性胸腹水在檢測過程中,需要注意以下事項:①標本30 min內送檢,60 min內完成標本處理和固定為脫落細胞學檢查的必要條件, 增加送檢次數可提高腫瘤細胞檢出率。②離心后需用吸管輕輕吸去上清液,勿用傾倒法。③血性胸腹水中紅細胞含量高,可在新柏氏細胞清洗液中適當增加冰乙酸量。④細胞塊固定液的選擇,使用4%中性甲醛切片定位準確、穩定性強,且重復性高。⑤胸腹水沉渣提取時,離心力選用2 000 r/min,能有效權衡細胞數量與細胞損傷程度。
綜上所述,血性胸腹水經過溶血、去黏液及蛋白液等處理,并采用TCT制片及細胞塊的制備結合形態學、免疫細胞化學等診斷技術的聯合應用,可使陽性檢出率大大提高,同時其細胞學診斷還可以用于判斷腫瘤的來源部位、分型、分期甚至評估預后等,為臨床診治提供重要依據[12-14],值得在實驗室推廣應用。
[1] 潘獻柱,潘獻曉,陳命家.氯化銨去紅細胞法在血性胸腹水脫落細胞學診斷中應用[J].臨床與實驗病理學雜志,2013,29(6):694-695.
[2] 田玉旺,李琳,朱紅艷,等.十六烷基三甲基溴化銨在細胞學血性胸腹水標本制片中的應用[J].臨床與實驗病理學雜志,2011,27(8):905-906.
[3] 毛渭東,賀丹丹,何洪偉,等.免疫組化標記在惡性漿膜腔積液診斷中的應用價值探討[J].診斷病理學雜志,2015,22(10):634-636.
[4] 禹樂,孟加榕,朱啟淦,等.液基薄層細胞涂片在胸腹水診斷中的應用[J].山西醫科大學學報,2017,48(2):149-152.
[5] Su YC,Hsu YC,Chai CY.Role of TTF-1,CK20,CK7,inmunohistochemistry for diagnosis of primary and secondary lung adenocarcinona[J].Kaohsiung J Med Sci,2006,22(1):14-19.
[6] 楊玉林,陳麗,王玉萍.腹水細胞石蠟切片技術的臨床應用[J].臨床檢驗雜志,2004,22(2):102.
[7] 郭以河,張閩峰,孟加榕,等.不同固定方法對胸水細胞塊組織形態及免疫細胞化學的影響[J].現代腫瘤醫學,2010,18(10):1925-1927.
[8] 虞紅珍,吳強.漿膜腔積液細胞學檢查中制片技術應用的現狀與進展[J].臨床與實驗病理學雜志,2014,30(4):434-436.
[9] Bolanca IK, Vranes J. Diagnostic methods and techniques in preventing cervical carcinoma. Part I: Conventional cytology and new cytological methods[J]. Med Glas (Zenica),2010,7(1):12-17.
[10] 王超,周小鴿,余小蒙.細胞塊免疫細胞化學和原位雜交在針吸細胞學中的應用[J].臨床與實驗病理學雜志,2006,22(1):96-97.
[11] 奉孝榮,陳莉,梁輝,等.胸腹水沉渣切片在脫落細胞學中的作用[J].西部醫學,2010,22(7):1230-1231.
[12] Ensani F,Nematizadeh F,Irvanlou G.Accuracy of immunohistochemistry in evaluation of malignant pleural and peritoneal effusions[J].Pol J Pathol,2011,62(2):95-100.
[13] Bassarova AV,Nesland JM,Davidson B.D2-40 is not a specific marker for cells of mesothelial origin in serous effusions[J].Am J Surg Pathol,2006,30(7):878-882.
[14] Sayed DM,el-Attar MM,Hussein AA.Evaluation of flow cytometric immunophenotyping and DNA analysis for detection of malignant cells in serosal cavity fluids[J].Diagn Cytopathol,2009,37(7):498-504.
R446
A
1007-6611(2017)10-1079-04
10.13753/j.issn.1007-6611.2017.10.023
中國人民解放軍第一七五醫院青年苗圃基金資助項目(16Y020)
朱啟淦,男,1988-03生,學士,主管技師,E-mail:694095459@qq.com
2017-06-01

