中年腦梗死合并2型糖尿病患者血清鐵蛋白水平的研究
金 鳳, 張哲峰, 祖艷穎, 王小紅, 謝永紅, 張玉潔, 項 寧
中年腦梗死合并2型糖尿病患者血清鐵蛋白水平的研究
金 鳳1, 張哲峰2, 祖艷穎3, 王小紅1, 謝永紅1, 張玉潔4, 項 寧3
腦卒中是嚴重威脅人們生命的疾病之一,病情嚴重時能夠引起患者致殘或死亡。與出血性腦卒中相比缺血性腦卒中更常見,腦動脈閉塞缺血能導致組織死亡。缺血性腦卒中占所有腦卒中80%以上,其特征是由于血栓或栓子引起的腦動脈血管阻塞[1]。在過去的幾十年里,全世界糖尿病發病率在急劇增加,這一變化導致了嚴重的個人發病率和死亡率,同時也造成了全球衛生保健系統的脆弱。全世界與糖尿病相關的醫療費用也不斷上升。目前,腦梗死和糖尿病患者日趨年輕化,很多中年腦梗死患者合并2型糖尿病,國內外對中年腦梗死合并2型糖尿病患者危險因素相關的研究報道很少。動脈粥樣硬化與腦梗死密切相關,研究顯示動脈粥樣硬化危險因素除了傳統的例如高血壓、高脂血癥、糖尿病、肥胖、缺乏體育鍛煉和吸煙這些因素外,還包括人體內鐵貯備改變,鐵在動脈粥樣硬化發病機制中起著重要的作用[2]。在人體內鐵蛋白是鐵的主要貯存形式,因此本研究旨在通過測定中年腦梗死合并2型糖尿病患者血清鐵蛋白表達水平,結合頸動脈超聲檢查和頭部核磁檢查來尋找腦梗死的危險因素。
1 臨床資料與方法
1.1 一般資料 選取2016年8月-2017年8月秦皇島市第一醫院神經內科收治的中年腦梗死合并2型糖尿病患者為Ⅰ組,年齡45~59歲,平均(51.24±3.77)歲,共49例,其中男25例,女24例;中年腦梗死患者為Ⅱ組,年齡45~59歲,平均(52.10±3.67)歲,共48例,其中男25例,女23例; 42例健康體檢者作為對照組Ⅲ組,年齡45~59歲,平均(52.17±3.51)歲,男22例,女20例。腦梗死患者符合1995年全國第四屆腦血管疾病學術會議通過的診斷標準,并且患者行頭部核磁影像學檢查證實為腦梗死。2型糖尿病的診斷是根據1999年世界衛生組織(World Health Organization,WHO)關于2型糖尿病的診斷標準。本研究中入選的對象排除以下情況包括嚴重肝、腎、心功能不全、腫瘤、房顫、精神疾病和昏迷患者、甲狀腺功能減低及服用影響血清鐵蛋白的藥物等。Ⅰ組、Ⅱ組和Ⅲ組年齡差異無統計學意義,性別構成差異無統計學意義,具有可比性。本研究經秦皇島市第一醫院倫理委員會批準。
1.2 研究方法
1.2.1 靜脈血標本采集 患者于入院第2日清晨空腹采集外周血進行檢測。
1.2.2 鐵蛋白等指標檢測 在秦皇島市第一醫院檢驗科分別對Ⅰ組、Ⅱ組和Ⅲ組血樣樣品進行相關的檢測。檢測項目包括鐵蛋白、甘油三酯(TG)、糖化血紅蛋白(HbA1c)、膽固醇(CHOL)等。采用電化學發光法測定血清鐵蛋白,鐵蛋白檢測試劑由羅氏公司提供,檢測操作按照說明書進行。甘油三酯(TG)采用GPO-PAP法檢測;膽固醇(CHOL)采用CHOD-PAP法檢測;糖化血紅蛋白(HbA1c)水平應用HPLC法進行檢測。
1.2.3 頸動脈彩色多普勒超聲檢查 超聲專業人員為Ⅰ組、Ⅱ組做頸部血管彩色多普勒超聲檢查,觀察雙側頸部動脈(頸總動脈、頸內動脈及頸外動脈)、雙側椎動脈是否光滑、有無斑塊及有無狹窄,并且檢測頸動脈內-中膜厚度(IMT)。一般頸動脈內-中膜厚度IMT <1.0 mm為頸動脈正常,IMT≥1.0 mm為頸動脈內膜增厚,IMT≥1.5 mm提示斑塊形成。
1.2.4 頭部核磁檢查 秦皇島市第一醫院影像專業人員為Ⅰ組、Ⅱ組在Siemens核磁共振儀上進行頭部核磁檢查(包括T1WI、 T2WI、FLAIR、DWI 檢查),醫院核磁科經驗豐富的醫生負責對影像學結果進行分析。根據腦梗死的病灶將腦梗死分為腔隙性腦梗死、單發腦梗死及多發腦梗死。
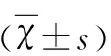
2 結 果
2.1 各組鐵蛋白及其他生化指標水平比較 鐵蛋白3組間分性別進行比較,結果顯示:與正常對照Ⅲ組相比,男性、女性Ⅰ組、Ⅱ組鐵蛋白水平均明顯高于Ⅲ組,差異具有統計學意義(P<0.05)。男性、女性Ⅰ組鐵蛋白水平與Ⅱ組比較,差異沒有統計學意義(P>0.05)。Ⅰ組HbA1c水平高于Ⅱ組、Ⅲ組(P<0.05)。Ⅰ組、Ⅱ組CHOL和TG水平均顯著高于Ⅲ組(P<0.05)(見表1)。
2.2 Ⅰ組、Ⅱ組患者頸動脈硬化程度比較 通過對Ⅰ組、Ⅱ組進行頸部血管彩色多普勒超聲檢查,結果表明Ⅰ組49例患者中,其中包括內膜增厚和斑塊的頸動脈硬化形成者共有39例,無頸動脈內膜增厚和斑塊的共有10例,頸動脈硬化患者占79.59%;Ⅱ組48例患者中,其中包括內膜增厚和斑塊的頸動脈硬化形成者共有28例,無頸動脈內膜增厚和斑塊的共有20例,頸動脈硬化患者占58.33%。兩組比較,Ⅰ組頸動脈硬化比例顯著增高(P<0.05)。
2.3 Ⅰ組、Ⅱ組腦梗死嚴重程度的比較 Ⅰ組、Ⅱ組患者接受頭部核磁檢查結果表明:Ⅰ組腔隙性腦梗死有6例,多發或單發腦梗死共有43例,Ⅰ組多發或單發腦梗死患者占87.76%;Ⅱ組腔隙性腦梗死14例,多發或單發腦梗死共有34例,Ⅱ組多發或單發腦梗死患者占70.83%。與Ⅱ組相比Ⅰ組腦梗死明顯嚴重(P<0.05)。

表1 各組Hcy及其他生化指標水平比較
與Ⅲ組比較*P<0.05;與Ⅱ組比較#P<0.05
3 討 論
缺血性腦卒中是全球導致死亡的主要原因之一,它以突然的大腦血流阻斷為特征引起細胞死亡和破壞,導致神經功能缺損。中年人缺血性腦卒中的發病率不斷增加,基于人群的研究已經識別了許多缺血性腦卒中的危險因素包括可以改變的危險因素如高血壓、血清膽固醇升高、吸煙等;也包括不可改變的危險因素如性別、非白人種族、家族史、較大的年齡等。糖尿病也是缺血性腦卒中的危險因素,一些中年腦梗死的患者合并2型糖尿病。
2型糖尿病是一種常見的慢性疾病,血糖控制不理想可能會導致小血管和大血管的并發癥。因此,我們研究中年腦梗死合并2型糖尿病的患者發病的危險因素。我們知道,腦梗死的發生與血管動脈粥樣硬化密切相關,而鐵蛋白和動脈粥樣硬化的關系不斷受到人們的關注,特別是在血清鐵蛋白和心血管疾病的研究方面,但血清鐵蛋白和缺血性腦卒中方面的研究較少,因此研究血清鐵蛋白和中年腦梗死合并2型糖尿病患者的相關性對于中年人至關重要,使中年人能更有效預防相關的血管疾病。
我們研究顯示與對照組比較血清鐵蛋白在中年腦梗死合并2型糖尿病組中升高,中年腦梗死組鐵蛋白的含量較對照組升高。我們的研究結果與國外Nasrin Sheikh等研究相似,Nasrin Sheikh等研究發現腦梗死患者鐵蛋白水平與對照組相比明顯升高[3]。也有報道提出高血清鐵蛋白與增加的缺血性腦卒中相關,鐵蛋白可能通過提供自由鐵發揮作用,鐵是羥自由基的來源,能夠誘導氧化應激[4,5]。我們的研究結果提示血清鐵蛋白很可能是中年2型糖尿病患者發生腦梗死的危險因素。
鐵是人體內重要的微量元素之一,機體內血清鐵蛋白是鐵重要儲存形式,血清鐵蛋白分子由24亞基組成,有重亞基和輕亞基,重亞基和輕亞基的比例在不同組織中變化。增加的血清鐵蛋白和鐵在30多年前開始被提出是心血管危險因素,在1981年Sullivan第一次提出鐵是心血管危險因素,他提出假設降低鐵具有保護作用[6]。動脈粥樣硬化增加腦梗死的發病風險,可能機制是引起血管狹窄甚至閉塞,從而引起腦梗死的發生。動脈粥樣硬化是一個以動脈內膜增厚和動脈斑塊形成為特征慢性的纖維增生的炎癥過程,鐵參與動脈粥樣硬化的發病機制與增加的氧化應激相關。鐵參與氧化還原反應通過三價鐵離子和二價鐵離子之間電子轉化,催化形成氫自由基等活性氧,氫自由基引起脂質和蛋白質氧化改變,DNA損傷、細胞增殖損傷、內皮功能損傷和免疫系統改變、細胞發生損傷等[2]。另外,鐵通過促炎的作用影響動脈斑塊開始、發展、失去穩定性。由此可見,鐵蛋白可能通過誘導氧化應激和影響動脈粥樣硬化形成,最終導致腦梗死的發生。
其次,我們在研究中還觀察到與健康對照組和中年腦梗死組相比中年腦梗死合并2型糖尿病組糖化血紅蛋白水平升高,糖化血紅蛋白的檢測可以用來評估血漿中近2~3個月血糖濃度,我們的研究表明腦梗死合并2型糖尿病組血糖控制不理想。一些研究顯示糖化血紅蛋白異常與頸動脈狹窄和腦室周圍的缺血性病變相關[7~9],也有研究表明糖化血紅蛋白對急性缺血性腦梗死的患者有預后價值[10]。
在本研究中,我們也觀察到與健康對照組相比中年腦梗死合并2型糖尿病組和中年腦梗死組膽固醇水平升高,我們的研究與流行病學研究相似,流行病學研究顯示腦卒中的風險與總膽固醇水平相關,高總膽固醇與缺血性腦卒中高風險相關[11]。但是,流行病學的研究也顯示甘油三酯和缺血性腦卒中的關系不一致,部分由于受到禁食和非禁食的影響[12]。我們研究發現與健康對照組相比中年腦梗死合并2型糖尿病組和中年腦梗死組甘油三酯水平明顯升高。
接下來我們又分析了中年腦梗死合并2型糖尿病與單純腦梗死患者之間頸動脈血管硬化程度及腦梗死程度。本結果顯示與中年腦梗死患者比較中年腦梗死合并2型糖尿病患者頸動脈硬化程度更嚴重,腦梗死程度更加嚴重。
綜上所述,我們的研究進一步提示鐵蛋白、年齡、糖尿病和血脂等可能相互作用,影響血管改變,最終影響腦部供血的血管,引起腦部缺血,發生腦梗死。通過限制肉類攝入、增加身體鍛煉等措施和加強傳統的健康生活方式來降低2型糖尿病患者的血清鐵蛋白,同時有效控制血糖和血脂可能有助于減少中年人腦梗死的發生。
[1]Durukan A,Tatlisumak T.Acute ischemic stroke:overview of major experimental rodent models,pathophysiology,and therapy of focal cerebral ischemia[J].Pharmacol Biochem Behav,2007,87(1):179-197.
[2]Kraml P.The role of iron in the pathogenesis of atherosclerosis[J].Physiol Res,2017,66(S1):55-67.
[3]Sheikh N,Tavilani H,Rezaie A,et al.Relationship between estradiol and antioxidant enzymes activity of ischemic stroke[J].J Biomed Biotechnol,2009,2009:841468.
[4]Carbonell T,Rama R.Iron,oxidative stress and early neurological deterioration in ischemic stroke[J].Curr Med Chem,2007,14(8):857-874.
[5]van der A DL,Grobbee DE,Roest M,et al.Serum ferritin is a risk factor for stroke in postmenopausal women[J].Stroke,2005,36(8):1637-1641.
[6]Sullivan JL.Iron and sex difference in heart disease risk[J].Lancet,1981,1(8233):1293-1294.
[7]Waje-Andreassen U,Naess H,Thomassen L,et al.Biomarkers related to carotid intima-media thickness and plaques in long-term survivors of ischemic stroke[J].Transl Stroke Res,2015,6(4):276-283.
[8]Rozanski M,Richter TB,Grittner U,et al.Elevated levels of hemoglobin A1c are associated with cerebral white matter disease in patients with stroke[J].Stroke,2014,45(4):1007-1011.
[9]Huisa BN,Roy G,Kawano J,et al.Glycosylated hemoglobin for diagnosis of prediabetes in acute ischemic stroke patients[J].J Stroke Cerebrovasc Dis,2013,22(8):e564-e567.
[10]Lieber BA,Taylor B,Appelboom G,et al.Meta-analysis of telemonitoring to improve HbA1c levels:promise for stroke survivors[J].J Clin Neurosci,2015,22(5):807-811.
[11]Yaghi S,Elkind MS.Lipids and cerebrovascular disease:research and practice[J].Stroke,2015,46(11):3322-3328.
[12]Shahar E,Chambless LE,Rosamond WD,et al.Plasma lipid profile and incident ischemic stroke:the Atherosclerosis Risk in Communities (ARIC) study[J].Stroke,2003,34(3):623-631.
1003-2754(2017)10-0939-02
R743.3
2017-08-17;
2017-10-04
(1.秦皇島市第一醫院內科,河北 秦皇島 066000;2.秦皇島市第一醫院胸外科,河北 秦皇島 066000;3.秦皇島市第一醫院神經內科,河北 秦皇島066000;4.秦皇島市第一醫院麻醉科,河北 秦皇島 066000)
項 寧,E-mail:doctorcyb@163.com

