ADC、EADC及其相對值在WHOⅡ級膠質瘤鑒別診斷中的價值*
龔軍偉,張 竹,程潤田,蔣佩伶,羅天友△,吳少平.重慶醫科大學附屬第一醫院 放射科(重慶 40006);2.成都醫學院第一附屬醫院 放射科(成都 60500)
·論著·
ADC、EADC及其相對值在WHOⅡ級膠質瘤鑒別診斷中的價值*
龔軍偉1,張 竹1,程潤田1,蔣佩伶1,羅天友1△,吳少平2△
1.重慶醫科大學附屬第一醫院 放射科(重慶 400016);2.成都醫學院第一附屬醫院 放射科(成都 610500)
目的研究表觀擴散系數(ADC)、指數表觀擴散系數(EADC)及其相對值對不同病理類型腦內WHOⅡ級膠質瘤的鑒別診斷價值。方法回顧性分析術后病理確診的51例腦內WHOⅡ級膠質瘤,包括30例星形細胞瘤(AC)、15例少突膠質細胞瘤(OD)、6例少突-星形細胞瘤(OA),分別測量其實質區ADC值和EADC值,計算rADC值、rEADC值,比較3組腫瘤各參數的差異,再用受試者工作特征曲線(ROC)確定AC與OD+OA的鑒別診斷截斷值、敏感度和特異度。結果ADC值、EADC值、rADC值和rEADC值在AC與OD、AC與OA瘤體實質區的組間差異有統計學意義(P<0.001),在OD與OA組間差異無統計學意義(P>0.05)。ROC曲線分析表明,ADC、EADC、rADC和rEADC曲線下面積均大于0.9,以1.150×10-3mm2/s、0.311、1.512、0.691為截斷值時,鑒別AC與OD+OA的診斷靈敏度和特異度均>80%。結論ADC值、EADC值、rADC值和rEADC值對腦內AC與OD、OA的鑒別具有一定的價值,鑒別OD和OA存在一定的局限性,鑒別AC與OD+OA時各參數均有較高且相仿的診斷效能。
磁共振成像;表觀擴散系數;指數表觀擴散系數;低級別膠質瘤
在沿用多年的2007版WHO中樞神經系統腫瘤分類標準中,Ⅱ級膠質瘤中的星形膠質瘤(AC)、少突膠質細胞瘤(OD)和少突-星形膠質瘤(OA)屬于低級別膠質瘤,約占膠質瘤的15%~25%[1],臨床上常難以治愈[2]。不同組織病理類型間的生物學行為、治療方案及預后評估不同[3],因此,其術前的影像學分型研究具有重要的臨床意義。借鑒Khayal等[4]應用DTI技術以ADC值、FA值鑒別WHOⅡ級膠質瘤的研究思路,本研究利用擴散加權成像(DWI)技術,測量瘤體實質區ADC值、EADC值及其相對值,探究上述參數鑒別WHOⅡ級膠質瘤的臨床應用價值。
1 資料與方法
1.1臨床資料
收集2012年10月至2016年6月在重慶醫科大學附屬第一醫院行頭顱MRI平掃+增強,且經手術病理證實的WHOⅡ級膠質瘤患者71例,納入其中有可供測量瘤體實質的研究對象51例,其中男28例,女23例,年齡12~62歲(39.4±12.4歲),按2007版WHO中樞神經系統腫瘤分級方法進行分組,其中含AC 組30例、OD 組15例、OA 組6例,所有患者MRI檢查前均未行特殊治療。主要癥狀包括:肢體抽搐和(或)伴意識障礙19例,頭暈、頭痛17例,頭痛伴乏力、抽搐、視物模糊6例,肢體乏力、幻聽、耳鳴、聽力下降6例,言語不利、記憶力減退2例,無癥狀1例。
1.2儀器與方法
采用 GE Signa HDxt 3.0 T MRI掃描儀,頭部專用8通道相控陣線圈。所有患者均行常規MRI掃描,包括平掃和增強掃描,平掃序列及參數如下:軸位T1-FLAIR(TR=1 650 ms,TE=23.7 ms,TI=720.0 ms)、FSE T2WI(TR=2 860 ms,TE=118.9 ms)、T2-FLAIR(TR=6 880 ms、TE=150 ms、TI=1 850 ms)及DWI(b=1 000 s/mm2),層厚5 mm,層間距1.5 mm;T1WI增強掃描各方位參數如下:軸位 TR=1 650 ms、TE=27.3 ms、TI=720.0 ms,矢狀位 TR=1 967 ms、TE=24.0 ms、TI=720.0 ms,冠狀位 TR=2 405 ms、TE=21.9 ms、TI=750 ms,對比劑采用釓噴替酸葡甲胺(Gd-DTPA,4 mmol/L),用量0.2 mmol/kg,使用專用高壓注射器(spectris solaris EP)經肘靜脈注射,流率為2~3 mL/s,注射完畢后再用20 mL生理鹽水以相同流率注射沖管。
1.3圖像分析及后處理
將采集的數據傳至GE ADW 4.6工作站Functool軟件后處理,獲得ADC偽彩圖和EADC圖。在兩名放射科高級職稱醫生指導下,以ADC偽彩圖和EADC圖為基礎,再結合軸位T1WI增強圖及T1WI、T2WI、T2-FLAIR,避開腦溝、腦池、壞死及囊變區域,共同確定測量區。具體方法如下(圖1和圖2):1)將ADC偽彩圖調整為灰階圖(color ramps→gray levels),再從顱頂到顱底逐層瀏覽ADC圖和EADC圖;2)若腫瘤無強化,則在腫瘤實質最大層面將ROI置于ADC圖呈低灰階、EADC圖呈高灰階相對應的區域;3)若腫瘤有強化,則將ROI置于強化最明顯區域所對應的ADC圖和EADC圖上;4)獲取腫瘤實質區ADC值和EADC值后,再測量鏡像正常腦白質區ADC值和EADC值,得到rADC值(瘤體實質區ADC/鏡像白質區ADC)和rEADC值(瘤體實質區EADC/鏡像白質區EADC)。
1.4統計學方法
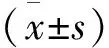

圖1 左額葉星形膠質細胞瘤
注:A.T2WI呈混雜稍高信號,伴瘤周小斑片水腫;B.T1WI增強未見明顯強化;C.ADC圖示腫瘤實質區表現為低灰階但高于鏡像正常腦白質區(ADC=1.253×10-3mm2/s,rADC=1.868);D.EADC圖示腫瘤實質區表現為高灰階但低于鏡像正常腦白質區(EADC=0.293,rEADC=0.571)

圖2 左額葉少突膠質細胞瘤
注:A.T2WI以高信號為主,伴瘤周小斑片水腫;B.T1WI增強見附壁結節樣明顯強化;C.ADC圖示明顯強化區表現為低灰階但高于鏡像正常腦白質區(ADC=1.041×10-3mm2/s,rADC=1.214);D.EADC圖示明顯強化區表現為高灰階但低于鏡像正常腦白質區(EADC=0.355,rEADC=0.833)
2 結果
2.1基本影像學表現
51例WHOⅡ級膠質瘤各腦葉的分布如下:額葉27例、頂葉2例、顳葉9例、額顳/額頂葉6例、頂枕葉/顳枕葉4例、基底節海馬區2例,跨中線累及雙側額葉1例。51例膠質瘤的瘤體直徑為(39.37±12.38)mm,腫瘤以長T1WI長T2WI信號為主,實質區呈稍長T1WI、等/稍長T2WI信號,DWI呈等/稍高信號,ADC圖表現為低灰階,EADC圖對應為高灰階;增強掃描未見明顯強化21例、不均勻輕度強化16例、附壁結節樣強化6例、不均勻明顯強化5例、花環樣強化3例;多數腫瘤瘤周伴片狀水腫信號(42例)。
2.2ADC值、EADC值及其相對值的比較
3組不同病理類型WHOⅡ級膠質瘤的ADC值、EADC值及其相對值組間比較差異有統計學意義(F值/2值分別為28.458、26.794、28.058、30.746,P值均<0.001);進一步兩兩比較發現,AC組與OD組、AC組與OA組各參數差異均有統計學意義(P<0.001),而OD組與OA組各參數差異無統計學意義(P>0.05)(表1)。

表1 WHOⅡ級膠質瘤ADC、EADC、rADC及rEADC的比較(n=51)
注:ADC值的單位為×10-3mm2/s;ADC和rADC取2值,EADC和rEADC取F值
2.3ROC曲線分析
進一步作AC組與OA+OD組ROC曲線分析,發現ADC、EADC、rADC和rEADC分別以1.150×10-3mm2/s、0.311、1.512、0.691為截斷值時,鑒別AC組與OD+OA組的敏感度和特異度較高,且曲線下面積均大于0.9;行4個參數曲線下面積的兩兩比較發現,差異無統計學意義(P>0.05)(表2)。

表2 AC組和OD+OA組各參數ROC曲線分析
3 討論
DWI可量化分析活體組織水分子的微觀運動情況,能反映組織細胞的空間結構特性[6]。但DWI信號強度受組織T2穿透效應影響,有時并不能真實反映病理情況下活體組織內水分子擴散速度的快慢。ADC圖和EADC圖能較好的消除T2穿透效應,因此ADC值和EADC值常被視為衡量活體組織水分子擴散速度變化的定量指標[7]。ADC值與DWI信號強度呈負指數函數關系(ADC=-ln(Sb/S0)/b),即ADC值增加,DWI信號降低;EADC值則由DWI信號除以SE EPI T2WI所得(EADC=Sb/S0)。近年來,國內外學者開展了ADC值鑒別顱內腫瘤類型[8-10]、鑒別WHOⅡ級膠質瘤[11]以及ADC值聯合EADC值鑒別顱內淋巴瘤與高級別膠質瘤的研究[12],但應用ADC值聯合EADC值鑒別WHOⅡ級膠質瘤的研究尚無報道。
作為定量研究,測量誤差的控制至關重要。為此,本研究在測量時將ADC偽彩圖調整為灰階圖,既便于與EADC圖對應,又較偽彩圖更清晰顯示瘤體實質區的內部結構;在腫瘤實質區ROI個數及面積的選擇上,本研究以最大限度涵蓋腫瘤實質細胞最密集區為原則,根據腫瘤具體情況,將其個數和面積分別控制在2~5個、10~26 mm ,且測量在兩名經驗豐富的放射科醫師共同指導下完成。同時,為增加不同個體間的可比性[13],本研究在納入ADC值和EADC值的同時,還增加了rADC和rEADC兩個指標。
ADC值與EADC值主要與腫瘤細胞密度、體積及空間結構的排列等因素密切相關[14]。腫瘤細胞排列越緊密、細胞間隙越小、細胞異型性越大、細胞體積越大,則擴散受限越明顯,對應的ADC值和rADC值越低,EADC值和rEADC值越高,反之亦然。本組患者中,AC組腫瘤實質成分的ADC值[(1.377±0.213)×10-3mm2/s]和rADC值[1.692(1.543-1.993)]明顯高于OD組和OA組,與文獻報道[4,11]一致,EADC值(0.264±0.048)和rEADC值(0.574±0.108)明顯低于OD組和OA組,且差異均具有統計學意義;但各參數在OD組和OA組比較,差異無統計學意義。眾所周知,在WHOⅡ級膠質瘤的組織病理上,AC的腫瘤細胞密度低,細胞核異形性低,核分裂少見,腫瘤實質內異常增殖的血管較少,壞死、鈣化少見,但細胞外基質較疏松;OD的細胞密度中等,核異形、核分裂偶見,腫瘤實質內可見較密集的“雞爪”狀血管網,亦可見微小鈣化[15];OA則由不同比例星形細胞和少突細胞混合而成,其微環境結構較復雜,但有爭議[16]。依據上述AC、OD、OA的組織病理學特點,筆者認為AC與OD、OA組間各參數差異有統計學意義的主要原因在于腫瘤細胞密度和細胞外基質疏松程度不同。而OD和OA組間差異無統計學意義的原因則可能與OA含有AC、OD兩種細胞成分但比例不定,導致ADC值和EADC值傾向性不同相關。進一步的AC組與OD+OA組ROC曲線分析可知,ADC、EADC、rADC及rEADC對AC和OD+OA的鑒別均有較高的診斷價值,且診斷效能相仿。
綜合本研究的結果,可見腫瘤實質成分ADC值聯合EADC值及其相對值的定量分析有助于WHOⅡ級AC與OD、OA及OD+OA的鑒別診斷。至于OD和OA之間鑒別的局限性,一方面可能與本組OA的樣本量較小有關,另一方面也可能與OA組織病理學起源尚未明確有關,如果按照2016版WHO中樞神經系統腫瘤分類標準,本研究中6例OA因未行基因檢測應歸為OA(未定型)類別,鑒于該6例OA與15例OD的ADC、EADC及其相對值差異無統計學意義,可推測OA中少突膠質細胞瘤基因型居多,但具體情況尚待基于基因型檢測的WHO Ⅱ級膠質瘤影像學研究來闡述。
[1]Louis D N, Ohgaki H, Wiestler O D,etal. The 2007 WHO classification of tumours of the central nervous system[J]. Acta Neuropathol, 2007, 114(2): 97-109.
[2]Duffau H, Taillandier L. New concepts in the management of diffuse low-grade glioma: Proposal of a multistage and individualized therapeutic approach[J]. Neuro-oncology, 2015, 17(3): 332-342.
[3]Babu R, Bagley J H, Park J G,etal. Low-grade astrocytomas: the prognostic value of fibrillary, gemistocytic, and protoplasmic tumor histology[J]. J Neurosurg, 2013, 119(2): 434-441.
[4]Khayal I S, McKnight T R, McGue C,etal. Apparent diffusion coefficient and fractional anisotropy of newly diagnosed grade II gliomas[J]. NMR Biomed, 2009, 22(4): 449-455.
[5]Hajian-Tilaki K. Receiver Operating Characteristic (ROC) Curve Analysis for Medical Diagnostic Test Evaluation[J]. Caspian J Intern Med, 2013, 4(2): 627-635.
[6]Attariwala R, Picker W. Whole body MRI: improved lesion detection and characterization with diffusion weighted techniques[J]. J Magn Reson Imaging, 2013, 38(2): 253-268.
[7]Barajas R F, Rubenstein J L, Chang J S,etal. Diffusion-weighted mr imaging derived apparent diffusion coefficient is predictive of clinical outcome in primary central nervous system lymphoma[J]. American Journal of Neuroradiology, 2009, 31(1): 60-66.
[8]Hu Y C, Yan L F, Sun Q,etal. Comparison between ultra-high and conventional mono b-value DWI for preoperative glioma grading[J]. Oncotarget, 2017, 8(23): 37884-37895.
[9]Cuccarini V, Erbetta A, Farinotti M,etal. Advanced MRI may complement histological diagnosis of lower grade gliomas and help in predicting survival[J]. J Neurooncol, 2016, 126(2): 279-288.
[10] 王健, 錢銀鋒, 楊奇芳, 等. 多b值DWI鑒別高級別膠質瘤及腦轉移瘤[J]. 臨床放射學雜志, 2015, 34(10): 1540-1543.
[11] 李曉光, 康厚藝, 張偉國. MR擴散和灌注加權成像在腦WHOⅡ級膠質瘤鑒別診斷中的價值[J]. 臨床放射學雜志, 2014, 33(3): 325-329.
[12] 李輝, 陳兵, 龔瑞, 等. 彌散加權成像在顱內淋巴瘤與Ⅲ-Ⅳ級星形細胞瘤鑒別中的應用[J]. 實用放射學雜志, 2013, 29(9): 12-13.
[13] Akter M, Hirai T, Makino K,etal. Diffusion-weighted imaging of primary brain lymphomas: effect of ADC value and signal intensity of T2-weighted imaging[J]. Comput Med Imaging Graph, 2008, 32(7): 539-543.
[14] Kim C K, Park J J, Park B K. Prostate diffusion-weighted imaging at 3T: effect of intravenous gadobutrol administration[J]. Eur Radiol, 2016, 26(5): 1450-1456.
[15] Walker C, Baborie A, Crooks D,etal. Biology, genetics and imaging of glial cell tumours[J]. Br J Radiol, 2011, 84(2): S90-S106.
[16] Sahm F, Reuss D, Koelsche C,etal. Farewell to oligoastrocytoma: in situ molecular genetics favor classification as either oligodendroglioma or astrocytoma[J]. Acta Neuropathol, 2014, 128(4): 551-559.
TheValueofADC,EADCandTheirRelativeValuesintheDifferentialDiagnosisofWHOGradeⅡGlioma
GongJunwei1,ZhangZhu1,ChengRuntian1,JiangPeiling1,LuoTianyou1△,WuShaoping2△.
1.DepartmentofRadiology,TheFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China; 2.DepartmentofRadiology,TheFirstAffiliatedHospitalofChengduMedicalCollege,Chengdu610500,China
ObjectiveTo study the value of apparent diffusion coefficient (ADC), exponential apparent diffusion coefficient (EADC) and their relative values in the differential diagnosis of WHO grade Ⅱ glioma.Methods51 cases with WHO grade II gliomas in brain confirmed pathologically were analyzed retrospectively. The cases consisted of 30 cases of astrocytomas (AC), 15 cases of oligodendrogliomas (OD) and 6 cases of oligoastrocytomas (OA). The values of ADC and EADC were measured and the values of the relative ADC (rADC) and relative EADC (rEADC) were calculated. Then the parameters were compared in order to analyze the differences between the three groups. The receiver operating characteristic curve (ROC) was used to determine the cut-off value, sensitivity and specificity for differential diagnosis between AC and OD+OA.ResultsThe values of ADC, EADC, rADC and rEADC in the parenchyma of the tumors were significantly different (P<0.001) between AC and OD and between AC and OA respectively, while there were no significant differences between OD and OA (P>0.05). The results of the ROC curve analysis showed that the areas under the curves were all greater than 0.9,and the diagnostic sensitivity and specificity were all more than 80% in differentiating AC and OD+OA when the values of 1.150×10-3mm2/s, 0.311, 1.512 and 0.691 were used respectively as the cut-off values for ADC, EADC, rADC and rEADC.ConclusionThe values of ADC, EADC, rADC and rEADC have certain value in differentiating OD or OA from AC, but there are some limitations in the differentiation of OD and OA. Those parameters have higher and similar diagnostic efficacy in the differentiation between AC and OD+OA.
Magnetic resonance imaging; Apparent diffusion coefficient; Exponential apparent diffusion coefficient; Low-grade glioma
http://kns.cnki.net/kcms/detail/51.1705.R.20171016.1110.010.html
10.3969/j.issn.1674-2257.2017.05.009
R739.41
A
國家臨床重點專科建設資助項目(No:國衛辦醫函[2013]544號)
△
羅天友,E-mail: ltychy@sina.com;吳少平,E-mail: 1006820907@qq.com

