胃癌患者血清ILF3蛋白水平變化與其淋巴結轉移的關系
劉羽,李勇,劉慶偉,郝英杰,賈楠,趙雪峰
(河北醫科大學第四醫院,石家莊050011)
胃癌患者血清ILF3蛋白水平變化與其淋巴結轉移的關系
劉羽,李勇,劉慶偉,郝英杰,賈楠,趙雪峰
(河北醫科大學第四醫院,石家莊050011)
目的觀察胃癌患者血清白細胞介素增強結合因子3(ILF3)蛋白水平變化,探討其與腫瘤淋巴結轉移的關系。方法選取行根治術的胃癌患者200例作為觀察組、體檢健康者100例作為對照組。采用雙抗體夾心法檢測術前1 d、術后1個月血清ILF3蛋白、IL-10、IL-6、TNF-α水平及胃癌組織、癌旁正常黏膜組織中ILF3蛋白水平,分析血清ILF3蛋白水平與胃癌淋巴結轉移及其他指標的關系。結果觀察組術前血清ILF3蛋白、IL-6、TNF-α水平高于術后及對照組(P均<0.05),血清IL-10水平低于術后及對照組(P均<0.05)。術后兩組血清ILF3蛋白、TNF-α、IL-6 、IL-10水平比較差異無統計學意義(P均>0.05)。胃癌組織ILF3蛋白水平高于癌旁正常黏膜組織(P<0.05)。淋巴結轉移陽性胃癌患者術前血清ILF3蛋白水平、癌組織ILF3蛋白水平高于淋巴結轉移陰性的胃癌患者(P均<0.05)。胃癌患者術前血清ILF3蛋白水平與腫瘤組織ILF3蛋白水平、術前血清TNF-α、IL-6水平呈正相關(rs分別為0.229、0.202、0.234,P均<0.05),與術前血清IL-10水平呈負相關(rs=-0.213,P<0.05)。結論胃癌患者血清ILF3蛋白水平升高,其可能通過調控炎性因子水平參與與胃癌淋巴結轉移。
胃癌;白細胞介素增強結合因子3;淋巴結轉移;炎性因子
胃癌是消化系統最常見的惡性腫瘤,根治性手術切除加區域淋巴結清掃是其主要治療措施。但由于該病進展迅速,手術常難以根治[1,2]。因此探討胃癌的發病機制對其診治有重要意義。研究表明,炎癥反應在胃癌的發生發展中發揮了重要作用,腫瘤壞死因子α(TNF-α)和白細胞介素6(IL-6)均參與其中[3,4],且有可能成為今后治療胃癌的新方向。白細胞介素增強結合因子3(ILF3)是近年來發現的參與機體炎癥反應的新基因[5]。有研究結果顯示,ILF3蛋白能調控腫瘤的浸潤及轉移[6,7]。但目前有關ILF3蛋白與胃癌炎癥過程的關系罕見報道。本研究對此進行了探討。
1 資料與方法
1.1 臨床資料 選取2015年1月~2016年12月本院確診并行根治術的胃癌患者200例(觀察組),男121例、女79例,年齡34~85(56.30±11.24)歲,淋巴結轉移陰性43例、陽性157例,手術清掃淋巴結均≥15枚。同時選取性別、年齡相匹配的體檢健康者100例作為對照組,男61例、女39例,年齡30~84(57.69±10.77)歲。患者均簽署知情同意書,并經本院醫學倫理委員會批準。
1.2 血清ILF3蛋白、IL-10、IL-6、TNF-α水平檢測 觀察組分別于術前1 d、術后1個月采血,對照組體檢時采血。取空腹靜脈血5 mL,室溫靜置30 min,3 000 r/min離心15 min,分離血清。采用雙抗體夾心法檢測血清ILF3蛋白、IL-10、IL-6、TNF-α水平。嚴格按照試劑盒說明書進行操作。全自動免疫分析儀購自瑞士Hamilton公司,試劑盒購自美國R&D Systems公司。
1.3 胃癌組織與癌旁正常黏膜組織中ILF3蛋白水平檢測 術中留取胃癌組織與癌旁正常黏膜組織(距腫瘤邊緣>3 cm)標本,用PBS漂洗,液氮保存備用。將標本融化,在2~8 ℃的環境下操作,加入PBS(pH 7.4),將標本充分勻漿。離心20 min(2 000~3 000 r/min)后收集上清液。采用雙抗體夾心法檢測組織中ILF3蛋白水平。
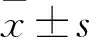
2 結果
2.1 兩組血清ILF3蛋白、TNF-α、IL-6 、IL-10水平比較 觀察組術前血清ILF3蛋白、IL-6、TNF-α水平高于術后及對照組(P均<0.05),血清IL-10水平低于術后及對照組(P均<0.05)。術后兩組血清ILF3蛋白、TNF-α、IL-6 、IL-10水平比較差異無統計學意義(P均>0.05)。見表1。
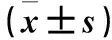
表1 兩組血清ILF3蛋白、TNF-α、IL-6 、IL-10水平比較
2.2 胃癌組織與癌旁正常黏膜組織中ILF3蛋白水平比較 觀察組胃癌組織ILF3蛋白水平[(785.37±93.23)pg/mL]高于癌旁正常黏膜組織[(58.32±6.38)pg/mL],二者比較差異有統計學意義(P<0.05)。
2.3 ILF3蛋白水平變化與胃癌淋巴結轉移的關系 淋巴結轉移陽性胃癌患者術前血清ILF3蛋白水平[639.27±73.27)pg/mL]高于淋巴結轉移陰性的胃癌患者[(444.67±55.18)pg/mL],二者比較差異有統計學意義(P<0.05)。淋巴結轉移陽性胃癌患者癌組織中ILF3蛋白水平[(847.66±91.04)pg/mL]高于淋巴結轉移陰性的胃癌患者[(557.84±74.38)pg/mL],二者比較差異有統計學意義(P<0.05)。
2.4 胃癌患者術前血清ILF3蛋白水平與其他指標的關系 Spearman相關分析結果顯示,胃癌患者術前血清ILF3蛋白水平與腫瘤組織ILF3蛋白水平呈正相關(rs=0.229,P<0.05),術后血清ILF3蛋白水平與腫瘤組織ILF3蛋白水平無相關性(rs=0.108,P>0.05)。胃癌患者術前血清ILF3蛋白水平與術前血清TNF-α、IL-6水平呈正相關(rs分別為0.202、0.234,P均<0.05),與術前血清IL-10水平呈負相關(rs=-0.213,P<0.05)。
3 討論
ILF3蛋白基因位于19號染色體短臂13區2帶,編碼894個氨基酸殘基,由1個NF45同源結構域、1個二聯的核定位信號、2個dsRBM的RNA結合結構域、RGG序列及GQSY富含區域組成。ILF3蛋白基因在mRNA的成熟、降解、轉錄、定位等一系列翻譯前活動及影響其穩定性方面有重要作用。研究顯示,ILF3蛋白在炎癥反應中發揮了重要作用,是白細胞介素在T細胞中表達所需的轉錄因子,參與白細胞介素的表達[8]。ILF3蛋白可通過轉錄調控功能參與腫瘤細胞的增殖、侵襲及轉移[9]。但關于ILF3蛋白與胃癌的發病、進展及轉移之間關系的報道少見。本研究發現,ILF3蛋白在胃癌組織的表達高于癌旁正常黏膜組織,提示ILF3蛋白的表達與腫瘤的發生發展密切相關。本研究還發現,淋巴結轉移陽性患者腫瘤組織中ILF3蛋白水平高于淋巴結轉移陰性者,提示ILF3蛋白的水平可能與胃癌淋巴結轉移密切相關,ILF3蛋白過表達可能預測腫瘤淋巴結轉移。
本研究發現,胃癌患者手術前血清ILF3蛋白水平高于對照組,腫瘤切除1個月后血清ILF3蛋白水平降至與對照組接近,說明血清中ILF3蛋白水平與患者體內腫瘤負荷有關。因此,ILF3蛋白可作為新的胃癌標志物。淋巴結轉移陽性患者血清ILF3蛋白水平高于淋巴結轉陰性者,提示ILF3蛋白是胃癌淋巴結轉移的重要標志。本研究的相關分析顯示,胃癌患者腫瘤組織中ILF3蛋白的水平和血清中ILF3蛋白的水平存在明顯正相關性,說明血清中ILF3蛋白的水平可能反映機體腫瘤組織的狀態;且血清檢測簡便快捷、可多次重復,監測血清ILF3蛋白水平可預測腫瘤發生發展。
TNF-α、IL-6、IL-10是炎癥反應時重要的炎癥因子[10]。腫瘤進展中一直伴隨炎癥反應。有研究顯示,腫瘤患者體內炎癥因子水平明顯升高[11]。本研究中胃癌患者術前血清TNF-α、IL-6水平高于對照組,IL-10水平低于對照組。而在腫瘤切除后炎癥因子TNF-α、IL-6水平下降,IL-10水平升高,提示TNF-α、IL-6、IL-10參與了胃癌的進展。相關分析發現,胃癌患者術前血清ILF3蛋白水平與TNF-α、IL-6水平存在正相關,與IL-10水平存在負相關,推測ILF3蛋白可能通過影響炎癥因子水平參與腫瘤的進展。
總之,胃癌患者腫瘤組織和血清中ILF3蛋白水平明顯升高,且具有正相關性;ILF3蛋白水平隨腫瘤組織的切除而下降。此外淋巴結轉移陽性的胃癌患者腫瘤組織及術前血清ILF3蛋白水平均高于淋巴結轉移陰性的胃癌患者。提示ILF3蛋白與腫瘤的發生、轉移密切相關。血清ILF3蛋白與血清TNF-α、IL-6水平存在正相關關系,ILF3蛋白與IL-10水平存在負相關關系,提示ILF3蛋白影響炎癥因子的水平。ILF3蛋白可能通過調節炎癥反應參與腫瘤的發展。因此,監測血清ILF3蛋白水平變化可為胃癌的診治提供依據。
[1] Choi YY, Noh SH, Cheong JH. Evolution of gastric cancer treatment: from the golden age of surgery to an era of precision medicine[J]. Yonsei Med J, 2015,56(5):1177-1185.
[2] Choi YY, An JY, Kim HI, et al. Current practice of gastric cancer treatment[J]. Chin Med J (Engl), 2014,127(3):547-553.
[3] Chen G, Tang N, Wang C, et al. TNF-α-inducing protein of Helicobacter pylori induces epithelial-mesenchymal transition (EMT) in gastric cancer cells through activation of IL-6/STAT3 signaling pathway[J]. Biochem Biophys Res Commun, 2017,484(2):311-317.
[4] Cobler L, Pera M, Garrido M, et al. CDX2 can be regulated through the signalling pathways activated by IL-6 in gastric cells[J]. Biochim Biophys Acta, 2014, 1839(9):785-792.
[5] Ohno M, Fujita M, Nishizuka M, et al. Interactions of thyroid hormone receptor with Ku proteins and interleukin enhancer binding factor 3 modulate the promoter activity of thyroid-stimulating hormone alpha[J]. Biol Pharm Bull, 2012,35(3):380-384.
[6] Agnoletto C, Brunelli L, Melloni E, et al. The anti-leukemic activity of sodium dichloroacetate in p53mutated/null cells is mediated by a p53-independent ILF3 /p21 pathway[J]. Oncotarget, 2015,6(4):2385-2396.
[7] Jiang W, Huang H, Ding L, et al. Regulation of cell cycle of hepatocellular carcinoma by NF90 through modulation of cyclin E1 mRNA stability[J]. Oncogene, 2015,34(34):4460-4470.
[8] Wandrey F, Montellese C, Koos K, et al. The NF45/NF90 Heterodimer Contributes to the Biogenesis of 60S Ribosomal Subunits and Influences Nucleolar Morphology[J]. Mol Cell Biol, 2015,35(20):3491-3503.
[9] Shamanna RA, Hoque M, Pe'ery T, et al. Induction of p53, p21 and apoptosis by silencing the NF90/NF45 complex in human papilloma virus-transformed cervical carcinoma cells[J]. Oncogene, 2013,32(43):5176-5185.
[10] Sarray S, Saleh LR, Lisa Saldanha F, et al. Serum IL-6, IL-10, and TNFα levels in pediatric sickle cell disease patients during vasoocclusive crisis and steady state condition[J]. Cytokine, 2015,72(1):43-47.
[11] Sideras K, Kwekkeboom J. Cancer inflammation and inflammatory biomarkers: can neutrophil, lymphocyte, and platelet counts represent the complexity of the immune system[J]. Transpl Int, 2014,27(1):28-31.
河北省醫學科學研究重點課題(20170147)。
李勇(E-mail: li_yong_hbth@126.com)
10.3969/j.issn.1002-266X.2017.37.020
R735.2
B
1002-266X(2017)37-0060-03
2017-06-16)

