麻花艽β-amyrin合成酶基因GsAS2的載體構建及遺傳轉化
劉艷玲,向鳳寧
(1.萊蕪職業技術學院信息工程系,山東 萊蕪 271100;2.山東大學生命科學院植物細胞工程與種質創新教育部重點實驗室,山東 濟南 250100)
麻花艽β-amyrin合成酶基因GsAS2的載體構建及遺傳轉化
劉艷玲1,向鳳寧2
(1.萊蕪職業技術學院信息工程系,山東 萊蕪 271100;2.山東大學生命科學院植物細胞工程與種質創新教育部重點實驗室,山東 濟南 250100)
【目的】本文擬進行麻花艽β-amyrin合成酶基因GsAS2的載體構建及遺傳轉化。【方法】 首先利用gateway方法進行GsAS2的RNAi載體(pK7GWIWG-GsAS2)和過表達載體(pK7WG2D-GsAS2)的構建,并利用基因槍轉化麻花艽胚性愈傷組織,經卡那霉素(Kan)篩選后,進一步用35S啟動子引物進行抗性植株總DNA的PCR檢測。【結果】獲得GsAS2的RNAi陽性植株5株,過表達植株8株,轉化頻率分別為2.94 %和4.00 %。對轉基因植株進行GsAS2的半定量RT-PCR分析和齊墩果酸的HPLC測定表明:GsAS2的表達在RNAi系中受到較大抑制,其齊墩果酸含量均低于對照(為對照的48.5 %~80.7 %),而在過表達系中GsAS2則超量表達,且齊墩果酸含量均高于對照(為對照的1.67~2.46倍)。【結論】說明GsAS2的表達與下游產物齊墩果酸的含量關系密切。
麻花艽;β-amyrin合成酶基因;載體構建;遺傳轉化
【研究意義】隨著基因工程技術的不斷完善,應用分子克隆和遺傳轉化手段對植物細胞代謝網絡進行修飾和改造來積累目標產物已成為研究的熱點領域[1-2]。【前人研究進展】目前,通過超量表達代謝途徑中的限速酶基因來提高目標產物含量已成為植物代謝工程的主要方法之一[3-5]。Yun等在顛茄中引入編碼莨菪堿-6β-羥化酶基因,結果使顛茄中含量很低的東莨菪堿大量積累,并且幾乎所有的莨菪堿都轉化成了東莨菪堿[6];Shim等在人參中過量表達SQS基因,測得轉基因植物中人參皂甙的含量為對照的2.5倍[7]。因此目前較好的方法就是用已獲得的有用基因建立起簡單的轉基因系來研究次生代謝途徑中的關鍵酶基因及與目標產物的關系。麻花艽(GentianastromineaMaxim.)系龍膽科(Gentianaceae)、龍膽屬(Gentiana)植物,是我國重要的傳統中藥材之一,主要有效成分為熊果酸、齊墩果酸、獐牙菜苷等,主治風濕性關節痛、黃膽性肝炎、膽結石等疾病[8-11]。其中齊墩果酸為抗肝炎的有效成分,其合成的前體物是β-amyrin。研究表明,β-amyrin合成酶為氧化角鯊烯環化酶(OSCs)家族的一員,是合成β-amyrin及其下游產物齊墩果酸的關鍵酶之一[12-13]。【本研究切入點】在前面的研究中,已經克隆獲得了β-amyrin合成酶基因GsAS2的全長序列并進行了功能驗證[14],本研究中,擬實現GsAS2對麻花艽愈傷組織的轉化,從而獲得GsAS2 RNAi系和過表達系的再生植株,分析陽性植株中GsAS2的表達量與齊墩果酸含量的關系。【擬解決的關鍵問題】為齊墩果酸代謝途徑的深入研究奠定基礎。
1 材料與方法
1.1 載體構建
1.1.1 載體 pDONR為入門載體,pK7GWIWG為RNAi載體,pK7WG2D為過表達載體。
1.1.2 PCR反應引物 P1:5′-AAAAAGCAGGCTTCATTCTTTACGCAGAGCCG-3′;P2:5′-AGAAAGC TGGGTCATCGTGCTGTGACCTTCTAT-3′; P3:5′-AA AAAGCAGGCTCGATGTGGAGGCTGAAGATCG-3′;P4:5′-AGAAAGCTGGGTCCGTCTCTCAAATCTTCAA GATGGCAA-3′。
1.1.3 BP反應 反應體系:二次PCR產物(40~100 fmol) 3.5 μl,pDONRTMvector (150 ng/μl) 0.5 μl,BP ClonaseTMenzyme mixture 1 μl,25 ℃水浴8 h。
1.1.4 LR反應 反應體系:BP產物(40~100 fmol) 3.5 μl,Destination vector (150 ng/μl) 0.5 μl,BP ClonaseTMenzyme mixture 1 μl,25 ℃水浴8 h。
1.2 遺傳轉化
1.2.1 基因槍轉化方法 在轉化之前將麻花艽愈傷組織轉至含有高滲培養基(MS+0.4 mol/L甘露醇)的培養皿中心2 cm2范圍內;基因槍為PDS-1000/He型,氣壓1100 psi;微彈制作過程參照Becker等[15]方法。轟擊的微彈量為2912 μg/g。
1.2.2 再生陽性植株篩選 轟擊后16 h 將胚性愈傷組織移至含150 mg/L卡那霉素的IB培養基上進行繼代篩選,然后在不含抗生素的IB培養基上分化出綠色再生植株。以CTAB法提取再生植株DNA,PCR擴增35S啟動子片段,篩選陽性轉基因植株。
1.3 齊墩果酸的HPLC測定
1.3.1 儀器與試劑 LC-10AD型高效液相色譜儀(日本島津公司),齊墩果酸對照品購自中國藥品生物制品檢定所。
1.3.2 實驗方法 分別取齊墩果酸標準品3、6、9、12、15 μl進樣,以峰面積為橫坐標,以進樣量為縱坐標作圖,得到回歸方程:y=0.0016x-180.44(R=0.0093)。表明齊墩果酸進樣量在200~1000 ng范圍內線性關系良好。
2 結果與分析
2.1 RNAi和過表達載體構建
采用gateway方法來構建麻花艽GsAS2基因載體。RNAi載體構建,首先要進行2次PCR反應,第一次以P1、P2為引物,pMD18T-GsAS2質粒為模板進行(圖1A);第二次以attB1和attB2為引物、一次PCR產物為模板進行(圖1B),然后經過BP反應,轉化大腸桿菌DH5α,并通過菌體PCR篩選獲得陽性質粒pDONR-GsAS2(圖1C),最后進行LR反應,獲得pK7G-GsAS2陽性質粒(圖1D),通過測序證明GsAS2的RNAi載體構建成功。
對于過表達載體構建,也是首先進行2次PCR反應,第一次以P3、P4為引物、pMD18T-GsAS2質粒為模板進行(圖2A),第二次以attB1和attB2為引物、一次PCR產物為模板進行(圖2B),然后經過BP反應,轉化大腸桿菌DH5α后,通過菌體PCR篩選獲得陽性質粒pDONR-GsAS2(圖2C),最后進行LR反應,獲得pK7W-GsAS2陽性質粒(圖2D),通過測序證明GsAS2的過表達載體構建成功。

A.GsAS2基因片段的一次PCR結果圖;B. GsAS2基因片段的二次PCR結果圖;C. BP反應轉化大腸桿菌后pDONR-GsAS2的菌體PCR驗證;D. LR反應轉化大腸桿菌后pK7G-GsAS2片段的菌體PCR驗證A.The first PCR of GsAS2 fragment; B. The second PCR of GsAS2 fragment; C. Thalli PCR verification of pDONR-GsAS2 fragment after BP reaction; D. Thalli PCR verification of pK7G-GsAS2 fragment after LR reaction圖1 麻花艽GsAS2 RNAi載體的構建Fig.1 Construction of RNAi vector for G. strominea gene GsAS2
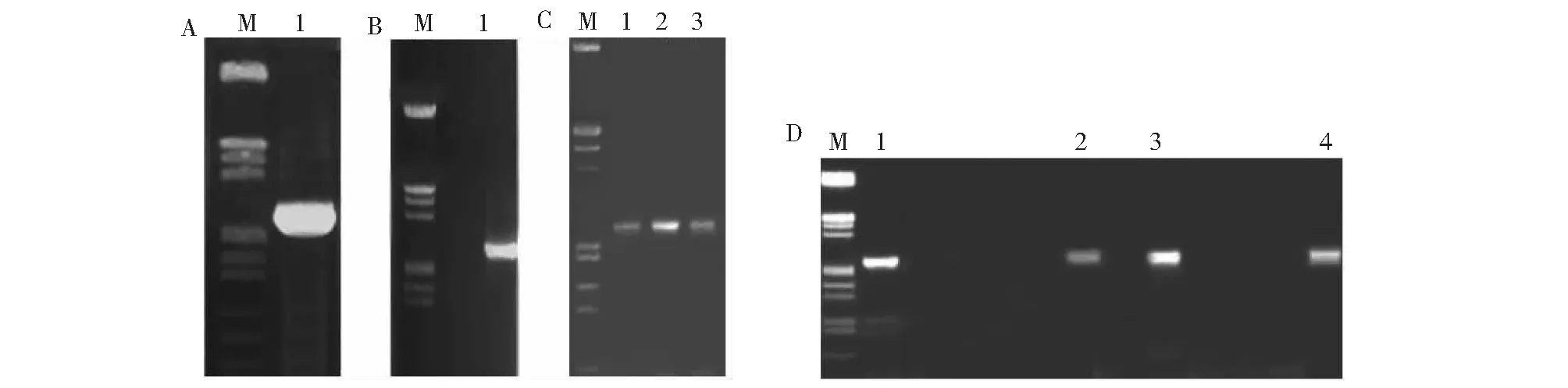
A.GsAS2基因片段的一次PCR結果圖;B. GsAS2片段的二次PCR結果圖;C.BP反應轉化大腸桿菌后pDONR-GsAS2的菌體PCR驗證;D. LR反應轉化大腸桿菌后pK7W-GsAS2 的菌體PCR驗證A.The first PCR of GsAS2 fragment; B. The second PCR of GsAS2 fragment; C. Thalli PCR verification of GsAS2 after BP reaction;D. Thalli PCR verification of GsAS2 fragment after LR reaction圖2 麻花艽GsAS2 過表達載體的構建Fig.2 Construction of overexpression vector for G. strominea gene GsAS2
2.2 麻花艽的遺傳轉化
選取具有胚性的麻花艽愈傷組織作為轉基因植物材料,置于培養皿中用于pK7G-GsAS2和pK7W-GsAS2的基因槍轉化。基因槍轟擊后,先將麻花艽愈傷組織暗培養24 h,然后轉接于B1培養基(含有150 mg/L卡那霉素)上,根據其生長情況留下黃綠色部分,剔除黑褐色部分,從而篩選出抗性愈傷組織。而后再轉接于IB培養基(不含卡那霉素)進行苗的分化培養,經過多次繼代待幼苗長出后,使用25 mg/L的卡那霉素進一步來篩選抗性植株,最終得到RNAi系植株21株、過表達系植株34株(圖3,表1)。用35S啟動子引物對抗性植株總DNA進行PCR檢測,結果表明,pK7G-GsAS2 RNAi系的陽性植株為5株,轉化率為2.94 %;pK7W-GsAS2過表達系的陽性植株為8株,轉化率為4.00 %(圖4,表1)。
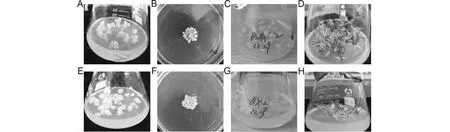
A~D. pK7G-GsAS2遺傳轉化過程;E-H. pK7W-GsAS2遺傳轉化過程;A、E. 轉化前愈傷組織;B、F. 遺傳轉化; C、G. 抗性愈傷組織的篩選; D、F. 陽性再生植株A-D. pK7G-GsAS2 genetic transformation;E-H. pK7W-GsAS2 genetic transformation;A,E. The calli before transformation;B,F. Genetic transformation; C,G. Selection of kan-resistant calli; D,F. Positive plants圖3 麻花艽愈傷組織的遺傳轉化Fig.3 The transformation of G.strominea calli
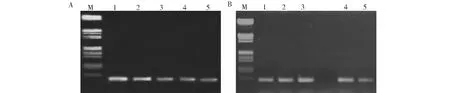
A. pK7G-GsAS2轉基因抗性植株的PCR結果(1~5:陽性植株);B. pK7W-GsAS2轉基因抗性植株的PCR結果(1~5:陽性植株)A. PCR result from resistant plants of pK7G-GsAS2 transformation (1-5:Positive plants); B. PCR result from resistant plants of pK7W-GsAS2 transformation (1-5:Positive plants)圖4 抗性植株的PCR檢測Fig.4 PCR result from transformation resistant plants
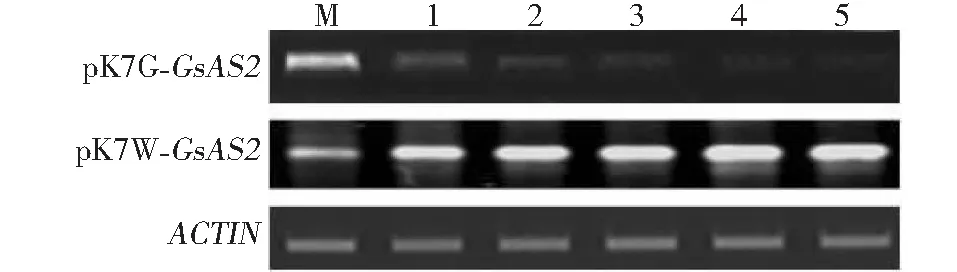
圖5 轉基因陽性植株GsAS2的半定量RT-PCRFig.5 RT-PCR of GsAS2 for positive plants of pK7G-GsAS2 and pK7W-GsAS2 transformation
2.3 轉基因植株的檢測
2.3.1 轉基因麻花艽GsAS2的RT-PCR分析 分別選取5株pK7G-GsAS2和pK7W-GsAS2的轉基因植株,進行麻花艽β-amyrin合成酶基因GsAS2的RT-PCR分析(圖5),在RNAi系轉基因植株中,GsAS2的表達量均顯著低于對照,而在過表達系轉基因植株中,其表達量均明顯高于對照,說明GsAS2的表達在RNAi系中受到較大抑制,而在過表達系中則超量表達。
2.3.2 轉基因植株的齊墩果酸含量分析 對上述選取的10株轉基因麻花艽進行齊墩果酸的HPLC分析。如圖6所示,RNAi系中的5株轉基因麻花艽的齊墩果酸含量均低于對照(為對照的48.5 %~80.7 %),而過表達系中的5株轉基因麻花艽的齊墩果酸含量均高于對照(為對照的1.67~2.46倍)。由此可見,可以通過抑制或促進GsAS2的表達來降低或提高齊墩果酸的合成,且抑制和促進的程度與齊墩果酸的含量呈正相關。
3 討 論
萜類化合物是目前最大的一類植物次級代謝物,近幾年,有關萜類的代謝工程研究已經取得了重要進展,從人參[7]、擬南芥[16-17]、豌豆[18]等植物中分離和克隆了許多OSCs基因,但是,有關OSCs基因的研究多局限在通過酵母表達體系來鑒定其生化功能,而在植物體中所參與代謝途徑的解析及生物學功能的研究還非常少[19-20]。本實驗對OSCs基因家族成員β-amyrin合成酶基因GsAS2進行了植物表達載體的構建,獲得了GsAS2的RNAi系和過表達系,并通過轉化麻花艽胚性愈傷組織,篩選得到了陽性植株,結果發現RNAi系中GsAS2基因表達量明顯下降,且其下游產物齊墩果酸含量也很低;而過表達系中,GsAS2基因表達量明顯上升,且齊墩果酸含量也大幅升高,二者具有很好的相關性。這為齊墩果酸代謝途徑的深入研究打下了良好的基礎。
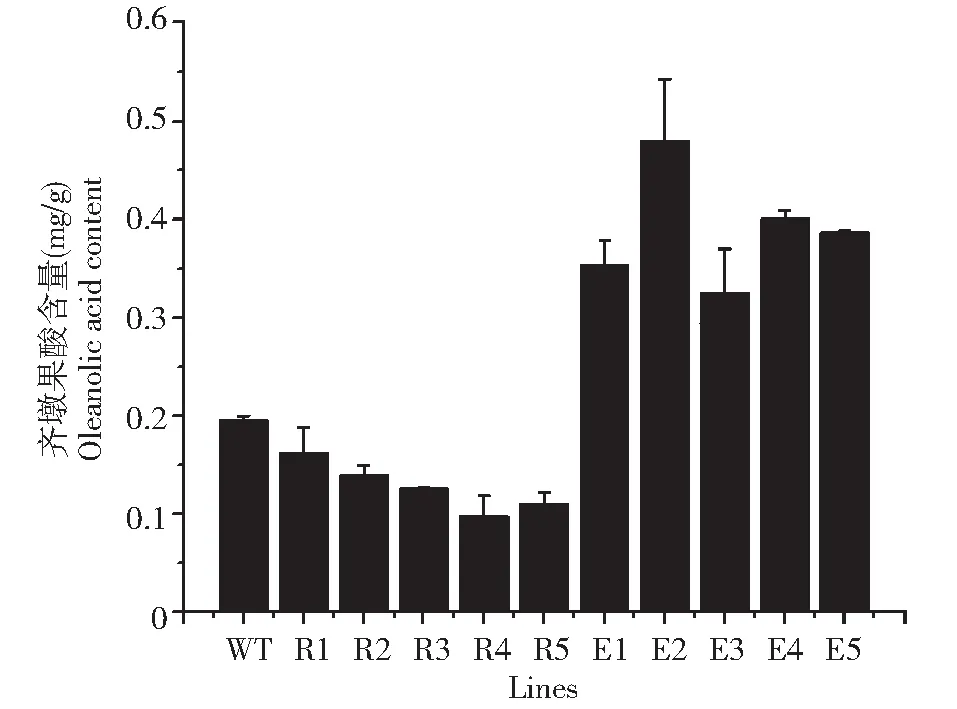
WT:野生型;R:RNAi系;E:過表達系WT: Wild type; R: RNAi lines; E: Over-expression lines圖6 轉基因陽性植株的齊墩果酸含量分析Fig.6 Oleanolic acid content of transgenic plants
植物次生代謝是一個龐大的網絡系統,中間涉及多條代謝途徑及參與這些途徑的基因和酶。目前我們掌握的信息還非常少,僅局限在鑒定和克隆少數幾個基因上,在齊墩果酸合成過程中,除β-amyrin合成酶基因外是否還有其它關鍵酶基因或旁支途徑影響其代謝還不得而知,因此要想全面探明影響齊墩果酸代謝的各種酶、各基因及各途徑的相互關系將是一個非常艱巨和長期的任務,需要進一步研究。
4 結 論
本研究通過進行麻花艽β-amyrin合成酶基因GsAS2的載體構建及遺傳轉化,獲得GsAS2的RNAi陽性植株5株,過表達植株8株,轉化頻率分別為2.94 %和4.00 %。且GsAS2的表達在RNAi系中受到較大抑制,其齊墩果酸含量均低于對照(為對照的48.5 %~80.7 %),而在過表達系中GsAS2則超量表達,齊墩果酸含量均高于對照(為對照的1.67~2.46倍)。說明GsAS2的表達與下游產物齊墩果酸的含量關系非常密切。
[1]王 麗, 史玲玲, 張艷霞, 等. 植物次生代謝物途徑及其研究進展[J]. 武漢植物學研究, 2007, 25(5):500-508.
[2]高 亞, 于麗杰. 植物細胞培養技術生產次生代謝產物的研究進展[J]. 牡丹江師范學院學報(自然科學版), 2008,62(1):25-27.
[3]Seo J W, Jeong J H, Shin C G, et al. Overexpression of squalene synthase inEleutherococcussenticosusincreases phytosterol and triterpene accumulation[J]. Phytochemistry,2005,66(8): 869-877.
[4]Banyai W, Kirdmanee C, Mii M, et al. Overexpression of farnesyl farnesyl pyrophosphate synthase (FPS) gene affected artemisinin content and growth ofArtemisiaannuaL.[J]. Plant Cell Tiss Org,2010,103(2):255-265.
[5]Muir S R, Collins G J, Robinson S, et al. Overexpression of petunia chalcone isomerase in tomato results in fruit containing increased levels of flavonols[J]. Nature Biotechnology, 2001, 19(5): 470-474.
[6]Yun D J, Hashimoto T, Yamada Y. Metabolic engineering of medicinal plants: transgenicAtropabelladonnawith an improved alkaloid composition[J]. Proceedings of the National Academy of Sciences, 1992, 89(24): 11799-11803.
[7]Shim J S, Lee O R, Kim Y J, et al. Overexpression ofPgSQS1 increases ginsenoside production and negatively affects ginseng growth rate inPanaxginseng[J]. Journal of Ginseng Research, 2010, 34(2): 98-103.
[8]張西玲, 晉 玲, 劉麗莎. 近10年秦艽、麻花艽研究概況[J]. 中國中醫藥信息雜志,2000, 10(增): 62-63.
[9]劉艷紅. 秦艽中的環烯醚苷類成分[J]. 云南植物研究, 1995,15(1):,85-91.
[10]近藤嘉和. 秦艽的成分研究[J]. 生藥學雜志,1996,46(3):42-343.
[11]Ji L J, Ma Y H, Chen G C, et al. Determination and evaluation of two iridoids inGentianastramineaherbs by HPLC[J]. Acta Botanica Boreali-Occidentalia Sinica,2004, 24(2):292-295.
[12]田麗婷, 馬 龍, 堵年生. 齊墩果酸的藥理作用研究概況. 中國中藥雜志,2002,27(12): 884-888.
[13]Haralampidis K, Trojanowska M, Osbourn A E. Biosynthesis of triterpenoid saponins in plants[J]. Adv. Biochem. Eng. Biotechnol,2002,75:31-49.
[14]Liu Y L, Cai Y F, Zhao Z J, et al. Cloning and Functional Analysis of a β-Amyrin Synthase Gene Associated with Oleanolic Acid Biosynthesis inGentianastramineaMAXIM[J]. Biol Pharm Bull, 2009, 32(5):818-824.
[15]Becker D, Brettschneider R, Lorz H. Fertile transgenic wheat from microprojectile bombardment of scutellar tissue[J]. Plant J.,1994,5(2):299-307.
[16]Segura M J, Meyer M M, Matsuda S P.ArabidopsisthalianaLUP1 converts oxidosqualene to multiple triterpene alcohols and a triterpene diol[J]. Org. Lett, 2000, 15(2): 2257-2262.
[17]Husselstein-Muller T, Schaller H, Benveniste P. Molecular cloning and expression in yeast of 2, 3-oxidosqualene triterpenoid cyclases fromArabidopsisthaliana[J]. Plant Mol. Biol., 2001,45(1): 75-82.
[18]Morita M, Shibuya M, Kushiro T. Molecular cloning and functional expression of triterpene synthases from pea (Pisumsativum) new alpha-amyrin-producing enzyme is a multifunctional triterpene synthase[J]. Eur. J. Biochem, 2000,267(12): 3453-3459.
[19]Masataka K, Katsuyuki T, Yamato, et al. Cloning and characterization of a cDNA encoding β-amyrin synthase from petroleum plantEuphorbiatirucalliL.[J]. Phytochemistry, 2005,66(15): 1759-1766.
[20]Maria C, Maria F C, Paola P, et al. Molecular characterization of β-amyrin synthase fromAstersedifoliusL. and triterpenoid saponin analysis[J]. Plant Science,2005,175(3):255-261.
(責任編輯 李 潔)
ConstructionandTransformationofβ-amyrinSynthaseGeneGsAS2VectorinGentianastramineaMaxim.
LIU Yan-ling1, XIANG Feng-ning2
(1.Biotechnology Institute, Laiwu College for Vocational Technology, Shandong Laiwu 271100,China; 2. Key Laboratory of Plant Cell Engineering and Germplasm Innovation, Ministry of Education, School of Life Sciences, Shandong University,Shandong Jinan 250100, China)
【Objective】Construction and transformation of β-amyrin synthase geneGsAS2 vector inGentianastramineaMaxim. was done in this subject. 【Method】Plant RNAi vector (pK7GWIWG-GsAS2) and overexpression vector (pK7WG2D-GsAS2) were constructed using gateway technique and transferred into callus ofG.Stramineaby particle gun. Resistant lines were gained by selecting in the culture medium with 150 mg/L kanamycin. 35S promoter primers were used to amplify a fragment ofGsAS2 from genome of resistant plants. 【Result】 The transformation rate was caculated (GsAS2 RNAi lines 2.94 %,GsAS2 overexpression lines 4.00%). The results of RT-PCR and HPLC analysis for transgenic plants showed that in RNAi lines the expression ofGsAS2 was suppressed and the plants had lower oleanolic acid, whereas in overexpression lines the expression ofGsAS2 was promoted and the plants accumulated more oleanolic acid. 【Conclusion】All this showed there was close relationship between the expression ofGsAS2 and the content of oleanolic acid.
GentianastromineaMaxim.; β-amyrin synthase geneGsAS2; Vector construction; Genetic transformation
Q81
A
1001-4829(2017)11-2444-05
10.16213/j.cnki.scjas.2017.11.009
2016-12-23
萊蕪職業技術學院博士科研啟動基金(2015bsky01)
劉艷玲(1977-),女,黑龍江北安人,博士研究生,主要研究方向:中藥材次生代謝,E-mail:lyling9030@163.com,Tel:13376343556。

