布地奈德對呼吸道合胞病毒感染的哮喘小鼠肺損傷保護作用
郭 穎,張 娟,蔡玉香,周寧娟,徐海軍,孫 新*
(1第四軍醫大學西京醫院兒科,西安 710032;2西安市兒童醫院新生兒科;*通訊作者,E-mail:sunxin6@fmmu.edu.cn)
布地奈德對呼吸道合胞病毒感染的哮喘小鼠肺損傷保護作用
郭 穎1,張 娟1,蔡玉香2,周寧娟1,徐海軍1,孫 新1*
(1第四軍醫大學西京醫院兒科,西安 710032;2西安市兒童醫院新生兒科;*通訊作者,E-mail:sunxin6@fmmu.edu.cn)
目的 觀察布地奈德對呼吸道合胞病毒(RSV)感染的哮喘小鼠模型肺部損傷的保護作用。 方法 6-8周齡雄性BALB/c小鼠36只,隨機分為對照組、模型組、布地奈德組,每組12只。模型組和布地奈德組用卵清蛋白腹腔注射致敏和霧化吸入激發,建立小鼠哮喘模型,對照組用生理鹽水替代。于28,30,32 d,用RSV病毒液隔日滴鼻,連續3次,建立急性病毒感染哮喘模型。對照組用生理鹽水滴鼻。布地奈德組于27-33 d給予布地奈德霧化吸入,每日1次,每次30 min,第34天給予各組小鼠肺泡灌洗,收集支氣管肺泡灌洗液(BALF),計數BALF中的白細胞數目;制作肺組織的病理切片,HE染色光鏡觀察肺組織病理變化;免疫組化法觀察HMGB1、TLR4在肺組織中的表達;ELISA檢測BALF與血清中細胞因子IFN-γ、IL-2、IL-13及嗜酸性粒細胞趨化因子。 結果 與對照組相比,模型組與布地奈德組小鼠BALF中嗜酸性粒細胞、中性粒細胞及巨噬細胞升高(P<0.01)。與模型組相比,布地奈德組小鼠BALF中白細胞總數明顯降低(P<0.01),BALF及血清中細胞因子,嗜酸性粒細胞趨化因子、IL-13水平降低(P<0.01);IFN-γ、IL-2水平明顯增高(P<0.01)。肺組織病理結果顯示吸入布地奈德可減少小鼠肺組織炎癥細胞浸潤,抑制HMGB1、TLR4在肺組織中的表達。 結論 布地奈德可減輕RSV感染的哮喘小鼠氣道炎癥,吸入布地奈德對于RSV感染的哮喘小鼠具有一定的治療作用。
布地奈德; 支氣管哮喘; 卵清蛋白; 肺損傷; 小鼠
支氣管哮喘是由多種細胞和細胞組分共同參與的氣道慢性炎癥性疾病[1]。研究證明,無論是發達國家還是發展中國家,呼吸道合胞病毒(RSV)是嬰幼兒下呼吸道感染最重要的病毒病原[2,3]。吸入糖皮質激素被認為是哮喘最有效安全的治療。布地奈德是一種抗炎作用較強的吸入用糖皮質激素,其脂溶性差,但對糖皮質激素受體的親和力較強,同時具有較高的肝臟首過代謝效應,使進入體循環的藥量明顯減少,上述特點決定了布地奈德具有較強的局部抗炎作用[4]。在哮喘的治療中,布地奈德臨床應用已經非常廣泛,但是布地奈德基礎研究較少。本實驗研究觀察吸入布地奈德對于RSV感染的哮喘小鼠模型肺組織炎性因子的影響。
1 材料與方法
1.1 細胞株、主要試劑及儀器
卵清蛋白OVA購自美國Sigma公司,布地奈德購自澳大利亞AstraZeneca公司,呼吸道合胞病毒A亞型來源于(首都兒科研究所),空壓霧化器購自歐姆龍大連有限公司。
1.2 病毒的細胞培養

1.3 實驗動物與分組
8周齡SPF級BALB/c雄性小鼠(生產許可證號:SCXK(軍)2012-0007)36只,體質量(20±2)g,購自第四軍醫大學實驗動物中心,飼養于第四軍醫大學基礎部動物房,隨機分為3組,每組12只,分別為對照組、模型組、布地奈德組,用不含OVA的顆粒飼料喂養,自由飲水。整個過程遵守《實驗動物管理條例》。
1.4 模型的建立
實驗第0,7,14天給予模型組、布地奈德組小鼠腹腔注射致敏液0.2 ml進行致敏。對照組小鼠采用僅含有Al(OH)3粉末的生理鹽水溶液,注射部位及劑量與實驗組相同。實驗第21-28天給予模型組、布地奈德組霧化液激發。方法是將模型組和布地奈德組小鼠放在5 L自制的密閉容器中,使小鼠暴露在1% OVA氣霧中,每日1次,每次30 min。第29,31天每日給予上述1%OVA霧化;第28,30,32天給予體積100 μl RSV上清液鼻腔滴入,共3次。待滴鼻第4天小鼠出現毛發豎立、無光澤,煩躁不安或精神萎靡,顫動或點頭、咳嗽及呼吸加深、節律性收腹樣喘促等陽性反應,表明RSV感染小鼠模型建立成功。對照組以生理鹽水代替OVA霧化激發和鼻腔滴入,頻次及時間同上。布地奈德組于實驗第27-33天采用布地奈德霧化吸入(布地奈德1 mg溶于注射用水中霧化,每次吸入30 min,每天1次),其他二組均采用等量生理鹽水代替布地奈德霧化。
1.5 血清中細胞因子檢測
在末次激發后處死小鼠,立即摘眼球取血,4 ℃、5 000 r/min,離心10 min獲取血清。用自制穿刺針進行氣管插管并固定,用0.8 ml PBS溶液進行支氣管肺泡灌洗,將回抽的BALF于4 ℃,2 500 r/min,離心5 min,收集上清液[6]。ELISA試劑盒檢測小鼠血清和BALF中各種因子(IFN-γ、IL-2、嗜酸性粒細胞趨化因子、IL-13)。具體步驟按照試劑盒說明書進行。
1.6 肺組織標本制備
取新鮮左肺,將小鼠肺組織制成4 μm厚的切片,分別給予蘇木精-伊紅染色和免疫組化分析,觀察支氣管壁的形態學改變及肺組織中高遷移率族蛋白B1(HMGB1)、Toll樣受體4(TLR4)的表達。
1.7 統計學分析
實驗采用SPSS 17.0統計軟件,數據用均數±標準差表示,符合正態分布且方差齊者,多組間比較采用One-Way ANOVA法,組間兩兩比較采用LSD法;數據不符合正態分布者,多組間比較采用Kruskal-WallisH檢驗,組間兩兩比較采用Mann-WhitneyU檢驗,P<0.05為差異具有統計學意義。
2 結果
2.1 RSV與Hep-2細胞孵育后的變化
RSV感染細胞后,24 h后出現細胞變圓、拉長及融合現象,48-96 h后細胞病變明顯,鏡下可見細胞邊界不清,病變細胞相互融合呈“多核巨細胞”的合胞體(見圖1)。
2.2 肺組織病理變化
肺組織HE染色顯示,對照組小鼠氣道周圍炎性細胞浸潤較少,肺泡壁完整,模型組小鼠肺組織炎性細胞浸潤明顯增多,肺泡腔明顯狹窄,肺泡壁斷裂,布地奈德組小鼠肺組織炎癥較模型組明顯減輕,炎癥細胞浸潤顯著減少,偶見肺泡壁斷裂及管腔狹窄(見圖2)。
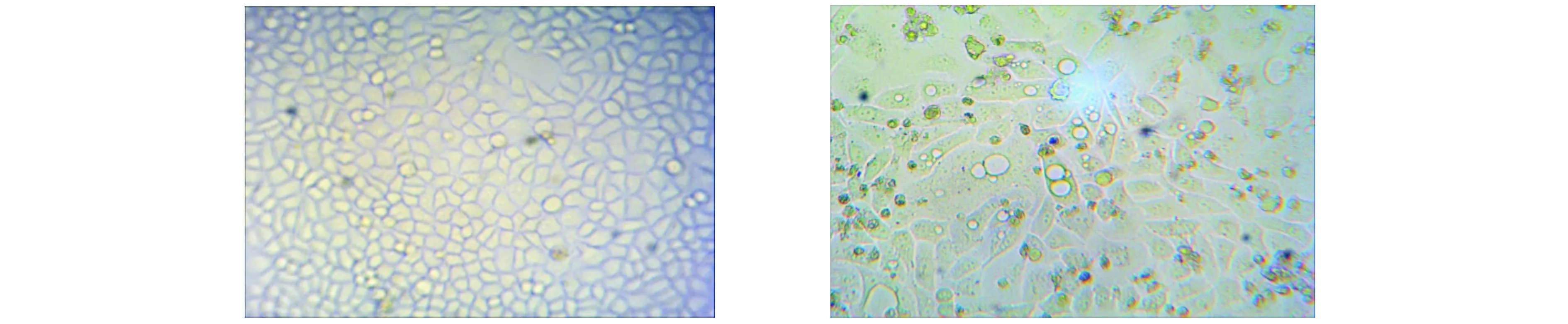
A.正常Hep-2細胞 B.接種RSV第5天的Hep-2細胞圖1 Hep-2細胞感染RSV病毒前后變化Figure 1 Changes of Hep-2 cells before and after infected with RSV virus
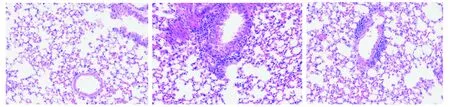
A.對照組 B.模型組 C.布地奈德組圖2 不同組肺組織HE染色結果 (×200)Figure 2 HE staining of lung tissue in three groups (×200)
2.3 肺組織免疫組化法檢測小鼠肺組織HMGB1表達
免疫組化法檢測各組小鼠肺組織HMGB1、TLR4的表達,結果顯示,對照組HMGB1、TLR4表達較弱;模型組HMGB1、TLR4表達較強;布地奈德組HMGB1、TLR4表達較哮喘組減弱;深棕黃色為HMGB1、TLR4表達陽性細胞(見圖3,4)。
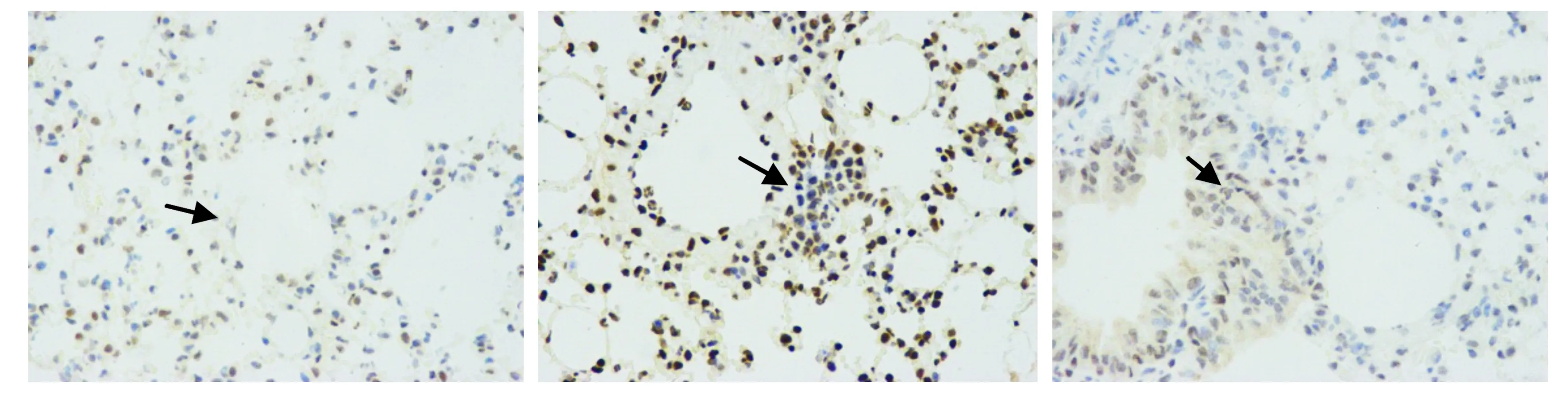
A. 對照組 B.模型組 C.布地奈德組圖3 肺組織免疫組化法檢測HMGB1表達 (×400)Figure 3 Expression of HMGB1 in lung tissues by immunohistochemical staining (×400)
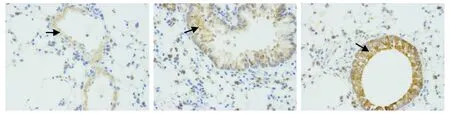
A.對照組 B.模型組 C.布地奈德組圖4 肺組織免疫組化法檢測TLR4的表達 (×400)Figure 4 Expression of TLR4 in lung tissues by immunohistochemical staining (×400)
2.4 BALF的炎癥細胞變化
與對照組小鼠相比,模型組小鼠BALF中白細胞總數明顯升高(P<0.01),主要表現為嗜酸性粒細胞、中性粒細胞及巨噬細胞的升高;布地奈德組小鼠BALF中嗜酸性粒細胞、中性粒細胞及巨噬細胞明顯降低(P<0.01,見圖5)。

與對照組相比較,**P<0.01;與模型組比較,#P<0.05,##P<0.01圖5 小鼠肺泡灌洗液中白細胞及其分類計數比較 (n=12)Figure 5 Comparison of leukocyte in bronchoalveolar lavage fluid of mice between three groups (n=12)
2.5 各組小鼠血清與BALF中IFN-γ、IL-2的檢測結果
與對照組相比,模型組小鼠血清和BALF中IFN-γ、IL-2水平明顯降低(P<0.01),與模型組比較,布地奈德組IFN-γ、IL-2明顯升高(P<0.01)。(見圖6、圖7)。
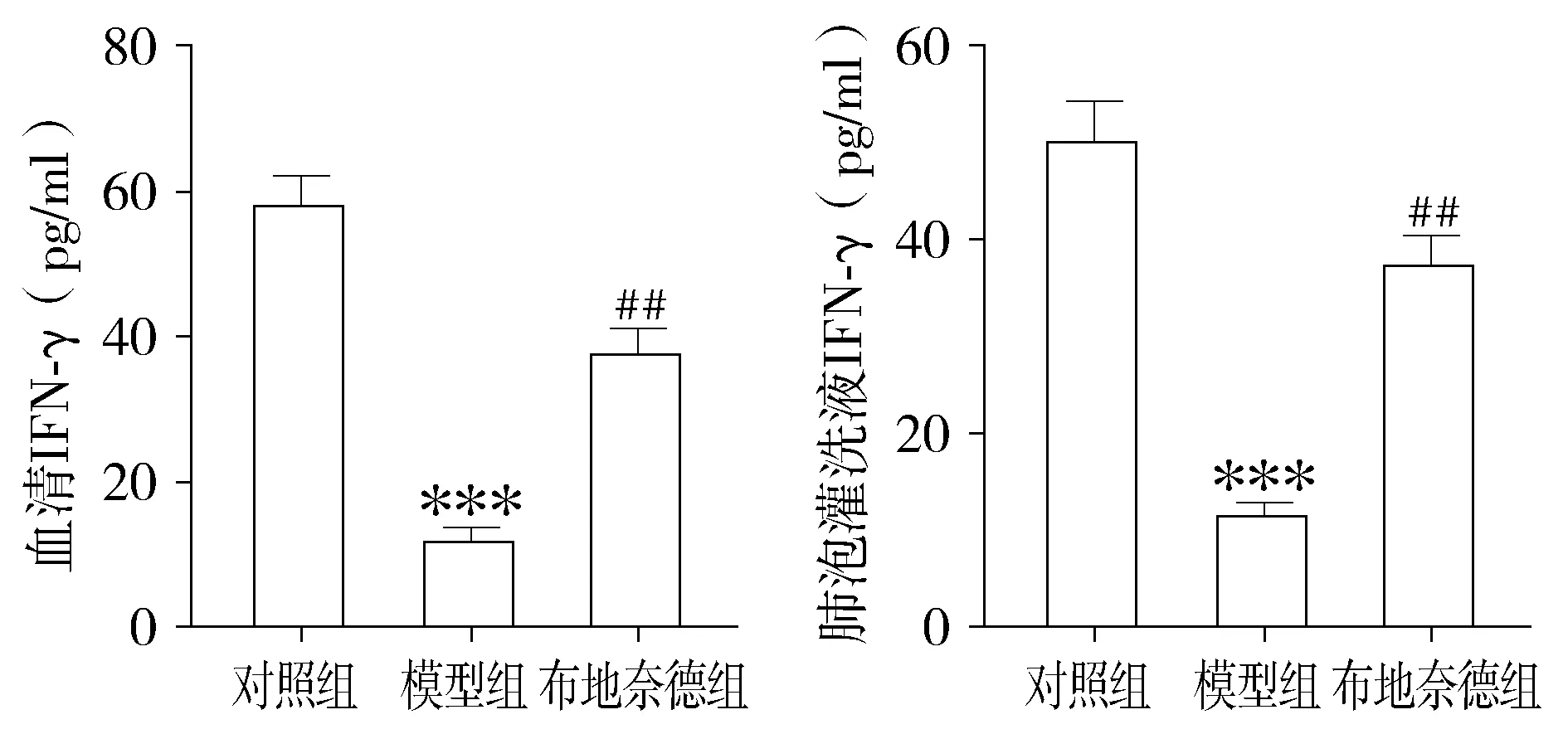
與對照組比較,***P<0.001;與模型組比較,##P<0.01圖6 各組小鼠血清和肺泡灌洗液中IFN-γ含量 (n=12)Figure 6 Comparison of levels of IFN-γ content in serum and bronchoalveolar lavage fluid of mice between three groups (n=12)
2.6 各組小鼠血清中嗜酸性粒細胞趨化因子、IL-13含量
與對照組相比,模型組小鼠血清和BALF中嗜酸性粒細胞趨化因子、IL-13水平明顯升高(P<0.01),霧化吸入布地奈德可以降低哮喘小鼠嗜酸性粒細胞趨化因子與IL-13水平(P<0.01,見圖8,9)。
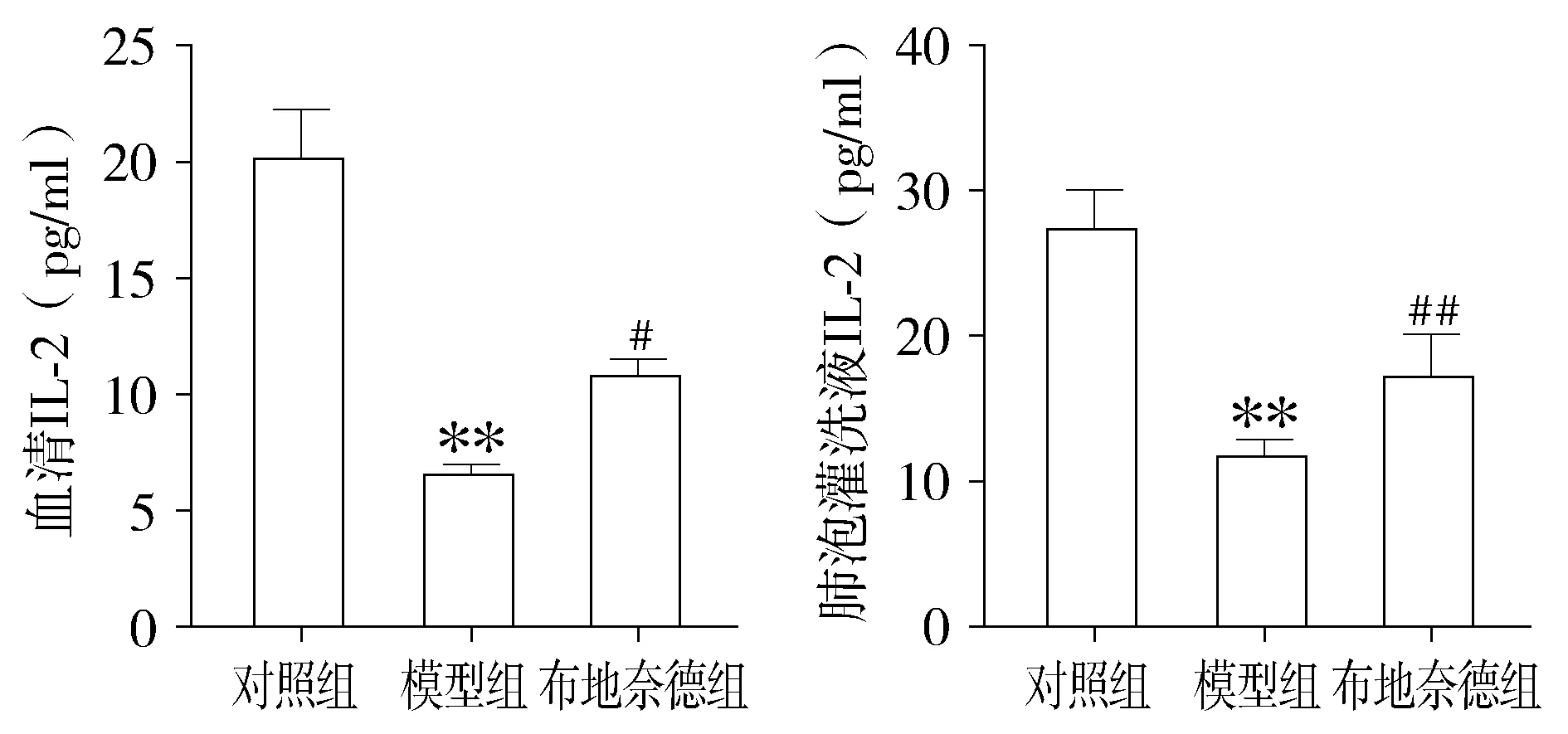
與對照組比較,*P<0.05,**P<0.01;與模型組比較,#P<0.05,##P<0.01圖7 各組小鼠血清和肺泡灌洗液中IL-2含量 (n=12)Figure 7 Comparison of IL-2 level in serum and bronchoalveolar lavage fluid of mice between three groups (n=12)
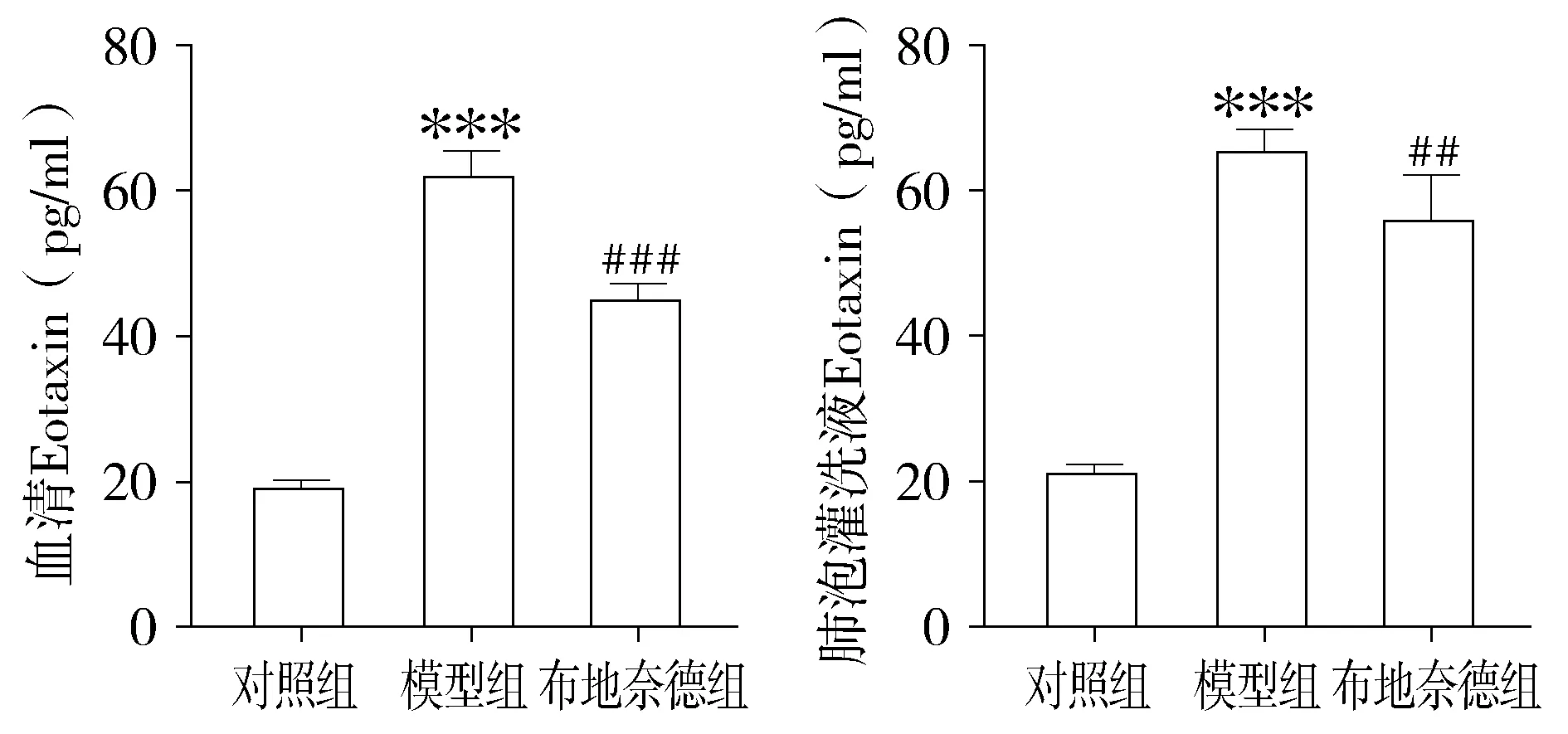
與對照組比較,***P<0.001;與模型組比較,##P<0.01,###P<0.001圖8 各組小鼠血清和肺泡灌洗液中嗜酸性粒細胞趨化因子含量 (n=12)Figure 8 Comparison of eosinophil chemokines contents in serum and bronchoalveolar lavage fluid of mice between three groups (n=12)
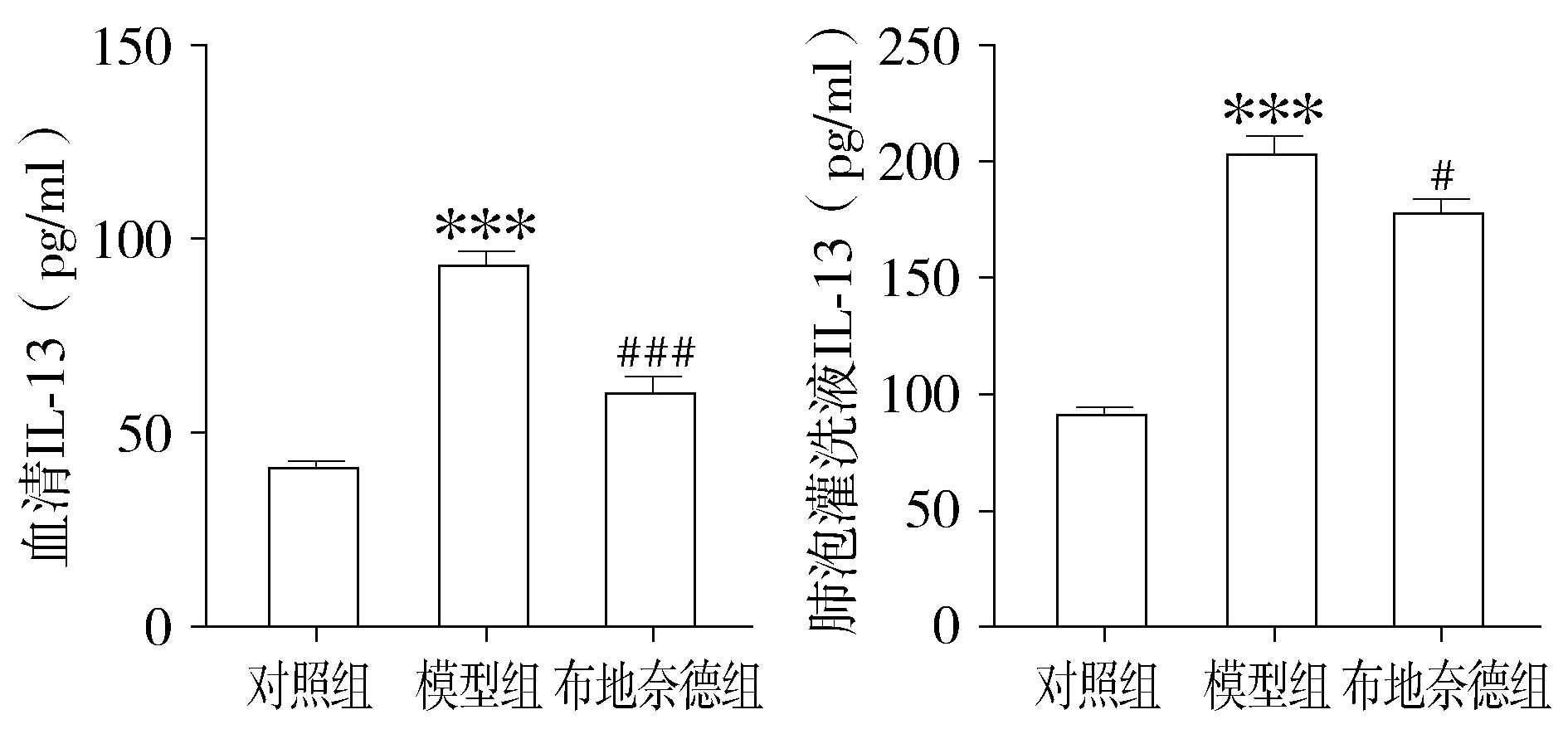
與對照組比較,***P<0.001;與模型組比較,#P<0.05,###P<0.001圖9 各組小鼠血清和肺泡灌洗液中IL-13含量 (n=12)Figure 9 Comparison of IL-13 contents in serum and bronchoalveolar lavage fluid of mice between three groups (n=12)
3 討論
支氣管哮喘(bronchial asthma)是由多種細胞和細胞組分參與的氣道慢性炎癥性疾病[7]。近年來,越來越多的證據表明Th1和Th2在過敏性哮喘發生中扮演者不同的角色[8,9]。當哮喘發作時,Th1細胞主要分泌IFN-γ、IL-2、IL-12等,Th2細胞主要分泌IL-4、IL-5、IL-13、嗜酸性粒細胞趨化因子等,Th1細胞可引發吞噬細胞介導的宿主防御應答,減少炎癥反應,而Th2細胞可促進炎癥反應。因此許多學者認為通過提高Th1細胞功能可達到抑制亢進的Th2反應,從而達到預防和治療哮喘的目的。IFN-γ通過調節血管內皮細胞上的黏附分子表達,激活單核細胞以及增強嗜酸性粒細胞活性等而參與哮喘反應。IL-2刺激T淋巴細胞增值,促進嗜酸性粒細胞趨化,參與哮喘反應。并且哮喘是一種以嗜酸粒細胞浸潤為特征的氣道炎癥性疾病[10],嗜酸性粒細胞趨化因子是組織嗜酸性粒細胞增多的主要調解者,促炎細胞因子TNF-γ和Th2型細胞因子IL-4各自誘導嗜酸性粒細胞趨化因子產生,并且它們的組合具有顯著協同作用[11]。IL-13促進IgE合成,增強巨噬細胞和樹突狀細胞活性,活化嗜酸性粒細胞。本實驗證明給予RSV感染哮喘小鼠霧化吸入布地奈德傾向于抑制Th2型細胞反應和增強Th1型細胞反應,最終促進Th1/Th2比例趨向正常水平[12,13]。
HMGB1(high mobility group box 1)是一種肺組織高遷移率族蛋白,具有高度保守性,在氣道炎癥反應中,作為一種免疫調節因子和炎性因子;Toll4(toll like receptors 4,TLR4)是一種重要的免疫識別受體,是連接獲得性免疫和天然免疫的媒介,參與啟動和調節氣道炎癥過程[14]。本實驗中證明吸入布地奈德可減少RSV感染的哮喘小鼠肺組織中HMGB1與TLR4,從而減少炎癥反應的進一步發生。
吸入性皮質類固醇(ICS)是控制哮喘癥狀的首選治療方法[15]。低劑量ICS治療可減少哮喘癥狀,增加肺功能,降低哮喘死亡的風險[16-19]。在治療哮喘的過程中,吸入布地奈德有效地改善了大量患者(包括兒童和成人)的氣道高反應性,控制了咳嗽、喘息癥狀,明顯提高了患者的生活質量[20,21]。布地奈德混懸液具有比其他同類藥物更強的局部抗炎作用。吸入后穿過細胞膜,與細胞質內的激素受體結合,進入細胞核起到抗炎作用,未與激素受體結合的布地奈德形成免疫復合物,可再次進入細胞核發揮抗炎作用,從而加強了局部抗炎效果[16]。本實驗結果顯示,霧化吸入布地奈德使RSV感染的哮喘小鼠肺組織中HMGB1與TLR4降低,可降低RSV感染的哮喘小鼠血清和BALF中炎細胞總數、在一定程度上誘導RSV感染的哮喘小鼠分泌Th1細胞因子IFN-γ、IL-2上調,降低嗜酸性粒細胞趨化因子及IL-13,減輕哮喘小鼠氣道炎癥,通過本次試驗更加深入和具體地證明吸入布地奈德對RSV感染的哮喘疾病的抗炎作用及對恢復Th1/Th2細胞平衡中的調節作用,為臨床應用布地奈德控制RSV感染加重的哮喘疾病提供更加深入的依據。
[1] 中華醫學會兒科學分會呼吸學組.兒童支氣管哮喘診斷與防治指南[J].中華兒科雜志,2008,46(6):745-753.
[2] McIntosh K. Respiratory Syncytial Virus[M]//Evans AS, Kaslow RA.Viral Infections of Humans. 4th ed.New York and London: Plenum Medical Book Company, 1997:691-711.
[3] 王之梁,朱宗涵,張梓荊,等.1976年冬至1981年春北京地區小兒下呼吸道感染的病原學研究[J].中華兒科雜志,1985,23(2):99.
[4] 李明華,殷凱生,蔡映云,等.哮喘病學[M].北京:人民衛生出版社,2005:475-476.
[5] 劉瑞清,張國成,黃可飛,等.重組人干擾素α1b對呼吸道合胞病毒感染小鼠外周T淋巴細胞亞群及肺組織病理學的影響[J].2013,13(9):1639-1644.
[6] 張娟,魏春,孫新,等.口服酪酸梭菌減輕哮喘小鼠氣道炎癥的研究[J].山西醫科大學學報,2015,46(11):1083-1087.
[7] 胡亞美,江載芳,申昆玲,等.諸福棠實用兒科學[M].北京:人民衛生出版社,2016:706-722.
[8] Neurath MF, Finotto S, Glimcher LH. The role of Th1/Th2 polarization in mucosal immunity[J]. Nat Med,2002,8(6):567-573.
[9] Yang YL, Pan YQ, He BS,etal. Reulatory T cells and Th1/Th2 in peripheral blood and their roles in asthmatic children[J]. Transl Pediatr, 2013, 2(1):27-33.
[10] Aeffner F, Davis IC. Respiratory syncytial virus reverses airway hyperresponsiveness tomethacholine inovalbumin-sensitized mice[J]. PLoS One, 2012, 7(10):e46660.
[11] Zhu W, Bi M, Liu Y,etal. Thrombin promotes airway remodeling via protease-activated recepror-1 and transforming growth factor-β1 in ovalbumin-allergic rats[J]. Inhaltion, 2013, 25(10):577-586.
[12] 薛濤.Th1/Th2型細胞因子及免疫狀態在支氣管哮喘患兒治療前后的變化[J].中國醫藥導報,2013,10(33):81-83.
[13] 李付廣,王芳,李玉琴,等.兒童過敏性哮喘特異性免疫治療過程中IL-10、TGF-β1和CD4+CD25+T細胞變化[J].現代免疫學,2009,29(1):59-62.
[14] 喬俊英,宋麗,張艷麗,等.哮喘小鼠HMGB1/TLR4/NF-κB信號通路及維生素D的作用[J].中國當代兒科雜志,2017,19(1):95-96.
[15] Peebles RS Jr, Shrller JR, Collins RD,etal. Inhaled corticosteroids (ICS) is the preferred method of treatment to control asthma symptoms[J]. J Med Virol, 2001, 63(2):178-188.
[16] Adams N, Lasserson TJ, Cates CJ,etal. Fluticasone versus beclomethasone or budesonide for chronic asthma in adults and children[J]. Cochrane Database Syst Rev,2007,(4):CD002310.
[17] Suissa S, Ernst P, Benayoun S,etal. Low-dose inhaled corticosteroids and the prevention of death from asthma[J]. N Engl J Med,2000,343:332-336.
[18] Barnes NC, Hallett C, Harris TA. Clinical experience with fluticasone propionate in asthma: a meta-analysis of efficacy and systemic activity compared with budesonide and beclomethasone dipropionate at half the microgram dose or less[J]. Respir Med, 1998,92:95-104.
[19] 王旭,左志通,凌春華,等.普米克令舒、博利康尼霧化吸入治療輕中度支氣管哮喘的臨床研究[J].臨床肺科雜志,2008,13(3):276-277.
[20] Rubin BK, Fink JB. Novel medications for asthma: a look at the future[J]. Expert Opin Investig Drugs,2007,16:889-897.
[21] The Childhood Asthma Management Program Research Group. Long-term effects of budesonide or nedocromial in children with asthma[J]. New England J Med,2000,343:1054-1063.
Protectiveeffectofbudesonideonlunginjuryinducedbyrespiratorysyncytialvirusinasthmaticmice
GUOYing1,ZHANG Juan1,CAI Yuxiang2,ZHOU Ningjuan1,XU Haijun1,SUN Xin1*
(1DepartmentofPediatrics,XijingHospital,FourthMilitaryMedicalUniversity,Xi’an710032,China;2DepartmentofNeonatology,Children’sHospitalofXi’an;*Correspondingauthor,E-mail:sunxin6@fmmu.edu.cn)
ObjectiveTo explore the protective effect of budesonide on lung injury induced by respiratory syncytial virus(RSV) in asthmatic mice.MethodsThirty-six male BALB/c mice aged 6-8 weeks were randomly divided into control group, model group, and budesonide group(n=12 in each group). The mice in model group and budesonide group were intraperitoneally injected with OVA for sensitization and atomization inhalation to establish the model of asthma. The mice in control group were given normal saline. At day 28, 30,32, RSV virus was given intranasally every other day to establish an acute viral infection model. The mice in control group were treated with saline. The mice in budesonide group were given budesonide inhalation for 30 min once a day at day 27-33, and the bronchoalveolar lavage fluid(BALF) was collected to count the white blood cells in BALF at day 34. The pathological changes of lung tissues were observed by HE. The expression of HMGB1 and TLR4 in lung tissue was observed by immunohistochemical method. The expression of cytokine IFN-γ, IL-2, IL-13 and eosinophil chemokines in BALF and serum was detected by ELISA.ResultsCompared with control group, the number of eosinophils, neutrophils and macrophages in the BALF increased in model group and budesonide group(P<0.01). Compared with model group, the total number of leukocytes in BALF was significantly decreased in budesonide group(P<0.01), the levels of cytokines, eosinophil chemokines and IL-13 in BALF and serum were decreased(P<0.01), while IFN-γ and IL-2 levels were significantly increased(P<0.01). Pathological results of lung tissue showed that the inflammatory cell infiltration decreased in budesonide group and the expression of HMGB1 and TLR4 in lung tissue was inhibited.ConclusionBudesonide can reduce the airway inflammation in children with RSV infection and inhaled budesonide has a certain therapeutic effect in RSV-infected asthmatic mice.
budesonide; bronchial asthma; ovalbumin; lung injury; mice
郭穎,女,1979-05生,碩士,住院醫師
2017-06-25
R562.25
A
1007-6611(2017)11-1135-06
10.13753/j.issn.1007-6611.2017.11.010

