內(nèi)質(zhì)網(wǎng)應(yīng)激信號(hào)通路在棕櫚酸誘導(dǎo)的血管內(nèi)皮細(xì)胞凋亡中的作用
許文虎,金春子,王曉龍,陳 晨,崔 蘭
(延邊大學(xué)附屬醫(yī)院1. 心血管內(nèi)科、2. 中心實(shí)驗(yàn)室,吉林 延吉 133000)
動(dòng)脈粥樣硬化(atherosclerosis,AS)性疾病屬于危及人類健康的重大疾病之一[1-5],內(nèi)皮細(xì)胞損傷、凋亡是AS病變形成的始動(dòng)環(huán)節(jié),脂質(zhì)代謝紊亂是導(dǎo)致AS發(fā)生的獨(dú)立危險(xiǎn)因素之一[6],降低脂質(zhì)、保護(hù)血管內(nèi)皮是AS性疾病防治的關(guān)鍵步驟。有關(guān)AS發(fā)生機(jī)制的炎癥學(xué)說認(rèn)為,AS是一個(gè)血管受損傷后的慢性炎癥過程,各種炎癥因子在動(dòng)脈中的浸潤和過量表達(dá)可以促進(jìn)AS的發(fā)生、發(fā)展[7]。研究發(fā)現(xiàn),導(dǎo)致心肌梗死的AS不穩(wěn)定性斑塊的兩個(gè)主要特征是斑塊中大量的炎癥因子浸潤和豐富的游離膽固醇。大量研究證實(shí),內(nèi)質(zhì)網(wǎng)應(yīng)激(endoplasmic reticulum stress,ERS)可能參與了AS的炎癥反應(yīng)的病理過程,ERS途徑可能是一種廣泛的血管炎癥和內(nèi)皮功能障礙的調(diào)節(jié)因素[8]。可見,ERS與血管內(nèi)皮細(xì)胞損傷有一定關(guān)聯(lián),但是ERS與脂毒性血管內(nèi)皮損傷之間的相關(guān)性研究甚少。基于此,本研究擬分析棕櫚酸對(duì)人臍靜脈血管內(nèi)皮細(xì)胞(human umbilical vein endothelial cells,HUVECs)的ERS信號(hào)通路活性及細(xì)胞凋亡的影響,闡明ERS信號(hào)通路與棕櫚酸所致血管內(nèi)皮細(xì)胞凋亡的關(guān)聯(lián),將為脂毒性內(nèi)皮損傷的防治提供指導(dǎo)意義。
1 材料與方法
1.1材料
1.1.1細(xì)胞系 HUVECs購自上海基免實(shí)業(yè)有限公司。
1.1.2試劑 GRP78、CHOP、PERK、IRE1、ATF6抗體均購自美國Abcam公司;Annexin V-FITC/PI雙染細(xì)胞凋亡檢測試劑盒購自BestBio(貝博)公司;CCK-8檢測試劑盒購自碧云天公司;DMEM培養(yǎng)基、胎牛血清、胰酶均購自美國Gibco公司;棕櫚酸(palmitic acid,PA)及ERS抑制劑4-苯基丁酸(4-phenylbutyric acid,4-PBA)均購自Sigma公司。
1.1.3儀器 超凈工作臺(tái)(上海博訊實(shí)業(yè)有限公司),二氧化碳培養(yǎng)箱(杭州利輝環(huán)境檢測設(shè)備有限公司),熒光顯微鏡及倒置顯微鏡(日本奧林巴斯公司),紫外分光光度計(jì)(上海凌析儀器有限公司),多功能酶標(biāo)儀(上海逍鵬生物科技有限公司),高速冷凍離心機(jī)(德國Sigma公司),電泳槽、電轉(zhuǎn)膜儀(Bio-Rad公司),化學(xué)發(fā)光凝膠成像系統(tǒng)(美國ProteinSimple公司)。
1.2方法
1.2.1游離脂肪酸的配制 用0.1 mol·L-1的NaOH溶液在70℃水浴中溶解一定量的PA,振蕩混勻10 min,過濾,配成100 mmol·L-1的PA儲(chǔ)存液。在55℃水浴中,用去離子水配50 g·L-1的BSA溶液,過濾。將上述PA溶液和BSA溶液按1∶19的體積比混合配成PA/BSA復(fù)合液,在水浴中振蕩10 s,繼續(xù)水浴10 min,取出后冷卻至室溫,過濾。然后,將上述復(fù)合液分別用高糖DMEM培養(yǎng)基稀釋。
1.2.2細(xì)胞培養(yǎng) HUVECs在細(xì)胞培養(yǎng)箱(飽和濕度、5% CO2、37℃)中培養(yǎng)至70%~80%融合度,經(jīng)消化、傳代,進(jìn)行實(shí)驗(yàn)。采用的DMEM培養(yǎng)液包含10 mL·L-1雙抗、2 mmol·L-1的L-谷氨酰胺、10 mmol·L-1的HEPES、10 mmol·L-1的丙酮酸鈉、5 mmol·L-1葡萄糖。
1.2.3實(shí)驗(yàn)分組 ① PA濃度梯度分析實(shí)驗(yàn):對(duì)照組、PA(0.1、0.2、0.4、0.8 mmol·L-1)組。② PA(0.4 mmol·L-1)時(shí)間梯度分析實(shí)驗(yàn):對(duì)照組、12 h刺激組、24 h刺激組、48 h刺激組。③ 抑制劑實(shí)驗(yàn):對(duì)照組、0.4 mmol·L-1PA組、10 mmol·L-14-PBA預(yù)處理2 h后,給予0.4 mmol·L-1PA組。
1.3檢測指標(biāo)
1.3.1CCK-8檢測細(xì)胞增殖率 HUVECs接種于96孔培養(yǎng)板中(每孔1×106個(gè)細(xì)胞),培養(yǎng)24 h后給藥,進(jìn)行孵育,每孔中加入10 μL CCK-8溶液反應(yīng)2 h,酶標(biāo)儀檢測570 nm處吸光度值。按公式:細(xì)胞增殖抑制率/%=(對(duì)照組吸光度值-給藥組吸光度值)/(對(duì)照組吸光度值-本底)×100%計(jì)算,共重復(fù)3次,每組6個(gè)復(fù)孔。
1.3.2Western blot法檢測ERS信號(hào)通路蛋白表達(dá)水平 每組血管內(nèi)皮細(xì)胞在細(xì)胞培養(yǎng)箱內(nèi)培養(yǎng)過夜后,用PBS清洗2次,按組別給藥后,培養(yǎng)箱內(nèi)孵育一定時(shí)間,在4℃用裂解液裂解細(xì)胞30 min后,用細(xì)胞刮將培養(yǎng)板內(nèi)細(xì)胞反復(fù)刮至離心管內(nèi),13 000 r·min-1離心分離15 min,蛋白定量后,取20 μL的蛋白樣品加入SDS-PAGE凝膠樣品槽內(nèi),經(jīng)電泳、轉(zhuǎn)膜、封閉等過程后,加入GRP78、CHOP、PERK、IRE1、ATF6抗體(均為1∶1 000),4℃孵育24 h,洗膜,加入二抗室溫反應(yīng)1 h后,用顯影液處理,用化學(xué)發(fā)光凝膠成像儀分析NADPH信號(hào)通路蛋白表達(dá)水平。
1.3.3Annexin V-FITC/PI雙染檢測細(xì)胞凋亡 Annexin V被作為檢測細(xì)胞早期凋亡的靈敏指標(biāo)之一。凋亡中晚期碘化丙啶(propidium Iodide,PI)能夠透過細(xì)胞膜而使細(xì)胞核染紅。因此,將Annexin V與PI聯(lián)合使用時(shí),PI 則被排除在活細(xì)胞(Annexin V-/PI-)和早期凋亡細(xì)胞(Annexin V+/PI-)之外,而晚期凋亡細(xì)胞和壞死細(xì)胞同時(shí)被FITC和PI結(jié)合染色呈現(xiàn)雙陽性(Annexin V+/PI+)。6孔細(xì)胞培養(yǎng)板接種HUVECs,當(dāng)細(xì)胞貼壁生長至70%~80%融合度,按組別給藥后,培養(yǎng)箱內(nèi)孵育24 h,PBS反復(fù)沖洗后,加入500 μL的1×Binding Buffer,加入5 μL的Annexin V-FITC避光室溫孵育15 min,再加入5 μL的PI孵育5 min,PBS反復(fù)沖洗后,采用熒光顯微鏡拍照,并用Image J 1.41 軟件分析綠色熒光強(qiáng)度。
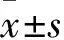
2 結(jié)果
2.1棕櫚酸對(duì)HUVECs細(xì)胞增殖的影響Fig 1A結(jié)果表明,0.1、0.2、0.4、0.8 mmol·L-1PA組在PA刺激24 h后,0.4、0.8 mmol·L-1PA組的血管內(nèi)皮細(xì)胞增殖率明顯降低(P<0.05)。Fig 1B結(jié)果表明,0.4 mmol·L-1PA刺激0、12、24、48 h 后,刺激時(shí)間在24~48 h 時(shí),血管內(nèi)皮細(xì)胞增殖率明顯降低(P<0.05)。

Fig 1 Influence of PA on cell viability in HUVECs(±s,n=5)
A: Cell viability was significantly suppressed when PA concentration increased to 0.4 mmol·L-1; B: HUVECs were treated with 0.4 mmol·L-1PA for different time, and inhibition of cell viability was calculated from CCK-8 assay.*P<0.05vs0 mmol·L-1group (A);#P<0.05vs0 h group (B).
2.2棕櫚酸對(duì)HUVECs細(xì)胞ERS信號(hào)通路蛋白表達(dá)的影響如Fig 2所示,0.4 mmol·L-1PA刺激0、12、24、48 h 后,刺激時(shí)間在24~48 h,GRP78、CHOP、PERK、IRE1、ATF6等ERS信號(hào)通路蛋白的水平出現(xiàn)高表達(dá)狀態(tài)(P<0.05);而24、48 h PA刺激組之間的ERS信號(hào)通路蛋白表達(dá)均無顯著性差異(P>0.05)。

Fig 2 Influence of PA(0.4 mmol·L-1)on expression of ERS in cell viability in HUVECs(±s, n=3)
A: Representative images of GRP78, CHOP, PERKphos, IRE1phosand ATF6 expression by Western blot; B: HUVECs were treated with 0.4 mmol·L-1PA for different time, and quantitative analysis of GRP78, CHOP, PERKphos, IRE1phosand ATF6 expression.*P<0.05vs0 h group.

Fig 3 Effects of PA(0.4 mmol·L-1)on apoptosis of HUVECs(scale bars: 50 μm)
Annexin V-FITC is green fluorescence; PI is red fluorescence. Fluorescence images of HUVECs stained with(Annexin V-FITC)/PI after cells were incubated for 0 h (A), 12 h (B), 24 h (C) and 48 h (D) with 0.4 mmol·L-1PA.

Fig 4 Influence of ERS inhibitor 4-PBA on apoptosis of HUVECs exposed to PA(scale bar: 50 μm)
Fluorescence images of HUVECs stained with(Annexin V-FITC)/PI after cells were incubated for 24 h with control (A), 0.4 mmol·L-1PA (B) and 0.4 mmol·L-1PA+10 mmol·L-14-PBA (C).
2.3棕櫚酸對(duì)HUVECs細(xì)胞凋亡的影響如Fig 3所示,0.4 mmol·L-1PA刺激0、12、24、48 h后,24、48 h組的紅色熒光明顯強(qiáng)于0、12 h組,說明刺激24~48 h時(shí)細(xì)胞出現(xiàn)明顯凋亡狀態(tài),而24、48 h PA刺激組之間的紅色熒光水平無顯著性差異。
2.4阻斷ERS信號(hào)通路對(duì)棕櫚酸刺激下HUVECs細(xì)胞凋亡水平的影響如Fig 4所示,0.4 mmol·L-1PA刺激24 h后,細(xì)胞出現(xiàn)明顯凋亡狀態(tài);而與單純PA(0.4 mmol·L-1)組相比,預(yù)處理內(nèi)質(zhì)網(wǎng)應(yīng)激抑制劑4-PBA組細(xì)胞凋亡明顯減少,與對(duì)照組無顯著性差異。
3 討論
1847年,膽固醇被鑒定為AS斑塊中的關(guān)鍵組成部分,繼而脂質(zhì)浸潤學(xué)說被認(rèn)為是由于血脂升高導(dǎo)致AS的重要學(xué)說。此學(xué)說主張,一般生理狀態(tài)下,血管內(nèi)皮設(shè)有屏障,使脂蛋白顆粒進(jìn)入動(dòng)脈受阻,而在高血脂等病理狀態(tài)下,血管壁局部上沉積膽固醇等脂質(zhì),從而誘發(fā)平滑肌細(xì)胞和單核/巨噬細(xì)胞聚集被細(xì)胞吞噬而出現(xiàn)泡沫細(xì)胞,細(xì)胞間質(zhì)增多,血管內(nèi)膜增厚,最終出現(xiàn)AS。可見,脂質(zhì)浸潤與血管內(nèi)皮損傷有密不可分的關(guān)聯(lián),因此,本研究建立了棕櫚酸所致血管內(nèi)皮細(xì)胞損傷模型,旨在模擬脂毒性AS體系。本研究結(jié)果顯示,棕櫚酸刺激血管內(nèi)皮細(xì)胞時(shí),細(xì)胞增殖功能出現(xiàn)明顯降低,此結(jié)果符合文獻(xiàn)報(bào)道。
內(nèi)皮細(xì)胞凋亡是AS的起始階段,研究表明ERS信號(hào)通路對(duì)AS疾病中內(nèi)皮細(xì)胞功能紊亂起著廣泛的調(diào)節(jié)作用[9]。內(nèi)質(zhì)網(wǎng)屬于真核細(xì)胞較關(guān)鍵的細(xì)胞器,主要發(fā)揮包括合成膽固醇和脂質(zhì)、合成蛋白質(zhì)、調(diào)節(jié)鈣等作用[10-14]。內(nèi)質(zhì)網(wǎng)是真核細(xì)胞中蛋白質(zhì)翻譯合成和細(xì)胞內(nèi)鈣離子存儲(chǔ)場所,新生的蛋白質(zhì)在分子伴侶的協(xié)助下進(jìn)行折疊,只有正確折疊的蛋白質(zhì)可以被轉(zhuǎn)運(yùn)到高爾基體,未折疊或者錯(cuò)誤折疊的蛋白仍留在內(nèi)質(zhì)網(wǎng),通過內(nèi)質(zhì)網(wǎng)相關(guān)降解機(jī)制逆移位至細(xì)胞質(zhì),并被蛋白酶體降解[15]。近年研究發(fā)現(xiàn),脂質(zhì)過度負(fù)荷可打破內(nèi)質(zhì)網(wǎng)的穩(wěn)態(tài),這種內(nèi)質(zhì)網(wǎng)功能紊亂時(shí)出現(xiàn)錯(cuò)誤折疊與未折疊蛋白在腔內(nèi)聚集以及Ca2+平衡紊亂的狀態(tài)被稱為ERS。為了減輕ERS,真核細(xì)胞激活一系列自身保護(hù)機(jī)制,稱為ERS反應(yīng),即從內(nèi)質(zhì)網(wǎng)向核內(nèi)的信號(hào)傳導(dǎo),而目前,ERS信號(hào)傳導(dǎo)主要涉及3個(gè)內(nèi)質(zhì)網(wǎng)跨膜效應(yīng)蛋白:PERK、IRE1和ATF6。正常情況下,這3種蛋白的內(nèi)質(zhì)網(wǎng)腔內(nèi)側(cè)都與GRP78/BIP結(jié)合而處于無活性狀態(tài),當(dāng)內(nèi)質(zhì)網(wǎng)腔內(nèi)未折疊蛋白或錯(cuò)誤折疊蛋白聚集超過內(nèi)質(zhì)網(wǎng)處理能力時(shí),GRP78/BIP即從這3種蛋白解離,與未折疊蛋白或錯(cuò)誤折疊蛋白結(jié)合,以協(xié)助其正確折疊,GRP78/BIP解離時(shí)PERK、IRE1、ATF6三個(gè)反應(yīng)器蛋白出現(xiàn)活化,進(jìn)而觸發(fā)ERS的信號(hào)傳導(dǎo)。如果ERS時(shí)間過長,3個(gè)內(nèi)質(zhì)網(wǎng)跨膜效應(yīng)蛋白持續(xù)表達(dá)也會(huì)上調(diào)凋亡相關(guān)的基因,如轉(zhuǎn)錄因子CHOP的表達(dá),促使細(xì)胞凋亡。本研究提示,棕櫚酸刺激血管內(nèi)皮細(xì)胞24 h后,ERS信號(hào)通路蛋白GRP78、PERK、IRE1、ATF6、CHOP的表達(dá)明顯升高,說明ERS信號(hào)通路的激活可能與棕櫚酸誘導(dǎo)的血管內(nèi)皮細(xì)胞損傷有密切關(guān)聯(lián)。而另一組研究提示,棕櫚酸刺激24 h時(shí)血管內(nèi)皮細(xì)胞凋亡水平出現(xiàn)明顯升高,而與單純棕櫚酸組相比,預(yù)處理ERS抑制劑4-PBA組細(xì)胞凋亡明顯減少。此現(xiàn)象說明血管內(nèi)皮細(xì)胞可在棕櫚酸的刺激下出現(xiàn)明顯的細(xì)胞凋亡,且此損傷與ERS信號(hào)通路的激活密切相關(guān)。
綜上所述,棕櫚酸刺激可抑制血管內(nèi)皮細(xì)胞的增殖能力,激活ERS信號(hào)通路,使細(xì)胞處于應(yīng)激性凋亡狀態(tài),而此狀態(tài)成功被ERS信號(hào)通路抑制劑所阻斷。此結(jié)果證實(shí),調(diào)控ERS信號(hào)通路對(duì)棕櫚酸引起的血管內(nèi)皮細(xì)胞損傷的防治有指導(dǎo)意義。
(致謝:本文實(shí)驗(yàn)主要在延邊大學(xué)基礎(chǔ)學(xué)院藥學(xué)分析實(shí)驗(yàn)室、基礎(chǔ)學(xué)院藥理學(xué)實(shí)驗(yàn)室、附屬醫(yī)院中心實(shí)驗(yàn)室完成,由湖北科技學(xué)院醫(yī)藥研究院省重點(diǎn)實(shí)驗(yàn)室協(xié)助完成。感謝廉麗花副教授、李晶副教授、碩士生馬偉平、金艷紅、權(quán)麗娜等對(duì)本實(shí)驗(yàn)的指導(dǎo)與幫助。)
[1] Nacif M S,Almeida A L C,Young A A. Three-dimensional volumetric assessment of diastolic function by cardiac magnetic resonance imaging: the multi-ethnic study of atherosclerosis(MESA) [J].ArqBrasCardiol, 2017,108(6):552-63.
[2] Sahebkar A, Watts G F. Developing role of microRNA-33 in lipid metabolism and atherosclerosis[J].CurrOpinLipidol,2016,27(2):197-9.
[3] Adamson P D, Newby D E, Dweck M R. Translational coronary atherosclerosis imaging with PET[J].CardiolClin,2016,34(1):179-86.
[4] Ali A,Tawakol A. FDG PET/CT imaging of carotid atherosclerosis[J].NeuroimagClinNAm,2016,26(1):45-54.
[5] 張亞云,林 超,孫 鑫. 雌激素介導(dǎo)的HSP27在動(dòng)脈粥樣硬化中作用的研究進(jìn)展[J]. 中國藥理學(xué)通報(bào), 2016,32(2):159-62.
[5] Zhang Y Y, Lin C, Sun X. Research progress of estrogen-mediated HSP27 in atherosclerosis [J].ChinPharmacolBull,2016,32(2):159-62.
[6] 祝曉慶,楊 潔,邵 娟. 復(fù)方總黃酮對(duì)ApoE基因敲除小鼠動(dòng)脈粥樣硬化的影響[J]. 中國藥理學(xué)通報(bào), 2017,33(2): 180-4.
[6] Zhu X Q, Yang J, Shao J. Effect of compound flavonoids on atherosclerosis in ApoE-/-mice[J].ChinPharmacolBull, 2017,33(2):180-4.
[7] 卞 芳,金 肆. NLRP3炎癥小體在動(dòng)脈粥樣硬化相關(guān)細(xì)胞中作用的研究進(jìn)展[J]. 中國藥理學(xué)通報(bào),2016,32(2):163-9.
[7] Bian F, Jin S. Research progress of NLRP3 inflammasome in atherosclerosis-related cells [J].ChinPharmacolBull, 2016,32(2):163-9.
[8] Yang J, Zhang X, Yu X Y. Renin-angiotensin system activation accelerates atherosclerosis in experimental renal failure by promoting?endoplasmic reticulum stress-related inflammation[J].IntJMolMed, 2017,39(3):613-21.
[9] Cui G M, Zhao Y X, Zhang N N. Amiloride attenuates lipopolysaccharide-accelerated atherosclerosis via inhibition of NHE1-dependent endothelial cell apoptosis[J].ActaPharmacolSin, 2013,34(2):231-8.
[10] Furmanik M, Shanahan C M. Endoplasmic reticulum stress in arterial smooth muscle cells: a novel regulator of vascular disease [J].CurrCardiolRev, 2017,13(2):94-105.
[11] Mami I, Bouvier N, Karoui K E. Angiogenin mediates cell-autonomous translational control under endoplasmic reticulum stress and attenuates kidney injury[J].JAmSocNephrol,2016,27(3):863-76.
[12] Reid D W, Nicchitta C V. Diversity and selectivity in mRNA translation on the endoplasmic reticulum[J].NatRevMolCellBiol,2015,16(4):221-31.
[13] Khan M M, Yang W L, Wang P. Endoplasmic reticulum stress in sepsis[J].Shock, 2015,44(4):294-304.
[14] Wang L L, Hu R C, Dai A G. Bevacizumab induces A549 cell apoptosis through the mechanism of endoplasmic reticulum stressinvitro[J].IntJClinExpPathol, 2015,8(5):5291-9.
[15] Castillero E, Akashi H, Pendrak K. Attenuation of the unfolded protein response and endoplasmic reticulum stress after mechanical unloading in dilated cardiomyopathy[J].AmJPhysiolHeartCircPhysiol, 2015,309(3): H459-70.

