梓醇對大腦皮質神經元的抗衰老保護作用研究
王靜歡,劉 珂,萬 東,祝慧鳳
(1. 西南大學藥學院暨中醫藥學院中藥藥理學實驗室,重慶 400715; 2. 重慶醫科大學附屬第一醫院急診醫學科&重癥醫學科,重慶 400016)
衰老又稱老化,分為生理性衰老與病理性衰老兩類。生理學衰老是生物體自成熟期開始,隨增齡發生的漸進的、受遺傳因素影響的、全身復雜的形態結構與生理功能不可逆的退行性變化。衰老是人類生命進程的重要環節,常伴隨著一些疾病的發生,如糖尿病、阿爾茨海默癥、冠心病等。
PI3K/Akt/mTOR信號通路參與調控細胞代謝、生長、增殖和存活。PI3K、Akt和mTOR是這一途徑的關鍵點[1]。PI3K活化后激活Akt,進一步激活mTOR。mTOR有2個亞型,即mTORC1和mTORC2。Akt激活的是mTORC1。mTORC1下游的直接底物為核糖體S6激酶1(S6K1)和真核起始因子4E結合蛋白1(4E-BP1);S6K1再進一步使核糖體蛋白S6磷酸化,最終啟動cap-依賴性蛋白翻譯(蛋白合成的限速步驟),實現蛋白合成、細胞生長和細胞周期進程的中心控制。處于生長狀態的神經元需要合成大量新的蛋白質,胞內磷酸化核糖體蛋白S6(p-S6)的表達水平會明顯上調。因此,p-S6表達水平可間接表征mTOR活性,并常作為神經元生長狀態的分子標志[2]。研究發現,隨著年齡的增加,p-S6蛋白表達減少,內在活性降低,軸突再生能力下降[3],提示衰老與細胞表達p-S6減少相關。
地黃作為滋陰補腎中藥,在臨床治療老年性疾病中占有重要地位。以地黃為君藥的復方在發育、衰老以及老年性疾病的治療中應用歷史也十分久遠,如六味地黃丸是《小兒藥證直訣》方,金匱腎氣丸是《金匱要略》方,單味地黃抗衰老的實驗研究已有較多報道[4-5]。梓醇(catalpol)是地黃最主要的有效成分之一,具有利尿、緩瀉、降血糖、保肝等多種藥理作用[6]。研究發現,梓醇對老年性疾病,如帕金森、腦卒中、糖尿病、老年性癡呆等有明顯的治療作用。梓醇可以促進離體大鼠皮質神經元軸突生長,上調軸突生長相關蛋白(growth associated protein-43,GAP-43)表達,有效促進腦卒中后的神經修復[7-8],提示梓醇對病理性衰老有治療作用。但衰老還存在生理性衰老形式,梓醇對生理性衰老是否具有抗衰老作用,是否可以延緩正常神經元衰老,延遲其死亡等問題,目前尚未見報道。
因此,本研究旨在觀察梓醇是否延緩正常離體皮質神經元衰老作用,并探討其可能的機制,為后續實驗提供實驗依據,為研發新的延緩衰老的天然藥物或保健活性物質奠定實驗基礎。
1 材料
1.1實驗動物健康SD大鼠,體質量(250±30)g,購自重慶醫科大學實驗動物中心,合格證批號:SCXK(渝)2007-2001。適應性喂養1周后合籠,讓其進行自然交配。動物實驗嚴格遵照實驗動物科學與管理有關規定,善待實驗動物。
1.2藥品與試劑梓醇(石家莊流波百鳥生物技術有限公司,批號20091091015,純度>98%);B27、Neurobasal-A神經元培養基(Gibco);Pen-strep、0.25%胰蛋白酶(Genview);DMEM基礎培養基 (Hyclone);胎牛血清(杭州四季青生物公司);p-S6兔單克隆抗體(Cell Signaling Technology);FITC標記山羊抗兔IgG、辣根過氧化物酶標記羊抗兔 IgG(H+L)、兔多克隆抗體Map-2、GAP-43、PI3K、p-PI3K、Akt、p-Akt、mTOR、p-mTOR,均購自Proteintech。
1.3儀器生物安全柜(Haier);CO2細胞培養箱(ESCO);倒置顯微鏡(奧林巴斯);酶標儀(Bioteck);PCR儀(Eppendorf);低溫冷凍離心機(Thermo);倒置熒光顯微鏡(Leica);化學發光成像儀(Tanon)。
2 方法
2.1皮質神經元培養參考文獻[9]并做改進,無菌條件下取出生后24 h內的乳鼠大腦皮質,剪去胼胝體和其他白質,PBS液清洗2遍,剪碎,離心,1 000 r·min-1× 8 min。0.25%胰酶溶液37℃消化10 min,每5 min振搖1次,加入含10% FBS的DMEM培養基終止消化10 min,每5 min振搖1次,過200目篩網。取濾液,離心,1 000 r·min-1× 5 min,棄上清,加含10% FBS的DMEM培養基,吹打均勻,計數,以1.4×108·L-1或者5×108·L-1的細胞密度接種在提前包被過L-多聚賴氨酸的96孔板和6孔板上。置于37℃、5% CO2的恒溫培養箱中培養8 h后,換為Neurobasal-A(含2% B27)無血清培養基,每隔2 d半量換液。d 7的神經元可用于實驗。
2.2實驗設計與分組皮質神經元培養至d 6,進行分組并作相應藥物干預。實驗分為:正常組、梓醇低(0.1 mg·L-1)、中(1 mg·L-1)、高(10 mg·L-1)劑量組。正常組不用任何藥物處理,僅用Neurobasal-A培養基培養;梓醇組用Neurobasal-A培養基稀釋至低、中、高劑量的梓醇進行干預。每組重復3次。
2.3顯微鏡觀察神經元接種后,分別于培養的7~13 d在倒置相差顯微鏡下觀察各組細胞的生長情況。每組各孔隨機選擇5個視野,進行拍照記錄。
2.4細胞活力檢測以96孔板每孔103~104個細胞種板,培養至6 d后,加入不同濃度梓醇進行干預,干預時間分別為1~6 d(即細胞培養d 7~13)。之后,每孔加入MTT溶液(5 g·L-1)20 μL,37℃繼續孵育4 h,終止培養,小心吸棄孔內培養基后,每孔加入150 μL DMSO,振蕩10 min。將96孔板置于酶標儀上,490 nm波長下,測定各孔吸光度(A)。
2.5細胞內在活性檢測皮質神經元培養至13 d后,棄培養液,用0.02 mol·L-1PBS洗5 min×3次,加入4%多聚甲醛4℃固定15 min后,用p-S6兔單克隆抗體免疫熒光染色檢測神經元細胞內在活性。陰性對照用0.02 mol·L-1PBS代替一抗,其余步驟同上。熒光顯微鏡下觀察,陽性細胞胞質呈現綠色熒光。在200倍鏡下,分別計數3個孔各5個視野的陽性細胞數和總細胞數,計算陽性細胞的百分比。
2.6軸突生長檢測皮質神經元培養至13 d后,棄培養液,用0.02 mol·L-1PBS洗5 min×3次,加入4%多聚甲醛4℃固定15 min后,用Map-2兔多克隆抗體免疫熒光染色檢測神經元軸突生長情況。陰性對照用0.02 mol·L-1PBS代替一抗,其余步驟同上。鏡下觀察,陽性細胞胞質呈綠色熒光。在200倍鏡下每組各孔隨機選擇5個視野,所測細胞必須有暈光和突起,每個視野測量20個神經元軸突長度,取其平均值為該組軸突生長長度。
2.7蛋白免疫印跡將細胞接種到6孔板中,細胞密度為5×108·L-1,每孔2 mL。待細胞培養至d 6,給予藥物干預,繼續培養至d 13后,除去培養基,收集細胞。每孔加100 μL RIPA裂解液裂解細胞。利用BCA試劑盒測定蛋白濃度。電泳,轉膜,切膜,免疫印跡(GAP-43、p-S6、p-PI3K、p-Akt、p-mTOR抗體稀釋度均為1 ∶1000,PI3K、Akt、mTOR抗體稀釋度均為1 ∶500)。將顯色后的膜照相,并用Multi-Gaμge軟件對圖像進行灰度分析,以灰度值代表蛋白的強度,以目的蛋白與內參蛋白(GAPDH、β-tubulin)的灰度比值作為目的蛋白表達的相對量。以上實驗重復3次,取其平均值。
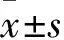
3 結果
3.1梓醇可促進皮質神經元存活,提高其細胞活力皮質神經元在培養至d 7時,胞體光暈明顯,突起增多,伸長且分支很多,形成致密細胞網絡;培養至d 8時,絕大多數神經元僅可見1根較長的軸突,少部分神經元突起有分支,部分細胞突起交織成網;培養至d 9時,細胞突起構成的網狀增多;從d 10開始,神經元數目開始減少,突起開始萎縮;至d 13時,只剩下胞體。由此可以推斷,皮質神經元在培養7~9 d時,細胞狀態最佳,處于旺盛期;在培養10~13 d時,細胞數目開始減少,細胞開始衰老、死亡,處于衰老期。梓醇干預各組(0.1、1、10 mg·L-1)神經元生長趨勢與時間點的關系與正常組一致,但是正常組對應時間點比較,梓醇干預各組細胞暈光明顯,軸突較正常組更粗,更長;梓醇各組神經元細胞突起多,神經元之間的網狀聯系均比正常組各對應時點更加豐富。培養至10~13 d時,梓醇干預各組神經元數目減少速度較正常組慢,d 13時,仍有部分神經元有軸突存在,而隨著培養時間的延長,正常組神經元數目逐漸減少,突起逐漸萎縮,至d 13時,只剩下胞體(Fig 1)。提示不同濃度梓醇均可減少神經元細胞死亡,延緩衰老,維持神經元較長時間的生長狀態。
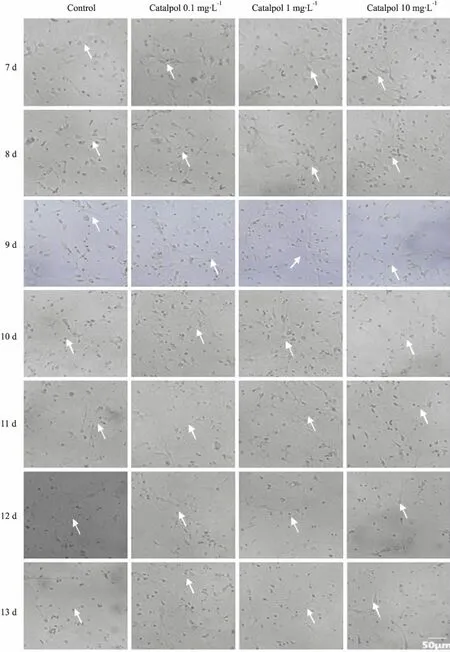
Fig 1 Morphological observation of cortical neurons in different time points in each group(×100)
Tab 1的MTT檢測結果顯示,隨著培養時間的延長,各組神經元細胞活力先升高,后降低。d 7~9,MTT值升高,與形態學觀察所見細胞數增加,細胞生長狀態增強一致;d 10~13,MTT值逐漸降低,與形態學觀察所見細胞數減少,細胞生長狀態減弱一致。梓醇各劑量組均明顯高于正常組相應時點的MTT吸光度值(P<0.05),而且呈現出一定的量效關系,在d 10之后尤其明顯。提示不同濃度的梓醇可以提高神經元細胞活力,延緩其衰老,延遲其細胞死亡的時間。據Fig 1、Tab 1的結果,本實驗后續研究選擇衰老后期的d 13進行相關形態及機制的探討。
3.2梓醇可升高p-S6陽性細胞數,促進p-S6蛋白表達,誘導皮質神經元細胞活性如Fig 2所示,藥物干預6 d(細胞培養至13 d)后,梓醇各組p-S6陽性細胞數較正常組均增多(P<0.05),其中梓醇1 mg·L-1劑量組增多最明顯。與正常組相比,梓醇1 mg·L-1劑量組可明顯促進p-S6蛋白表達(P<0.05);而梓醇0.1、10 mg·L-1劑量組則無明顯變化。提示不同濃度的梓醇可在神經元處于衰老期時誘導其細胞內在活性,延緩細胞衰老。
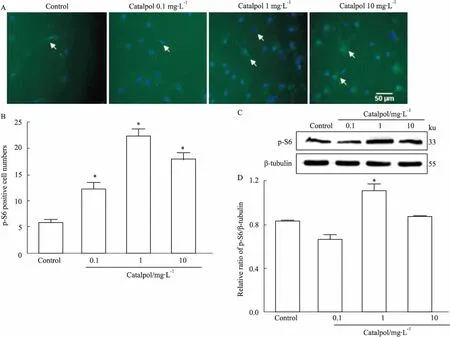
Fig 2 Catalpol increased number of p-S6 positive cells, promote p-S6 protein expression and induce cortical neuronal cell activity


Tab 1 Effects of catalpol at different doses on neuronal cell viability(A490,±s, n=6 )
*P<0.05vscontrol
3.3梓醇可促進GAP-43蛋白表達,促進皮質神經元軸突延伸如Fig 3所示,給藥6 d(細胞培養至13 d)后,正常組神經元軸突萎縮,軸突長度驟減,梓醇給藥各組神經元軸突長度均比正常組明顯延長(P<0.05)。梓醇各組間比較,濃度為1 mg·L-1時對神經元軸突生長促進作用最強。與正常組相比,梓醇10 mg·L-1劑量組可明顯促進GAP-43蛋白表達(P<0.05)。提示不同濃度梓醇可明顯促進神經元軸突延伸。
3.4梓醇對皮質神經元的抗衰老作用與PI3K/Akt/mTOR信號通路的調控有關如Fig 4所示,各組內參蛋白GAPDH和β-tubulin的表達差異無顯著性。給藥6 d(細胞培養至13 d)后,與正常組相比,梓醇1、10 mg·L-1組可明顯促進p-PI3K/t-PI3K、p-Akt/t-Akt蛋白表達(P<0.05);梓醇各組p-mTOR/t-mTOR蛋白表達隨著梓醇濃度的升高先增加后降低,但其表達均明顯高于正常組(P<0.05)。
4 討論
地黃是滋陰補血、填精補髓的代表中藥,本研究觀察了地黃的主要活性成分梓醇對離體培養的新生大鼠皮質神經元的抗衰老作用。本研究結果發現,皮質神經元培養至7~9 d,細胞狀態最佳,處于旺盛期;在培養至10~13 d時,細胞數目開始減少,細胞開始衰老、死亡,處于衰老期。我們的結果與其他研究一致[10-11]。皮質神經元培養至d 7時,細胞極性狀態最佳,適合觀測和研究樹突與軸突的生長機制。而培養至13 d左右,細胞萎縮,處于衰老、死亡的邊緣。本實驗主要目的是觀測梓醇對抗神經元衰老的作用和機制,故后期實驗中衰老期的d 13進行機制的探討。
本研究發現,與相應時點的正常組比較,梓醇終濃度在0.1~10 mg·L-1時可明顯增加MTT吸光度值,促進神經元存活;從形態上看,梓醇低、中、高劑量組神經元數量多,光暈明顯,軸突較長,神經元突起形成的網狀聯系豐富;而且更明顯的是,不同濃度的梓醇組,在細胞培養d 10~13時,細胞活力均明顯高于正常組(P<0.05)。提示不同濃度的梓醇在細胞衰老期時可延緩神經元衰老,維持細胞較長時間的細胞活力。
Fig 3 Catalpol promoted GAP-43 protein expression and delayed cortical neuron axonal atrophy

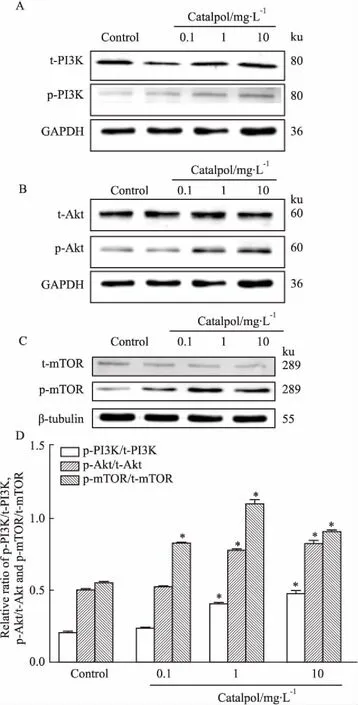
Fig 4 Effect of catalpol on PI3K/Akt/mTOR signaling pathway related proteins in cortical neurons(±s, n=3 )
A-C: Effects of each group on expressions of t-PI3K, p-PI3K, t-Akt, p-Akt, t-mTOR, p-mTOR protein; D: Analysis of expressions of p-PI3K/t-PI3K, p-Akt/t-Akt, p-mTOR/t-mTOR protein in each group.*P<0.05vscontrol group.
研究表明[12],人在20~90歲神經元數量的減少不會超過10%或20%。大腦功能更多取決于神經元聯系的質量,而不是神經元的數量。因此,與衰老有關的神經功能障礙是神經元網絡連接質量下降的結果。細胞內在生長活性的提高與神經元聯系的質量、大腦功能具有較強的關聯度。因此,本研究選擇p-S6染色來表征細胞內在活性,GAP-43染色來表征神經元內在聯系。結果發現:當細胞培養至13 d后,梓醇各組p-S6陽性細胞數較正常組均增多,其中梓醇1 mg·L-1劑量組增多最明顯。同時,梓醇能夠增加神經元突起的長度,神經元之間的聯系明顯比正常組豐富,其變化趨勢同p-S6染色結果一致,提示梓醇對神經元內在活性的調節與促進神經元內在聯系有關,梓醇可能通過誘導神經元內在活性,提升神經元內在聯系,來延緩神經元衰老。
PI3K/Akt/mTOR信號通路參與調控細胞生長、增殖、存活和分化[13]。本研究采用Western blot法檢測了PI3K/Akt/mTOR信號通路的關鍵磷酸化蛋白,以探討梓醇延緩離體培養的神經元衰老,維持較長時間細胞活力的可能機制。研究發現,給藥6 d(細胞培養至13 d)后,與正常組相比,梓醇各組p-PI3K/t-PI3K和p-Akt/t-Akt比值隨著梓醇濃度的升高而增加,呈現出濃度依賴性,且梓醇(1、10 mg·L-1)組差異具有顯著性(P<0.05);而p-mTOR/t-mTOR比值與梓醇濃度的關系與磷酸化S6蛋白變化一致,均是先升高后降低。梓醇(0.1、1、10 mg·L-1)組p-S6蛋白表達先升高后降低;但與正常組相比,僅梓醇(1 mg·L-1)組差異具有顯著性(P<0.05)。梓醇(10 mg·L-1)組可明顯促進GAP-43蛋白表達。提示在細胞衰老期,GAP-43蛋白表達受PI3K/Akt/mTOR通路調控。PI3K蛋白活化,Akt被磷酸化激活,mTOR被進一步磷酸化激活,從而促進磷酸化S6蛋白和GAP-43蛋白表達,減緩軸突萎縮,增加突起,豐富神經元之間的聯系,延緩神經細胞衰老。
總之,本研究結果證實了梓醇具有誘導神經元內在活性,提高神經元細胞活力,延緩軸突萎縮,豐富神經元之間的聯系,延緩神經元衰老的潛能。其機制可能與調控PI3K/Akt/mTOR信號通路有關。提示梓醇對中樞神經系統損傷后神經再生和抗衰老可能有潛在的治療價值。
(致謝:本研究在西南大學藥學院中藥藥理學實驗室完成,感謝各位老師和同學對本實驗的指導、幫助。)
[1] Altomare D A, Khaled A R. Homeostasis and the importance for a balance between Akt/mTOR activity and intracellular signaling [J].CurrMedChem, 2012,19(22): 3748-62.
[2] Lachyankar M B, Sultana N, Schonhoff C M, et al. A role for nuclear PTEN in neuronal differentiation [J].JNeurosci, 2000,20(4): 1404-13.
[3] Park K K, Liu K, Hu Y, et al. Promoting axon regeneration in the adult CNS by modulation of the PTEN/mTOR pathway [J].Science, 2008,322(5903): 963-6.
[4] 朱坤杰, 孫建寧. 六味地黃丸對D-半乳糖所致衰老大鼠學習記憶的改善作用及機理[J]. 中國實驗方劑學雜志, 2006,12(8): 44-6.
[4] Zhu K J, Sun J N. Effects of Liuwei Dihuang pills on learning and memory of D-galactose-induced senile rats and its mechanism [J].ChinJExpTraditMedFormul, 2006,12(8): 44-6.
[5] 管家齊, 劉軍蓮, 王傳金. 干地黃在金匿腎氣丸中抗衰老實驗研究[J].南京中醫藥大學學報(自然科學版), 2002,18(3): 169-71.
[5] Guan J Q, Liu J L, Wang C J. Experimental study on anti-aging effect of dry Rehmannia in Jin Ni Shen Qi Wan [J].JNanjingUnivTraditChinMed, 2002,18(3): 169-71.
[6] 王靜歡, 鄒 利, 萬 東, 等. 梓醇多效性相關信號通路研究進展[J]. 中國藥理學通報, 2015,31(9): 1189-94.
[6] Wang J H, Zou L, Wan D, et al. Research progress of catalpol on related signal pathways [J].ChinPharmacolBull, 2015,31(9): 1189-94.
[7] 萬 東, 祝慧鳳, 羅 勇, 等. 梓醇促大鼠大腦皮質神經元軸突生長的離體研究[J]. 中國中藥雜志, 2007,32(17): 1771-4.
[7] Wan D, Zhu H F, Luo Y, et al. The study of catalpol on axon growth in the cerebral cortical neurons in vitro [J].ChinaJChinMaterMed, 2007,32(17): 1771-4.
[8] 祝慧鳳, 萬 東, 羅 勇, 等. 梓醇上調GAP-43表達伴隨局灶腦缺血大鼠神經功能恢復[J].中國藥理學通報, 2007,23(9): 1231-6.
[8] Zhu H F, Wan D, Luo Y, et al. Catalpol upregulated GAP-43 expression and made nerve function recovery in rats with focal cerebral ischemia [J].ChinPharmacolBull, 2007,23(9): 1231-6.
[9] 林 牧, 龔其海, 吳 芹, 等. 金釵石斛多糖對脂多糖作用大鼠皮層膠質細胞-神經元體系的保護作用[J]. 中國藥理學通報, 2016,32(8): 1144-8.
[9] Lin M, Gong Q H, Wu Q, et al. Protective effect of Dendrobium nobile polysaccharide on cortical glial cell-neuronal system induced by lipopolysaccharide in rats [J].ChinPharmacolBull, 2016,32(8): 1144-8.
[10] 張 瑋, 唐卉凌, 王 筠, 等. 大鼠大腦皮質神經元原代培養不同培養體系及純化方法的比較研究[J]. 現代生物醫學進展, 2010,10(6): 1043-6.
[10] Zhang W, Tang H L, Wang J, et al. Comparative study on different culture systems and purification methods of primary culture of rat cerebral cortical neurons [J].ProgModBiomed, 2010,10(6): 1043-6.
[11] Lin Y C, Huang Z H, Jan I S, et al. Development of excitatory synapses in cultured neurons dissociated from the cortices of rat embryos and rat pups at birth [J].JNeurosciRes, 2002,67(4): 484-93.
[12] Pakkenberg B, Gundersen H J G. Neocortical neuron number in humans: effect of sex and age[J].JCompNeurol,1997,384(2): 312-20.
[13] 孫曉慧, 王 燕, 牟艷玲. 2型糖尿病大鼠心肌PI3K/Akt/mTOR信號通路的改變及Sirt1的調控機制研究[J]. 中國藥理學通報, 2017,33(6): 793-8.
[13] Sun X H, Wang Y, Mou Y L. Changes of PI3K/Akt/mTOR signaling pathway in myocardium of type 2 diabetic rats and the regulatory mechanism of Sirt1 [J].ChinPharmacolBull, 2017,33(6): 793-8.

