過表達THEM4對高糖誘導的人腎小管上皮細胞膠原分泌的影響
陳 寧,郝 軍,朱桂云,安曉穎,康麗菲,李曉霞,楊永輝
(1. 河北省胸科醫院病理科,河北 石家莊 050041;2. 河北醫科大學病理學教研室,河北 石家莊 050017)
目前普遍認為腎小管間質纖維化是糖尿病腎病發展為終末期腎功能衰竭(end-stage renal disease, ESRD)的病理基礎,而腎小管上皮細胞向間質細胞轉分化(epithelial to mesenchymal transition, EMT)以及導致的細胞外基質(extracellular matrix, ECM)的過度積聚是腎小管間質纖維化發生的前提[1]。新近研究揭示PI3K/Akt信號通路的異常激活與糖尿病腎病ECM沉積相關[2]。而硫酯酶超家族成員4(thioesterase superfamily member 4, THEM4)作為Akt的內源性負向調控因子[3]是否參與了糖尿病腎病ECM沉積的發生,目前尚未見報道。因此,本研究通過構建THEM4過表達質粒并轉染至人腎小管上皮細胞(human renal proximal tubular epithelial cell, HKC)內,觀察高糖刺激下PI3K/Akt/THEM4的表達與膠原分泌的關系(膠原是ECM的主要組成成分),以及過表達THEM4能否起到干預作用,為糖尿病腎病ECM沉積的防治提供新的思路。
1 材料
1.1細胞株人腎小管上皮細胞株HKC來自河北醫科大學病理學實驗室凍存。
1.2試劑pYr-ads-4-THEM4 vector、pYr-adshuttle-4 empty vector均購自長沙贏潤生物有限公司;人Collagen Ⅰ ELISA試劑盒、人Collagen Ⅲ ELISA試劑盒均購自BlueGene Biotech;TRITC-羊抗兔IgG、兔抗THEM4單克隆抗體(14692-1-AP)、兔抗β-actin單克隆抗體(20536-1-AP)、兔抗α-SMA單克隆抗體(14295-1-AP),均購自美國Protein Tech公司;兔抗phospho-Akt (Ser 473)單克隆抗體(#4060)、兔抗Akt單克隆抗體,均購自美國Cell Signaling公司;兔抗TGF-β1單克隆抗體(#AP12348a) 購自ABGENT。
1.3儀器熒光顯微鏡、相差倒置顯微鏡(日本Olympus公司);CO2培養箱(日本SANYO);高速低溫離心機(德國Eppendorf公司)。
2 方法
2.1HKC細胞實驗分組用含10%胎牛血清的DMEM培養基常規培養人腎小管上皮細胞,采用Lipofectamine 2000分別轉染pYr-ads-4-THEM4表達質粒及pYr-adshuttle-4空質粒,轉染后的細胞進行G418(800 mg·L-1)抗性篩選,將篩選出的陽性克隆細胞進行傳代培養。經同步化后,將細胞隨機分為正常對照組(5.5 mmol·L-1,Control)、高糖組(30 mmol·L-1, HG)、高糖+pYr-ads-4-THEM4質粒轉染組(HG+THEM4)、高糖+pYr-adshuttle-4空質粒對照組(HG+V)。后3組經高糖刺激48 h后終止培養,收集細胞進行免疫熒光化學染色和細胞總蛋白提取。
2.2免疫熒光細胞化學檢測采用6孔板細胞爬片,培養終止后,細胞用0.01 mol·L-1PBS沖洗數次,4%多聚甲醛固定30 min;0.5% Triton X-100 37℃打孔10 min,PBS沖洗,5 min×3次;正常山羊血清封閉,37℃孵育1 h;棄封閉液,滴加1 ∶200稀釋的THEM4一抗,4℃過夜;PBS沖洗,5 min×3次;滴加TRITC-羊抗兔IgG,37℃孵育1 h;PBS沖洗,5 min×3次;滴加 DAPI(1:100配制),37℃孵育10 min;PBS沖洗,5 min×3次;熒光顯微鏡下觀察并攝取圖像。
2.3Westernblot檢測蛋白表達收集各組細胞并加入冰冷的裂解液(50 mmol·L-1Tris-HCl pH 7.4、150 mmol·L-1NaCl、1 mmol·L-1EDTA、aprotinin 2 mg·L-1、PMSF 100 mg·L-1)200 μL,提取總蛋白。采用考馬斯亮藍法測定蛋白濃度,分裝后-80℃保存。每個樣品取50 μg總蛋白,經SDS-PAGE凝膠電泳后,電轉移至PVDF膜;5% BSA 37℃封閉1 h,一抗[THEM4、Akt、phospho-Akt(Ser 473)、α-SMA、TGF-β1、β-actin,1 ∶1 000稀釋] 4℃過夜。TBST洗膜后,加辣根過氧化物酶標記的羊抗兔IgG(1 ∶5 000稀釋),室溫孵育2 h;TBST洗膜,滴加ECL增強化學發光試劑,Odyssey FC成像系統顯影。用美國UVP公司LabWorks 4.5軟件對條帶進行定量分析,讀取積分光密度值(IOD),目的蛋白條帶的IOD值除以內參條帶的IOD值作為最終結果進行統計分析。
2.4ELISA法檢測細胞上清液中ColⅠ、ColⅢ的含量先后加入稀釋后的標準品50 μL、待測樣品50 μL于反應孔內,立即加入50 μL生物素標記的一抗,輕輕振蕩混勻,37℃孵育45 min。甩去孔內液體,震蕩洗滌4次,每次30 s。每孔加入100 μL辣根酶標記的二抗,輕輕振蕩混勻,37℃孵育30 min。甩去孔內液體,震蕩洗滌4次,每次30 s。每孔加入底物A、B各50 μL,輕輕振蕩混勻,37℃孵育5 min,避免光照。取出酶標板,迅速加入50 μL終止液,立即測定結果。在450nm波長處測定各孔的OD值。以標準品的吸光度OD值為縱坐標,相應標準品濃度為橫坐標,做出標準曲線,樣品含量根據其OD值,由標準曲線換算出相應濃度。
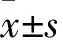
3 結果
3.1pYr-ads-4-THEM4表達質粒抑制高糖刺激下人腎小管上皮細胞內phospho-Akt蛋白的活化質粒轉染后,Western blot法檢測THEM4蛋白的表達,Fig 1結果顯示,pYr-ads-4-THEM4質粒轉染成功逆轉了高糖刺激下人腎小管上皮細胞內THEM4的低表達,與pYr-adshuttle-4 空質粒組相比,THEM4的表達上調了1.98倍。同時,Fig 2免疫熒光結果顯示,THEM4質粒轉染組與高糖組及pYr-adshuttle-4 空質粒組相比,THEM4表達明顯增加,主要定位于人腎小管上皮細胞的胞質。與THEM4的表達恰好相反,高糖可誘導人腎小管上皮細胞phospho-Akt (Ser 473)的活化,而經pYr-ads-4-THEM4質粒轉染后,phospho-Akt (Ser 473)的表達明顯降低,與空質粒轉染組相比下調了35.11%,而總Akt的表達在各組間未見明顯差異 (Fig 1)。
3.2pYr-ads-4-THEM4表達質粒抑制高糖刺激下人腎小管上皮細胞α-SMA及TGF-β1蛋白的表達Western blot法進一步檢測了質粒轉染并給予高糖刺激后,人腎小管上皮細胞內α-SMA及TGF-β1的表達情況。Fig 3結果顯示,高糖刺激時人腎小管上皮細胞內α-SMA、TGF-β1的表達明顯增強,而經THEM4表達質粒轉染后,二者的表達均被明顯抑制,與空質粒對照組相比,二者分別下調了51.59%、76.53%。

Fig 1 THEM4, phospho-Akt (Ser 473) and Akt in HKC cells by Western blot
*P<0.05vscontrol group;#P<0.05vsHG+V group

Fig 2 Immunofluorescence staining for THEM4 protein (indicated in red) with DAPI counterstaining in HKC cells
White arrows show positive signal. Scale bar: 50 μm. A: Control group; B: HG group; C: HG+THEM4 group; D: HG+V group

Fig 3 Expression of α-SMA and TGF-β1 protein in HKC cells by Western blot
*P<0.05vscontrol group;#P<0.05vsHG+V group
3.3pYr-ads-4-THEM4表達質粒抑制高糖刺激下人腎小管上皮細胞ColⅠ、ColⅢ的分泌ELISA法檢測了各組細胞上清液中ColⅠ、ColⅢ的分泌情況。如Fig 4所示,高糖刺激后48 h,ColⅠ、ColⅢ的分泌較正常對照組明顯增加(P<0.05),而經pYr-ads-4- THEM4質粒轉染后,ColⅠ、ColⅢ的分泌較空質粒對照組分別下調了32.31%、51.83%。
4 討論

Fig 4 Secretion of Co lⅠ and Col Ⅲ in HKC cells by ELISA
*P<0.05vscontrol group;#P<0.05vsHG+V group
新近研究報道,高糖可誘導PI3K/Akt/mTORC1通路的活化,上調人腎小管上皮細胞骨橋蛋白(osteopontin,OPN) 的表達,而應用LY294002(PI3K特異性抑制劑)以及雷帕霉素(mTORC1特異性抑制劑)后,OPN表達明顯降低。可見,通過抑制PI3K/Akt信號通路的激活將為糖尿病腎病的防治提供新的干預靶點[4]。另外,有學者發現,高糖可誘導人腎小管上皮細胞內膽固醇蓄積,進而引起細胞脂質代謝異常[5]。那么,PI3K/Akt/THEM4通路是否參與高糖誘導人腎小管上皮細胞ECM的分泌呢?因此,本研究通過編碼THEM4的表達質粒pYr-ads-4-THEM4并轉染至人腎小管上皮細胞內,觀察過表達THEM4對高糖誘導的人腎小管上皮細胞膠原分泌的影響。
THEM4又稱C末端調節蛋白,在多種組織及細胞中被揭示,可抑制Akt的磷酸化活性,是Akt的一種內源性抑制因子[3]。近年來,對THEM4基因學的研究越來越多[6-7],有學者發現THEM4是一種與人體代謝相關的基因之一,可能與慢性腎臟疾病、糖尿病以及心血管疾病的發生相關[8]。Mondal等[9]發現THEM4基因可能是位于1號染色體長臂21-24區的一種易感基因,通過調節體內糖平衡狀態而增加2型糖尿病的易感性。Shin等[10]發現,在H-ras12V肝癌小鼠模型中,THEM4通過抑制Akt1磷酸化,抑制腫瘤細胞的增殖和血管生成,具有一定的抗腫瘤效應。新近研究報道,維生素D具有上調THEM4的功能,進而通過抑制巨噬細胞Akt/NF-κB信號通路介導的COX-2釋放,在一些炎癥性疾病甚至腫瘤的治療中具有輔助效果[11]。
本研究結果證實了高糖介導的人腎小管上皮細胞THEM4的低表達及phospho-Akt(Ser 473)的活化是引起α-SMA、TGF-β1表達上調,進而導致膠原分泌的重要發病機制。而THEM4作為Akt的內源性抑制因子,過表達THEM4通過抑制phospho-Akt(Ser 473)的活化,下調α-SMA以及TGF-β1表達,從而減少高糖刺激的人腎小管上皮細胞膠原分泌。可見,PI3K/Akt/THEM4信號通路是糖尿病腎臟ECM沉積的重要通路,而通過應用Akt的內源性抑制劑THEM4后能夠抑制高糖誘導的膠原分泌,減輕ECM積聚。
我們下一步的研究將在體外實驗的基礎上,通過尾靜脈注射將THEM4表達質粒轉染至糖尿病小鼠體內,進一步觀察THEM4在糖尿病小鼠體內的表達及影響,從整體水平上探討糖尿病腎病ECM沉積的發生機制,為其防治提供理論依據。
(致謝:本實驗于河北醫科大學病理學實驗室完成,感謝實驗室全體老師的幫助。)
[1] Wight T N, Potter-Perigo S. The extracellular matrix: an active or passive player in fibrosis[J]?AmJPhysiolGastrointestLiverPhysiol, 2011,301(6):G950-5.
[2] Zhu L, Zhao S, Liu S, et al. PTEN regulates renal extracellular matrix deposit via increased CTGF in diabetes mellitus[J].JCellBiochem, 2016,117(5) : 1187-98.
[3] Zhao H, Lim K, Choudry A, et al. Correlation of structure and function in the human hotdog-fold enzyme hTHEM4[J].Biochemistry, 2012,51(33) : 6490-2.
[4] 杜春陽,史永紅,朱 艷,等. 高糖對腎小管細胞膽固醇轉運的影響及花青素的干預研究[J]. 中國藥理學通報, 2016,32(1): 114-8.
[4] Du C Y, Shi Y H, Zhu Y, et al. Effect of high glucose on cholesterol efflux in renal tubular cell and intervention of anthocyanins [J].ChinPharmacolBull, 2016, 32(1) : 114-8.
[5] 王鳳梅,蔣克國,張桂霞,等. 高糖激活 PI3K /AKT /m TORC1通路誘導人腎小管上皮細胞骨橋蛋白的表達[J]. 中國藥理學通報, 2014,30(8) : 1156-60.
[5] Wang F M, Jiang K G, Zhang G X, et al. High glucose induces expression of osteopontin through activation of PI3K/AKT/m TORC1 pathway in human renal tubular epithelial cells[J].ChinPharmacolBull, 2014,30(8):1156-60.
[6] Bhinder B, Shum D, Li M, et al. Discovery of a dicer-independent, cell-type dependent alternate targeting sequence generator: implications in gene silencing & pooled RNAi screens[J].PLoSOne, 2014,9(7):e100676.
[7] Lai F N, Zhai H L, Cheng M, et al. Whole-genome scanning for the litter size trait associated genes and SNPs under selection in dairy goat (Capra hircus)[J].SciRep, 2016,6: 38096.
[8] Yu B, Zheng Y, Alexander D, et al. Genetic determinants influencing human serum metabolome among African Americans[J].PLoSGenet, 2014,10(3): e1004212.
[9] Mondal A K, Sharma N K, Elbein S C, et al. Allelic expression imbalance screening of genes in chromosome 1q21-24 region to identify functional variants for type 2 diabetes susceptibility[J].PhysiolGenomics, 2013,45(13) : 509-20.
[10] Shin J Y, Chung Y S, Kang B, et al. Co-delivery of LETM1 and CTMP synergistically inhibits tumor growth in H-ras12V liver cancer model mice[J].CancerGeneTher, 2013,20(3) : 186-94.
[11] Wang Q S,He Y H,Shen Y J,et al. Vitamin D inhibits COX-2 expression and inflammatory response by targeting thioesterase superfamily member[J].JBiolChem,2014,289(17) : 11681-94.

