“魚浮靈”增氧原理的實驗探究
張曉紅
摘要:以“魚浮靈”作為探究對象,利用溶解氧傳感器和pH傳感器對“魚浮靈”增氧原理進行了實驗探究。結果發現,“魚浮靈”中碳酸鈉溶于水顯堿性,堿性條件能促進H2O2的分解,從而達到緩解水體缺氧的目的。
關鍵詞:溶解氧傳感器;pH傳感器;魚浮靈;實驗探究
文章編號:1005–6629(2017)11–0074–03 中圖分類號:G633.8 文獻標識碼:B
1 問題提出
作為高考考查科目之一,江蘇高考化學試卷命題以考查學生的科學素養和化學學科能力為主旨,重點考查學生的信息獲取與加工、化學實驗探究、從化學視角分析解決問題和化學學科思維等能力。要求學生能設計解決簡單化學問題的實驗探究方案,能運用觀察實驗、閱讀資料等多種手段收集證據,能基于證據推理形成探究結論,并運用多種方式準確地表達探究結果[1]。筆者現從教高三,感覺高中化學教材中多為結合教材內容的簡單定性或定量實驗,與高考考查要求尚有一定距離。受啟發于2016年江蘇高考化學試卷第18題,題中涉及供氧劑過氧化鈣(CaO2·8H2O)的制備以及過氧化鈣溶于水后溶液中溶解氧的測定。另外考慮到簡單易操作、實驗安全、有探究價值等因素,本實驗選擇“魚浮靈”作為研究對象,運用數字化手持技術探究“魚浮靈”的增氧原理,與學生一起體驗化學實驗探究的歷程。
2 實驗原理
在水產養殖或運輸過程中,如果水體缺氧會導致養殖的魚蝦等輕則出現浮頭,重則泛池、窒息死亡,造成重大經濟損失。漁民們通常采用機械增氧、生物增氧和化學增氧三種方法增加水中溶解氧,實驗探究的“魚浮靈”就是一種化學增氧劑。“魚浮靈”溶于水后能迅速增加水體溶氧量并在長時間內維持,提高魚苗及活魚運輸的成活率,緩解消除水體中有機酸及分子氨的積累,增加水生動物的抗病能力。通過產品說明和查閱資料,得知“魚浮靈”主要成分是過氧碳酸鈉(2Na2CO3·3H2O2),俗稱固體雙氧水。
3 實驗設計
3.1 藥品及儀器
藥品:魚浮靈、NaCl(s)、Na2CO3(s)、NaOH(6mol/L)、H2O2(4%)、蒸餾水
儀器:數據采集器(蘇威爾軟件)、溶解氧傳感器、pH傳感器、計算機、磁力攪拌器、100mL燒杯、洗氣瓶、量筒等
3.2 操作要點
(1)pH傳感器比較靈敏,使用前需要用pH=4和pH=9.18的標準液校準;溶解氧傳感器比較穩定,一般出廠后不需要校準,但使用時要注意探頭處不能有氣泡。
(2)4% H2O2的密度約1.0g/mL,根據溶液質量分數和濃度的換算公式,可求出其物質的量濃度約為1.2mol/L。為使對比各組之間實驗因素的影響盡量一致,通過計算求出80mL蒸餾水中加入“魚浮靈”的質量約為6.7g,使其溶于水后H2O2濃度也等于1.2mol/L。
(3)NaOH固體溶于水放熱,為了排除溫度對反應速率的影響,因此實驗中選擇用6mol/L的NaOH溶液調節溶液pH。
3.3 實驗裝置
實驗裝置如圖1所示。
3.4 實驗探究
(1)向100mL燒杯中加入80mL蒸餾水,插入溶解氧傳感器探頭、pH傳感器探頭,連接數據采集器,打開磁力攪拌器,加入6.7g“魚浮靈”,繪制溶解氧(mg/L)和pH隨時間變化的曲線。
(2)向100mL燒杯中加入80mL H2O2(4%),同(1)操作;待曲線變化平穩后加入少量NaCl固體,觀察曲線變化;待曲線變化平穩后再加入少量Na2CO3固體,觀察曲線變化。
(3)向100mL燒杯中加入80mL H2O2(4%),同(1)操作;待曲線變化平穩后加入少量NaOH溶液(6mol/L),觀察曲線變化。
(4)圖表分析。由于水中溶解氧量程為0~20(mg/L),pH量程為0~14,兩者相差不大,可以在坐標軸上同時繪制溶解氧(mg/L)-時間(s)、pH-時間(s)兩條曲線,以便于觀察分析。(注:pH傳感器探頭從溶液中取出時pH會發生突變)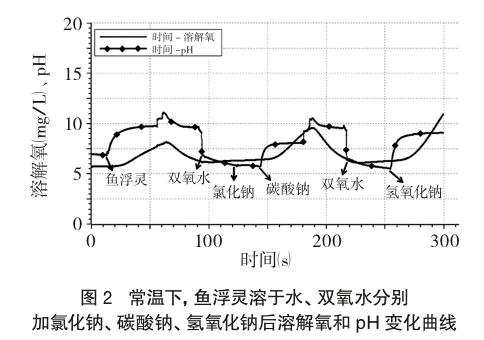
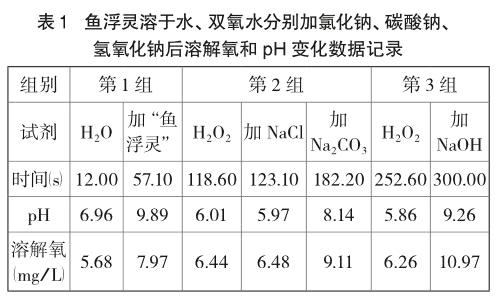
由圖2、表1可知:常溫下蒸餾水pH約為7,溶有少量O2;加入“魚浮靈”后溶液pH大于7,顯堿性,水中溶解氧明顯增大。常溫下H2O2 pH小于7,呈弱酸性,溶解氧大于純水,且隨時間遞增,水中溶解氧緩慢增大,說明常溫下H2O2能緩慢分解產生O2;加入NaCl后溶液呈弱酸性、溶解氧變化不明顯;加Na2CO3后溶液pH增大,堿性增強,溶解氧增大;加NaOH后溶液pH增大,堿性增強,溶解氧明顯增大。(注:表中數據取自加入不同試劑后,pH變化平穩再次突變前的點)
3.5 實驗再探究
為了進一步確定溶液酸堿性對H2O2分解情況的影響,增加實驗:向5個100mL燒杯中分別加入80mL H2O2(4%),用NaOH(6mol/L)調節五組溶液的酸堿性,使溶液的pH逐漸增大,依次插入溶解氧傳感器探頭、pH傳感器探頭,繪制溶解氧(mg/L)和pH隨時間變化的曲線。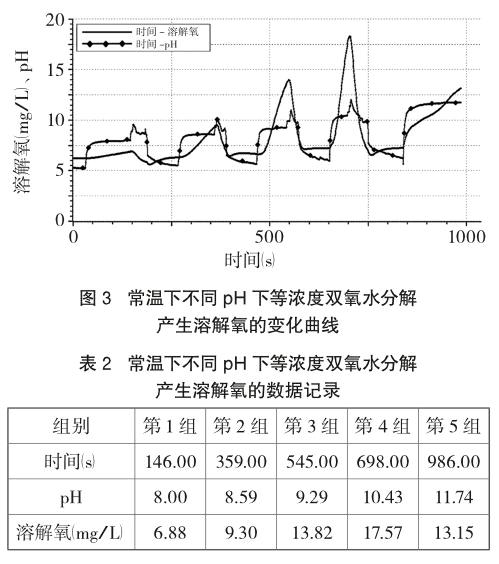
由上述圖3、表2可知:除溫度、濃度、催化劑等條件,溶液的酸堿性也能影響H2O2的分解速率。不同pH下H2O2分解產生O2的速率不同,一定pH范圍內,pH越大,溶液堿性越強,H2O2分解速率越快,但是pH調至11.74后,由圖3中溶解氧變化趨勢及表2中數據分析,發現H2O2分解速率不升反降,可推測H2O2分解速率與pH并不是完全正相關。(注:表中數據取自五組H2O2分別加入不同體積NaOH溶液后,pH變化平穩再次突變前的點)endprint

