孕婦及其新生兒端粒長度的影響因素分析
翁 僑, 杜江波, 俞 飛, 靳光付, 沈洪兵*, 胡婭莉*
1. 南京大學醫學院附屬鼓樓醫院婦產科,南京 210008 2. 南京醫科大學公共衛生學院流行病學系,南京 211166
孕婦及其新生兒端粒長度的影響因素分析
翁 僑1, 杜江波2, 俞 飛2, 靳光付2, 沈洪兵2*, 胡婭莉1*
1. 南京大學醫學院附屬鼓樓醫院婦產科,南京 210008 2. 南京醫科大學公共衛生學院流行病學系,南京 211166
目的全面評估孕期各種因素對孕婦及新生兒端粒長度的影響,為探討端粒在疾病發生和發展中的作用機制提供依據。方法2015年3月—2016年2月在南京大學醫學院附屬鼓樓醫院出生444例新生兒,對其母親進行問卷調查、體格檢查和臨床相關指標檢測,并采集新生兒臍靜脈血及其配對的母體外周血樣本。采用定量PCR法測量各樣本的相對端粒長度。然后采用配對t檢驗比較母兒端粒長度,采用一般線性模型分析新生兒與母親端粒長度等連續性變量之間的相關性,采用方差分析法和t檢驗分析不同亞組間相對端粒長度的差異。結果新生兒相對端粒長度(均數為0.358)明顯大于母親相對端粒長度(均數為0.309,P<0.001),未發現母兒端粒長度之間有明顯的相關性(r2=0.004,P=0.174)。母親受教育程度越高,新生兒相對端粒長度越長(P=0.022);而孕周、分娩方式、新生兒性別和出生體質量均與母嬰端粒長度無明顯相關性。孕期攝入奶制品較多,母體相對端粒長度較短(P=0.048);孕期攝入蔬菜水果、肉制品、動物內臟、魚蝦、豆制品、煎烤及腌制食品、葉酸及多種維生素不同組之間,新生兒和母體的相對端粒長度差異均無統計學意義;孕期飲用咖啡,新生兒相對端粒長度較短(P=0.011);孕期二手煙暴露、飲酒及飲茶情況對母體和新生兒相對端粒長度均無明顯影響;孕期經常參加體育鍛煉的母體相對端粒長度較不鍛煉或很少鍛煉者長(P=0.01),新生兒相對端粒長度未見明顯差異(P=0.187)。結論受教育程度以及孕期攝入奶制品、飲用咖啡和參加體育鍛煉可能影響孕婦或新生兒的端粒長度,為進一步揭示端粒在疾病發生發展中的作用提供了線索。
端粒縮短;孕婦;胎血;影響因素
端粒是特異性結合蛋白與真核細胞染色體末端TTAGGG六堿基重復序列串聯組成的復合體,與衰老和疾病風險高度相關。端粒長度主要取決于出生時端粒長度和出生后氧化應激的程度[1]。因此,對出生時端粒長度開展研究,有助于預測疾病發生風險以及闡明端粒相關疾病的發病機制。
有研究發現,孕期母親的精神壓力與新生兒臍血單核細胞端粒長度線性相關,并且可能通過胎盤血流改變或代謝改變對子代產生影響[1];孕早期母親血清葉酸濃度每增加10 ng/mL,新生兒臍血白細胞端粒長度可延長5.8%[2];而母親吸煙等生活方式會導致新生兒端粒縮短[3]。極低體質量早產兒的端粒長度長于低體質量早產兒,且隨著孕周增加,端粒長度明顯縮短[4]。隨后Cross等[5]研究發現,新生兒臍血端粒長度與父親年齡、孕周、母親吸煙、母親社會剝奪指數、新生兒出生體質量、臍血炎性反應標志物水平均無相關性。Imam等[3]研究發現,母親外周血白細胞端粒長度與新生兒臍血端粒長度正相關;然而Njajou等[6]基于人群的家族研究則發現,父親的壽命和端粒長度與子代端粒長度相關,但母親的壽命和端粒長度與其子女端粒長度無明顯相關性。由此可見,有關出生時端粒長度的影響因素,目前的研究結論尚不一致。因此,采用大樣本量和更加嚴謹設計的研究策略對新生兒出生時母嬰端粒長度的影響因素進行深入分析,就顯得十分必要。
本研究采用一般線性模型深入分析444例配對的孕婦外周血及其新生兒臍靜脈血端粒長度與各種環境因素的相關性,以期明確新生兒出生時端粒長度的影響因素,為了解及預測端粒相關疾病提供依據。
1 資料與方法
1.1 一般資料 本研究入組病例為2015年3月—2016年2月在南京鼓樓醫院進行孕檢及生產的444例產婦。所有病例均為單胎妊娠,28周以后分娩,排除死胎、死產。本研究采用橫斷面研究,對444例產婦外周血及相應新生兒臍血的端粒長度進行檢測,采用一般線性模型分析各種社會人口學因素、環境因素與端粒長度的相關關系。
1.2 研究方法
1.2.1 流行病學調查 為實現流行病學調查過程的標準化并保證調查質量,本研究針對調查問卷內容制定了專門的調查手冊,由婦產科學專業和流行病學專業的研究人員進行問卷調查,并使用統一設計的生育狀況記錄表。調查內容主要包括一般人口學資料,個人健康狀況,職業暴露情況,孕期吸煙、飲酒等生活方式,遺傳病史及疾病家族史等;妊娠及分娩相關信息以及臨床診治資料從病歷檔案中摘錄。其中,關于受教育程度:初等教育是指最高學歷為小學或以下;中等教育是指最高學歷為中學,包括初級中學、高級中學或中等專科學校;高等教育是指最高學歷為大學或以上。根據世界衛生組織對二手煙暴露的定義,以孕婦在家庭或工作場所每周被動吸煙15 min以上判定為存在二手煙暴露,否則定義為非二手煙暴露。
所有參與的調查人員在現場調查開展前需接受統一培訓及預調查。所有的研究對象由經過培訓的調查人員進行面訪調查,調查開始前需征求調查對象同意,并由調查對象填寫參與本次研究的知情同意書。調查問卷經過質量控制評估合格后,使用EpiData 3.0軟件進行雙軌錄入。
1.2.2 臍血和外周血DNA端粒長度檢測 使用美國Life Technologies公司的TaqMan 9700 PCR擴增儀擴增端粒重復序列的拷貝數(telomere repeat copy number,T)和單拷貝基因36B4的拷貝數(single copy gene 36B4 copy number,S),通過T/S比值相對定量母體外周靜脈血及新生兒臍靜脈血基因組DNA的相對端粒長度(relative telomere length,RTL)。引物序列見表1。RTL是由PCR擴增獲得的Ct值計算所得[7]:RTL=2-(ΔCt1-ΔCt2)。其中,ΔCt1是待測樣本DNA的端粒擴增Ct值與單拷貝基因36B4擴增的Ct值之差,而ΔCt2是標準DNA端粒擴增的Ct值與單拷貝基因36B4擴增的Ct值之差。

表1 端粒長度測量所需引物相關信息
1.3 統計學處理 采用STATA version 9.2(STATA Corp LP)軟件進行數據分析。母血和臍血之間端粒長度的比較采用t檢驗,不同亞組間端粒長度差異的比較采用方差分析和t檢驗;采用一般線性模型分析母血、臍血端粒長度之間的相關性,以及與其他連續性變量之間的相關性。檢驗水準(α)為0.05。
2 結 果
2.1 母嬰端粒長度的分布情況及二者相關性 444例配對的母體外周靜脈血和新生兒臍靜脈血樣本中,母血提取的DNA平均含量為99.7 ng/μL、D260/D280為1.88,臍血提取的DNA平均含量為101 ng/μL、D260/D280為1.86,兩者差異無統計學意義(P<0.05)。母血和臍血RTL均呈近似正態分布(圖1);母血RTL(均數為0.309)明顯短于新生兒臍血RTL(均數為0.358,P<0.001;圖2);母血和臍血RTL之間無明顯相關性(r2=0.004,P=0.174;圖2)。

圖1 產婦外周血(A)和新生兒臍帶血(B)端粒長度分布的直方圖

圖2 產婦外周血和新生兒臍帶血相對端粒長度的比較(A)以及相關性分析(B)
2.2 環境因素與母血及臍血端粒長度的關聯研究
2.2.1 產婦一般情況亞組間RTL的比較 結果(表2)表明:不同產婦年齡階段的母血和臍血RTL差異均無統計學意義。母親受教育程度越高,母血端粒長度越短,差異無統計學意義;對應的新生兒臍血端粒長度越長,差異有統計學意義(P=0.05)。分娩孕周越大,母親端粒長度越短,差異無統計學意義;臍血端粒長度未見明顯改變。剖宮產和陰道分娩組母血、臍血RTL差異均無統計學意義。
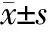
表2 產婦一般情況亞組間母血及臍血相對端粒長度的比較 N=444,
2.2.2 新生兒一般情況亞組間RTL的比較 結果(表3)表明:女性新生兒組母血及臍血RTL均略長于男性新生兒組,但差異無統計學意義;不同新生兒出生體質量組的母血及臍血RTL差異也無統計學意義。
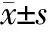
表3 新生兒一般情況亞組間母血及臍血相對端粒長度的比較 N=444,
2.2.3 母兒一般情況與RTL的回歸分析 結果(表4)表明:產婦年齡與母血及臍血RTL沒有相關性;產婦受教育程度與母血RTL無明顯相關性,但與臍血RTL明顯正相關(P=0.022);分娩孕周與母血及臍血RTL無明顯相關性;新生兒出生體質量與母血及臍血RTL也無相關性。

表4 母血及臍血相對端粒長度與母兒一般情況的回歸分析
2.2.4 孕期膳食攝入亞組間RTL的比較 結果(表5)表明:孕婦攝入蔬菜水果、肉制品和動物內臟、魚蝦、豆制品、煎烤及腌制食品不同亞組之間,母血和臍血RTL均未見明顯差異;孕婦攝入奶制品較多組母血RTL較攝入奶制品較少組短(P=0.048),但兩亞組臍血RTL差異無統計學意義。
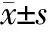
表5 孕期膳食攝入不同亞組間母血及臍血相對端粒長度的比較 N=444,
2.2.5 孕期膳食補充劑攝入亞組間RTL比較 結果(表6)表明:在葉酸以及多種維生素補充攝入不同亞組之間,母血和臍血RTL差異均無統計學意義。
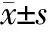
表6 孕期膳食補充劑攝入不同亞組間母血及臍血相對端粒長度的比較 N=444,
2.2.6 孕期生活方式亞組間RTL的比較 結果(表7)表明:孕期存在二手煙暴露與沒有二手煙暴露兩亞組間,母血和臍血RTL差異均無統計學意義;孕期飲酒和飲茶不影響母血和臍血RTL;孕期飲用咖啡組臍血RTL短于不飲用咖啡組(P=0.011),兩亞組母血RTL差異無統計學意義;孕期經常參加體育鍛煉組母血RTL長于不鍛煉或很少鍛煉組(P=0.010),臍血RTL差異無統計學意義。
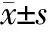
表7 相對端粒長度在孕期生活方式亞組間比較 N=444,
3 討 論
既往基于人群的研究[8-10]已證實,端粒長度與年齡負相關。本研究發現,新生兒端粒長度比母親端粒長度長15%;這也證實了端粒在細胞分裂過程中呈進行性縮短,這一特性使其成為記錄人體衰老進程的“生物時鐘”[11]。然而,本研究尚未發現產婦的端粒長度與年齡負相關的證據,這可能與本研究入組產婦的年齡跨度較小有關。本研究中產婦年齡為19~42歲,大多數為20~40歲。已有大量研究[12-14]證實,隨著年齡增長,端粒長度并非呈線性縮短,端粒縮短的速率在兒童期和老年期較快,而在成年期相對穩定。Aubert等[15]研究還發現,出生后第1年端粒縮短的速率是1~18歲的10倍,是19歲以后的28倍,而到了50歲以后,端粒縮短的速率再度增加[16-17]。由此可見,在本研究對象中,端粒縮短的速率處于最微弱狀態,年齡間的差異極小。另外,孕婦更加傾向于健康的生活方式并且盡可能減少不良的外在暴露,也是端粒縮短不明顯的重要原因。近期一項經過5年隨訪的前瞻性研究[18]發現,通過改善生活方式能夠增加端粒長度。因此,本研究中入組產婦在孕期采取健康的生活方式很可能一定程度上稀釋了年齡的端粒損耗。本研究還發現,新生兒端粒長度與母親端粒長度沒有明顯的線性相關性;這與Imam[3]的研究結論相反,但與Njajou等[6]和Nordfjall等[19]的研究結果一致,今后還需更大樣本量的獨立研究進行評估。
本研究發現,母親受教育水平不同,新生兒端粒長度有明顯差異。分析其原因,可能高學歷的孕婦更可能有較高的收入水平,更可能在孕期保持健康的飲食和生活方式,因此孕婦的高學歷可能是其子代保持較長端粒的有利因素。近期Wojcicki等[20]在拉丁美洲新生兒中也得到相似的結果。該研究發現,母親受到高等教育的新生兒端粒長度明顯長于母親受低等教育的新生兒,并且母親的受教育程度與社會經濟狀態正相關,而社會經濟狀況較低又與成人及兒童端粒長度較短明顯相關。另外,也有多個研究證實,炎性反應狀態會導致端粒縮短[21]。近期一項研究[22]報道,較低的受教育水平與炎性反應的生物標志物——C反應蛋白水平升高顯著相關。
已有研究[12,23-26]報道,成年女性的端粒長度長于成年男性的端粒長度。近期,Benetos等[27]研究相同及不同性別的雙胞胎時發現,性別之間端粒長度的差異主要是胎兒在子宮內就已經發生,這種差異與不同性別胎兒激素分泌不同有關。隨后的一項研究也指出,男性新生兒出生時端粒長度較女性新生兒短,推測與宮內雌激素對端粒酶產生激活作用相關[20]。本研究中,盡管女性新生兒的端粒長度較男性新生兒長4%,但差異無統計學意義,這可能與本研究入組樣本量較小有關。今后還需要進一步增加樣本量以研究不同性別胎兒及其宮內環境對端粒長度的潛在影響。
關于奶制品攝入與端粒長度的關系,目前尚有爭議。近期一項針對韓國中年人的隊列研究發現,奶制品攝入與端粒長度正相關[28]。而Gu等[29]研究發現,非西班牙裔白人攝入奶制品增多與端粒長度縮短相關。Song等[30]對1 481名絕經后婦女的飲食情況進行研究,發現在調整了年齡、種族、體質指數、吸煙、飲酒和飲食等混雜因素的影響后,女性攝入非脫脂牛奶越多,端粒長度越短,而在1 228名攝入脫脂牛奶的婦女中則未見端粒長度有明顯差異;推測其可能原因是,非脫脂牛奶的脂肪含量較高,造成氧化應激增加,從而導致端粒長度縮短。本研究也發現孕期奶制品的攝入與孕婦端粒長度負相關,這不排除與孕婦攝入的奶制品中相當一部分含脂較高有關。但是本研究沒有發現孕期奶制品的攝入對新生兒端粒長度有明顯影響。
對于蔬菜、水果、肉類、魚蝦、豆制品和維生素等攝入與端粒長度的相關性,既往的研究報道較少,而且已有的研究局限于歐洲人群,研究結論也不一致。有研究[7,29,31]發現,蔬菜水果攝入和端粒長度沒有相關性;但也有研究得出相反的結論[28,32]。Nettleton等[33]研究發現,肉制品的攝入與端粒長度負相關;但是Mirabello等[34]的研究則沒有相同發現。而本研究中也未發現孕期蔬菜、肉類、魚蝦、豆制品和維生素等攝入與母親及新生兒端粒長度相關。以上研究結果不一致的原因可能為:(1)飲食的多樣化使得僅用調查表無法準確定量食物攝入以及攝入的某種食物占全部飲食的比例;(2)不同種族和地區的人群對于食物組成的需求不同;(3)由于端粒長度的影響因素眾多,盡管有許多研究已經調整了各種協變量,但是一些潛在的混雜因素無法完全排除,這也可能對研究結果造成影響。
咖啡被認為具有抗氧化作用,因此有助于維持端粒長度[28]。但本研究發現飲用咖啡對母血端粒長度沒有明顯影響,但臍血端粒長度明顯縮短。本研究結果可能與樣本量較小有關,還可能是由于在中國人群尤其是孕婦在孕期飲用咖啡并不多見,即使飲用,量也很少,因此無法得出與國外非孕人群一致的結論。孕期飲用咖啡說明不注意改善生活方式,這可能是本研究中孕期飲用咖啡者臍血端粒長度縮短的一個原因。國外關于咖啡攝入與端粒長度的關系研究也有不一致的結論。一項多中心研究共納入包括美國白人、黑人、西班牙裔和華裔等840例研究對象,發現飲用咖啡并不影響端粒長度[33]。因此,未來還需要更大樣本、涉及多個地區和種族的隊列研究,進一步探討飲用咖啡對端粒長度的影響。
本研究還發現,孕期經常保持體育鍛煉的產婦端粒長度長,這與既往研究[35]結論一致。英國的雙胞胎及遺傳流行病學研究中心通過調查雙胞胎志愿者的體育活動水平,發現孿生同胞中運動較多的比運動較少的端粒平均長88 bp;在調整年齡、性別、體質指數、吸煙情況和社會經濟狀態的影響后,二者仍然具有顯著差異,由此認為久坐生活方式會縮短端粒長度,而規律的體育鍛煉對于維持端粒長度有重要作用[35]。近年來一項5年隨訪研究還發現,通過堅持適度的有氧運動能夠延長個體的外周血端粒長度。孕期健康的生活方式可能通過增加抗氧化蛋白的基因表達以及減少炎癥因子的分泌來影響端粒長度[18]。
綜上所述,本研究首次較全面地評估了孕期各種社會環境暴露對產婦及新生兒端粒長度的影響,發現受教育程度、攝入奶制品、飲用咖啡、體育鍛煉頻率影響母親或新生兒端粒長度,這對于進一步全面評價母親和新生兒端粒長度的影響因素提供了重要的依據,并為揭示端粒在疾病發生和發展過程中發揮作用的生物學機制提供了線索。
[ 1 ] ENTRINGER S, EPEL E S, LIN J, et al. Maternal psychosocial stress during pregnancy is associated with newborn leukocyte telomere length[J]. Am J Obstet Gynecol, 2013, 208(2): 134.e1-e7.
[ 2 ] ENTRINGER S, EPEL E S, LIN J, et al. Maternal folate concentration in early pregnancy and newborn telomere length[J]. Ann Nutr Metab, 2015, 66(4): 202-208.
[ 3 ] IMAM T, JITRATKOSOL M H, SOUDEYNS H, et al. Leukocyte telomere length in HIV-infected pregnant women treated with antiretroviral drugs during pregnancy and their uninfected infants[J]. J Acquir Immune Defic Syndr, 2012, 60(5): 495-502.
[ 4 ] FRIEDRICH U, SCHWAB M, GRIESE E U, et al. Telomeres in neonates: new insights in fetal hematopoiesis[J]. Pediatr Res, 2001, 49(2): 252-256.
[ 5 ] CROSS J A, TEMPLE R C, HUGHES J C, et al. Cord blood telomere length, telomerase activity and inflammatory markers in pregnancies in women with diabetes or gestational diabetes[J]. Diabet Med, 2010, 27(11): 1264-1270.
[ 6 ] NJAJOU O T, CAWTHON R M, DAMCOTT C M, et al. Telomere length is paternally inherited and is associated with parental lifespan[J]. Proc Natl Acad Sci USA, 2007, 104(29): 12135-12139.
[ 7 ] CHAN R, WOO J, SUEN E, et al. Chinese tea consumption is associated with longer telomere length in elderly Chinese men[J]. Br J Nutr, 2010, 103(1): 107-113.
[ 8 ] VALDES A M, ANDREW T, GARDNER J P, et al. Obesity, cigarette smoking, and telomere length in women[J]. Lancet, 2005, 366(9486): 662-664.
[ 9 ] BLASCO M A. Telomeres and human disease: ageing, cancer and beyond[J].Nat Rev Genet,2005,6(8): 611-622.
[10] ISHII A, NAKAMURA K, KISHIMOTO H, et al. Telomere shortening with aging in the human pancreas[J]. Exp Gerontol, 2006, 41(9): 882-886.
[11] BOJESEN S E. Telomeres and human health[J]. J Intern Med, 2013, 274(5): 399-413.
[12] NAWROT T S, STAESSEN J A, GARDNER J P, et al. Telomere length and possible link to X chromosome[J]. Lancet, 2004, 363(9408): 507-510.
[13] FRENCK R J, BLACKBURN E H, SHANNON K M. The rate of telomere sequence loss in human leukocytes varies with age[J]. Proc Natl Acad Sci USA, 1998, 95(10): 5607-5610.
[14] YAMAGUCHI H, CALADO R T, LY H, et al. Mutations in TERT, the gene for telomerase reverse transcriptase, in aplastic anemia[J]. N Engl J Med, 2005, 352(14): 1413-1424.
[15] AUBERT G, BAERLOCHER G M, VULTO I, et al. Collapse of telomere homeostasis in hematopoietic cells caused by heterozygous mutations in telomerase genes[J]. PLoS Genet, 2012, 8(5): e1002696.
[16] BAIRD D M, BRITT-COMPTON B, ROWSON J, et al. Telomere instability in the male germline[J]. Hum Mol Genet, 2006, 15(1): 45-51.
[17] CAWTHON R M, SMITH K R, O’BRIEN E, et al. Association between telomere length in blood and mortality in people aged 60 years or older[J]. Lancet, 2003, 361(9355): 393-395.
[18] ORNISH D, LIN J, CHAN J M, et al. Effect of comprehensive lifestyle changes on telomerase activity and telomere length in men with biopsy-proven low-risk prostate cancer: 5-year follow-up of a descriptive pilot study[J]. Lancet Oncol, 2013, 14(11): 1112-1120.
[19] NORDFJALL K, LAREFALK A, LINDGREN P, et al. Telomere length and heredity: Indications of paternal inheritance[J]. Proc Natl Acad Sci USA, 2005, 102(45): 16374-16378.
[20] WOJCICKI J M, OLVEDA R, HEYMAN M B, et al. Cord blood telomere length in Latino infants: relation with maternal education and infant sex[J]. J Perinatol, 2016, 36(3): 235-241.
[21] AIKATA H, TAKAISHI H, KAWAKAMI Y, et al. Telomere reduction in human liver tissues with age and chronic inflammation[J]. Exp Cell Res, 2000, 256(2): 578-582.
[22] DINWIDDIE G Y, ZAMBRANA R E, DOAMEKPOR L A, et al. The impact of educational attainment on observed race/ethnic disparities in inflammatory risk in the 2001-2008 National Health and Nutrition Examination Survey[J]. Int J Environ Res Public Health, 2016, 13(1): 42.
[23] FITZPATRICK A L, KRONMAL R A, GARDNER J P, et al. Leukocyte telomere length and cardiovascular disease in the cardiovascular health study[J]. Am J Epidemiol, 2007, 165(1): 14-21.
[24] BROUILETTE S W, MOORE J S, MCMAHON A D, et al. Telomere length, risk of coronary heart disease, and statin treatment in the West of Scotland Primary Prevention Study: a nested case-control study[J]. Lancet, 2007, 369(9556): 107-114.
[25] DU J, ZHU X, XIE C, et al. Telomere length, genetic variants and gastric cancer risk in a Chinese population[J]. Carcinogenesis, 2015, 36(9): 963-970.
[26] GARDNER M, BANN D, WILEY L, et al. Gender and telomere length: systematic review and meta-analysis[J]. Exp Gerontol, 2014, 51: 15-27.
[27] BENETOS A, DALGARD C, LABAT C, et al. Sex difference in leukocyte telomere length is ablated in opposite-sex co-twins[J]. Int J Epidemiol, 2014, 43(6): 1799-1805.
[28] LEE J Y, JUN N R, YOON D, et al. Association between dietary patterns in the remote past and telomere length[J]. Eur J Clin Nutr, 2015, 69(9): 1048-1052.
[29] GU Y, HONIG L S, SCHUPF N, et al. Mediterranean diet and leukocyte telomere length in a multi-ethnic elderly population[J]. Age (Dordr), 2015, 37(2): 24.
[30] SONG Y, YOU N C, SONG Y, et al. Intake of small-to-medium-chain saturated fatty acids is associated with peripheral leukocyte telomere length in postmenopausal women[J]. J Nutr, 2013, 143(6): 907-914.
[31] GARCIA-CALZON S, MOLERES A, MARTINEZ-GONZALEZ M A, et al. Dietary total antioxidant capacity is associated with leukocyte telomere length in a children and adolescent population[J]. Clin Nutr, 2015, 34(4): 694-699.
[32] TIAINEN A M, MANNISTO S, BLOMSTEDT P A, et al. Leukocyte telomere length and its relation to food and nutrient intake in an elderly population[J]. Eur J Clin Nutr, 2012, 66(12): 1290-1294.
[33] NETTLETON J A, DIEZ-ROUX A, JENNY N S, et al. Dietary patterns, food groups, and telomere length in the Multi-Ethnic Study of Atherosclerosis (MESA) [J]. Am J Clin Nutr, 2008, 88(5): 1405-1412.
[34] MIRABELLO L, HUANG W Y, WONG J Y, et al. The association between leukocyte telomere length and cigarette smoking, dietary and physical variables, and risk of prostate cancer[J]. Aging Cell, 2009, 8(4): 405-413.
[35] CHERKAS L F, HUNKIN J L, KATO B S, et al. The association between physical activity in leisure time and leukocyte telomere length [J]. Arch Intern Med, 2008, 168(2): 154-158.
Influence factors for maternal and neonatal telomere length
WENG Qiao1, DU Jiang-bo2, YU Fei2, JIN Guang-fu2, SHEN Hong-bing2*, HU Ya-li1*
1.Department of Obstetrics and Gynecology, Nanjing Drum Tower Hospital, Nanjing University Medical College, Nanjing 210008, Jiangsu, China 2.Department of Epidemiology, School of Public Health, Nanjing Medical University, Nanjing 211166, Jiangsu, China
Objective: To comprehensively investigate the environmental factors influencing maternal and neonatal telomere length at birth, and to provide evidences for exploring the role of telomere in pathogenesis and development of diseases.MethodsFrom March 2015 to February 2016, 444 newborns and their mothers in Nanjing Drum Tower Hospital were enrolled. Questionnaire surveys, physical examinations and clinical assessments were conducted in pregnant women, and the maternal peripheral blood samples as well as their matching umbilical venous blood samples were collected. The relative telomere length was measured by quantitative PCR method. The maternal telomere length and neonatal telomere length were compared by pairedttest. The telomere length between different subgroups was compared by variance analysis andttest. The correlation between maternal telomere length and neonatal telomere length as well as the correlations of telomere length with other continuous variables were analyzed by using general linear model.ResultsThe overall telomere length of cord blood was significantly longer than that of maternal blood (0.358vs0.309,P<0.001), but there was no significant correlation between telomere length of maternal blood and telomere length of cord blood (r2=0.004,P=0.174). There was a significant positive correlation between maternal education level and the telomere length of cord blood (P=0.022). There were no obvious correlations of maternal and neonatal telomere length with gestational age, delivery mode, newborn sex and birth weight . The more dairy intake during pregnancy, the shorter maternal telomere length (P=0.048). There were no significant differences of maternal and neonatal telomere length among different subgroups intaking fruits, vegetables, meat, animal offal, fish, shrimp, bean products, baked and preserved food, folic acid and vitamins. Coffee drinking during pregnancy was significantly associated with shorter neonatal telomere length (P=0.011). Second hand smoke exposure, alcohol consumption and tea drinking during pregnancy were not significantly associated with maternal and neonatal telomere lengths. Longer maternal telomere length was observed in those taking physical exercise during pregnancy (P=0.01), but no significant difference was observed in neonatal telomere length (P=0.187).ConclusionsVarious environment exposures such as education level, intake of dairy products, coffee drinking and physical exercise during pregnancy have significant effects on maternal and neonatal telomere length. This study provides valuable clues for further revealing the role of telomere in diseases.
telomere shortening; pregnant women; fetal blood; influencing factors
2017-09-10接受日期2017-11-14
中央高校基本科研專項資金(021414380319). Supported by the Fundamental Research Funds for the Central Universities (021414380319).
翁 僑,博士,主治醫師. E-mail: shuishangfanyi@sina.com
*通信作者(Corresponding authors). Tel: 025-86869077,E-mail: hbshen@njmu.edu.cn;Tel:025-83106666,E-mail: glyyhuyali@163.com
10.12025/j.issn.1008-6358.2017.20170777
R 394.1
A
[本文編輯] 葉 婷,張藝鳴

